改良的重编程方法和细胞培养平台与流程
本专利申请根据35 U.S.C.§119(e)要求于2014年3月4日提交的美国临时申请号61/947,979的利益,所述美国临时申请以引用的方式全文并入本文。
关于序列表的陈述
与本专利申请相关的序列表以文本形式代替文件拷贝提供,并且在此以引用的方式并入说明书内。含有序列表的文本文件的名称为FATE_122_01WO_ST25.txt。文本文件是8KB,于2015年3月4日创建,并且与说明书提交同时经由EFS-Web电子提交。
技术领域
本发明一般涉及用于制造多能细胞的组合物和方法。特别地,本发明涉及用于制造具有基态多能性的多能细胞的改良的培养平台。
背景技术:
当今的基于多能干细胞的疾病和毒理学筛选努力以及明日的自体/同种异体多能干细胞疗法将需要人胚胎干细胞(hESC)和人诱导多能干细胞(hiPSC)的细胞系生成和扩增的稳健、可重现方法。hiPSC已通过经由基因组整合逆转录病毒和慢病毒表达系统引入的多能性因子的异位表达生成。消除尽可能多的整合事件的努力已包括用小分子抑制剂代替许多重编程因子。另外,非整合方法已证明是无效和费力的,从而需要另外的重编程因子或在使所有体细胞重编程中是无效的(Lee等人,2013)。
与多能干细胞培养相关的几个挑战仍有待解决,以允许细胞变得适合于未来的工业和临床应用。在最常用的常规培养系统中,hESC和hiPSC在作为块传代时维持在饲养细胞上,以防止广泛细胞死亡和基因组异常(Thomson等人,1998)。在无饲养者(FF)环境中不能单细胞培养hiPSC严重限制潜在的工业规模筛选或细胞疗法应用(Skottman等人,2007;Valamehr等人,2011)。另外,关于改良hiPSC的近期努力已集中于慢病毒衍生的hiPSC,所述hiPSC并非是无转基因的,从而限制此类努力的治疗关联性。
仍有待成功解决的另一个挑战,即基因组修饰的缺乏,是培养中的人多能干细胞的自发分化的倾向(Pera和Trounson,2004;Sathananthan和Trounson,2005;Valamehr等人,2011)。
hESC和hiPSC中的研究已得到描述,但需要多能性基因的连续异位表达以维持基态,从而导致基因组修饰的人多能干细胞(Hanna等人,2010a),所述人多能干细胞不适合于工业和临床级别的多能细胞。
相应地,关于人多能细胞产物的高流通量、无转基因或足迹生成的组合物和方法的不存在迄今被证明是在未来的多能干细胞疗法的发展和商业化中的重大障碍。
技术实现要素:
本发明一般提供了改良的细胞培养平台。
在各个实施例中,本发明部分考虑了包含下述的组合物:(a)Wnt途径激动剂;(b)MEK抑制剂;和(c)ROCK抑制剂,其中所述组合物不包含TGFβR抑制剂。
在特定实施例中,Wnt途径激动剂是GSK3抑制剂。
在某些实施例中,GSK3抑制剂是CHIR99021或BIO。
在另外的实施例中,MEK抑制剂是PD98059或PD032901。
在进一步的实施例中,ROCK抑制剂是thiazovivin或Y27632。
在一些实施例中,GSK3抑制剂是CHIR99021;MEK抑制剂是PD032901;并且ROCK抑制剂是thiazovivin。
在某些实施例中,前述组合物中的任一种还包含bFGF或LIF。
在进一步的实施例中,前述组合物中的任一种还包含bFGF和LIF。
在各个实施例中,本发明提供了包含前述组合物中的任一种的培养基,其中所述培养基不包含TGFβR抑制剂。
在一些实施例中,培养一个或多个多能细胞的方法包括在根据前述细胞培养基中的任一种的细胞培养基中培养所述一个或多个多能细胞。
在另外的实施例中,一个或多个多能细胞是胚胎干细胞(ESC)或诱导多能干细胞(iPSC)。
在特定实施例中,一个或多个多能细胞是iPSC。
在某些实施例中,组合物包含多能细胞群。
在进一步的实施例中,多能细胞群是多能细胞的同质群。
在特定实施例中,多能细胞群的至少95%表达SSEA4-FITC和TRA1-81或TRA1-60。
在一些实施例中,多能细胞群的至多5%表达α-平滑肌肌动蛋白(SMA)、TUJ1或FoxA2。
在特定实施例中,多能细胞先前在包含TGFβR抑制剂的细胞培养基中进行培养。
在另外的实施例中,在细胞培养基中培养多能细胞减少培养细胞的自发分化。
在一个实施例中,与一种或多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的多能细胞中的表达相比较,一种或多种分化标记物基因在培养细胞中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在另一个实施例中,一种或多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在另外一个实施例中,与两种或更多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的多能细胞中的表达相比较,所述两种或更多种分化标记物基因在培养细胞中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在另外一个实施例中,两种或更多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在一个特定实施例中,与三种或更多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的多能细胞中的表达相比较,所述三种或更多种分化标记物基因在培养细胞中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在某些实施例中,三种或更多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在另外的实施例中,与五种或更多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的多能细胞中的表达相比较,所述五种或更多种分化标记物基因在培养细胞中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在一个进一步的实施例中,五种或更多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在某些实施例中,在细胞培养基中培养多能细胞维持或诱导多能性的基态。
在特定实施例中,一个或多个多能细胞的多能性的基态维持至少5代。
在某些特定实施例中,一个或多个多能细胞的多能性的基态维持至少10代。
在进一步的特定实施例中,一个或多个多能细胞的多能性的基态维持至少50代。
在另外的特定实施例中,一个或多个多能细胞的多能性的基态维持至少100代。
在各个实施例中,前述方法还包括在传代期间解离一个或多个多能细胞。
在某些实施例中,一个或多个多能细胞的活力在传代期间得到维持。
在某些特定实施例中,一个或多个多能细胞包含正常核型。
在某些另外的实施例中,一个或多个多能细胞在无饲养者环境中进行培养。
在某些进一步的实施例中,一个或多个多能细胞的基因组稳定性维持至少10代。
在某些相关实施例中,一个或多个多能细胞的基因组稳定性维持至少50代。
在某些其他实施例中,一个或多个多能细胞的基因组稳定性维持至少100代。
在各个实施例中,本发明部分考虑了使多能细胞适应无饲养者培养的方法,所述方法包括:(a)分离在饲养细胞的存在下培养的一个或多个多能细胞;(b)在化学成分确定的细胞培养基中培养一个或多个多能细胞,所述细胞培养基包含:Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和ROCK抑制剂,其中所述培养基不包含TGFβR抑制剂。
在各个特定实施例中,本发明部分考虑了培养作为单细胞酶促传代的多能细胞的方法,所述方法包括:(a)酶促处理一个或多个多能细胞,以传代单个多能细胞;(b)在无饲养者环境中培养单个多能细胞;(c)在化学成分确定的细胞培养基中培养单个多能细胞,所述细胞培养基包含:Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和ROCK抑制剂,其中所述培养基不包含TGFβR抑制剂。
在各个某些实施例中,本发明部分考虑了减少一个或多个多能细胞的自发分化的方法,所述方法包括:(a)在无饲养者环境中培养一个或多个多能细胞;(b)在化学成分确定的细胞培养基中培养一个或多个多能细胞,所述细胞培养基包含:Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和ROCK抑制剂,其中所述培养基不包含TGFβR抑制剂。
在各个另外的实施例中,本发明部分考虑了制造诱导多能干细胞(iPSC)的方法,所述方法包括:(a)获得一个或多个非多能细胞;(b)使一个或多个非多能细胞重编程为多能状态;(c)在不包含TGFβR抑制剂的细胞培养基中培养多能细胞,由此产生iPSC。
在特定实施例中,一个或多个非多能细胞包含体细胞。
在一些实施例中,一个或多个非多能细胞包含成人干细胞。
在某些实施例中,一个或多个非多能细胞通过增加细胞中的内源OCT4表达而重编程为多能状态。
在进一步的实施例中,使一个或多个非多能细胞重编程为多能状态包括将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、ECAT1、UTF1、ESRRB和SV40LT。
在另外的实施例中,使一个或多个非多能细胞重编程为多能状态包括将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、ECAT1、UTF1、ESRRB和SV40LT。
在某些实施例中,使一个或多个非多能细胞重编程为多能状态包括将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、SOX2和NANOG。
在某些实施例中,使一个或多个非多能细胞重编程为多能状态包括将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、NANOG、ECAT1、UTF1和ESRRB。
在某些实施例中,使一个或多个非多能细胞重编程为多能状态包括将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、ECAT1和UTF1。
在特定实施例中,一种或多种多核苷酸是慢病毒载体。
在一些实施例中,一种或多种多核苷酸是附加型载体。
在相关特定实施例中,细胞培养基包含Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和ROCK抑制剂。
在进一步的特定实施例中,使一个或多个非多能细胞重编程包括使一个或多个非多能细胞与下述接触:Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和TGFβR抑制剂,以及任选的ROCK抑制剂。
在另外的实施例中,iPSC包含iPSC群。
在特定实施例中,iPSC群是iPSC的同质群。
在特定实施例中,iPSC群的至少95%表达SSEA4和TRA1-81或TRA1-60。
在某些实施例中,多能细胞群的至多5%表达α-平滑肌肌动蛋白(SMA)、TUJ1或FoxA2。
在特定实施例中,在细胞培养基中培养多能细胞减少自发分化,或者维持或诱导多能性的基态。
在另外的实施例中,与一种或多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的iPSC中的表达相比较,一种或多种、两种或更多种、三种或更多种、四种或更多种、或者五种或更多种分化标记物基因在所述iPSC中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在特定实施例中,一种或多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在某些实施例中,自发分化中的减少维持至少5代。
在其他实施例中,自发分化中的减少维持至少10代。
在特定实施例中,自发分化中的减少维持至少50代。
在另外的实施例中,自发分化中的减少维持至少100代。
在进一步的实施例中,前述方法包括在传代期间解离iPSC。
在另外的实施例中,iPSC的活力在传代期间得到维持。
在某些实施例中,iPSC包含正常核型。
在其他实施例中,iPSC在无饲养者环境中进行培养。
在特定实施例中,iPSC的基因组稳定性维持至少10代。
在另外的实施例中,iPSC的基因组稳定性维持至少50代。
在特定的另外实施例中,iPSC的基因组稳定性维持至少100代。
在各个实施例中,本发明部分提供了根据前述实施例中任何一个产生的包含基态多能性的诱导多能干细胞(iPSC)。
在各个某些实施例中,本发明部分提供了包含基态多能性的诱导多能干细胞(iPSC),其中所述iPSC不包含编码重编程因子多肽的外源引入的多核苷酸。
在各个特定实施例中,本发明部分提供了制造诱导多能干细胞(iPSC)的方法,所述方法包括:a)获得一个或多个多能干细胞;(b)在不包含TGFβR抑制剂的细胞培养基中培养一个或多个多能干细胞,由此产生基态iPSC。
在某些实施例中,一个或多个iPSC包含重编程的体细胞。
在另外的实施例中,一个或多个iPSC包含重编程的成人干细胞。
在其他实施例中,一个或多个iPSC通过增加一个或多个iPSC中的内源OCT4表达而重编程为多能状态。
在特定实施例中,一个或多个iPSC通过将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸引入一个或多个非多能细胞内进行重编程:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、ECAT1、UTF1、ESRRB和SV40LT。
在某些特定实施例中,一个或多个iPSC通过引入编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸进行重编程:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、ECAT1、UTF1、ESRRB和SV40LT。
在另外的实施例中,一个或多个iPSC通过将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入所述一个或多个非多能细胞内进行重编程:OCT4、SOX2和NANOG。
在另外的实施例中,一个或多个iPSC通过将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入所述一个或多个非多能细胞内进行重编程:OCT4、NANOG、ECAT1、UTF1和ESRRB。
在另一个实施例中,一个或多个iPSC通过将编码选自下述的重编程因子的一个或多个拷贝的一种或多种多核苷酸引入所述一个或多个非多能细胞内进行重编程:OCT4、ECAT1和UTF1。
在各个实施例中,慢病毒载体包含一种或多种多核苷酸。
在特定实施例中,附加型载体包含一种或多种多核苷酸。
在其他实施例中,细胞培养基包含Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和ROCK抑制剂。
在某些实施例中,获得一个或多个iPSC包括使一个或多个非多能细胞或部分多能细胞与下述接触:Wnt途径激动剂,任选地其中所述Wnt途径激动剂是GSK3抑制剂;MEK抑制剂;和TGFβR抑制剂,以及任选的ROCK抑制剂,以产生一个或多个iPSC。
在另外的实施例中,iPSC包含iPSC群。
在另外的实施例中,iPSC群是iPSC的同质群。
在特定实施例中,iPSC群的至少95%表达SSEA4和TRA1-81或TRA1-60。
在特定实施例中,一个或多个iPSC通过使多能细胞群重编程而获得,其中所述多能细胞群的至多5%表达α-平滑肌肌动蛋白(SMA)、TUJ1或FoxA2。
在进一步的实施例中,前述方法包括在细胞培养基中培养一个或多个iPSC减少自发分化,或者维持或诱导多能性的基态。
在某些实施例中,具有减少的自发分化的iPSC包含基因表达,其中与一种或多种分化标记物基因在包含TGFβR抑制剂的培养基中培养的iPSC中的表达相比较,一种或多种、两种或更多种、三种或更多种、四种或更多种、或者五种或更多种分化标记物基因在iPSC中的表达减少至少约10%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述分化标记物基因选自:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在另外的实施例中,一种或多种分化标记物基因选自T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。
在其他实施例中,减少的自发分化维持至少5代。
在某些实施例中,减少的自发分化维持至少10代。
在另外的实施例中,减少的自发分化维持至少50代。
在特定实施例中,减少的自发分化维持至少100代。
在进一步的实施例中,前述方法包括在传代期间解离一个或多个iPSC。
在特定实施例中,一个或多个iPSC的活力在传代期间得到维持。
在其他实施例中,一个或多个iPSC包含正常核型。
在另外的实施例中,一个或多个iPSC在无饲养者环境中进行培养。
在某些实施例中,一个或多个iPSC的基因组稳定性维持至少10代。
在另外的实施例中,一个或多个iPSC的基因组稳定性维持至少50代。
在特定实施例中,一个或多个iPSC的基因组稳定性维持至少100代。
在各个特定实施例中,本发明部分提供了根据前述实施例中任何一个产生的包含基态多能性的诱导多能干细胞(iPSC)。
在各个实施例中,本发明部分提供了包含基态多能性的诱导多能干细胞(iPSC),其中所述iPSC不包含编码重编程因子多肽的外源引入的多核苷酸。
在一些实施例中,本发明提供了用于使非多能细胞重编程为多能细胞的方法,所述方法包括将下述引入非多能细胞内:(i)编码选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少一种多肽的一种或多种多核苷酸,或(ii)选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少一种多肽,由此使非多能细胞重编程为多能细胞。
在一个特定实施例中,引入包括(i)引入编码OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的一种或多种多核苷酸,或(ii)引入OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽。
在另一个实施例中,引入包括(i)引入编码OCT4多肽、ECAT1多肽和UTF1多肽的一种或多种多核苷酸,或(ii)引入OCT-4多肽、ECAT1多肽和UTF1多肽。
在一些实施例中,一种或多种多核苷酸通过逆转录病毒、仙台病毒、腺病毒、附加体、微环、具有表达盒的载体系统或mRNA而引入。
在一个特定实施例中,逆转录病毒是慢病毒。
在另一个实施例中,多能细胞不含外源多核苷酸。
在另一个实施例中,一种或多种多核苷酸通过CRE介导的切除进行切除。
在一些实施例中,该方法还包括将下述引入非多能细胞内:(i)编码SV40LT多肽的多核苷酸,或(ii)SV40LT多肽。
在一个实施例中,该方法还包括使所述非多能细胞与下述中的至少一种接触:TGFβR抑制剂、Wnt途径激动剂、MEK抑制剂和ROCK抑制剂,其中所述Wnt途径激动剂任选是GSK3抑制剂。
在另一个实施例中,非多能细胞与下述接触:TGFβR抑制剂、Wnt途径激动剂、MEK抑制剂和ROCK抑制剂,其中所述Wnt途径激动剂任选是GSK3抑制剂。
在一个特定实施例中,该方法还包括在包含Wnt途径激动剂、MEK抑制剂和ROCK抑制剂的培养基中培养多能细胞,其中所述Wnt途径激动剂任选是GSK3抑制剂,并且其中所述培养基不包含TGFβR抑制剂。
在一些实施例中,ROCK抑制剂是thiazovivin或Y27632,TGFβR抑制剂是A-83-01或SB431542,GSK3抑制剂是CHIR99021或BIO,或MEK抑制剂是PD98059或PD032901。
在另一个实施例中,多能细胞的多能性维持至少5次细胞分裂或至少10次细胞分裂。
在一个特定实施例中,一种或多种多核苷酸作为包含多重多核苷酸的多顺反子载体引入,所述多重多核苷酸通过至少一个2A肽分开。
在一个实施例中,多顺反子载体包含编码OCT4多肽的多重多核苷酸。
在一些实施例中,该方法包括通过在多能细胞中选择OCT4表达来鉴定多能细胞。
在一个实施例中,OCT4表达的选择包括异位Oct-4表达的选择。
在另一个实施例中,培养产生多能干细胞群。
在另一个实施例中,多能干细胞群是至少70%同质的、至少80%同质的、或至少90%同质的。
在另外一个实施例中,多能细胞群的至少70%、至少80%、或至少90%表达SSEA和Tra-181。
在一个实施例中,多能细胞或多能细胞群能够单细胞传代。
在一个实施例中,通过单细胞传代产生的细胞具有正常核型。
在一个实施例中,本发明提供了根据上文方法中任何一种的方法产生的多能细胞。
在另一个实施例中,本发明提供了包含经分离的非多能细胞的组合物,所述经分离的非多能细胞包含(i)编码选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少一种多肽的一种或多种外源多核苷酸,或(ii)选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少一种外源多肽。
在一个实施例中,细胞包含(i)编码OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽中的至少两种的一种或多种外源多核苷酸,或(ii)选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少两种外源多肽。
在另一个实施例中,细胞包含(i)编码OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽中的至少三种的一种或多种外源多核苷酸,或(ii)选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少三种外源多肽。
在一个特定实施例中,细胞包含(i)编码OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的一种或多种外源多核苷酸,或(ii)外源OCT4多肽、外源ECAT1多肽、外源UTF1多肽、外源NANOG多肽和外源ESRRB多肽。
在另一个实施例中,细胞包含编码OCT4多肽、ECAT1多肽和UTF1多肽的一种或多种外源多核苷酸,或外源OCT4多肽、外源ECAT1多肽和外源UTF1多肽。
在一个实施例中,已使细胞与TGFβR抑制剂、GSK3抑制剂、MEK抑制剂和ROCK抑制剂中的至少一种接触。
在另一个实施例中,已使细胞与TGFβR抑制剂、Wnt途径激动剂、MEK抑制剂和ROCK抑制剂接触,其中所述Wnt途径激动剂任选是GSK3抑制剂。
在一个特定实施例中,ROCK抑制剂是thiazovivin或Y27632,TGFβR抑制剂是A-83-01或SB431542,GSK3抑制剂是CHIR99021或BIO,或MEK抑制剂是PD98059或PD032901。
在另一个实施例中,一种或多种外源多核苷酸通过逆转录病毒、仙台病毒、腺病毒、附加体、微环、具有表达盒的载体系统或mRNA而引入非多能细胞。
在另一个实施例中,逆转录病毒是慢病毒。
在一个特定实施例中,细胞不含外源多核苷酸。
在一个实施例中,一种或多种外源多核苷酸通过CRE介导的切除进行去除。
在另一个实施例中,细胞包含编码SV40LT抗原多肽的外源多核苷酸,或外源SV40LT抗原多肽。
在一个实施例中,一种或多种外源多核苷酸作为包含多重多核苷酸的多顺反子载体引入,所述多重多核苷酸通过至少一个2A肽分开。
在另一个实施例中,多顺反子载体包含编码OCT4多肽的多重多核苷酸。
在一个实施例中,编码OCT4多肽的外源多核苷酸连接至可选标记物。
在一个特定实施例中,本发明提供了由下述中的至少一种、至少两种或至少三种组成的组合物:(i)编码OCT4多肽的cDNA、(ii)编码ECAT1多肽的cDNA、(iii)编码UTF1多肽的cDNA、(iv)编码NANOG多肽的cDNA、和(v)编码ESRRB多肽的cDNA。
在一个实施例中,组合物由编码OCT4多肽的cDNA、编码ECAT1多肽的cDNA、编码UTF1多肽的cDNA、编码NANOG多肽的cDNA、和编码ESRRB多肽的cDNA组成。
在另一个实施例中,组合物由编码OCT4多肽的cDNA、编码ECAT1多肽的cDNA和编码UTF1多肽的cDNA组成。
在一个特定实施例中,每种cDNA在逆转录病毒、仙台病毒、腺病毒、附加体、微环、具有表达盒的载体系统或mRNA中编码。
在一个实施例中,本发明提供了包含一种或多种多核苷酸的载体,所述一种或多种多核苷酸编码选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽的至少一种重编程因子多肽。
在一个实施例中,一种或多种多核苷酸编码OCT多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽。
在另一个实施例中,一种或多种多核苷酸编码OCT多肽、ECAT1多肽和UTF1多肽。
在另一个特定实施例中,载体还包含编码SV40LT抗原多肽的多核苷酸。
在一个实施例中,载体是逆转录病毒、仙台病毒、腺病毒、附加体、微环、具有表达盒的载体系统或mRNA。
在一个实施例中,逆转录病毒是慢病毒。
在一个特定实施例中,本发明提供了用于使非多能细胞重编程为多能细胞的试剂盒,所述试剂盒包括:编码选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽或ESRRB多肽的至少一种多肽的一种或多种多核苷酸;或选自OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽或ESRRB多肽的至少一种多肽;和TGFβR抑制剂、Wnt途径激动剂、MEK抑制剂和ROCK抑制剂中的至少一种,其中所述Wnt途径激动剂任选是GSK3抑制剂。
在一个实施例中,一种或多种多核苷酸编码OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽,或至少一种多肽包含OCT4多肽、ECAT1多肽、UTF1多肽、NANOG多肽和ESRRB多肽。
在另一个实施例中,一种或多种多核苷酸编码OCT4多肽、ECAT1多肽和UTF1多肽,或至少一种多肽包含OCT4多肽、ECAT1多肽和UTF1多肽。
在一个实施例中,试剂盒包括编码SV40LT抗原多肽的多核苷酸,或SV40LT抗原多肽。
在另一个实施例中,试剂盒包括TGFβR抑制剂、Wnt途径激动剂、MEK抑制剂和ROCK抑制剂,其中所述Wnt途径激动剂任选是GSK3抑制剂。
在一个实施例中,ROCK抑制剂是thiazovivin或Y27632,TGFβR抑制剂是A-83-01或SB431542,GSK3抑制剂是CHIR99021或BIO,或MEK抑制剂是PD98059或PD032901。
在另一个实施例中,至少一种多核苷酸在逆转录病毒、仙台病毒、腺病毒、附加体、微环、具有表达盒的载体系统或mRNA中编码。
在另一个实施例中,逆转录病毒是慢病毒。
在一个实施例中,至少一种多核苷酸在多顺反子载体中编码,其中每种多核苷酸通过2A肽分开。
在另外一个实施例中,多顺反子载体包含编码OCT4多肽的两种或更多种多核苷酸。
在一个特定实施例中,编码OCT4多肽的至少一种多核苷酸连接至可选标记物。
在另一个特定实施例中,本发明提供了用于产生多能干细胞群的方法,所述方法包括:提供非多能细胞群;将连接至可选标记物的编码OCT4多肽的多核苷酸引入非多能细胞群内;在足以使非多能细胞群的至少一部分重编程为多能细胞的条件下,使非多能细胞群与多核苷酸一起温育;选择表达可选标记物的细胞,由此提供多能干细胞群。
在另一个实施例中,多核苷酸作为多顺反子载体引入,所述多顺反子载体包含编码OCT4多肽的多重多核苷酸。
在一个实施例中,多重多核苷酸通过至少一个2A肽分开。
在另外一个实施例中,细胞群中的至少10%的细胞表达SSEA和TRA-181。
附图说明
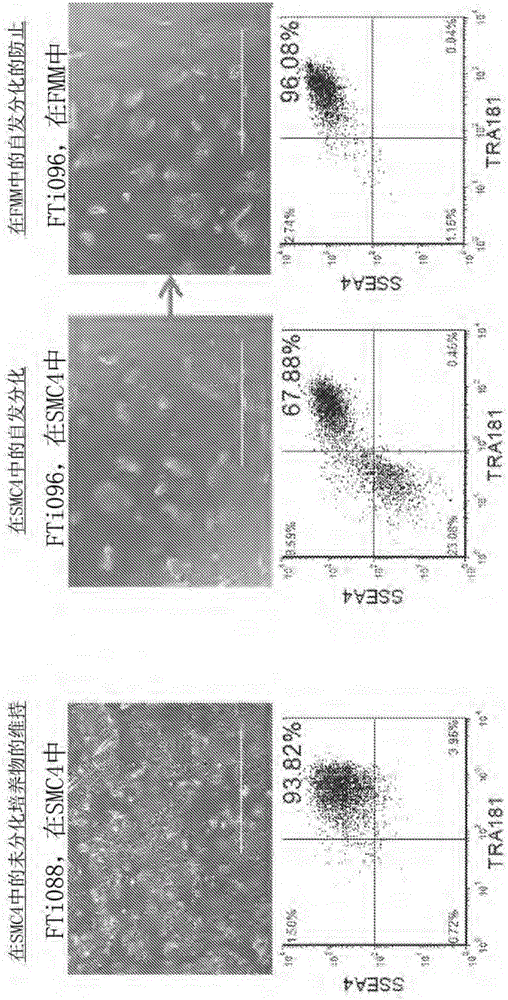
图1A-1E显示了来自关于增强的重编程和hiPSC维持的多阶段培养平台的结果。(1A)慢病毒生成的hiPSC克隆FTi088在SMC4中维持非分化细胞的同质群,而自发分化在SMC4中培养的慢病毒生成的hiPSC系FTi096中可见。当FTi096转变为FMM共3次传代时,自发分化降到最低,如通过形态(上图)以及关于SSEA4和TRA1-81的流式细胞术(下图)所示。(1B)关于病毒元件WPRE的转基因表达的qRT-PCR。表达针对GAPDH且相对于慢病毒感染后四天(第4天P.I.)亲本成纤维细胞系的WPRE表达进行标准化。未感染的成纤维细胞系(成纤维细胞)和人ESC系HUES9用作阴性对照。每个集合的值在条上方指出。(1C)在10次传代后,各种培养基组分对无转基因慢病毒诱导的hiPSC群的SSEA4和TRA1-81的作用的筛选;SB431542(-TGFβRi)的去除从10增加到100ng/mL bFGF,添加10ng/mL LIF。(1D)成纤维细胞细胞系用含有基因集合OCT4/KLF4/SOX2的慢病毒构建体进行转染,并且拆分到各种培养基(常规培养基;Conv.)内,培养17天且在第17天时就SSEA4和TRA1-81双阳性群进行分选。分选门以蓝色突出显示。每个集合在分别的培养基中培养另外10天,除了拆分到FMM和SMC4内的SMC4集合之外。在第27天时,培养物就SSEA4和TRA1-81双阳性群进行重新分选,以分选事件的标准化密度种植且在分别的培养基中维持另外9天。将常规培养集合门控扩大,以实现标准化数目的细胞。在第36天时,每种培养物就OCT4和NANOG表达进行染色。关于每个集合的代表性免疫细胞化学图像显示于右图中。(1E)第36天染色的集落计数如(1D)中讨论的。误差条代表关于FRM至FMM和FRM的一式三份以及关于FMM和hESC的一式两份。
图2A-2E显示了个别附加体重编程的hiPSC被有效选择且种植在96孔板中用于克隆扩增。(2A)附加体诱导、多阶段培养平台、流式细胞术分选和克隆扩增的示意性时机图示。(2B)在所示的转染后天数时,在FF培养(在2A中概述)中的FRM至FMM转变中维持的附加体诱导的重编程的流式细胞术概况。用于每种亲本系(SSEA4+/TRA1-81+/CD30+群)的分选门控策略以分别的颜色示出,对应于代表含有个别hiPSC克隆的96孔板的孔百分比的底部直方图小图。含有多重克隆或分化克隆的孔不进行评分。实线代表在所有衍生中的平均百分比,而虚线代表标准差。(2C)在MEF细胞的存在下,在常规培养基中维持的转染后19天诱导至重编程的FTC007的流动概况。诱导群取自(2B)中的相同FTC007群,然而,其后在不同培养中进行处理。(2D)在96孔板中的分选集落的各种多能性标记物的免疫细胞化学分析。右下角小图代表DAPI染色。(2E)关于以3个细胞/孔的SSEA4/TRA1-81/CD30直接分选的(FACS)96孔板的每个孔的NANOG表达的qRT-PCR。表达范围在如图例中所述相对于H1人ESC且针对GAPDH标准化的零至四倍表达之间。
图3A-3F显示了附加体重编程的hiPSC克隆维持其未分化状态且不含转基因序列。(3A)在单细胞传代后24小时,hiPSC克隆的典型形态。(3B)在培养期间hiPSC克隆的代表性图像。(3C)关于来源于各种hiPSC克隆的附加型DNA的PCR分析。泳道1,FTC007-c1p4;泳道2,FTC007-c21p4;泳道3,FTC016-c25p5;泳道4,FTC016-c36p5;泳道5,FTC017-c11p7;泳道6,FTC017-c14p7;泳道7,FTC017-c17p6(用作阳性对照的维持附加体构建体的系);泳道8,未经转染的FTC007;泳道9,使用慢病毒构建体生成的hiPSC(以充当针对交叉感染的对照);泳道10,用作阳性对照的附加型载体。100ng基因组DNA的输入和35个PCR循环用于所有集合。(3D)对于OCT4、NANOG、TRA1-81和TRA160的表达,通过免疫荧光检测的多能性标记物。(3E)关于来自各种亲本系的所选择的hiPSC克隆的流式细胞术概况。上面一行概括SSEA4/TRA1-81表面表达。下面一行概括OCT4/NANOG细胞内表达。(3F)关于内源多能基因表达的qRT-PCR分析。数据针对GAPDH且相对于HUES9hESC进行标准化。在KLF4表达的情况下,两个数据点比HUES9大超过15倍且在图上注明。误差条代表重复的标准差。
图4A-4E显示了基因组稳定性和多能性在连续单细胞和FF培养中得到维持。(4A)来自在FF和单细胞培养中维持的各种hiPSC克隆的20至40个G带中期细胞的细胞遗传学分析。(4B)在FF和单细胞培养中长期传代(p25-30)的hiPSC克隆的流式细胞术概况和细胞遗传学分析。(4C)FTC017-c11三至四天的定向分化。(4D)hiPSC克隆的胚状体形成和分化证实三系分化。免疫细胞化学在分化后28天进行:外胚层,TUJ1;中胚层,α平滑肌肌动蛋白(aSMA);内胚层,AFP。(4E)来源于代表每个体细胞谱系的FTC007-c21和FTC016-c25的畸胎瘤的组织切片。黑色箭头,内胚层;白色箭头,外胚层;灰色箭头,中胚层。
图5A-5J显示了具有最低限度数目的重编程因子的hiPSC克隆的衍生。(5A)将OCT4、SOX2和NANOG以各种形式克隆到pCEP4内。表代表载体系统和缩写。(5B)在诱导后第13天时,通过各种基因组合诱导的重编程动力学的SSEA4和TRA1-81流式细胞术概况。(5C)代表以3和9个细胞/孔在96孔板的孔中TRA1-81阳性hiPSC克隆的存在的效率直方图。(5D)关于来源于各种hiPSC克隆的附加型DNA的PCR分析。泳道1 2xO+OS+ONS+T-c7p6;泳道2,2xO+OS+ONS+T-c10p6;泳道3,2xO+ONS+T-c5p5;泳道4,2xO+ONS+T-c9p5;泳道5,2xO+OS+T-c7p7;泳道6,2xO+OS+T-c9p6;泳道7,未经转染的FTC007;泳道8,使用慢病毒构建体生成的hiPSC;泳道9,用作阳性对照的附加型载体。100ng基因组DNA的输入和35个PCR循环用于所有集合。(5E)来源于2xO+OS+T的克隆9的形态。(5F)关于OCT4、NANOG、TRA1-81和TRA160的表达,通过免疫荧光检测的多能性标记物。图像以10x放大率获得。(5G)来源于所选择的基因集合的hiPSC克隆的流动概况。上面一行概括SSEA4/TRA1-81表面表达。下面一行概括OCT4/NANOG细胞内表达。(5H)转染后大约72至96小时,所选择的hiPSC克隆的定向分化。(5I)来自在FF和单细胞培养中维持的各种hiPSC克隆的G带中期细胞的细胞遗传学分析。(5J)来源于代表每个体细胞谱系的hiPSC克隆2xO+OS+ONS+T-c10的畸胎瘤的组织切片。左图,内胚层;中图,中胚层;右图,外胚层。
图6A-6B显示了在FMM中最低限度因子附加体诱导的hiPSC的相对基因表达概况。热图结果来源于Fluidigm动态阵列,描述常规维持的hiPSC系、常规维持的H1hESC以及在FMM中维持的使用各种基因组合衍生的附加型hiPSC系的多能性(6A)和分化(6B)基因的相对基因表达水平(RQ)。关于每个系的相对基因表达在每个框内注明,并且基于三个表达水平编码的颜色概括于图例中(右下)。所有集合一式两份进行,针对两种持家基因(GAPDH和HPRT1)的平均表达进行标准化,并且参考代表1x值的六个对照常规系(在MEF上的OSK hiPSC和H1hESC)的中值表达水平。
图7A-7G显示了FMM维持的hiPSC具有分化基因的减少表达且代表基态。(7A)总共339个探针组在常规和FMM培养之间差异表达大于或小于2.5倍。基于欧几里得距离测量,使用完全连锁方法,关于339个探针组的分层聚类。(7B)对于常规培养(与FMM培养相比较),213个探针组的基因本体生物过程富集分析(D.A.V.I.D.)上调2.5倍或更大。(7C)代表基态或亚稳多能性态的基因列表。列表来源于正文中注明的参考文献。7(D)基于欧几里得距离测量,使用完全连锁方法,关于对应于(7C)中的基因的231个探针组的分层聚类。(7E)关于对应于(7C)中的基因的探针组的RMA(log2)强度。左图代表关于基态的39个探针组,右图代表关于亚稳态的188个探针组。平均常规培养强度水平在X轴上标绘,而平均FMM/SMC4强度在Y轴上标绘,黑线指示相等表达。(7F)使用Affymetrix探针组,在衍生且在常规培养基培养中培养的hiPSC克隆和其适应SMC4培养的配对物之间的X染色体定位基因的基因表达比较。与XIST基因表达相关的探针组是突出显示的。(7G)在FMM中维持或适应常规培养共5代的hiPSC克隆上的HEK27me3的代表性图像。左图中的虚线箭头指向不存在H3K27me3染色的代表性核,而右图中的实线箭头指向对于H3K27me3染色阳性的核。核阳性染色百分比在每个小图的左下侧指出。FMM培养的细胞具有更大的核。比例尺=50μm。
图8A-8D显示了对于FRM和FMM附加体诱导的重编程。(8A)重编程库的第10天SSEA4和TRA1-81流动概况。(8B)在重编程期间可见的典型集落的代表性形态。图像在转染后第13天时获取。(8C)对于前14天在FRM中维持的附加体重编程成纤维细胞进行拆分,且在FRM中维持或转变成FMM。重编程培养物随后在转染后第21天时就SSEA4/TRA1-81/CD30进行分选,并且在分析前在FRM或FMM中维持另外10天。(8D)在FRM或FMM中的代表性培养物的形态和流动概况。白色箭头指向培养物中的分化细胞区域,所述培养物由未分化和分化群的混合物组成。黑色箭头指向大部分未分化群的尖锐边缘。下图是代表性流动概况。FSC;前向侧散射。
图9A-9B显示了各种亲本系的重编程。(9A)在该研究中使用的起始细胞系的概括表。除与每个系相关的具体信息之外,注明了在附加体转染后分选时的阳性SSEA4/TRA1-81/CD30群百分比。(9B)描述CD34富集的脐带血细胞的分选和培养的图示。先前在库中维持的0.5ml体积的脐带血用于提取65,000个CD34+CD45+Lin-细胞,所述细胞在附加体转染之前悬浮培养6天。
图10A-10G显示了在重编程和维持过程期间hiPSC的表征。(10A)单细胞96孔板分选后三天的典型集落形态。比例尺代表400μm。(10B)由各种起始细胞分选后7-9天,单细胞衍生的hiPSC样集落的代表性形态。比例尺代表1000μm。(10C)关于在96孔板中的hiPSC样集落的NANOG表达的免疫细胞化学。(10D)诱导为重编程且在Matrigel或玻连蛋白涂布的培养板上维持的FTC007的第16天流动概况分析。(10E)亮视野图像,(10F)关于OCT4和NANOG的免疫荧光,或(10G)关于在Matrigel上连续或关于5次传代玻连蛋白的在FMM中维持的FTC016-c28的SSEA4和TRA1-81的流式细胞术分析。
图11A-11C显示了对于FMM培养平台,最低限度基因重编程的例子。(11A)使用含有潮霉素选择盒的附加型构建体,从转染后第2天到第5天用潮霉素处理的细胞的形态。(11B)重编程库维持更长持续时间且在转染后第16天时进行概况分析。(11C)在Matrigel或玻连蛋白上维持的培养物外观。
图12A-12E显示了在多重条件下培养的hiPSC的特征。(12A)慢病毒衍生和SMC4维持的FTi111展示多能性的标志且维持基因组完整性。(12B)FTi111p43的解冻策略描述。单个小瓶如注明的解冻到四个培养环境内。存活培养物在分别培养中进行传代,除了在饲养细胞上补充有thiazovivin的常规培养之外,所述常规培养在饲养细胞的存在下转变为不含Thiazovivin的常规培养,且作为块进行传代。(12C)在解冻后的各种培养中的回收细胞的形态。在饲养细胞的存在下,在不含Thiazovivin的常规培养中未鉴定到存活细胞。(12D)在解冻后的第3代时的培养集合的形态。更大的集落形态与常规培养相关。比例尺1000μm。(12E)关于每个培养集合的内源多能基因表达的qRT-PCR分析。数据针对GAPDH且相对于H1hESC进行标准化。
图13A-13E显示了在各种条件下培养的hiPSC的基因表达概况的基因本体学。(13A)描述在总体基因表达研究中所述的每个系的衍生和维持的表。(13B)总共300个探针组在常规和小分子(FMM和SMC4)培养条件之间差异表达大于或小于2.5倍。基于欧几里得距离测量,使用完全连锁方法,关于300个探针组的分层聚类。(13C)对于常规培养(与小分子培养相比较),133个探针组的基因本体生物过程富集分析(D.A.V.I.D.)上调2.5倍或更大。(13D)对于小分子培养(与常规培养相比较),167个探针组的基因本体生物过程富集分析(D.A.V.I.D.)上调2.5倍或更大。(13E)对于FMM培养(与常规培养相比较),126个探针组的基因本体生物过程富集分析上调2.5倍或更大。
图14A-14F显示了示出用于重编程的慢病毒构建体(14A-14B)和附加型构建体(14C-14F)的例子的克隆图。慢病毒构建体包括EF1α启动子和关于CRE介导的转基因切除的LOXP位点。附加型构建体还包括EF1α启动子。
图15A-15C显示了在第8-15天时,关于各种重编程因子组合的代表性流动分析。人成纤维细胞用慢病毒介导的重编程因子包括OCT4、ECAT1和UTF1的各种组合进行诱导。
图16A-16D显示了在第21-27天时,关于各种重编程因子组合的代表性流动分析和iPSC形态特征。数据显示独特重编程组合可用于衍生SSEA4+/TRA181+hiPSC。
图17A-17B显示了如通过流动分析(SSEA4+/TRA181+和CD30+群)和iPSC形态特征示出的高度增强的慢病毒重编程效率。人成纤维细胞用OCT4、ECAT1、UTF1、ESRRB和NANOG进行重编程。细胞使用FRM进行重编程且在FMM中维持。
图18A-18D显示了在96孔分选后,在7-9次传代后,建立的四个iPSC克隆的代表性流动分析和相图像。克隆用慢病毒重编程因子(OCT4、ECAT1、UTF1、ESRRB和NANOG)与FRM生成且在FMM中维持。表达高SSEA4+/TRA181+的群指示多能性。
图19A-19B显示了在用慢病毒重编程因子OCT4、ECAT1、UTF1、NANOG和ESRRB重编程的人成纤维细胞中的OCT4和NANOG表达的代表性流动分析。克隆使用FRM进行重编程且在FMM中维持。表达高OCT4+/NANOG+的群指示多能性。
图20A-20C显示了来源于用慢病毒重编程因子OCT4、ECAT1、UTF1、NANOG和ESRRB重编程的人成纤维细胞的hIPSC克隆的核型分析。克隆使用FRM进行重编程且在FMM中维持。克隆显示出正常、雄性核型。
图21显示了与重编程因子组合OCT4/NANOG/SOX2/LARGE T相比较,重编程因子组合OCT4/ESRRB/NANOG/ECAT1/UTF1的96孔板分选效率。
图22A-22B显示了(22A)在4、6和11天时,用OCT4-P2A-OCT4/NANOG-P2A-ESRRB-T2A-LIN28/ECAT1-T2A-UTF1,和(22B)对于两个孔在7天时和一个孔在10天时,用OCT4-P2A-ESRRB/OCT4-P2A-NANOG/ECAT1-T2A-UTF1重编程的细胞的96孔扩增期间的集落图像。
图23A-23C显示了(23A)证实重编程因子化学计量学的效应的流动分析和使用遗传标记物用于选择具有异位OCT4表达的细胞的结果概括,(23B)关于用附加型OCT4-P2A-NANOG-T2A-SOX2/SV40大T抗原重编程,不含OCT4的选择的人成纤维细胞的流动分析,和(23C)关于用附加型OCT4-P2A-NANOG-T2A-SOX2/SV40大T抗原/OCT2-P2A-OCT4-嘌呤霉素重编程的人成纤维细胞的流动分析。
图24显示了对于多能性标记物OCT4(绿色)和TRA181(红色)用以蓝色的DAPI染色的衍生的iPSC克隆的免疫荧光分析。
图25显示了CRE介导的切除后,SSEA4+/TRA181+/CD30+96孔板分选的克隆的图像。集落由最初来源于人成纤维细胞的iPSC克隆进行分选,用慢病毒因子OCT4、ECAT1、UTF1、NANOG和ESRRB进行重编程,并且随后就转基因进行切除。分选的集落显示iPSC表型。
具体实施方式
A.概述
用于多能细胞的生产和维持的现有方法仍未实现无足迹多能细胞的同质培养,所述多能细胞不含自发分化且顺应高分辨率/高克隆形成能力单细胞传代和大规模扩增。基态多能细胞可赋予克服这些挑战的质量和特征。然而,迄今为止,不存在在无饲养者条件下基态多能细胞的高流通量生成的可靠或稳健的方法。因此,现有方法可能不适合于生产工业或临床级别的多能细胞。本文考虑的本发明解决了在基态多能性中或具有基态多能性特征的稳定多能细胞的稳健生成的需要,并且解决了在适合于工业和临床使用的稳定多能细胞制造中的问题。
一般而言,本发明涉及用于多能细胞,特别是具有减少的自发分化的细胞,包括基态多能细胞的改良制造的组合物和方法。更特别地,本发明涉及以阶段特异性方式,利用细胞信号转导途径的小分子调制剂的多阶段培养平台,且使多能细胞能够衍生和维持至其中培养方法和衍生多能细胞的方法不再是下游使用的变化性和/或门控活性源的点。此外,本文考虑的培养平台使多能细胞在无饲养者条件下的衍生和维持成为可能,具有改善的基因组稳定性、改善的未分化状态、减少的自发分化、改善的培养同质性、改善的培养中的存活、解离和单个多能细胞的传代,以及使细胞无转基因或足迹重编程为基态多能性的改良方法。因此,本文考虑的组合物和方法使多能细胞和/或基态多能细胞的制造成为可能,所述多能细胞适合于工业和临床用途。
迄今为止,小分子驱动的平台未证实增强来源于人细胞的无足迹诱导多能干细胞(iPSC)的重编程且支持单细胞和FF培养的能力(Nichols和Smith,2012)。本文考虑的培养平台部分提供了小分子抑制剂的特定组合以阶段特异性方式的应用,以使多能干细胞能够快速和稳健的重编程以及稳定的长期培养。在各个实施例中,本发明提供了用于诱导或维持改善的未分化多能态包括基态多能性的培养平台。本文考虑的平台还提供了用于生产和维持人iPSC(hiPSC)中的基态多能性的稳健培养系统。在一个实施例中,培养平台使无转基因或足迹的重编程方法成为可能。在特定实施例中,本文考虑的平台代表用于制造hiPSC的改良方法,所述方法克服在无转基因hiPSC的多路衍生和维持中的关键挑战。
除非特别指出相反,否则本发明的实践将采用在本领域技术内的化学、生物化学、有机化学、分子生物学、微生物学、重组DNA技术、遗传学、免疫学、细胞生物学、干细胞方案、细胞培养和转基因生物学的常规方法,其中许多在下文描述用于举例说明的目的。此类技术在文献中充分说明。参见例如Sambrook等人,Molecular Cloning:A Laboratory Manual(第3版,2001);Sambrook等人,Molecular Cloning:A Laboratory Manual(第2版,1989);Maniatis等人,Molecular Cloning:A Laboratory Manual(1982);Ausubel等人,Current Protocols in Molecular Biology(John Wiley and Sons,2008年7月更新);Short Protocols in Molecular Biology:A Compendium of Methods from Current Protocols in Molecular Biology,Greene Pub.Associates and Wiley-Interscience;Glover,DNA Cloning:A Practical Approach,第I&II卷(IRL Press,Oxford,1985);Anand,Techniques for the Analysis of Complex Genomes,(Academic Press,New York,1992);Guthrie和Fink,Guide to Yeast Genetics and Molecular Biology(Academic Press,New York,1991);Oligonucleotide Synthesis(N.Gait编辑,1984);Nucleic Acid Hybridization(B.Hames&S.Higgins编辑,1985);Transcription and Translation(B.Hames&S.Higgins编辑,1984);Animal Cell Culture(R.Freshney编辑,1986);Perbal,A Practical Guide to Molecular Cloning(1984);Fire等人,RNA Interference Technology:From Basic Science to Drug Development(Cambridge University Press,Cambridge,2005);Schepers,RNA Interference in Practice(Wiley-VCH,2005);Engelke,RNA Interference(RNAi):The Nuts&Bolts of siRNA Technology(DNA Press,2003);Gott,RNA Interference,Editing,and Modification:Methods and Protocols(Methods in Molecular Biology;Human Press,Totowa,NJ,2004);Sohail,Gene Silencing by RNA Interference:Technology and Application(CRC,2004);Clarke和Sanseau,microRNA:Biology,Function&Expression(Nuts&Bolts series;DNA Press,2006);Immobilized Cells And Enzymes(IRL Press,1986);the treatise,Methods In Enzymology(Academic Press,Inc.,N.Y.);Gene Transfer Vectors For Mammalian Cells(J.H.Miller和M.P.Calos编辑,1987,Cold Spring Harbor Laboratory);Harlow和Lane,Antibodies,(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1998);Immunochemical Methods In Cell And Molecular Biology(Mayer和Walker编辑,Academic Press,London,1987);Handbook Of Experimental Immunology,第I-IV卷(D.M.Weir和C.Blackwell编辑,1986);Riott,Essential Immunology,第6版,(Blackwell Scientific Publications,Oxford,1988);Embryonic Stem Cells:Methods and Protocols(Methods in Molecular Biology)(Kurstad Turksen编辑2002);Embryonic Stem Cell Protocols:Volume I:Isolation and Characterization(Methods in Molecular Biology)(Kurstad Turksen编辑,2006);Embryonic Stem Cell Protocols:Volume II:Differentiation Models(Methods in Molecular Biology)(Kurstad Turksen编辑,2006);Human Embryonic Stem Cell Protocols(Methods in Molecular Biology)(Kursad Turksen编辑,2006);Mesenchymal Stem Cells:Methods and Protocols(Methods in Molecular Biology)(Darwin J.Prockop,Donald G.Phinney和Bruce A.Bunnell编辑,2008);Hematopoietic Stem Cell Protocols(Methods in Molecular Medicine)(Christopher A.Klug和Craig T.Jordan编辑,2001);Hematopoietic Stem Cell Protocols(Methods in Molecular Biology)(Kevin D.Bunting编辑,2008)Neural Stem Cells:Methods and Protocols(Methods in Molecular Biology)(Leslie P.Weiner编辑2008);Hogan等人,Methods of Manipulating the Mouse Embyro(第2版,1994);Nagy等人,Methods of Manipulating the Mouse Embryo(第3版,2002),和The Zebrafish book.A guide for the laboratory use of zebrafish(Danio rerio),第4版,(Univ.of Oregon Press,Eugene,OR,2000)。
本文引用的所有出版物、专利和专利申请在此以引用的方式全文并入。
B.定义
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解相同的含义。为了本发明的目的,下文定义了下述术语。
冠词“一个”、“一种”和“该/所述”在本文中用于指一个或超过一个(即至少一个)冠词的语法对象。例如,“元件”意指一个元件或超过一个元件。
替代(例如“或”)的使用应理解为意指替代方案中任一、两者或其任何组合。
术语“和/或”应理解为意指替代方案中任一或两者。
如本文使用的,术语“约”或“大约”指与参考数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度相比较,改变多达15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度。在一个实施例中,术语“约”或“大约”指围绕参考数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度±15%、±10%、±9%、±8%、±7%、±6%、±5%、±4%、±3%、±2%或±1%的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度范围。
如本文使用的,术语“基本上”或“大体上”指与参考数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度相比较,约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%或更高的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度。在一个实施例中,术语“大体上相同”或“基本上相同”指与参考数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度大约相同的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度范围。
如本文使用的,术语“基本上不含”和“大体上不含”可互换使用,并且当用于描述组合物例如细胞群或培养基时,指不含指定物质,例如95%不含、96%不含、97%不含、98%不含、99%不含指定物质的组合物,或如通过常规手段测量是无法检测的。类似含义可应用于术语“不存在”,当指不存在组合物的特定物质或组分时。
如本文使用的,术语“可观的”指通过一种或多种标准方法可容易检测的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度范围。术语“不可观的(not-appreciable)”和“不可观的(not appreciable)”以及等价物指通过标准方法无法容易检测或无法检测的数量、水平、值、数目、频率、百分比、尺度、大小、量、重量或长度范围。在一个实施例中,如果事件小于5%、4%、3%、2%、1%、0.1%、0.01%、0.001%或更少的时间发生,则它是不可观的。
本说明书自始至终,除非上下文另有要求,否则单词“包含(comprise)”、“包含(comprises)”和“包含(comprising)”应理解为暗示包括所述步骤或元件或者步骤或元件组,但不排除任何其他步骤或元件或者步骤或元件组。在特定实施例中,术语“包括”、“具有”、“含有”和“包含”同义使用。
“由……组成”意指包括但限制于在短语“由……组成”后的任何。因此,短语“由……组成”指示所列出的元件是必需或强制性的,并且可不存在其他元件。
“基本上由……组成”意指包括在短语后列出的任何元件,并且限制于不干扰或促成所列出的元件的公开内容中指定的活性或动作的其他元件。因此,短语“基本上由……组成”指示所列出的元件是必需或强制性的,但其他元件并非任选的,并且取决于它们是否影响所列出的元件的活性或动作,可存在或不存在。
本说明书自始至终提及“一个实施例”、“实施例”、“特定实施例”、“相关实施例”、“某个实施例”、“另外的实施例”或“进一步的实施例”或其组合意指与实施例结合描述的特定特点、结构或特征包括在本发明的至少一个实施例中。因此,前述短语在本说明书自始至终的各个地方的出现不一定全部指相同实施例。此外,特定特点、结构或特征可以任何合适方式在一个或多个实施例中组合。
术语“离体”一般指在生物外发生的活性,例如在生物外的人工环境中在活组织中或活组织上完成的实验或测量,优选伴随天然条件的最低限度改变。在特定实施例中,“离体”程序涉及从生物中获得的活细胞或组织,并且在实验室仪器中培养,通常在无菌条件下,且通常为数小时或最高达约24小时,但包括最高达48或72小时,取决于环境。在某些实施例中,可收集且冷冻此类组织或细胞,并且随后解冻用于离体处理。使用活细胞或组织持续长于几天的组织培养实验或程序通常视为“在体外”,尽管在某些实施例中,该术语可与离体互换使用。
术语“在体内”一般指在生物内发生的活性。
如本文使用的,术语“重编程”或“去分化”或“增加细胞潜能”或“增加发育潜能”指增加细胞潜能或使细胞去分化为较少分化状态的方法。例如,与非重编程状态中的相同细胞相比较,具有增加的细胞潜能的细胞具有更多发育可塑性(即可分化成更多细胞类型)。换言之,重编程细胞是处于比非重编程状态中的相同细胞较少分化状态的细胞。
如本文使用的,术语“潜能”指细胞可接近的所有发育选项总和(即发育潜能)。本领域普通技术人员将认识到细胞潜能是连续体,范围从最多可塑性细胞(具有最多发育潜能的全能干细胞)到最少可塑性细胞(具有最少发育潜能的终末分化细胞)。细胞潜能的连续体包括但不限于全能细胞、多能细胞、多潜能细胞、寡能细胞、单能细胞和终末分化细胞。
如本文使用的,术语“多能的”指细胞形成机体或躯体(即胚体)的所有谱系的能力。例如,胚胎干细胞是能够形成来自三个胚层各自的细胞的一类多能干细胞:外胚层、中胚层和内胚层。
多能性可部分通过评价细胞的多能性特征进行测定。多能性特征包括但不限于:(i)多能干细胞形态;(ii)无限自我更新的潜能,(iii)多能干细胞标记物包括但不限于下述的表达:SSEA1(仅小鼠)、SSEA3/4;SSEA5、TRA1-60/81;TRA1-85、TRA2-54、GCTM-2、TG343、TG30、CD9、CD29、CD133/prominin、CD140a、CD56、CD73、CD90、CD105、OCT4、NANOG、SOX2、CD30和/或CD50;(iv)分化成所有三个体细胞谱系(外胚层、中胚层和内胚层)的能力,(v)由三个体细胞谱系组成的畸胎瘤形成;和(vi)由来自三个体细胞谱系的细胞组成的胚状体形成。
两类多能性先前已得到描述:类似于晚期胚泡的上胚层干细胞(EpiSC)的多能性的“引发”或“亚稳”态,以及类似于早期/植入前胚泡的内细胞团的多能性的“幼稚”或“基”态。虽然两种多能状态均显示出如上所述的特征,但幼稚或基态还显示出:(i)雌性细胞中的X染色体的预失活或复活,(ii)在单细胞培养期间改善的克隆形成能力和存活,(iii)DNA甲基化的总体减少,(iv)在发育调节基因启动子上的H3K27me3阻遏染色质标记物沉积的减少,和(v)相对于引发态多能细胞,分化标记物的减少表达。其中外源多能性基因引入体细胞、表达且随后沉默或从所得的多能细胞中去除的细胞重编程的标准方法一般可见具有多能性引发态的特征。在标准多能细胞培养条件下,此类细胞保持引发态,除非外源转基因表达得到维持,其中观察到基态的特征。
如本文使用的,术语“多能干细胞形态”指胚胎干细胞的典型形态特点。正常胚胎干细胞形态的特征在于圆且小的形状、具有高核质比、核仁的显著存在和典型细胞间间隔。
如本文使用的,术语“基因表达谱”、“基因表达标志”、“基因表达板(panel)”、“基因板”或“基因标志”指多重基因的表达或表达水平,所述基因作用于区分细胞或细胞群与另一细胞或细胞群。例如,在培养基中维持以防止自发分化的多能细胞群可展示基因表达谱,所述基因表达谱包含相对于并非在相同培养基中维持的相同起源的多能细胞对照群的分化基因的减少表达。
如本文使用的,术语“分化标记物基因”或“分化基因”指其表达指示在细胞例如多能细胞内发生的细胞分化的基因。分化标记物基因包括但不限于下述基因:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
如本文使用的,术语“分化标记物基因谱”、或“分化基因谱”、“分化基因表达谱”、“分化基因表达标志”、“分化基因表达板”、“分化基因板”或“分化基因标志”指多重分化标记物基因的表达或表达水平。
在特定实施例中,显示减少的自发分化的多能细胞群的特征可在于分化标记物基因或分化标记物基因谱的表达的减少。例如,可指示多能细胞或多能细胞群中减少的自发分化,其中与缺乏相同培养条件的对照多能细胞或多能细胞群的分化标记物基因表达相比较,给定组的培养条件引起一种或多种分化标记物基因表达的至少10%、20%、25%、30%、40%、50%、60%、70%、80%、90%或更多的减少。
如本文使用的,“基因表达”指生物样品例如多能细胞或包含多能细胞的细胞群中的基因的表达和/或表达模式的相对水平。在特定实施例中,多能细胞是iPSC。
本文涵盖本领域可得的用于检测表征本发明细胞的基因表达的任何方法。如本文使用的,术语“检测表达”意指测定基因的RNA转录物或其表达产物的数量或存在。用于检测基因表达的方法,即基因表达概况分析,包括基于多核苷酸的杂交分析的方法、基于多核苷酸测序的方法、免疫组织化学方法和基于蛋白质组学的方法。方法一般检测目的基因的表达产物(例如mRNA)。在一些实施例中,使用基于PCR的方法例如逆转录PCR(RT-PCR)(Weis等人,TIG 8:263-64,1992),以及基于阵列的方法例如微阵列(Schena等人,Science 270:467-70,1995)。
“贴壁”指在适当培养基的存在下,细胞附着至容器,例如细胞附着至无菌塑料(或涂布塑料)细胞培养皿或烧瓶。某些类别的细胞在培养中无法持续或不生长,除非它们贴壁至细胞培养容器。某些类别的细胞(“非贴壁细胞”)无需贴壁在培养中维持和/或增殖。
“培养”或“细胞培养”指在体外环境中的细胞维持、生长和/或分化。“细胞培养基”、“培养基”(在每种情况下单数的“培养基”)、“补充物”和“培养基补充物”指栽培细胞培养物的营养组合物。
“栽培”指在组织或机体外,例如在无菌塑料(或涂布塑料)细胞培养皿或烧瓶中的细胞持续、繁殖(生长)和/或分化。“栽培”可利用培养基作为营养素、激素和/或帮助使细胞繁殖和/或持续的其他因子的源。
如本文使用的,“解离的”细胞指已与其他细胞或表面(例如培养板表面)基本上分开或者纯化离开其他细胞的细胞。例如,细胞可通过机械或酶促方法与动物或组织解离。可替代地,在体外聚集的细胞可酶促或机械地例如通过解离成簇、单细胞或单细胞和簇的混合物的悬浮液彼此解离。在另外一个可替代实施例中,贴壁细胞与培养板或其他表面解离。解离因此可涉及破坏细胞与细胞外基质(ECM)和基质(例如培养表面)的相互作用,或破坏细胞之间的ECM。
如本文使用的,术语“富集(enrich)”和“富集(enriching)”指增加组合物例如细胞组合物中的指定组分的量,并且当用于描述细胞的组合物例如细胞群时,“富集的”指与富集前细胞群中的此类组分的比例相比较,具有按比例增加量的指定组分的细胞群。例如,组合物例如细胞群可就靶细胞类型(即具有指定特征的细胞)而言进行富集,因此与富集前细胞群中存在的靶细胞比例相比较,具有增加比例或百分比的靶细胞类型。细胞群可通过本领域已知的细胞选择和分选方法就靶细胞类型进行富集。在一些实施例中,细胞群通过如本文实例中所述的分选或选择方法进行富集。在一个特定实施例中,就靶细胞群富集的方法使细胞群就靶细胞群而言富集至少约20%,从而意指富集的细胞群包含比群富集前群中按比例多约20%的靶细胞类型。在一个实施例中,就靶细胞群富集的方法使细胞群就靶细胞群而言按比例富集至少约30+%、40+%、50+%、60+%、70+%、80%、85%、90%、95%、97%、98%或99%,或至少约98%,或在特定实施例中,约99%。
在某些实施例中,细胞群就多能细胞或显示出多能性特征的细胞的量而言进行富集。在本发明的特定实施例中,经历重编程的细胞群就具有多能性特征的靶细胞进行富集,所述多能性特征例如表达多能性标记物包括但不限于SSEA3、SSEA4、TRA 1-60、TRA-1-81、CD30或CD50。
在特定实施例中,使用对于分化细胞谱系或非多能细胞特异性的表面标记物,使细胞群例如经历重编程的细胞群耗尽非多能细胞,所述表面标记物可包括例如CD13、CD26、CD34、CD45、CD31、CD46或CD7。所得到的细胞群因此可描述为富含多能细胞的细胞群。
在特定实施例中,富集细胞包含不同的基因或蛋白质表达谱,例如至少两种多能性标记物例如SSEA3、SSEA4、TRA 1-60、TRA-1-81、CD30和CD50的细胞表面表达。在一些实施例中,富集细胞包含两种或更多种多能性标记物。在特定实施例中,富集细胞表达与TRA-181或TRA-160组合的SSEA4。在更特定的实施例中,富集细胞表达SSEA4、TRA181和CD30。在一个实施例中,细胞群包含至少约5%、10%、15%、20%、25%、30%、40%、50%、70%、75%、80%、90%、95%、97%、98%或99%的富集细胞例如多能细胞。
因此,在一些实施例中,就多能细胞富集细胞群的方法包括基于多能性标记物例如SSEA3、SSEA4、TRA 1-60、TRA-1-81、CD30和CD50的细胞表面表达分选细胞群,并且收集表达此类标记物的细胞级分,以获得富含多能细胞的细胞群。在其他实施例中,通过基于分化中或分化细胞标记物例如CD13、CD26、CD34、CD45、CD31、CD46和CD7的细胞表面表达分选细胞群,并且耗尽此类细胞的细胞群以获得富含多能细胞的细胞群,使细胞群富含多能细胞。在特定实施例中,细胞群基于CD13的表达进行分选,并且从细胞群中去除CD13+细胞,以获得富含多能细胞的细胞群。
如本文使用的,“饲养细胞”或“饲养者”是用于描述与第二类型的细胞共培养的一个类型的细胞,以提供第二类型的细胞可在其中生长的环境,因为饲养细胞提供用于支持第二细胞类型的生长因子和营养素。饲养细胞任选来自与它们支持的细胞不同的物种。例如,某些类型的人细胞包括干细胞可通过小鼠胚胎成纤维细胞和永生化小鼠胚胎成纤维细胞的原代培养物得到支持。当与其他细胞共培养时,饲养细胞通常可通过照射或用抗有丝分裂剂例如丝裂霉素c处理而失活,以防止其生长超过它们支持的细胞。不限于前文,一个具体饲养细胞类型可为人饲养者,例如人皮肤成纤维细胞。另一饲养细胞类型可以是小鼠胚胎成纤维细胞(MEF)。
如本文使用的,“无饲养者”(FF)环境指大体上不含饲养细胞和/或未通过饲养细胞栽培而预条件化的环境例如细胞培养或培养基。“预条件化的”培养基指在饲养细胞已在培养基内栽培一段时间例如至少一天后收获的培养基。预条件化的培养基含有许多介质物质,包括通过在培养基中栽培的饲养细胞分泌的生长因子和细胞因子。
基因组稳定性指细胞忠实复制DNA且维持DNA复制过程的完整性的能力。如本文使用的,术语“基因组稳定的细胞”和“具有基因组稳定性的细胞”指显示出一定频率的突变和染色体异常(例如易位、非整倍体、拷贝数变异和重复)的细胞,所述频率基本上类似于相对于正常人体细胞的突变和染色体异常的频率。
“成分”指可用于细胞培养基中以维持和/或促进细胞生长和/或分化的任何化合物或其他材料,无论在起源中是化学还是生物的。术语“组分”、“营养素”和“成分”可互换使用。用于细胞培养基的常规成分可包括但不限于氨基酸、盐、金属、糖、脂质、核酸、激素、维生素、脂肪酸、蛋白质等等。促进和/或维持离体细胞栽培的其他成分可通过本领域普通技术人员根据需要对于所需效应加以选择。
“分离(isolate)”或“分离(isolating)”指使组合物或材料与其天然环境分开且收集,例如个别细胞或细胞培养物与组织或机体的分开。在一个方面,细胞群或组合物基本上不含它在自然界中可与之结合的细胞和材料。就靶细胞群而言,“分离的”或“纯化的”或“基本上纯的”指就构成总细胞群的靶细胞而言,至少约50%、至少约75%、至少约85%、至少约90%,并且在特定实施例中,至少约95%纯的细胞群。细胞群或组合物的纯度可通过本领域众所周知的适当方法进行评价。例如,基本上纯的多能细胞群指就构成总细胞群的多能细胞而言,至少约50%、至少约75%、至少约85%、至少约90%,并且在特定实施例中,至少约95%,并且在某些实施例中,约98%纯的细胞群。术语“大体上纯的”在本文中可与“基本上纯的”互换使用。
“传代(passage)”或“传代(passaging)”指当细胞已增殖至所需程度时,将细胞细分且铺平板到多重细胞培养表面或容器内的动作。在一些实施例中,“传代(passage)”或“传代(passaging)”指将细胞细分、稀释且铺平板。当细胞从原代培养表面或容器传代到后续组的表面或容器内时,后续培养在本文中可被称为“继代培养”或“第一次传代”等。每个细分且铺平板到新培养容器内的动作被视为一次传代。
“铺平板”指将一个或多个细胞置于培养容器内,使得细胞贴壁至细胞培养容器且在细胞培养容器上铺展。
“多能性因子”指单独或与其他试剂组合能够增加细胞的发育潜能的试剂。多能性因子包括但不限于能够增加细胞的发育潜能的多核苷酸、多肽和小分子。示例性多能性因子包括例如转录因子和小分子重编程试剂。
“增殖”指一个细胞分裂成两个大体上等同的细胞或细胞群数目增加(例如复制)的性质。
“繁殖”指使组织或机体外的细胞例如在无菌容器例如塑料(或涂布塑料)细胞培养皿或烧瓶中生长(例如经由细胞增殖复制)。
“原代培养”指其中经分离的细胞置于具有培养基的第一培养容器中的细胞、组织和/或培养物。然而,细胞、组织和/或培养物可持续和/或可增殖,只要细胞、组织和/或培养物保留在第一容器中,细胞、组织和/或培养物被称为原代培养。
术语“小分子重编程试剂”或“小分子重编程化合物”在本文中可互换使用,并且指单独或与其他多能性因子组合可增加细胞的发育潜能的小分子。“小分子”指具有小于约5kD、小于约4kD、小于约3kD、小于约2kD、小于约1kD或小于约.5kD的分子量的试剂。小分子包括但不限于:核酸、拟肽、类肽、碳水化合物、脂质或者其他有机或无机分子。化学和/或生物混合物例如真菌、细菌或藻类提取物的文库是本领域已知的,并且在某些实施例中,可用作小分子源。在特定实施例中,本文使用的小分子重编程试剂具有小于10,000道尔顿,例如小于8000、6000、4000、2000道尔顿,例如在50-1500、500-1500、200-2000、500-5000道尔顿之间的分子量。
C.细胞
在一个特定实施例中,一个或多个细胞可使用本文考虑的组合物和方法进行培养、解离且传代。在一个实施例中,单细胞使用本文考虑的组合物和方法进行培养、解离且传代。在另一个实施例中,细胞群或多个细胞使用本文考虑的组合物和方法进行培养、解离且传代。
适用于特定实施例中的起始细胞群可来源于大体上任何合适的源,并且就细胞类型或多能性状态而言可以是异质或同质的。合适的细胞包括胎儿细胞和成人细胞。另外,合适的细胞在起源中可以是哺乳动物,例如来自啮齿类动物、猫、犬、猪、山羊、绵羊、马、牛或灵长类动物。在一个实施例中,细胞是人细胞。
细胞可以是体细胞、非多能、不完全或部分多能干细胞、多潜能细胞、寡能细胞、单能细胞、终末分化细胞、或包含前述的任何组合的混合细胞群。适用于特定实施例中的多能细胞包括但不限于天然存在的干细胞、胚胎干细胞或iPSC。“混合”细胞群是具有不同程度的发育潜能的细胞群。例如,混合细胞群可包含经历重编程的细胞,使得混合群包含多能细胞、部分多能细胞和非多能细胞例如完全分化细胞。
在一个实施例中,起始细胞群选自成人或新生儿干/祖细胞。在特定实施例中,起始干/祖细胞群选自:中胚层干/祖细胞、内胚层干/祖细胞和外胚层干/祖细胞。
中胚层干/祖细胞的举例说明性例子包括但不限于:中胚层干/祖细胞、内皮干/祖细胞、骨髓干/祖细胞、脐带干/祖细胞、脂肪组织衍生的干/祖细胞、造血干/祖细胞(HSC)、间充质干/祖细胞、肌肉干/祖细胞、肾干/祖细胞、成骨细胞干/祖细胞、软骨细胞干/祖细胞等等。
外胚层干/祖细胞的举例说明性例子包括但不限于神经干/祖细胞、视网膜干/祖细胞、皮肤干/祖细胞等等。
内胚层干/祖细胞的举例说明性例子包括但不限于肝干/祖细胞、胰腺干/祖细胞、上皮干/祖细胞等等。
在某些实施例中,起始细胞群可以是选自下述的异质或同质细胞群:胰岛细胞、CNS细胞、PNS细胞、心肌细胞、骨骼肌细胞、平滑肌细胞、造血细胞、骨细胞、肝细胞、脂肪细胞、肾细胞、肺细胞、软骨细胞、皮肤细胞、滤泡细胞、血管细胞、上皮细胞、免疫细胞、内皮细胞等等。
D.用于减少自发分化和诱导基态多能性的培养平台
细胞建库、疾病建模和细胞疗法应用已对制造高质量多能细胞提出渐增需求。例如,无足迹iPSC的高流通量衍生及其在允许规模化生产的系统中的扩增仍是技术上难以捉摸的。在特定实施例中,考虑了允许在阶段特异性培养基组合物中使用小分子途径抑制剂的多能细胞的快速、平行生成、选择和扩增的培养平台。本文考虑的平台支持在完全无饲养者环境中使用最低限度重编程因子的有效和加快的重编程;使多能细胞的单细胞培养和扩增成为可能,同时维持同质和基因组稳定的多能群。此外,本文考虑的培养平台提供了将多能细胞包括hESC和hiPSC培养至减少的自发分化状态和常见的基态多能性,与遗传背景无关且不依赖于转基因表达。
本文考虑的培养平台可部分用于产生在培养中具有减少的自发分化的工业或临床级别的多能细胞。在一个实施例中,非多能细胞进行诱导,以变成多能细胞,并且培养以维持多能性。在另一个实施例中,非多能细胞进行诱导,以变成多能细胞,并且培养以实现和/或维持培养中减少的自发分化。在另一个实施例中,非多能细胞进行诱导,以变成多能细胞,并且培养以实现和/或维持基态多能性。
在各个实施例中,本文考虑的培养平台使一个或多个多能细胞维持基态多能性、正常核型和基因组稳定性至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、60、70、80、90、100次或更多次传代,包括任何中间数目的传代。
在其他实施例中,本文考虑的培养平台使一个或多个多能性细胞中减少的自发分化维持至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、60、70、80、90、100次或更多次传代,包括任何中间数目的传代。
在一个实施例中,培养平台包括细胞培养基,所述细胞培养基包含细胞培养基和GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂。在各个实施例中,本文考虑的细胞培养基不包含或缺乏TGFβ/激活素信号传导途径的抑制剂,包括TGFβ受体(TGFβR)抑制剂和ALK5抑制剂。不希望受任何特定理论束缚,本发明人惊讶地发现虽然TGFβR/ALK5抑制剂增加重编程效率,但这些抑制剂抵消多能细胞群的长期维持、质量和同质性,即TGFβ途径信号传导的抑制改善细胞重编程的效率,但从这种抑制中解除是多能细胞群在体外培养系统中,特别是在使用无饲养细胞和单细胞、酶促传代的系统中的后续维持所需的,其中具有减少的自发分化的同质多能群是优选的,并且更特别地,其中不存在转基因表达。另外,如本文公开的,在包含GSK-3抑制剂和MEK抑制剂和任选的ROCK抑制剂,但缺乏TGFβR/ALK5抑制剂的培养基中培养亚稳多能细胞,使多能细胞转变,以实现减少的自发分化和/或实现基态多能性。本文考虑的培养基平台还使多能细胞在无饲养者环境中的有效重编程和长期培养成为可能。此外,虽然“ALK5抑制剂”不预期涵盖非特异性激酶抑制剂,但“ALK5抑制剂”应理解为涵盖除ALK5之外还抑制ALK4和/或ALK7的抑制剂,例如SB-431542(参见例如Inman等人,J Mol.Pharmacol.62(1):65-74(2002))。
在一个优选实施例中,培养平台包括包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和任选的LIF和/或bFGF的细胞培养基,并且不包含TGFβ/激活素信号传导途径的小分子抑制剂,包括但不限于TGFβR或ALK5抑制剂。
在另外的实施例中,细胞培养基基本上不含细胞因子和/或生长因子,且任选是无饲养者环境。在其他实施例中,细胞培养基含有补充物例如血清、提取物、生长因子、激素、细胞因子等等。
在一个优选实施例中,培养平台包含无饲养者培养。
本文考虑的培养平台还提供众多优点,例如制造具有减少的自发分化和/或实现基态多能性的工业或临床级别多能细胞的同质群。如本文使用的,术语“同质的”指其中每个细胞与群中的其他细胞相同或基本上相同的细胞群。在一个实施例中,如果每个细胞表达与本文考虑的相同多能性标记物(例如SSEA4和TRA1-81)中的一种或多种,则细胞与群中的其他细胞相同。在一个实施例中,如果至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多细胞与群中的其他细胞相同或基本上相同,则群是同质的。
1.TGFβ受体/ALK5抑制剂
TGFβ受体(例如ALK5)抑制剂可包括针对TGFβ受体(例如ALK5)的抗体、TGFβ受体的显性失活(negative)变体和压制TGFβ受体表达的反义核酸。示例性TGFβ受体/ALK5抑制剂包括但不限于SB431542(参见例如Inman等人,Molecular Pharmacology 62(1):65-74(2002)),A-83-01也称为3-(6-甲基-2-吡啶基)-N-苯基-4-(4-喹啉基)-1H-吡唑-1-硫代甲酰胺(参见例如Tojo等人,Cancer Science 96(11):791-800(2005),且由例如Toicris Bioscience商购可得);2-(3-(6-甲基吡啶-2-基)-1H-吡唑-4-基)-1,5-萘啶,Wnt3a/BIO(参见例如以引用的方式并入本文的Dalton等人,WO2008/094597),BMP4(参见Dalton,同上),GW788388(-{4-[3-(吡啶-2-基)-1H-吡唑-4-基]吡啶-2-基}-N-(四氢-2H-吡喃-4-基)苯甲酰胺)(参见例如Gellibert等人,Journal of Medicinal Chemistry 49(7):2210-2221(2006)),SM16(参见例如Suzuki等人,Cancer Research 67(5):2351-2359(2007)),IN-1130(3-((5-(6-甲基吡啶-2-基)-4-(喹喔啉-6-基)-1H-咪唑-2-基)甲基)苯甲酰胺)(参见例如Kim等人,Xenobiotica 38(3):325-339(2008)),GW6604(2-苯基-4-(3-吡啶-2-基-1H-吡唑-4-基)吡啶)(参见例如de Gouville等人,Drug News Perspective 19(2):85-90(2006)),SB-505124(2-(5-苯并[1,3]二氧杂环戊烯-5-基-2-叔丁基-3H-咪唑-4-基)-6-甲基吡啶盐酸盐)(参见例如DaCosta等人,Molecular Pharmacology 65(3):744-752(2004))和嘧啶衍生物(参见例如以引用的方式并入本文的Stiefl等人,WO2008/006583中列出的那些)。此外,虽然“ALK5抑制剂”不预期涵盖非特异性激酶抑制剂,但“ALK5抑制剂”应理解为涵盖除ALK5之外还抑制ALK4和/或ALK7的抑制剂,例如SB-431542(参见例如Inman等人,J Mol.Pharmacol.62(1):65-74(2002))。不预期限制本发明的范围,认为ALK5抑制剂影响间充质至上皮转换/转变(MET)过程。TGFβ/激活素途径是上皮至间充质转变(EMT)的驱动物。因此,抑制TGFβ/激活素途径可有助于MET(即重编程)过程。
考虑到本文显示抑制ALK5的效应的数据,认为TGFβ/激活素途径的抑制将具有抑制ALK5的相似效应。因此,TGFβ/激活素途径的任何抑制剂(例如上游或下游)可与ALK5抑制剂组合使用或代替ALK5抑制剂使用,如本文的每个段落中所述。示例性TGFβ/激活素途径抑制剂包括但不限于:TGFβ受体抑制剂、SMAD 2/3磷酸化抑制剂、SMAD 2/3和SMAD 4相互作用抑制剂、以及SMAD 6和SMAD 7激活物/激动剂。此外,下文描述的分类仅用于组构目的,并且本领域技术人员将知道化合物可影响途径内的一个或多个点,并且因此化合物可在超过一个限定类别中起作用。
TGFβ受体(TGFβR)抑制剂可包括针对TGFβ受体的抗体、TGFβ受体的显性失活变体以及靶向TGFβ受体的siRNA或反义核酸。TGFβ受体抑制剂的具体例子包括但不限于SU5416;2-(5-苯并[1,3]二氧杂环戊烯-5-基-2-叔丁基-3H-咪唑-4-基)-6-甲基吡啶盐酸盐(SB-505124);lerdelimumb(CAT-152);美替木单抗(CAT-192);GC-1008;ID11;AP-12009;AP-11014;LY550410;LY580276;LY364947;LY2109761;SB-505124;SB-431542;SD-208;SM16;NPC-30345;Ki26894;SB-203580;SD-093;Gleevec;3,5,7,2',4'-五羟基黄酮(Morin);激活素-M108A;P144;可溶性TBR2-Fc;以及靶向TGFβ受体的反义转染的肿瘤细胞。(参见例如Wrzesinski等人,Clinical Cancer Research 13(18):5262-5270(2007);Kaminska等人,Acta Biochimica Polonica 52(2):329-337(2005);和Chang等人,Frontiers in Bioscience 12:4393-4401(2007))。
SMAD 2/3磷酸化抑制剂可包括针对SMAD2或SMAD3的抗体、SMAD2或SMAD3的显性失活变体、以及靶向SMAD2或SMAD3的反义核酸。抑制剂的具体例子包括PD169316;SB203580;SB-431542;LY364947;A77-01;和3,5,7,2',4'-五羟基黄酮(Morin)。(参见例如以引用的方式并入本文的Wrzesinski,同上;Kaminska,同上;Shimanuki等人,Oncogene 26:3311-3320(2007);和Kataoka等人,EP1992360)。
SMAD 2/3和smad4相互作用抑制剂可包括针对SMAD2、SMAD3和/或smad4的抗体,SMAD2、SMAD3和/或smad4的显性失活变体,以及靶向SMAD2、SMAD3和/或smad4的反义核酸。SMAD 2/3和smad4相互作用抑制剂的具体例子包括但不限于Trx-SARA、Trx-xFoxH1b和Trx-Lef1。(参见例如Cui等人,Oncogene 24:3864-3874(2005)和Zhao等人,Molecular Biology of the Cell,17:3819-3831(2006))。
SMAD 6和SMAD 7激活物/激动剂包括但不限于针对SMAD 6或SMAD 7的抗体,SMAD 6或SMAD 7的显性失活变体,以及靶向SMAD 6或SMAD 7的反义核酸。抑制剂的具体例子包括但不限于smad7-as PTO-寡核苷酸。(参见例如两者均以引用的方式并入本文的Miyazono等人,US6534476,以及Steinbrecher等人,US2005119203)。
2.WNT途径激动剂
如本文使用的,术语“Wnt信号促进试剂”、“Wnt途径激活试剂”或“Wnt途径激动剂”指Wnt信号传导途径的激动剂,包括但不限于Wntl、Wnt2、Wnt2b/13、Wnt3、Wnt3a、Wnt4、Wnt5a、Wnt5b、Wnt6、Wnt7a、Wnt7b、Wnt7c、Wnt8、Wnt8a、Wnt8b、Wnt8c、Wnt10a、Wntl0b、Wnt11、Wnt14、Wnt15或Wnt16中的一种或多种的激动剂。Wnt途径激动剂还包括但不限于下述多肽或其片段中的一种或多种:Dkk多肽、crescent多肽、cerberus多肽、axin多肽、Frzb多肽、T细胞因子多肽、或显性失活散乱(disheveled)多肽。
Wnt途径激动剂的非限制性例子还包括下述中的一种或多种:包含编码Wnt多肽的核苷酸序列的核酸,包含Wnt多肽的氨基酸序列的多肽,包含编码活化Wnt受体的核苷酸序列的核酸,包含活化Wnt受体的氨基酸序列的多肽,促进Wnt/β-连环蛋白信号传导的小有机分子,抑制Wnt拮抗剂的表达或活性的小有机分子,抑制Wnt拮抗剂表达的反义寡核苷酸,抑制Wnt拮抗剂表达的核酶,抑制Wnt拮抗剂表达的RNAi构建体、siRNA或shRNA,与Wnt拮抗剂结合且抑制Wnt拮抗剂活性的抗体,包含编码β-连环蛋白多肽的核苷酸序列的核酸,包含β-连环蛋白多肽的氨基酸序列的多肽,包含编码Lef-1多肽的核苷酸序列的核酸,包含Lef-1多肽的氨基酸序列的多肽。
Wnt途径激动剂还包括GSK3抑制剂,例如包含编码显性失活GSK-3、GSK3α或GSK3β多肽的核苷酸序列的核酸,包含显性失活GSK-3、GSK3α或GSK3β多肽的氨基酸序列的多肽,与GSK-3、GSK3α或GSK3β结合且抑制GSK-3、GSK3α或GSK3β的表达或活性的小有机分子,与GSK-3、GSK3α或GSK3β结合且抑制GSK-3、GSK3α或GSK3β的表达和/或活性的RNAi构建体、siRNA或shRNA,与GSK-3、GSK3α或GSK3β结合且抑制GSK-3、GSK3α或GSK3β的表达的反义寡核苷酸,与GSK-3、GSK3α或GSK3β结合且抑制GSK-3、GSK3α或GSK3β的表达和/或活性的抗体,与GSK-3、GSK3α或GSK3β结合且抑制GSK-3、GSK3α或GSK3β的表达的核酶,以及在效应上类似于GSK3抑制的活化β-连环蛋白靶基因的任何GSK-3不依赖性试剂。
3.GSK-3β抑制剂
GSK-3β抑制剂是适用于本文考虑的组合物中的具体示例性Wnt途径激动剂,并且可包括但不限于多核苷酸、多肽和小分子。本文考虑的GSK-3β抑制剂可减少GSK-3β表达和/或GSK-3β活性。本文考虑的GSK-3β抑制剂的举例说明性例子包括但不限于抗GSK-3β抗体,显性失活GSK-3β变体,靶向GSK-3β的siRNA、shRNA、miRNA和反义核酸。
其他举例说明性GSK-3β抑制剂包括但不限于:肯帕罗酮、1-氮杂坎帕罗酮、CHIR99021、CHIR98014、AR-A014418、CT 99021、CT 20026、SB216763、AR-A014418、锂、SB 415286、TDZD-8、BIO、BIO-丙酮肟、(5-甲基-1H-吡唑-3-基)-(2-苯基喹唑啉-4-基)胺、吡啶卡巴唑-环戊二烯基钌络合物、TDZD-8 4-苄基-2-甲基-1,2,4-噻二唑烷-3-,5-二酮、2-硫代(3-碘苄基)-5-(1-吡啶基)-[1,3,4]-噁二唑、OTDZT、α-4-二溴苯乙酮、AR-AO 144-18、3-(1-(3-羟丙基)-1H-吡咯并[2,3-b]吡啶-3-基]-4-吡嗪-2-基-吡咯-2,5-二酮;TWSl 19吡咯并嘧啶化合物、L803H-KEAPPAPPQSpP-NH2或其肉豆蔻酰化形式;2-氯-1-(4,5-二溴-噻吩-2-基)-乙酮;GF109203X;RO318220;TDZD-8;TIBPO;和OTDZT。
在特定举例说明性实施例中,GSK-3β抑制剂是CHIR99021、BIO或肯帕罗酮。
在一个优选实施例中,GSK-3β抑制剂是CHIR99021。
4.ERK/MEK抑制剂
适用于本文考虑的组合物中的ERK/MEK抑制剂包括但不限于多核苷酸、多肽和小分子。本文考虑的ERK/MEK抑制剂可减少MEK或ERK表达和/或MEK或ERK活性。本文考虑的ERK/MEK抑制剂的举例说明性例子包括但不限于抗MEK或抗ERK抗体,显性失活MEK或ERK变体,靶向MEK或ERK的siRNA、shRNA、miRNA和反义核酸。
其他举例说明性ERK/MEK抑制剂包括但不限于PD0325901、PD98059、UO126、SL327、ARRY-162、PD184161、PD184352、舒尼替尼、索拉非尼、凡德他尼、帕唑帕尼、阿西替尼、GSKl 120212、ARRY-438162、RO5126766、XL518、AZD8330、RDEAl 19、AZD6244、FR180204和PTK787。
另外的举例说明性MEK/ERK抑制剂包括公开于国际公开专利申请WO 99/01426、WO 02/06213、WO 03/077914、WO 05/051301和WO2007/044084中的那些化合物。
MEK/ERK抑制剂的进一步举例说明性例子包括下述化合物:6-(4-溴-2-氯-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-羧酸(2,3-二羟基-丙氧基)-酰胺;6-(4-溴-2-氯-苯基氨基)-7-氟-3-(四氢-吡喃-2-基甲基)-3H-苯并咪唑-5-羧酸(2-羟基-乙氧基)-酰胺、1-[6-(4-溴-2-氯-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-基]-2-羟基乙酮、6-(4-溴-2-氯-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-羧酸(2-羟基-1,1-二甲基-乙氧基)-酰胺、6-(4-溴-2-氯-苯基氨基)-7-氟-3-(四氢-呋喃-2-基甲基)-3H-苯并咪唑-5-羧酸(2-羟基-乙氧基)-酰胺、6-(4-溴-2-氟-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-羧酸(2-羟基-乙氧基)-酰胺、6-(2,4-二氯-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-羧酸(2-羟基-乙氧基)-酰胺、6-(4-溴-2-氯-苯基氨基)-7-氟-3-甲基-3H-苯并咪唑-5-羧酸(2-羟基-乙氧基)-酰胺,下文被称为MEK抑制剂1;2-[(2-氟-4-碘苯基)氨基]-N-(2-羟基乙氧基)-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-甲酰胺;下文被称为MEK抑制剂2;和4-(4-溴-2-氟苯基氨基)-N-(2-羟基乙氧基)-1,5-二甲基-6-氧代-1,6-二氢哒嗪-3-甲酰胺或其药学可接受的盐。
在一个优选实施例中,MEK/ERK抑制剂是PD98059。
5.ROCK抑制剂
Rho相关激酶(ROCK)是充当Rho激酶的下游效应物的丝氨酸/苏氨酸激酶(其中存在三种同种型--RhoA、RhoB和RhoC)。适用于本文考虑的组合物中的ROCK抑制剂包括但不限于多核苷酸、多肽和小分子。本文考虑的ROCK抑制剂可减少ROCK表达和/或ROCK活性。本文考虑的ROCK抑制剂的举例说明性例子包括但不限于抗ROCK抗体,显性失活ROCK变体,靶向ROCK的siRNA、shRNA、miRNA和反义核酸。
本文考虑的举例说明性ROCK抑制剂包括但不限于:thiazovivin、Y27632、Fasudil、AR122-86、Y27632H-1152、Y-30141、Wf-536、HA-1077、羟基-HA-1077、GSK269962A、SB-772077-B、N-(4-吡啶基)-N'-(2,4,6-三氯苯基)脲、3-(4-吡啶基)-1H-吲哚、和(R)-(+)-反式-N-(4-吡啶基)-4-(1-氨基乙基)-环己烷甲酰胺以及公开于美国专利号8,044,201中的ROCK抑制剂,所述美国专利以引用的方式全文并入本文。
在一个实施例中,ROCK抑制剂是thiazovivin、Y27632或pyrintegrin。
在一个优选实施例中,ROCK抑制剂是thiazovivin。
在本文考虑的组合物和细胞培养基中的小分子的量可改变,并且可根据具体培养条件进行优化,包括所使用的具体分子和组合、在培养基中培养的细胞类型以及具体应用。在一个实施例中,小分子存在于组合物中的浓度足以诱导多能性、改善重编程效率、增加或维持细胞的潜能、或者诱导或维持基态多能性。
在特定实施例中,在本发明的细胞培养基中的小分子的优选浓度和组合在表1中显示为命运维持培养基(FMM)。培养基的组分可以在表1中所示的最佳浓度附近的最佳范围内的量存在于培养基中。命运重编程培养基(FRM)可用于包括细胞重编程的本文考虑的培养平台中,但不适合于基态多能细胞的建立和长期维持。
表1
6.细胞因子和生长因子
在特定实施例中,本发明的细胞培养基基本上不含细胞因子和/或生长因子。在某些实施例中,细胞培养基含有一种或多种补充物,包括但不限于血清、提取物、生长因子、激素、细胞因子等等。
在一个举例说明性实施例中,培养基可包含ECM蛋白、层粘连蛋白1、纤连蛋白、IV型胶原同种型、蛋白酶、蛋白酶抑制剂、细胞表面粘附蛋白、细胞信号传导蛋白质、钙粘素、氯离子细胞内通道1、跨膜受体PTK7、胰岛素样生长因子、或抑制素βA中的一种或多种,但不包含TGFβ/激动素/nodal信号传导途径的诱导物和激活素A。在其他实施例中,培养基可包含TGFβ/激动素/nodal信号传导途径的诱导物。
在另一个举例说明性实施例中,培养基包含下述细胞因子或生长因子中的一种或多种:表皮生长因子(EGF)、酸性成纤维细胞生长因子(aFGF)、碱性成纤维细胞生长因子(bFGF)、白血病抑制因子(LIF)、肝细胞生长因子(HGF)、胰岛素样生长因子-1(IGF-1)、胰岛素样生长因子2(IGF-2)、角化细胞生长因子(KGF)、神经生长因子(NGF)、血小板衍生的生长因子(PDGF)、转化生长因子β(TGF-β)、血管内皮细胞生长因子(VEGF)、转铁蛋白、各种白介素(如IL-1至IL-18)、各种集落刺激因子(如粒细胞/巨噬细胞集落刺激因子(GM-CSF))、各种干扰素(如IFN-γ)以及对干细胞具有作用的其他细胞因子例如干细胞因子(SCF)和促红细胞生成素(Epo)。这些细胞因子可在商业上得自例如R&D Systems,Minneapolis,Minn,并且可为天然的或重组的。在特定实施例中,生长因子和细胞因子可以本文考虑的浓度添加。在某些实施例中,生长因子和细胞因子可以凭经验测定或如由确认的细胞因子技术指导的浓度添加。
7.培养基质
任何合适的容器或细胞培养容器均可用作基础培养基和/或细胞培养补充物中的细胞培养的支持物。在支持物上的基质涂层不是必要的。然而,用贴壁促进基质(例如胶原、纤连蛋白、含RGD多肽、明胶等等)涂布培养容器的表面促进细胞的附着,并且在特定实施例中,可增强本文公开的细胞培养基和补充物的效应。用于培养和传代细胞的合适基质是本领域已知的,并且包括但不限于玻连蛋白、明胶、层粘连蛋白、纤连蛋白、胶原、弹性蛋白、骨桥蛋白、天然存在的细胞系生产的基质的混合物例如MatrigelTM以及合成或人造表面例如聚胺单层和羧基封端单层。
在一个实施例中,本文考虑的培养平台包括包含MatrigelTM或玻连蛋白的基质。
8.无饲养者环境
用于培养多能细胞的现有方法在很大程度上依赖于饲养细胞或用饲养细胞预条件化且含有胎牛血清的培养基;然而,此类环境可能不适合于产生用于临床和治疗用途的细胞。例如,在此类异物污染的环境中栽培的细胞一般视为不适合于人细胞移植,因为对动物组分的暴露可呈现免疫排斥和将未经鉴定的病原体传递给被治疗患者的严重危险,并且可潜在使动物逆转录病毒复活。使用无动物培养基例如本文考虑的无饲养者环境的培养系统有助于临床级别细胞系特别是hESC和hiPSC细胞系的制造。
在特定实施例中,无饲养者环境基本上不含人饲养细胞,包括但不限于小鼠胚胎成纤维细胞、人成纤维细胞、角化细胞和胚胎干细胞,并且不通过饲养细胞预条件化。无饲养者细胞培养基适用于培养多能细胞,使细胞重编程,多能细胞的单细胞培养、解离和传代,多能细胞的细胞分选,基态多能细胞的生成,以及基态多能性的维持。在特定实施例中,无饲养者环境用于诱导多能性,改善重编程效率,和/或增加或维持细胞潜能。在某些实施例中,无饲养者环境基本上不含细胞因子和生长因子,包括bFGF。
9.解离
由本文考虑的培养平台提供的优点之一在于培养、传代和解离单个基态多能细胞的增强活力和存活。细胞解离成单细胞例如单细胞悬浮液可通过酶促或机械手段来完成。本领域已知的允许细胞解离成单细胞的任何酶促试剂均可用于本发明的方法中。在一个实施例中,解离试剂选自胰蛋白酶/EDTA、TrypLE-Select、胶原酶IV和分散酶。
根据本文考虑的方法,在解离细胞中还可使用单独或与酶促试剂组合的螯合剂例如EDTA、Accutase或AccuMax。解离试剂可溶解于无钙和镁的PBS中,以有助于解离为单细胞。
为了增强细胞在解离期间和在解离后的存活,可加入存活促进物质(例如生长因子、涉及细胞死亡和细胞凋亡的细胞途径的抑制剂、或条件化培养基),例如ROCK抑制剂例如thiazovivin。
细胞培养和培养基收集中的技术在下述中概述:Hu等人,Curr.Opin.Biotechnol.8:148,1997;K.Kitano,Biotechnology 17:73,1991;Curr.Opin.Biotechnol.2:375,1991;Birch等人,Bioprocess Technol.19:251,1990;“Teratocarcinomas and embryonic stem cells:A practical approach”(E.J.Robertson编辑,IRL Press Ltd.1987);“Guide to Techniques in Mouse Development”(P.M.Wasserman等人编辑,Academic Press 1993);“Embryonic Stem Cell Differentiation in vitro”(M.V.Wiles,Meth.Enzymol.225:900,1993);“Properties and uses of Embryonic Stem Cells:Prospects for Application to Human Biology and Gene Therapy”(P.D.Rathjen等人,1993)。
干细胞的分化在Robertson,Meth.Cell Biol.75:173,1997;和Pedersen,Reprod.Fertil.Dev.10:31,1998中综述。
10.富集和耗尽策略
在特定实施例中,本发明提供了用于就多能细胞例如iPSC富集细胞群的策略。在一个实施例中,富集提供了用于在相对短的时间内衍生克隆iPSC集落的方法,由此改善iPSC生成的效率。富集可包括分选细胞群,所述细胞群已进行诱导以重编程,以鉴定且获得表达多能性标记物的细胞,由此获得富含多能细胞的细胞群。另外的富集方法包括表达分化标记物的细胞或非多能细胞的耗尽,以获得多能细胞的富集群。在一些实施例中,细胞在诱导重编程后培养约4至30天、约4至24天、约6至22天、或约8至约12天。
在一个实施例中,就多能细胞富集细胞群包括通过使群中的细胞解离且使细胞重悬浮来制备单细胞悬浮液。解离的细胞可重悬浮于任何合适溶液或培养基中,用于维持细胞或执行细胞分选。在特定实施例中,单细胞悬浮液含有GSK3抑制剂、MEK抑制剂和ROCK抑制剂,且缺乏TGFβR抑制剂。在某些实施例中,GSK3抑制剂是CHIR99021,MEK抑制剂是PD0325901,并且ROCK抑制剂是thiazovivin。
在一个特定实施例中,细胞群进行分选,以阳性选择多能细胞,和/或使群耗尽非重编程或非多能细胞,由此获得富含多能细胞的细胞群。在一个实施例中,制备单细胞悬浮液,并且随后单细胞准备用于分选,例如通过使用例如适当抗体就多能性标记物染色。细胞可通过分选细胞的任何合适方法,例如通过磁珠或流式细胞术(FACS)分选进行分选。
细胞可基于各种多能性标记物进行分选,包括SSEA3/4、TRA1-60/81、TRA1-85、TRA2-54、GCTM-2、TG343、TG30、CD9、CD29、CD133/prominin、CD140a、CD56、CD73、CD105、OCT4、NANOG、SOX2、KLF4、SSEA1(小鼠)、CD30、SSEA5、CD90和CD50的表达。在各个实施例中,细胞基于至少两种、至少三种或至少四种多能性标记物进行分选。在某些实施例中,细胞基于SSEA4的表达进行分选,并且在某些特定实施例中,基于与TRA1-81或TRA1-60组合的SSEA4表达进行分选。在某些实施例中,细胞基于SSEA4、TRA1-81或TRA1-60和CD30表达进行分选。在某些实施例中,细胞最初使用分化细胞的表面标记物包括但不限于CD13、CD26、CD34、CD45、CD31、CD46或CD7耗尽非重编程细胞,并且随后就多能标记物例如SSEA4、TRA1-81和CD30进行富集。
富含多能细胞的群可置于细胞培养系统例如常规hESC培养基或本发明的细胞培养基中。细胞培养系统可补充有饲养细胞,或任选是无饲养者环境。在一些实施例中,表达多能性标记物的分选细胞置于补充饲养细胞的培养系统中,并且随后转移至无饲养者环境。在一个实施例中,细胞培养基是无饲养者环境,且包含GSK3抑制剂、MEK抑制剂和ROCK抑制剂,并且缺乏TGFβ抑制剂。在特定实施例中,GSK3抑制剂是CHIR99021,MEK抑制剂是PD0325901,并且ROCK抑制剂是thiazovivin。在本发明的其他特定实施例中,细胞培养系统是包含MatrigelTM涂布的组织板的无饲养者环境。在一个实施例中,细胞培养系统包含表1中所述的FMM培养基。
富集的细胞群可在本文描述的细胞培养系统中进行培养,以获得基态iPSC集落,通常在分选后约3至约25天;分选后约5-9天,或分选后约5-7天出现。iPSC集落可进行挑选或分选用于克隆扩增。使用本文考虑的富集策略,细胞群就多能细胞富集至少约3倍、5倍、或10倍或更多倍。
在一些实施例中,使经历重编程的细胞群或多能细胞群耗尽分化细胞。在一个实施例中,多能细胞群或诱导为重编程的细胞群可耗尽具有分化细胞的细胞表面标记物的细胞。分化细胞的细胞表面标记物的举例说明性例子包括但不限于CD13、CD26、CD34、CD45、CD31、CD46或CD7。在特定实施例中,CD13用作分化细胞的表面标记物。
在其他实施例中,细胞群进行诱导以分化成所需谱系,且耗尽多能细胞,以获得分化中细胞或分化细胞的富集群。在一些实施例中,分化细胞群包含已诱导以分化成特异性谱系的细胞群例如ESC或iPSC群。使用上文描述的负细胞分选技术(“淘选”),例如根据磁珠或基于多能性标记物的FAC分选群中的细胞,细胞群可耗尽多能细胞。在一些实施例中,包含分化细胞的细胞群通过FAC使用多能性标记物进行分选,并且获得耗尽表达多能性标记物的细胞的级分。在其他实施例中,细胞群通过FAC基于分化标记物,例如谱系特异性标记物如CD13、CD26、CD34、CD45、CD31、CD46或CD7进行分选,以获得耗尽多能性标记物的级分。CD13在本发明的特定实施例中用作分化细胞的表面标记物。
E.用于使细胞重编程的培养平台
推行各种策略以诱导细胞中的多能性,或增加细胞中的潜能(Takahashi,K.和Yamanaka,S.,Cell 126,663-676(2006);Takahashi等人,Cell 131,861-872(2007);Yu等人,Science 318,1917-1920(2007);Zhou等人,Cell Stem Cell 4,381-384(2009);Kim等人,Cell Stem Cell 4,472-476(2009);Yamanaka等人,2009;Saha,K.,Jaenisch,R.,Cell Stem Cell 5,584-595(2009)),且改善重编程效率(Shi等人,Cell Stem Cell 2,525-528(2008a);Shi等人,Cell Stem Cell 3,568-574(2008b);Huangfu等人,Nat Biotechnol 26,795-797(2008a);Huangfu等人,Nat Biotechnol 26,1269-1275(2008b);Silva等人,Plos Bio 6,e253.doi:10.1371/journal.pbio.0060253(2008);Lyssiotis等人,PNAS 106,8912-8917(2009);Ichida等人,Cell Stem Cell 5,491-503(2009);Maherali,N.,Hochedlinger,K.,Curr Biol 19,1718-1723(2009b);Esteban等人,Cell Stem Cell 6,71-79(2010);Feng等人,Cell Stem Cell 4,301-312(2009))。然而,现有方法仍有待实现用于制造工业或临床级别多能细胞的高流通量解决方案,所述细胞即具有同质多能性、无显著的自发分化以及在确定的无异物、饲养细胞培养系统中使用单细胞酶促传代培养且扩增细胞群的能力的克隆无转基因多能细胞群。
本文考虑的培养平台可部分用于生产高级别诱导多能干细胞(iPSC)。在一个实施例中,非多能细胞重编程为多能性且培养以维持多能性。在另一个实施例中,iPSC培养至基态多能性。
在各个实施例中,培养平台使无转基因和/或足迹重编程方法成为可能。本文考虑的培养平台提供了高度有效的附加体重编程,具有hiPSC生成所需的时间和努力的显著减少。不希望受任何特定理论束缚,考虑通过在重编程过程中早期阻断分化迹象且通过特异性途径(MEK、ERK、TGFβ和ROCK)的小分子抑制促进间充质至上皮转变(MET),hiPSC生成的效率使用附加型载体在FF和单细胞培养系统中得到显著改善。
在一个实施例中,培养平台包括使一个或多个非多能细胞重编程为多能状态,包括增加细胞中的内源OCT4表达。细胞中的内源OCT4表达可通过引入OCT4表达的一种或多种多核苷酸、多肽或小分子诱导物得到增加。在一个实施例中,将编码OCT4的多核苷酸或OCT4多肽引入细胞内足以诱导OCT4在细胞中的内源表达。
在一个实施例中,培养平台包括使一个或多个非多能细胞重编程,包括将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC和SV40LT。在另一个实施例中,培养平台包括使一个或多个非多能细胞重编程,包括将选自下述的一种或多种多肽引入一个或多个非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1。
在一个实施例中,培养平台包括使一个或多个非多能细胞重编程,包括将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸引入一个或多个非多能细胞内:OCT4、NANOG、ESRRB、ECAT1和UTF1。在另一个实施例中,培养平台包括使一个或多个非多能细胞重编程,包括将选自下述的一种或多种多肽引入一个或多个非多能细胞内:OCT4、NANOG、ESRRB、ECAT1和UTF1。
如本文使用的,在特定实施例中,术语“引入”指包括使细胞与多核苷酸、多肽或小分子接触的过程。引入步骤还可包括将多核苷酸或多肽显微注射到细胞内,使用脂质体以将多核苷酸或多肽递送到细胞内,或使多核苷酸或多肽与细胞可渗透部分融合以将其引入细胞内。
在特定实施例中,编码选自下述的重编程因子中的一种或多种的1、2、3、4、5个或更多个拷贝的一种或多种多核苷酸可引入非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1,以使细胞重编程。引入细胞内的每种重编程因子的拷贝数在适合于实现如本文考虑的基态多能性的任何组合中可以是相同或不同的。
在一个实施例中,将编码选自下述的重编程因子中的一种或多种的1、2、3、4、5个或更多个拷贝的一种或多种多核苷酸引入非多能细胞内:OCT4、SOX2和NANOG。
在一个实施例中,将编码OCT4、SOX2和NANOG各自的1、2、3、4、5个或更多个拷贝的一种或多种多核苷酸引入非多能细胞内。
在一个实施例中,将编码OCT4和SOX2各自的1、2、3、4、5个或更多个拷贝的一种或多种多核苷酸引入非多能细胞内。
在一个实施例中,将编码OCT4的1、2、3、4、5个或更多个拷贝的一种或多种多核苷酸引入非多能细胞内。
在一个实施例中,将编码OCT4的2个拷贝、SOX2的2个拷贝和NANOG的2个拷贝的一种或多种多核苷酸引入非多能细胞内,其中SV40LT任选被引入非多能细胞内。
在另一个实施例中,将编码OCT4的3个拷贝、SOX2的2个拷贝、NANOG的一个拷贝和UTF1的一个拷贝的一种或多种多核苷酸引入非多能细胞内。
在各个举例说明性实施例中,包括使非多能细胞重编程的培养平台包括引入编码OCT4的多核苷酸的1至5个拷贝;编码SOX2的多核苷酸的1至3个拷贝,以及任选地,编码NANOG的多核苷酸的1至2个拷贝。多核苷酸可作为一种或多种更大多核苷酸的任何组合引入细胞内。在一个非限制性例子中,将编码OCT4的1至4个拷贝、SOX2的1或2个拷贝和NANOG的1个拷贝的一种或多种多核苷酸引入非多能细胞内。在另一个非限制性例子中,使非多能细胞重编程为多能状态包括将编码OCT4的2个拷贝的第一多核苷酸、编码OCT4的1个拷贝和SOX2的1个拷贝的第二多核苷酸;以及编码OCT4的1个拷贝、SOX2的1个拷贝和NANOG的1个拷贝的第三多核苷酸引入非多能细胞内。在进一步的非限制性例子中,使一个或多个非多能细胞重编程包括将编码OCT4的2个拷贝的第一多核苷酸以及编码OCT4的1个拷贝、SOX2的1个拷贝和NANOG的1个拷贝的第二多核苷酸引入一个或多个非多能细胞内。在再进一步的非限制性例子中,将编码OCT4的2个拷贝的第一多核苷酸以及编码OCT4的1个拷贝和SOX2的1个拷贝的第二多核苷酸引入一个或多个非多能细胞内,以产生多能细胞。
在一个实施例中,将包括包含本文考虑的重编程因子的任何数目和组合的多核苷酸的单一载体引入非多能细胞内,且足以使细胞重编程为多能状态。
在一个实施例中,将包括包含本文考虑的重编程因子的任何数目和组合的1、2、3、4、5种或更多种多核苷酸的一种或多种载体引入非多能细胞内,且足以使细胞重编程为多能状态。
在一个优选实施例中,用于使非体细胞重编程的包含本文考虑的一种或多种多核苷酸的一种或多种载体用于将一种或多种多核苷酸引入细胞内,且足以使细胞重编程。
在最优选的实施例中,用于使非体细胞重编程的包含本文考虑的一种或多种多核苷酸的一种或多种附加型载体用于将一种或多种多核苷酸引入细胞内,且足以使细胞重编程。展示减少的自发分化和/或基态的多能细胞可用如本文考虑的附加型载体进行制造,并且随后培养直至载体丧失,以获得展示减少的自发分化和/或基态的多能细胞,所述多能细胞不包含编码重编程因子的外源核酸。
还考虑当包含其的多核苷酸或载体包括编码至少两种重编程因子或重编程因子的至少两个拷贝的多核苷酸时,多核苷酸包含在如本文考虑的重编程因子各自之间的IRES序列或编码自切割多肽序列的多核苷酸。
在一些方面,在将重编程因子多核苷酸引入非多能细胞内之后,通过就一种或多种重编程因子多核苷酸的异位表达进行选择,增加使非多能细胞重编程的效率。此类选择可例如通过下述发生:使重编程因子多核苷酸中的一种或多种与可选标记物连接,将重编程因子多核苷酸和可选标记物引入非多能细胞内,并且选择表达可选标记物的那些细胞,其中所述选择鉴定相对于缺乏标记物及其相关的重编程因子多核苷酸的表达的细胞具有增加的重编程效率的细胞。本领域技术人员应了解在特定实施例中,可使用鉴定通过非多能细胞的所引入重编程多核苷酸表达的任何可选标记物。
此类可选标记物的一个非限制性例子包括但不限于抗生素抗性基因例如嘌呤霉素抗性。可选标记物可与下述重编程因子多核苷酸中的一种或多种连接:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1。在一些实施例中,重编程因子多核苷酸的特异性组合作为多顺反子载体引入,其中可选标记物连接至重编程因子多核苷酸的特异性组合。重编程因子多核苷酸的特异性组合可编码本文公开的重编程因子多核苷酸的两个或更多个拷贝。
在一个非限制性实施例中,多顺反子载体编码与可选标记物例如编码嘌呤霉素抗性的基因连接的OCT4多核苷酸的两个或更多个拷贝。
在一些方面,除一种或多种分开的重编程因子多核苷酸之外,还将编码一种或多种重编程因子多核苷酸的多顺反子载体和可选标记物引入非多能细胞内,其中就表达可选标记物的细胞进行选择产生具有比缺乏可选标记物表达的细胞更大的重编程效率的细胞群。
在该选择过程的一个非限制性例子中,除编码与嘌呤霉素抗性基因连接的OCT4的两个或更多个拷贝的多顺反子载体之外,还将OCT4、NANOG和SOX2多核苷酸引入非多能细胞内。表达可选标记物的非多能细胞的后续选择鉴定相对于不表达可选标记物的非多能细胞,具有更大的重编程效率的非多能细胞。所选细胞可具有至少5%、至少10%、至少15%、至少20%、至少30%或至少40%的重编程效率。
小分子通常包括在特定优选实施例的重编程步骤中。不希望受任何特定理论束缚,考虑各种分化途径的小分子抑制剂的包括增加重编程效率和动力学。相应地,在特定实施例中,包含使非多能细胞重编程的培养平台包括如本文考虑的将一种或多种重编程因子引入细胞内,并且使细胞与GSK3抑制剂;MEK抑制剂;TGFβR抑制剂和ROCK抑制剂接触。
重编程效率的改善可通过下述进行测量:(1)多能细胞重编程和生成所需的时间的减少(例如与不含小分子的相似或相同过程相比较,通过使生成多能细胞的时间缩短至少一天),或可替代地或与(2)组合,(2)通过特定过程生成的多能细胞数目的增加(例如与不含小分子的相似或相同过程相比较,给定时间段中重编程的细胞数目增加至少10%、30%、50%、100%、200%、500%等)。在一些实施例中,观察到重编程效率的2倍至20倍改善。在一些实施例中,重编程效率改善超过20倍。在一些实施例中,观察到超过不含小分子重编程试剂的方法超过100倍的效率改善(例如生成的多能细胞数目的超过100倍增加)。
在一个实施例中,通过如本文考虑的将一种或多种重编程因子引入细胞内,且使细胞与GSK3抑制剂;MEK抑制剂;和TGFβR抑制剂,以及任选的ROCK抑制剂接触,本文考虑的培养平台包括使非多能细胞重编程。
在一个优选实施例中,通过如本文考虑的将一种或多种重编程因子引入细胞内,且使细胞与GSK3抑制剂;MEK抑制剂;TGFβR抑制剂以及ROCK抑制剂接触,本文考虑的培养平台包括使非多能细胞重编程。
在一个更优选的实施例中,通过如本文考虑的将一种或多种重编程因子引入细胞内,且使细胞与GSK3抑制剂;MEK抑制剂;TGFβR抑制剂以及ROCK抑制剂接触,本文考虑的培养平台包括使非多能细胞重编程,其中所述ROCK抑制剂是Thiazovivin。
然而,为了使多能细胞在无饲养细胞和酶促传代的培养系统中的长期培养成为可能,伴随减少的自发分化或无显著的自发分化,或者为了诱导和/或维持基态多能性,iPSC需要在包含GSK-3抑制剂、MEK抑制剂和任选的Rho激酶(ROCK)抑制剂的细胞培养基中的后续培养,其中所述细胞培养基不包含或缺乏TGFβ/激活素信号传导途径的抑制剂,包括TGFβ受体(TGFβR)抑制剂和ALK5抑制剂,如本文考虑的。不希望受任何特定理论束缚,考虑多能细胞与TGFβR/ALK5抑制剂一起长期培养导致培养的无转基因iPSC的自发分化和基态多能性的最终丧失。
在各个实施例中,两步培养平台用于使体细胞稳定重编程,以实现培养中减少的自发分化,包括基态多能性。在某些实施例中,非多能细胞通过本领域公开的任何合适方法进行重编程,并且随后,通过在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养细胞,来培养重编程的体细胞以实现培养中减少的自发分化,其中所述培养基缺乏TGFβR/ALK5抑制剂。在一些实施例中,培养重编程的体细胞以提供基态多能细胞。
在特定实施例中,非多能细胞通过本文公开的方法进行重编程,并且随后,通过在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养细胞,将重编程的体细胞培养至稳定的基态多能性,其中所述培养基缺乏TGFβR/ALK5抑制剂。
在一些实施例中,通过引入一种或多种重编程因子,并且在包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和TGFβR/ALK5抑制剂的培养基中培养细胞,使非多能细胞重编程,并且随后,通过在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养细胞,来培养重编程的体细胞以提供具有减少的自发分化的细胞,其中所述培养基缺乏TGFβR/ALK5抑制剂。
在一些实施例中,通过引入一种或多种重编程因子,并且在包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和TGFβR/ALK5抑制剂的培养基中培养细胞,使非多能细胞重编程,并且随后,通过在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养细胞,将重编程的体细胞培养至稳定的基态多能性,其中所述培养基缺乏TGFβR/ALK5抑制剂。
在优选实施例中,通过引入一种或多种重编程因子,并且在包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和TGFβR/ALK5抑制剂的培养基中培养细胞,使非多能细胞重编程,并且随后,通过在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养细胞,将重编程的体细胞培养至稳定的基态多能性,其中所述培养基缺乏TGFβR/ALK5抑制剂,并且其中不存在重编程转基因的显著残留表达。
在一个实施例中,通过引入如本文其他地方公开的选自下述的一种或多种重编程因子:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1,并且在包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和TGFβR/ALK5抑制剂的培养基中培养细胞,使非多能细胞重编程,并且随后,在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养重编程的体细胞,其中所述培养基缺乏TGFβR/ALK5抑制剂。
在一个优选实施例中,通过引入如本文其他地方公开的选自下述的一种或多种重编程因子:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1,并且在包含GSK-3抑制剂、MEK抑制剂、Rho激酶(ROCK)抑制剂和TGFβR/ALK5抑制剂的培养基中培养细胞,使非多能细胞重编程,并且随后,在包含GSK-3抑制剂、MEK抑制剂和Rho激酶(ROCK)抑制剂的培养基中培养重编程的体细胞,其中所述ROCK抑制剂是Thiazovivin,其中所述培养基缺乏TGFβR/ALK5抑制剂。
在各个实施例中,本发明提供了使用本文考虑的培养平台,制造具有减少的自发分化的多能细胞和/或基态诱导多能干细胞(iPSC)的方法。
在特定实施例中,使用包含一个或多个非多能细胞或部分多能干细胞的原材料,并且在不包含TGFβR抑制剂的培养基中培养一个或多个多能细胞或部分多能干细胞,制造具有减少的自发分化的多能细胞和/或基态诱导多能干细胞(iPSC)。原材料可获得或制备。例如,非多能干细胞或部分多能干细胞可由商业厂商或其他源提供,或者可从头获得:非多能细胞还可从组织或器官中分离;并且部分多能细胞还可通过使体细胞或成人干细胞重编程来生成。在一些实施例中,使用本文描述的培养基和平台,多能胚胎干细胞或通过体细胞核转移获得的多能细胞可进行诱导,以实现基态多能性。
在特定实施例中,一个或多个IPSC群可包含重编程的体细胞或重编程的成人干细胞。在特定实施例中,可通过任何已知方法通过执行方法或获得通过方法生成的IPSC来生成IPSC。
生成IPSC的示例性方法包括但不限于:增加非多能细胞中的内源OCT4表达;将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸,任选以一个或多个拷贝引入一个或多个非多能细胞内:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1;或将编码选自下述的一种或多种重编程因子的一种或多种多核苷酸,任选以一个或多个拷贝引入一个或多个非多能细胞内:OCT4、SOX2和NANOG。生成IPSC的方法还可包括使一个或多个非多能细胞或部分多能细胞与GSK3抑制剂;MEK抑制剂;和TGFβR抑制剂,以及任选的ROCK抑制剂接触,以产生一个或多个iPSC。
在某些实施例中,细胞培养基包含GSK3抑制剂;MEK抑制剂;和ROCK抑制剂。
在优选实施例中,细胞培养基包含GSK3抑制剂;MEK抑制剂;和ROCK抑制剂,其中所述ROCK抑制剂是Thiazovivin。
在特定实施例中,在细胞培养基中培养一个或多个多能细胞例如IPSC维持或诱导基态多能性、活力、正常核型、基因组稳定性和减少速率的自发分化,其可维持至少5次传代、至少10次传代、至少50次传代、至少100次传代或更多次传代,包括任何中间数目的传代。
F.表征多能细胞
使用本文考虑的培养平台制造的多能细胞还可包括多能细胞产物,包括例如基态多能细胞或具有减少的自发分化的多能细胞的选择或验证。多能细胞可在重编程且随后用本文考虑的组合物和方法进行培养之后,或如果多能细胞未重编程,在多能细胞转变至本文考虑的培养方法之后,进行选择和/或验证。细胞的多能性可基于与多能性相关的有关和可检测的形态、分子和/或生物化学变化进行表征和/或选择。
在评价细胞潜能中可分开或组合监控的细胞多能性的具体特征包括但不限于基因表达、甲基化以及体内和体外特征,例如:i)圆形的多能干细胞形态;ii)多能干细胞标记物包括SSEA3/4(人多能干细胞);TRA1-60/81;TRA1-85、TRA2-54、GCTM-2、TG343、TG30、CD9、CD29、CD133/prominin、CD140a、CD56、CD73、CD105、OCT4、NANOG、SOX2、CD30、SSEA5、CD90和/或CD50和前述的组合的表达;iii)多能干细胞的畸胎瘤形成;iv)胚状体形成和体外三系分化;和v)失活的X染色体复活。在某些实施例中,上述特征中的任一个的亚集用于监控细胞潜能。在一个实施例中,多能细胞的特征在于具有圆形集落形态,SSEA4、TRA1-81和OCT4的表达,以及形成胚状体和畸胎瘤的能力。
在另一个实施例中,在体外培养中具有减少的自发分化的多能细胞可通过基因表达标志进行鉴定,所述基因表达标志包括与在TGFβR抑制剂的存在下培养的多能细胞相比较,下述分化标记物基因中的一种或多种表达中的至少约10%、20%、25%、30%、40%、50%、60%、70%、80%、90%减少:FOXA2、FGF5、SOX17、XIST、NODAL、COL3A1、OTX2、DUSP6、EOMES、NR2F2、NR0B1、CXCR4、CYP2B6、GATA3、GATA4、ERBB4、GATA6、HOXC6、INHA、SMAD6、RORA、NIPBL、TNFSF11、CDH11、ZIC4、GAL、SOX3、PITX2、APOA2、CXCL5、CER1、FOXQ1、MLL5、DPP10、GSC、PCDH10、CTCFL、PCDH20、TSHZ1、MEGF10、MYC、DKK1、BMP2、LEFTY2、HES1、CDX2、GNAS、EGR1、COL3A1、TCF4、HEPH、KDR、TOX、FOXA1、LCK、PCDH7、CD1D FOXG1、LEFTY1、TUJ1、T基因(Brachyury)和ZIC1。
在一个实施例中,具有减少的自发分化的多能细胞的特征在于一种或多种分化标记物基因的减少表达,所述基因包括但不限于:T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2和TUJ1。在特定实施例中,具有减少的自发分化的多能细胞可通过基因表达标志进行鉴定,所述基因表达标志包括与在TGFβR抑制剂的存在下培养的多能细胞相比较,一种或多种分化标记物基因(例如T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2、TUJ1)的表达中的至少约10%、20%、25%、30%、40%、50%、60%、70%、80%、90%减少。[在另一个特定实施方案中,具有减少的自发分化的多能细胞可通过基因表达标志进行鉴定,所述基因表达标志包括一种或多种分化标记物基因(例如T基因、CXCR4、NODAL、GATA4、SOX17、FOXA2、OTX2、TUJ1)的表达中的至少约10%、20%、25%、30%、40%、50%、60%、70%、80%、90%减少。
在特定实施例中,基态多能细胞具有显著阻遏的Xist表达以及分化细胞的早期标记物例如Foxa2、Sox17和Brachyury的表达,而常规培养的多能细胞仅显示Xist表达的适度阻遏以及早期分化标记物的显著表达。
在特定实施例中,基态多能细胞保留基态多能性的特征共多个细胞传代,例如至少1、3、5、7、10、15、20次或更多次传代。
G.多核苷酸
在各个举例说明性实施例中,本发明部分考虑了本文考虑的多核苷酸、编码多肽和融合多肽的多核苷酸、以及包含其的组合物。在各个其他举例说明性实施例中,本发明部分考虑了用编码至少一种重编程因子的一个或多个拷贝的多核苷酸使非多能细胞重编程。用于与本文描述的培养平台一起使用的重编程因子包括但不限于:OCT4、SOX2、NANOG、KLF4、LIN28、C-MYC、SV40LT、hTERT、SALL4、GLIS、ESRRB、DPPA2、ECAT1、SOX1、SOX3、KLF2、KLF5、L-MYC、N-MYC、LRH1和UTF1。在优选实施例中,多核苷酸包含如本文所示的重编程因子的序列。
如本文使用的,术语“基因”可指包含增强子、启动子、内含子、外显子等等的多核苷酸序列。在特定实施例中,术语“基因”指编码多肽的多核苷酸序列,与多核苷酸序列是否等同于编码多肽的基因组序列无关。
如本文使用的,“经分离的多核苷酸”指已从序列中纯化的多核苷酸,所述序列在天然存在的状态中侧接其,例如已从与片段通常邻近的序列中去除的DNA片段。在特定实施例中,“经分离的多核苷酸”指在自然界中不存在且已通过人工制备的互补DNA(cDNA)、重组DNA或其他多核苷酸。
在特定实施例中,一种或多种多核苷酸可以任何合适次序排列在更大的多核苷酸例如载体内。在优选实施例中,载体是附加型载体。
与其编码序列长度无关,本文考虑的多核苷酸可与其他DNA序列组合,例如表达控制序列、启动子和/或增强子、非翻译区(UTR)、Kozak序列、多腺苷酸化信号、另外的限制性酶位点、多克隆位点、内部核糖体进入位点(IRES)、重组酶识别位点(例如LoxP、FRT和Att位点)、终止密码子、转录终止信号、和编码自切割多肽的多核苷酸、附加表位,如本文其他地方公开的或如本领域已知的,使得其总体长度可相当大地改变。因此考虑可采用几乎任何长度的多核苷酸片段,其中总长度优选受制备的容易和在预期重组DNA方案中的使用限制。
多核苷酸可使用本领域已知和可获得的各种充分确定的技术中的任一种进行制备、操纵和/或表达。为了表达所需多肽,编码多肽的核苷酸序列可插入适当载体内。载体的例子是质粒、自主复制序列和可易位元件。另外的示例性载体包括但不限于质粒,噬菌粒,粘粒,人工染色体如酵母人工染色体(YAC)、细菌人工染色体(BAC)、或P1衍生的人工染色体(PAC),噬菌体如λ噬菌体或M13噬菌体,以及动物病毒。可用作载体的动物病毒类别的例子包括但不限于逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如单纯疱疹病毒)、痘病毒、杆状病毒、乳头状瘤病毒和乳多空病毒(例如SV40)。表达载体的例子是用于在哺乳动物细胞中表达的pClneo载体(Promega);用于慢病毒介导的基因转移和在哺乳动物细胞中表达的pLenti4/V5-DESTTM、pLenti6/V5-DESTTM和pLenti6.2/V5-GW/lacZ(Invitrogen)。在特定实施例中,本文公开的多肽的编码序列可连接到此类表达载体内,用于在哺乳动物细胞中表达多肽。
在特定实施例中,载体是附加型载体或染色体外维持的载体。如本文使用的,术语“附加型”指无需整合到宿主的染色体DNA内能够复制且不具有从分裂中宿主细胞的逐步丧失的载体,还意指所述载体在染色体外或附加型复制。载体进行改造,以容纳来自嗜淋巴疱疹病毒或γ疱疹病毒、腺病毒、SV40、牛乳头状瘤病毒或酵母的编码DNA复制起点或“ori”的序列,具体地嗜淋巴疱疹病毒或γ疱疹病毒的复制起点,对应于EBV的oriP。在一个特定方面,嗜淋巴疱疹病毒可以是EB病毒(EBV)、卡波济氏肉瘤疱疹病毒(KSHV)、松鼠猴疱疹病毒(HS)或马立克氏病病毒(MDV)。EB病毒(EBV)和卡波济氏肉瘤疱疹病毒(KSHV)也是γ疱疹病毒的例子。通常,宿主细胞包含活化复制的病毒复制反式激活蛋白质。
表达载体中存在的“表达控制序列”、“控制元件”或“调节序列”是载体的那些非翻译区—复制起点、选择盒、启动子、增强子、翻译起始信号(Shine Dalgarno序列或Kozak序列)、内含子、多聚腺苷酸化序列,5'和3'非编码区—所述非翻译区与宿主细胞蛋白质相互作用,以进行转录和翻译。此类元件可在其强度和特异性上不同。取决于所利用的载体系统和宿主,可使用任何数目的合适转录和翻译元件,包括遍在启动子和诱导型启动子。
术语“可操作地连接”指其中所述组分处于允许其以其预期方式起作用的关系中的并排。在一个实施例中,该术语指表达控制序列(例如启动子和/或增强子)和第二多核苷酸序列之间的功能连接,其中表达控制序列指导对应于第二序列的核酸的转录。
适用于本发明的特定实施例中的举例说明性遍在表达控制序列包括但不限于巨细胞病毒(CMV)立即早期启动子,猿猴病毒40(SV40)(例如早期或晚期),莫洛尼鼠白血病病毒(MoMLV)LTR启动子,Rous肉瘤病毒(RSV)LTR,单纯疱疹病毒(HSV)(胸苷激酶)启动子,来自牛痘病毒的H5、P7.5和P11启动子,延伸因子1-α(EF1a)启动子,早期生长应答1(EGR1),铁蛋白H(FerH),铁蛋白L(FerL),甘油醛3-磷酸脱氢酶(GAPDH),真核翻译起始因子4A1(EIF4A1),热休克70kDa蛋白5(HSPA5),热休克蛋白90kDaβ成员1(HSP90B1),热休克蛋白70kDa(HSP70),β-驱动蛋白(β-KIN),人ROSA 26基因座(Irions等人,Nature Biotechnology 25,1477-1482(2007)),泛素C启动子(UBC),磷酸甘油酸激酶-1(PGK)启动子,巨细胞病毒增强子/鸡β-肌动蛋白(CAG)启动子和β-肌动蛋白启动子。
诱导型启动子/系统的举例说明性例子包括但不限于甾类诱导型启动子,例如用于编码糖皮质激素或雌激素受体的基因的启动子(可通过用相应激素处理诱导)、金属硫蛋白启动子(可通过用各种重金属处理诱导)、MX-1启动子(可通过干扰素诱导)、“基因开关”米非司酮可调节系统(Sirin等人,2003,Gene,323:67)、cumate诱导型基因开关(WO 2002/088346)、四环素依赖性调节系统等。
条件表达还可通过使用位点特异性DNA重组酶来实现。根据本发明的某些实施例,多核苷酸包含关于通过位点特异性重组酶介导的重组的至少一个(通常为两个)位点。如本文使用的,术语“重组酶”或“位点特异性重组酶”包括切除或整合蛋白质、酶、辅因子或相关蛋白质,所述相关蛋白质涉及牵涉一个或多个重组位点(例如二、三、四、五、六、七、八、九、十个或更多个)的重组反应,所述相关蛋白质可以是野生型蛋白质(参见Landy,Current Opinion in Biotechnology 3:699-707(1993)),或其突变体、衍生物(例如含有重组蛋白质序列或其片段的融合蛋白)、片段和变体。适用于本发明的特定实施例中的重组酶的举例说明性例子包括但不限于:Cre、Int、IHF、Xis、Flp、Fis、Hin、Gin、ΦC31、Cin、Tn3解离酶、TndX、XerC、XerD、TnpX、Hjc、Gin、SpCCE1和ParA。
在特定实施例中,本文考虑的多核苷酸包括编码一种或多种多肽的一种或多种多核苷酸。在特定实施例中,为了实现多重多肽各自的有效翻译,多核苷酸序列可通过一种或多种IRES序列或编码自切割多肽的多核苷酸序列分开。如本文使用的,“内部核糖体进入位点”或“IRES”指促进对顺反子(蛋白质编码区)的起始密码子例如ATG的直接内部核糖体进入的元件,由此导致基因的帽不依赖性翻译。参见例如Jackson等人,1990.Trends Biochem Sci15(12):477-83)以及Jackson和Kaminski.1995.RNA 1(10):985-1000。由本领域技术人员一般采用的IRES的例子包括美国专利号6,692,736中描述的那些。本领域已知的“IRES”的进一步例子包括但不限于可得自小核糖核酸病毒的IRES(Jackson等人,1990)。
H.多肽
本发明部分考虑了包含多肽、融合多肽和表达多肽的载体的组合物。在优选实施例中,多肽包含本文阐述的氨基酸序列。“多肽”、“多肽片段”、“肽”和“蛋白质”可互换使用,除非有相反的说明,且根据常规含义,即作为氨基酸的序列。在一个实施例中,“多肽”包括融合多肽及其他变体。多肽可使用各种众所周知的重组和/或合成技术中的任一种进行制备。多肽并不限于特定长度,例如它们可包含全长蛋白质序列、全长蛋白质的片段或融合蛋白,并且可包括多肽的翻译后修饰,例如糖基化、乙酰化、磷酸化等等,以及本领域已知的其他修饰,天然存在和非天然存在的两者。
如本文使用的,“经分离的肽”或“经分离的多肽”等等指肽或多肽分子从细胞环境和与细胞的其他组分结合中的体外分离和/或纯化,即它不与体内物质显著结合。
在一个实施例中,当需要两种或更多种多肽的表达时,编码其的多核苷酸序列可通过如本文其他地方讨论的IRES序列分开。在另一个实施例中,两种或更多种多肽可作为融合蛋白表达,所述融合蛋白包含在本文描述的多肽结构域各自之间的多肽切割信号。另外,多肽位点可置于任何接头肽序列内。示例性多肽切割信号包括多肽切割识别位点,例如蛋白酶切割位点、核酸酶切割位点(例如罕见限制性酶识别位点、自切割核酶识别位点)和自切割病毒寡肽(参见deFelipe和Ryan,2004.Traffic,5(8);616-26)。
合适的蛋白酶切割位点和自切割肽是技术人员已知的(参见例如Ryan等人,1997.J.Gener.Virol.78,699-722;Scymczak等人(2004)Nature Biotech.5,589-594)。示例性蛋白酶切割位点包括但不限于马铃薯Y病毒NIa蛋白酶(例如烟草蚀纹病毒蛋白酶)、马铃薯Y病毒HC蛋白酶、马铃薯Y病毒P1(P35)蛋白酶、byovirus NIa蛋白酶,byovirus RNA-2编码的蛋白酶,口蹄疫病毒L蛋白酶、肠道病毒2A蛋白酶、鼻病毒2A蛋白酶、picorna 3C蛋白酶、豇豆花叶病毒24K蛋白酶、线虫传多面体病毒24K蛋白酶、RTSV(水稻东格鲁球状病毒)3C样蛋白酶、PYVF(欧防风黄点病毒)3C样蛋白酶、肝素、凝血酶、因子Xa和肠激酶的切割位点。由于其高切割严格性,TEV(烟草蚀纹病毒)蛋白酶切割位点在一个实施例中是优选的,例如EXXYXQ(G/S)(SEQ ID NO:29),例如ENLYFQG(SEQ ID NO:30)和ENLYFQS(SEQ ID NO:31),其中X代表任何氨基酸(通过TEV的切割在Q和G或Q和S之间发生)。
在某些实施例中,自切割多肽位点包含2A或2A样位点、序列或结构域(Donnelly等人,2001.J.Gen.Virol.82:1027-1041)。在一个特定实施例中,病毒2A肽是口蹄疫病毒2A肽、马铃薯Y病毒2A肽或心病毒2A肽。
在一个实施例中,病毒2A肽选自:口蹄疫病毒(FMDV)2A肽、马鼻炎A病毒(ERAV)2A肽、明脉扁刺蛾β四体病毒(Thosea asigna virus)(TAV)2A肽、猪捷申病毒-1(PTV-1)2A肽、泰勒病毒2A肽和脑心肌炎病毒2A肽。
表2:示例性2A位点包括下述序列:
在优选实施例中,编码一种或多种重编程因子多肽的载体包含在重编程因子各自之间的相同或不同蛋白酶切割位点中的一个或多个。
本说明书中引用的所有出版物、专利申请和颁发专利以引用的方式并入本文,如同每个个别出版物、专利申请或颁发专利特别且各别指出以引用的方式并入。
尽管本发明已通过举例说明和例子略微详细地进行描述用于明确理解的目的,但对于本领域普通技术人员显而易见的是,根据本发明的教导,可对其作出某些改变和修饰,而不背离所附权利要求的精神或范围。提供下述实例仅作为例子而不是限制。本领域技术人员容易认识到可改变或修饰以获得大体上相似的结果的各种非关键参数。
实例
本文公开的实例鉴定了使用在阶段特异性培养基组合物中的小分子途径抑制剂,用于hiPSC的快速、平行生成、选择和扩增的平台。该平台支持在完全无饲养者环境中使用最低限度重编程因子的有效和加速的附加体重编程。所得到的hiPSC不含转基因,容易作为单细胞培养且扩增,同时维持同质和基因组稳定的多能群。在实例中考虑的培养基组合物中生成或维持的hiPSC显示出与基态多能性相关的特性,并且代表用于制造均匀的工业或临床级别hiPSC的稳健高流通量系统。
实例1
用于iPSC的长期维持和扩增的培养基平台的鉴定
概述
在SMC4补充的培养中的大多数慢病毒衍生的hiPSC系维持未分化细胞的同质群;然而,在系亚集中的转基因重编程因子的沉默展示在扩增培养中不同程度的自发分化(图1A和B)。因此,评价各种细胞培养组分,以便鉴定与残留转基因表达无关,在连续FF培养和单细胞酶促传代期间维持多能性的条件。靶向重编程和维持过程的不同阶段时的独特途径的多阶段培养系统鉴定为hiPSC生成的有效和稳健方法。
结果
在长期维持期间TGFβ途径的抑制鉴定为具有沉默的转基因表达的hiPSC系的自发分化中的显著因子(图1C)。将发现经历自发分化的iPSC细胞系之一转变为在新培养基制剂即命运维持培养基(FMM)中的培养(表1)。自发分化被消除,并且在2-3代内建立SSEA4/TRA1-81阳性细胞的同质群(图1A)。
还比较了在常规培养(在MEF饲养细胞上的hESC培养基)、在FF培养中补充SMC4的培养基或在FF培养中新近配制的FMM(图1D)中的OCT4/KLF4/SOX2(OKS)慢病毒重编程。在慢病毒重编程诱导后十七天,SSEA4/TRA1-81阳性细胞通过FAC加以选择,并且在SMC4或FMM中再铺平板用于比较(图1D)。SMC4改善重编程的动力学,并且在诱导后第17天时导致比用FMM重编程显著更多的SSEA4/TRA1-81阳性细胞(2.72%相对于FMM的0.76%和常规培养的0.10%;图1D)。
在初始分选后,细胞在其分别条件下维持10天,随后为第二SSEA4/TRA1-81阳性流式细胞术选择(图1D)。培养维持另外9天(总共转染后36天),并且基于OCT4和NANOG共表达就未分化集落进行评分(图1D和1E)。在SMC4中的初始重编程随后转变为FMM的组合最终导致相对于在SMC4中的连续维持,更多OCT4/NANOG阳性集落和显著减少数目的OCT4/NANOG阴性集落(图1D和1E)。尽管OCT4/NANOG阳性集落在FMM中专一维持的培养物中检测到,但集落数目和大小看起来不如阶段特异性培养基方法。
这些结果显示靶向重编程和维持过程的不同阶段时的独特途径的新型多阶段培养系统导致高质量hiPSC的有效制造。
实例2
用于制造在单细胞传代和FF形式中的无转基因hiPSC的平台
概述
使用附加型载体系统的非整合重编程方法的效率极低(<0.001%),尤其是在FF环境中(Narsinh等人,2011;O'Doherty等人,2013)。附加体诱导在包括两种培养基的多阶段培养系统中进行测试:含有SMC4和显示为改善重编程的培养基添加剂的命运重编程培养基(FRM)以及FMM(图2A和表1)。
结果
由基因组合OCT4/SOX2/NANOG/KLF4/LIN28/MYC/SV40LT(OSNKLMT)组成的附加体表达系统用于转染各种成纤维细胞。附加体表达诱导后二十四小时,将重编程培养转变为FRM,以增强重编程动力学。在第一周内观察到早期集落形成,并且到第10天时,检测到SSEA4/TRA1-81阳性细胞的大群(>1%)(图8A和8B)。在第14天时,将由FRM支持的重编程培养物拆分到FRM或FMM培养基内。在第21天时,FACS用于鉴定培养中的SSEA4/TRA1-81/CD30阳性细胞(图8C)。FRM维持的培养物含有分化细胞和未分化细胞两者,而FMM培养物主要含有未分化细胞(图8D)。
这种方法的流通量和稳健性用成纤维细胞和CD34+细胞进行测试,所述CD34+细胞由来自不同年龄、性别和种族性的供体的最低体积的脐带血扩增(图9A和9B)。体细胞重编程如图2A中概述的使用附加体基因组合集合OSNKLMT进行诱导,并且96孔板流式细胞术在第16和21天之间就个别hiPSC进行分选(图2B)。对于测试的大多数系观察到SSEA4/TRA1-81/CD30阳性细胞的大群。与使用常规培养基和饲养细胞的平行重编程实验相比较,FRM和FMM培养基系统导致hiPSC克隆数目的显著增加(对于FTC007成纤维细胞系,FRM/FMM中的8.55%相对于常规培养中的0.02%;图2B和2C)。对于每个体细胞系可见平均起来22个克隆hiPSC/96孔板(图2B、10A和10B),所述体细胞系包括先前已观察到对用SMC4培养基的慢病毒重编程抗拒的成纤维细胞FTC008。集落随后通过分析细胞内和表面标记物表达以及关于NANOG的直接qRTPCR证实为真正的hiPSC克隆(图2D、2E和10C)。使用96孔分选和选择过程的重编程效率也得到增加(图2E)。用确定的表面涂布玻连蛋白也观察到相似的重编程效率(图10D)。
这些数据显示当应用于附加体重编程时,平台是稳健和可重现的,并且允许以高流通量形式平行执行多重重编程实验,伴随最低限度的努力且不妥协iPSC终末产物的质量。
实例3
无转基因hiPSC系在FMM中的长期传代和扩增
概述
使用在FF培养中作为单细胞扩增的来自实例2的hiPSC克隆,研究使用FRM和FMM的多阶段培养基平台的hiPSC的长期传代和扩增(图3A和3B)。
结果
根据实例2重编程的hiPSC系到第4-7代时丧失附加型DNA,并且因此不依赖于基于转基因的重编程因子而多能(图3C)。hiPSC系维持对于SSEA4、TRA1-81、OCT4和NANOG阳性的未分化细胞的同质群。此外,这些系在不存在任何清除策略的情况下维持多能特征(图3F),所述清除策略常用于多能培养中(图3D和3E)。当在常规的单细胞传代培养期间,Matrigel替换为确定的表面涂布玻连蛋白时,观察到均匀hiPSC培养物的相似扩增(图10E-10G)。
基因组异常通常在FF环境中作为单细胞培养的hESC和hiPSC系中检测到(Laurent等人,2011;Taapken等人,2011)。所有分析的hiPSC系的核型分析证实在FMM培养中的基因组稳定性(图4A)。另外,在FMM中维持延长时期(25-30代)的单细胞和FF培养的hiPSC克隆继续维持其未分化概况和基因组稳定性,而无需培养物清除或选择(图4B)。
在FMM中维持的附加体衍生的hiPSC克隆也容易产生所有三个体细胞谱系,经由胚状体的体外分化,以及通过畸胎瘤形成的体内分化(图4C-E)。
这些数据证实FRM和FMM多阶段培养基平台使无转基因hiPSC克隆能够以FF和单细胞酶促传代形式容易生成且扩增,同时维持多能和基因组稳定的细胞的同质群。
实例4
多阶段培养基平台使使用最低限度基因的附加体重编程成为可能
概述
具有癌基因例如KLF4、MYC和LIN28的减少依赖性或在重编程过程中需要敲减P53的有效的无足迹表达系统具有用于多能干细胞治疗的极大价值(Lee等人,2013;Okita等人,2011;Yu等人,2009)。因为多阶段培养基平台证实使用OSNKLMT重编程因子用于生成和扩增无转基因hiPSC细胞的极度有效和稳健的平台,平台的稳健性针对重编程因子的需求进行测量。
结果
在改变基因表达组合和剂量的尝试中,构建包含最低限度基因集合的几种附加体表达盒,包括OCT4/NANOG/SOX2(ONS)、OCT4/SOX2(OS)或OCT4/OCT4(2xO)(图5A)。用OCT4、NANOG、SOX2和SV40LT的组合转染成纤维细胞细胞系,并且使用FRM/FMM平台进行培养。在重编程第13天时,SV40LT单独不产生任何真正的SSEA4/TRA1-81阳性细胞,但改善转染后的细胞存活(图5B和11A)。各种重编程因子组合导致有效重编程,如通过SSEA4/TRA1-81阳性群在重编程过程中早期的出现证实的(到第13天时,关于OCT4/SOX2/SV40LT的>0.5%和关于OCT4/NANOG/SOX2/SV40LT的>3.5%;图5B)。重编程另外几天的培养物显著增加SSEA4/TRA1-81阳性群(到第16天时,关于OCT4/SOX2/SV40LT的>4.0%;图11B)。令人惊讶的是,观察到的重编程细胞的百分比与含有癌基因KLF4和MYC的慢病毒和附加体诱导系统可比较(图2B、5B和11B)。
在流式细胞术分选和选择个别hiPSC克隆之前,几种重编程因子组合推进且转变为FMM培养基。类似于OSNKLMT附加体重编程,克隆hiPSC系容易来源于含有最低限度基因OCT4、SOX2和SV40LT的组合(2xO+OS+T)以及其他组合(图5C)。到第5-7代时已丧失转基因和附加型载体标记物的hiPSC克隆推进用于进一步分析(图5D)。所选择的克隆作为单细胞在FF环境中连续传代,且维持基因组稳定的未分化细胞的同质群,且展示有效分化成三个体细胞谱系的能力(图5E-J)。
总之,这些数据指示hiPSC通过在FRM/FMM、基于流式细胞术的重编程平台中瞬时表达最低限度的重编程基因而容易地生成。
实例5
FMM平台支持基态多能性
概述
为了进一步评估FMM平台,通过现有方法重编程的体细胞的基因表达特征与使用本文考虑的FMM平台重编程的体细胞的基因表达特征相比较。评估小分子和常规维持的hiPSC培养之间的基因表达差异(Hanna等人,2010b;Saha和Jaenisch,2009)。
结果
在一组实验中,评估小分子介导的培养和常规培养之间的基因表达模式。慢病毒诱导的hiPSC克隆FTi111在小分子培养中生成且维持,且显示为多能的。克隆直接解冻到各种培养环境内,包括:i)具有饲养细胞的常规培养基,和ii)具有饲养细胞或在FF表面上的含有小分子抑制剂的培养基(图12A和12B)。在常规培养中的hiPSC集落仅在Thiazovivin,ROCK抑制剂的存在下回收,并且随后将回收的细胞转换为块培养(图12B和12C)。每组培养条件证实独特的集落形态(图12D)和多能标记物的基因表达的不同模式(图12E)。在饲养细胞上的常规维持的培养比其在小分子中维持的配对培养更紧密地类似在常规培养中维持的hESC对照H1和HUES9(图12E)。这些数据显示不同的基因表达模式存在于小分子介导的培养和常规培养之间。
基因表达中的差异还在使用慢病毒诱导和常规ESC/饲养者培养衍生的hiPSC以及附加体衍生的系之间进行评估,并且进一步在FRM/FMM平台中维持的用重编程因子的不同组合衍生的附加体系之间进行评估。高含量qRT-PCR分析用于定量与多能性和分化相关的基因表达。调查的大多数多能性基因展示在FMM培养或含有饲养细胞的常规培养中维持的hiPSC之间可比较的表达模式(图6A)。然而,在与分化相关的基因的评价上观察到细胞系之间的差异(图6B)。当与在常规培养基中和在饲养细胞上维持的hiPSC和H1hESC两者相比较时,FMM维持的hiPSC展示与三个体细胞谱系相关的大多数基因的更低表达。通过附加型基因集合OSNKLMT诱导的系亚集看起来显示外胚层谱系OTX2和TUJ1的表达,而这种表达在不使用Lin28、KLF4和c-MYC的附加体衍生的hiPSC中可忽略不计(图6B)。令人惊讶的是,测试的所有分化基因的表达在来源于附加体最低限度基因集合且在FMM中维持的所有hiPSC中被完全压制(图6B)。总之,这些数据指出FRM/FMM平台可使用很少的基于附加体的重编程因子使细胞稳健地重编程,并且可使hiPSC维持在稳定多能基态。
对于来源于下述方法的hiPSC测定总体基因表达模式:i)在FMM中维持的附加体诱导,ii)在FMM中维持但对于三次传代转变为常规培养基的附加体诱导,iii)在SMC4中维持的慢病毒诱导;和iv)在常规培养中维持的慢病毒诱导(图13A、13B)。在评估基因表达谱之前,所有系均测定为多能的、基因组稳定的;并且能够分化成所有三个体细胞谱系。在小分子培养和常规培养之间差异表达的基因的簇分析揭示hiPSC系基于目前的培养条件而不是最初的衍生方法和培养成组(图13B)。展示2.5倍表达差异的300种基因的基因本体分类将分化和发育鉴定为在常规培养组中高度富集的主要类别,而在小分子培养组中上调的基因与细胞增殖和性发育调节最相关(图13C和13D)。
重复基因表达分析,并且直接比较FMM、常规或转变培养系统(FMM,Conv,FMM→Conv,Conv→FMM;图13A)。簇分析产生与生成方法或先前培养系统无关,基于目前培养系统分开的两组(图7A)。例如,在转变为常规培养之前,hiPSC克隆FTC016-c28在FRM/FMM平台下生成且维持。这个克隆与在常规培养中专一地维持的培养物而不是与其在FMM中维持的亲本系成组;可比较结果用系例如OKS慢病毒诱导的hiPSC克隆可见,所述hiPSC克隆在常规培养中生成且在常规集合内成组直至转变为FMM,在其上它在FMM簇内成组(图7A)。基因本体使常规培养分类以富集与分化和发育相关的基因(即p值=2.2E-10,模式指定过程;图7B和13E)。总之,这些数据显示与分化倾向相关的基因在FMM培养中显著减少,并且hiPSC可适合FMM培养平台,以减少自发分化潜能。
汇集代表人多能干细胞的基态和亚稳态的基因列表(De Los Angeles等人,2012;Han等人,2011;Hanna等人,2010a;Hirata等人,2012;Nichols和Smith,2012;Valamehr等人,2012;Zhou等人,2010)(图7C)。对于在FMM或常规培养中的hiPSC系执行基于这些基因列表的基因聚簇(图7D)。类似于总体基因表达比较,集中的基因聚簇显示基于其目前培养条件的细胞系分开,具有看起来可相互转换的概况。例如,从FMM转变为常规培养的hiPSC克隆FTC016-c28与H1hESC而不是与其在FMM中维持的亲本hiPSC系成组(图7D)。类似地,来源于在常规培养中维持的成纤维细胞系的慢病毒hiPSC克隆与HUES9hESC和在常规培养中的其他hiPSC克隆成组;然而,当转变为FMM时,它与来源于脐带血的附加体hiPSC以及其他FMM培养的系成组(图7D)。代表两个簇内的基态和亚稳态的基因分布通过就小分子(SMC4/FMM)相对于常规培养而言标绘关于每个探针组的平均强度进行测定(图7E)。令人惊讶的是,与基态相关的大多数基因显示在小分子培养簇中升高的表达,并且在常规培养簇中检测到与亚稳态相关的基因的增加表达(图7E)。
在常规培养中培养且维持的hiPSC的X失活状态与其适应小分子培养且维持10代的配对物相比较(图7F)。当与常规培养相比较时,在小分子培养中维持的hiPSC显示X染色体基因表达的增加,其提示沉默的X染色体的复活(图7F)。值得注意的例外是X失活特异性转录物(XIST),其在转变为小分子培养中是下调的(图7F)。X活化的进一步证据通过相对于其适应常规培养基的配对培养,在FMM中培养的hiPSC中的H3K27me3的差异染色提供(图7G)。在FMM中的大多数hiPSC缺乏H3K27me3染色;然而,在常规培养中的大多数hiPSC展示H3K27me3核灶,具有核大小减少的外观,这提示X失活(与常规培养中的>90%H3K27me3染色相比较,在FMM中的<10%H3K27me3染色;图7G)。
实例6
小分子培养中的hiPSC维持
一旦培养物的汇合达到75-90%,衍生的hiPSC(用重编程因子的各种组合包括OCT4/NANOG/SOX2、OCT4/ECAT1/UTF1或OCT4/ECAT1/UTF1/ESRRB/NANOG诱导的成纤维细胞或血细胞)就作为单细胞照常规传代。对于单细胞解离,hiPSC用磷酸盐缓冲盐水(PBS)(Mediatech)洗涤一次,且在37℃下用Accutase(Millipore)处理3至5分钟,随后为吹吸以确保单细胞解离。单细胞悬浮液随后以等体积与常规培养基混合,以225g离心4分钟,重悬浮于命运维持培养基(FMM)中,且在hESC合格Matrigel(Corning)涂布表面上铺平板。根据制造商的说明书,制备Matrigel且用于涂布表面。传代通常为1:3-1:6,组织培养板先前在37℃下用Matrigel涂布1-4小时,并且每两到三天用FMM供养。细胞培养在设为37℃和5%CO2下的加湿温箱中维持。常规培养基由DMEM/F12(Mediatech)、20%敲除血清替代物(Life Technologies)、1x Glutagro(Mediatech)、1x非必需氨基酸(NEAA)(Mediatech)、1x Pen/Strep(Mediatech)和100μMβ-巯基乙醇组成。FMM由常规培养基组成,所述常规培养基补充有5μM Thiazovivin(内部合成)、0.4μM PD0325901(Biovision)、1μM CHIR99021(Biovision)、100ng/mLbFGF(Life Technologies)和10ng/mL hLIF(Millipore)。关于在FMM中扩增的培养物的流动分析和形态呈现于图18A-D和19A-B中。在FMM中扩增的细胞还证实经过多次传代的正常核型,如图20A-D中所示。
实例7
在小分子培养中使用最低限度基因的重编程
为了起始重编程,重编程因子的后生表达通过使用NIL的慢病毒转导、常规整合慢病毒或用附加型载体的电穿孔进行诱导。如图14A-B中所示,慢病毒表达系统由几个特点组成,所述特点包括EF1α启动子、特异性基因组合(表3)和在3'末端处的LOXP位点,以允许CRE介导的整合转基因的切除。在CRE切除后,衍生的hiPSC基因组不再含有转基因且基本上是无足迹的。如图14C-F中所示,附加型构建体具有独特特点,包括EF1α启动子和独特的重编程因子。在转染后,附加型构建体位于核内,并且以不整合到基因组内的反式介导方式起作用。
对于慢病毒感染,根据制造商的说明书,起始人成纤维细胞以7x104-1x105个细胞/用Matrigel(Corning)涂布的6孔板的孔进行种植。来自293T细胞的新鲜慢病毒上清液以1∶2稀释度(一份慢病毒上清液:一份成纤维细胞培养基)加入起始细胞中。NIL病毒上清液以1x浓度使用且不稀释。如果使用先前冷冻的病毒,则它不稀释且以1x浓度使用。各种因子的病毒上清液组合(表3)直到总共2mL培养基/6孔。这补充有5μg/mL聚凝胺(Millipore)和10mM Hepes(Meditech),随后为自旋感染。六孔板用石蜡膜密封且在32℃下以600g离心90分钟。板随后转移至37℃和5%CO2温箱12-16小时。在与慢病毒一起温育后,细胞用PBS进行洗涤,并且培养基转变为含有一份命运重编程培养基(FRM)和一份成纤维细胞培养基的50/50培养基。培养基在感染后4至6天之间完全转变为FRM。FRM由补充有下述的常规培养基(上文描述的)组成:5μM Thiazovivin(内部合成)、0.4μM PD0325901(Biovision)、1μM CHIR99021(Biovision)、2μM SB431542(Biovision)、100ng/mL bFGF(Life Technologies)、10ng/mL hLIF(Millipore)、1x N2补充物(Life Technologies)和1x B27补充物(Life Technologies)。一旦孔变得汇合,细胞就在先前用Matrigel涂布的10cm皿上进行传代。传代由在Matrigel涂布的表面上用Accutase(Millipore)解离组成(如上所述)。在第14和18天之间,或当iPSC集落变得存在时,培养基从FRM转变为FMM。单细胞解离的细胞扩增到具有FMM的Matrigel涂布的板上,并且维持直至流式细胞术分选时。关于hiPSC表型表达的结果呈现于表3、图15A-C(在8-15天时)和图16A-D、图17A-B(在第4周时Oct-4/Ecat1/UTF1/Esrrb/Nanog)。
表3:重编程因子组合和多能表型表达
对于附加型载体重编程,使用NEON转染系统(Life Technologies)进行使用图13中所示的质粒的成纤维细胞或脐带血细胞转染。如通过产品手册描述的,大致地,使用在适当缓冲液中1650v/10ms/3次脉冲的设置,总共3μg含有重编程因子的附加型质粒与EBNA(以mRNA的形式或作为克隆质粒pCDNA中的盒)共转染到5x105成纤维细胞或2.5x105脐带血细胞内。将经转染的细胞直接种植到6孔板的孔上,所述6孔板用含有Matrigel的成纤维细胞培养基或脐带血培养基(取决于细胞类型)进行涂布,所述培养基补充有4ng/mL bFGF和5μg/mL纤连蛋白(BD Biosciences),不含抗生素。脐带血培养基由SFMII+CC110(Stem Cell Technologies)组成。转染后二十四小时,将FRM以等体积加入培养中。对于成纤维细胞培养,转染后四十八小时,将50μg/mL潮霉素(Corning)加入培养中。培养基在第5天时完全转变为FRM,其中潮霉素在转染后7天去除。转染后14天,所有重编程培养转变为FMM。对于脐带血培养,感染后二十四小时,将FRM以等体积加入,并且每几天连续加入,直至转染后第14天,其中培养物被抽吸且替换为完全FMM。在两种情况下,在转染后5至7天左右可见贴壁圆形细胞的簇。一旦在FMM中,所有重编程培养均得到维持,并且在Matrigel涂布的表面上使用Accutase进行单细胞传代(上文描述)。单细胞解离的细胞扩增到具有FMM的Matrigel涂布的板上,并且维持直至流式细胞术分选。
实例8
重编程因子及其化学计量学的影响
人成纤维细胞用含几种重编程因子的慢病毒进行自旋感染。所有样品均用OCT4、SOX2、NANOG和SV40LT进行感染,使用不含抗生素选择因子的慢病毒质粒。细胞用含有嘌呤霉素选择盒以及各种重编程因子的单一慢病毒质粒共感染。这些因子包括OCT4-P2A-SOX2、OCT4-P2A-NANOG-T2A-SOX2或OCT4-P2A-OCT4。感染后两天,将在50/50培养基中的500ng/mL嘌呤霉素(Life Technologies)加入每个孔中。在第5天时,在嘌呤霉素选择的三天后,培养基变成不含嘌呤霉素的FRM。在第14天时,培养基转变为FMM。在第24和27天之间,对于SSEA4+/TRA181+群进行流动分析。观察到增加的OCT4表达显著改善重编程效率(图23A)。
实例9
实验程序
在常规培养系统中的hiPSC维持
常规培养的hiPSC维持在丝裂霉素C处理的MEF(Millipore)饲养细胞上,并且用常规培养基(在正文中被称为常规培养基)进行培养,所述常规培养基含有DMEM/F12(Mediatech)、20%v/v敲除血清替代物(Life Technologies)、1%v/v非必需氨基酸(Mediatech)、2mM L-谷氨酰胺(Mediatech)、100μMβ-巯基乙醇(Life Technologies)和10ng/mL bFGF(Life Technologies)。在汇合时,常规培养的hiPSC使用1mg/mL胶原酶IV(Life Technologies)在37℃下酶促解离7分钟,随后机械解离成小片(称为块传代),收集且每5–7天1:3–1:4稀释传代到新鲜种植的饲养细胞上,伴随常规培养基的每天添加。在过度自发分化的情况下,手动挑选集落且使用胰岛素注射器(Becton Dickinson)的尖端切割成小片,并且转移至新鲜种植的饲养细胞。细胞培养维持在设为37℃和5%CO2下的加湿温箱中。
体细胞的重编程
为了起始重编程,重编程因子的后生表达通过慢病毒转导或附加型载体转染进行诱导。慢病毒转染遵循如先前描述的(Valamehr等人,2012)。简言之,起始细胞以1x105个细胞/6孔板的孔铺平板到Matrigel(BD Biosciences)涂布的表面上。除非指定,否则所有Matrigel涂层均由下述组成:将Matrigel溶液(重悬浮于25mL DMEM/F12中的1等分试样的Matrigel)加入组织培养表面,并且允许在37℃下的2-4小时温育。来自生成表达转基因OCT4/SOX2/KLF4的慢病毒的293T细胞的上清液以1∶2稀释度(一份慢病毒上清液:1份成纤维细胞培养基)加入起始细胞,补充有4μg/mL聚凝胺(Millipore),并且转移至37℃和5%CO2共12-16小时。成纤维细胞培养基:DMEM(Mediatech)、10%FBS(Life Technologies)、1x glutamax(Life Technologies)、1x非必需氨基酸(Mediatech)。在与慢病毒一起温育后,细胞用PBS洗涤三次且用成纤维细胞培养基供养。转染后48小时,培养基转变为含有一份FRM(或SMC4)和一份成纤维细胞培养基的50/50培养基。一旦培养物传代到较大容器内,通常在转染后第4至6天之间,培养基就完全转变为FRM(或SMC4)。传代由在Matrigel涂布的表面上用Accutase解离组成(如下所述)。培养维持在FRM(或SMC4)中直至下一次应用。
对于附加型载体重编程,使用NEON转染系统(Life Technologies)进行使用基因集合OCT4/SOX2/NANOG/KLF4/LIN28/MYC/SV40LT(A14703,Life Technologies)的成纤维细胞或脐带血细胞的转染。如通过产品手册描述的,大致地,使用在适当缓冲液中1650v/10ms/3次脉冲的设置,将4μg载体组转染到5x105个成纤维细胞或2.5x105个脐带血细胞内。将经转染的细胞直接铺平板到10cm皿(成纤维细胞)或6孔板(脐带血)的孔内,所述10cm皿或6孔板用Matrigel进行涂布,且含有成纤维细胞培养基或脐带血培养基(取决于细胞类型),所述培养基补充有10ng/mL bFGF和5μg/mL纤连蛋白(BD Biosciences)。脐带血培养基:SFMII+CC110(Stem Cell Technologies)。转染后二十四小时,将FRM以等体积加入培养中。对于成纤维细胞培养,转染后四十八小时,将50μg/mL潮霉素(Mediatech)加入培养中。培养基在第5天时转变为完全FRM,其中潮霉素在转染后第7天时去除。在转染后第14天时,所有重编程培养转变为FMM。对于脐带血培养,转染后二十四小时,将FRM以等体积加入,并且每几天连续加入,直至转染后第14天,其中培养物被抽吸且替换为完全FMM。在两种情况下,在转染后5至7天左右可见贴壁圆形细胞的簇。一旦在FMM中,所有重编程培养均得到维持,并且使用Accutase进行单细胞传代。单细胞解离的细胞扩增到具有FMM的Matrigel涂布的板上,并且维持直至流式细胞术分选。在玻连蛋白(Life Technologies)表面涂布研究中,所有方面均保持相同,除了将Matrigel替换为玻连蛋白之外。对于减少因子的附加体重编程,pCEP4(Life Technologies)载体主链构建为含有在EF1α启动子调节下的OCT4-P2A-OCT4、OCT4-P2A-SOX2或OCT4-P2A-NANOG-T2A-SOX2。减少因子的附加型载体的转染遵循与上文所述相同的方案,除了少数修饰之外。EBNA与EBNA mRNA(20μg)或载体盒(2μg)共转染(Howden等人,2006)。潮霉素选择维持10天,并且FMM在第16天时引入。
慢病毒的生成
293T(ATCC)维持在不含抗生素的成纤维细胞培养基中,且允许达到超过80%汇合。成纤维细胞培养基由DMEM(Mediatech)、10%胎牛血清(FBS)(Life Technologies)、1x Glutagro(Mediatech)和1x NEAA(Mediatech)组成。细胞通过首先用PBS洗涤随后在37℃下与0.05%胰蛋白酶(Mediatech)一起的4分钟温育进行传代。解离的细胞重悬浮于成纤维细胞培养基中,以225g离心4分钟,且种植到所需板上。为了生成整合慢病毒,对于每种病毒制备物,293T在第1天时以3.5x106个细胞/10cm皿进行传代。在第2天时,转染前1小时,培养基变成10mL新鲜成纤维细胞培养基。DNA使用CalPhos Kit(Clontech)进行转染。将下述组合用于转染:5μg含有目的基因的慢病毒克隆质粒、3.2μg包装质粒pPAX、630ng包装质粒pMDG、87μL钙溶液和水直到700μL。加入700μL HBS溶液,同时使用1mL血清学吸管产生气泡。这在室温下温育15分钟,且随后逐滴加入293T的10cm板。在第3天时,取出病毒上清液,弃去,并且将15mL新鲜成纤维细胞培养基加入板中。在第4天时,转染后48小时,收集病毒上清液且贮存于4℃下。将15mL成纤维细胞培养基加入板中。在第5天时,转染后72小时,收集病毒上清液且加入第4天上清液中。这个病毒合并物(pool)使用0.45μm滤器进行过滤,并且使用Lenti-X GoStix(Clontech)检查滴度。病毒用于感染或以等分试样在-80℃下冷冻。为了生成非整合慢病毒(NIL)(Invivogen),对于每种病毒制备物,使用T75烧瓶,遵循根据制造商说明书的方案。转染后48、72和96小时收集病毒上清液,合并,过滤且如上所述滴定。NIL病毒用于感染或以等分试样在-80℃下冷冻。
在小分子培养中的hiPSC维持
一旦培养物的汇合达到75-90%,衍生的hiPSC就照常规作为单细胞进行传代。注意到过度汇合可导致分化。对于单细胞解离,hiPSC用磷酸盐缓冲盐水(PBS)(Mediatech)洗涤一次,且在37℃下用Accutase处理3至5分钟,随后为吹吸以确保单细胞解离。单细胞悬浮液随后以等体积与常规培养基混合,以225g离心4分钟,重悬浮于FMM中,且在Matrigel涂布的表面上铺平板。传代通常为1:4–1:8,转移先前在37℃下用Matrigel涂布2-4小时的组织培养板,并且每隔一天用FMM供养。细胞培养在设为37℃和5%CO2下的加湿温箱中维持。关于FMM和FRM的培养基配方在表1中描述。先前讨论了SMC4培养(Valamehr等人,2012)。简言之,将小分子0.4mM PD0325901(Biovision)、1mM CHIR99021(Biovision)、5mM Thiazovivin和2mM SB431542(Biovision)加入常规培养基中,并且根据方案进行传代。
流式细胞术分析和分选
单细胞解离的(上文描述)重编程库重悬浮于冷却的染色缓冲液中,所述染色缓冲液含有Hanks'平衡盐溶液(MediaTech)、4%胎牛血清(Invitrogen)、1x青霉素/链霉素(Mediatech)和10mM Hepes(Mediatech)。将缀合的一抗包括SSEA4-FITC、TRA1-81-Alexa Fluor-647和CD30-PE(BD Biosciences)加入细胞溶液中,且在冰上温育15分钟。所有抗体均在100μL染色缓冲液以7-10μL/百万个细胞使用。溶液在染色缓冲液中洗涤一次,以225g向下旋转4分钟,且重悬浮于含有10μM Thiazovivin的染色缓冲液中,且在冰上维持用于流式细胞术分选。使用同上描述的门控策略,在FACS Aria II(BD Biosciences)上执行流式细胞术分选。分选的细胞使用100μM喷嘴以3和9个事件/孔的浓度直接喷射到96孔板内。分选3个细胞/孔是优选浓度,因为注意到分选的事件不一定与分选后每个孔中可见的实际细胞数目关联,并且3个细胞/孔给予含有个别集落的优选孔数目。每个孔预填充有补充了5μg/mL纤连蛋白和1x青霉素/链霉素(Mediatech)的200μL FMM,并且先前用5x Matrigel涂布过夜。5x Matrigel预涂布包括将一等分试样的Matrigel加入5mL DMEM/F12内,随后在4℃下温育过夜,以允许适当重悬浮且最后以50μL/孔加入96孔板,随后为在37℃下的过夜温育。在将培养基加入每个孔之前立即抽吸5x Matrigel。在分选完成后,96孔板在温育前以225g离心1-2分钟。板不受打扰七天。在第七天时,从每个孔中取出150μL培养基且替换为100μL FMM。孔在分选后第10天时用另外100μL FMM再供养。集落形成早在第2天时检测到,并且大多数集落在分选后第7-10天之间进行扩增。在第一代中,孔用PBS洗涤且在37℃下用30μL Accutase解离大约10分钟。延长的Accutase处理的需要反映在培养中静置延长持续时间的集落的紧密性。在细胞可见解离后,将200μL FMM加入每个孔中,并且吹吸几次以破坏集落。解离的集落转移至先前用5x Matrigel涂布的96孔板的另一个孔,并且随后在温育前以225g离心2分钟。进行这种1:1传代以使早期集落铺展开。后续传代照常规完成:用Accutase处理3-5分钟,并且1:4扩增到先前用在FMM中的1x Matrigel涂布的更大的孔内。流式细胞术分析在Guava EasyCyte 8HT(Millipore)上执行,并且使用FCS Express 4(De Novo Software)进行分析。
实时RT-PCR和Fluidigm分析
使用Pico Pure RNA Isolation Kit(Life Technologies)分离总RNA。使用iScript cDNA Synthesis Kit(Bio-Rad),由100ng分离的总RNA逆转录互补DNA(cDNA)。使用TaqMan PreAmp Master Mix Kit(Life Technologies)和0.2x浓度的合并TaqMan测定,cDNA随后用于22种特异性靶基因和两种参考对照基因的预扩增。使用14个扩增循环,使用在制造商的方案中所述的标准循环条件,执行来自cDNA的特异性靶扩增(STA)。预扩增的cDNA反应(n=48)1:5稀释(在无菌水中),并且用作实时定量PCR反应的模板。使用NanoFlex IFC Controller MX(Fluidigm)装载48.48Dynamic阵列(Fluidigm),其中TaqMan测定一式两份装载,并且使用BioMark Real-Time PCR System(Fluidigm)执行实时反应。使用BioMark Real-Time PCR Analysis软件(Fluidigm)分析结果。从计算中排除具有超过32的循环阈值(Ct)的样品。平均Ct由测定重复进行计算,并且使用两种参考基因(GAPDH和HPRT1)的平均值针对六种对照MEF细胞系(在MEF上的OSK hiPSC和H1ESC)的中值计算delta-delta Ct(ΔΔCt)。相对基因表达(RQ)结果以热图形式在Excel(Microsoft)中展示。
表4.FAM标记的TaqMan探针
测试转基因的存在
使用DNA Mini Kit和蛋白酶K消化(Qiagen)分离基因组DNA。使用Taq PCR Master Mix Kit(Qiagen),使用转基因特异性引物组(下表5)扩增100ng基因组DNA(Yu等人,2007)。PCR反应如下运行35个循环:94℃30秒(变性)、60-64℃30秒(退火)和72℃1分钟(延伸)。来自使用慢病毒方法生成的成纤维细胞和hiPSC的基因组DNA用作阴性对照。附加型构建体的DNA用作阳性对照。
表5.转基因特异性引物组
免疫细胞化学分析
细胞使用4%v/v多聚甲醛(Alfa Aesar)进行固定,用含有0.2%v/v Tween的PBS(PBST)(Fisher Scientific)洗涤三次,并且在25℃下使用在PBS中的0.15%v/v TritonX-100(Sigma-Aldrich)渗透化处理1小时。在渗透化处理后,细胞在25℃下用在PBST中的1%v/v BSA(Invitrogen)(PBSTB)(Fisher Scientific)封闭30分钟。在PBSTB的轻柔去除后,细胞与在PBSTB中的一抗一起在4℃下温育过夜。在该研究中使用的一抗包括OCT4(Santa Cruz)、NANOG(Santa Cruz)、TRA160(Millipore)、TRA1-81(Millipore)、SSEA4(Millipore)、β-III微管蛋白(TUJ1、R&D Systems)、α-平滑肌肌动蛋白(Sigma)、FoxA2(R&D Systems)、Sox17(R&D Systems)、NESTIN(Abcam)和α-1-胎蛋白(Dako)。在过夜温育后,细胞用PBST洗涤三次,并且在37℃下用在PBSTB中1:250稀释的二抗(Alexa Fluor 488或555;Invitrogen)染色1小时。细胞在PBS中洗涤三次,并且用Hoechst染料(Invitrogen)进行染色。对于H3K27me3染色分析,hiPSC在盖玻片上生长72至96小时,并且在25℃下用在PBS中的4%多聚甲醛(Electron Microscopy Science,EMS)固定15分钟。细胞渗透化处理在25℃下用在PBS中的0.1%Triton X-100执行1小时,并且随后细胞在25℃下与封闭溶液(在PBS中的1%BSA)一起温育30分钟。在封闭后,盖玻片在4℃下与抗三甲基组蛋白H3(Lys27)抗体(Millipore 07-449,H3K27me3)的1:1600稀释物一起在封闭溶液中温育过夜。二抗是Alexa Fluor 555山羊抗兔IgG(Life Technologies,A21429)。核用DAPI进行复染,并且用Axio Observer Inverted Microscope(Carl Zeiss)观察。用AxioVS40v4.8.1.0(Carl Zeiss Imaging Solutions Gmbh)捕获图像。
根据实例7重编程的细胞使用4%v/v多聚甲醛(Alfa Aesar)进行固定,用PBS(Mediatech)洗涤,并且在25℃下使用在PBS中的0.15%v/vTritonX-100(Sigma-Aldrich)渗透化处理1小时。在渗透化处理后,细胞在25℃下用在PBS中的1%v/v BSA(Sigma)(PBSB)封闭30分钟。在PBSB的轻柔去除后,细胞与在PBSB中的一抗一起在4℃下温育过夜。在该研究中使用的一抗包括OCT4(Santa Cruz)和TRA181(Millipore)。在过夜温育后,细胞用PBS洗涤三次,并且在37℃下用在PBSB中1:250稀释的二抗(Alexa Fluor 488或555;Life Technologies)染色1小时。细胞在PBS中洗涤三次,并且用Hoechst染料(Invitrogen)进行染色。染色的细胞用Axio Observer Inverted Microscope(Carl Zeiss)观察。用AxioVS40v4.8.1.0(Carl Zeiss Imaging Solutions Gmbh)捕获图像。
分化分析(EB和定向)
hiPSC在分化培养基中分化为EB,所述分化培养基含有DMEM/F12(Mediatech)、20%胎牛血清(Invitrogen)、1%非必需氨基酸(Mediatech)、2mML-谷氨酰胺(Mediatech)和100μMβ-巯基乙醇。简言之,对于EB形成,将hiPSC种植到FMM中,并且第二天转变为常规,以使细胞引发。在常规培养基中3至4天后,培养物是用Accutase(Millipore)解离的单细胞,并且在包括10μM Y27632的分化培养基中重悬浮至100,000个细胞/mL的最终浓度。注意到ROCK抑制剂Y27632代替Thiazovivin用于EB形成。细胞以100μL/孔种植到V形底96孔非组织培养板(Nunc)中,并且以950g离心5分钟。第二天,使用P1000以在分化培养基中的大约30–40个EB/孔,将紧密的“球样块”转移至超低结合6孔板(Corning)。在7天后,EB以1:1转移至Matrigel涂布的6孔板,并且每三天用分化培养基供养。在培养3周后,将细胞固定且染色。对于定向单层分化,将hiPSC种植到Matrigel涂布的孔中的FMM中,以在第二天递送50%和90%汇合。两个密度均诱导至分化。对于神经诱导,将FMM培养基替换为补充有10μM SB431542和100nM LDN-193189(两种SMAD抑制剂,Biovision)的hESC培养基。在2天后,除双重SMAD抑制剂之外,分化培养基还补充有3μM CHIR99021(Biovision)。两天后使细胞固定且就巢蛋白(Abcam)进行染色。对于中胚层分化,将培养基替换为补充有1x B27培养基添加剂(Life Technologies)、3μM CHIR99021、4ng/ml bFGF和10ng/ml BMP4的RPMI(Mediatech)。每隔一天更换培养基,并且在第4天时使细胞固定,并且就αSMA(Sigma)进行染色。使用Human Pluripotent Stem Cell Functional Identification Kit(R&D Systems)执行内胚层分化。hiPSC与内胚层分化培养基一起温育3天,固定且就SOX17(R&D Systems)进行染色。
基因表达分析
使用制造商推荐的方案,使用PicoPure RNA Isolation试剂盒(Life Technologies)提取RNA。使用Nanodrop 2000分光光度计(Thermo Scientific)定量总RNA。简言之,使用用于MessageAmp II aRNA Amplification Kit(Applied Biosystems/Ambion,Austin,TX)的标准方案,利用任选的第二轮扩增,由大致100ng总RNA制备生物素化的aRNA,并且随后使用标准方案,使用MessageAmp II Biotin Enhanced Kit(Applied Biosystems/Ambion,Austin,TX),转录成生物素标记的aRNA。生物素标记的aRNA根据Affymetrix建议进行纯化且片段化。20μg片段化的aRNA在45℃下用于与Human Genome U133-plus-2.0芯片(Affymetrix Inc.Santa Clara,CA)杂交16小时。将阵列洗涤且在Affymetrix Fluidics Station 450中染色,并且使用Affymetrix GeneChip Scanner 3000 7G进行扫描。原始表达数据文件在Gene Expression Omnibus(GSE50868)上可获得。使用Affymetrix Expression Console软件,使用缺省分析设置分析图像数据。阵列通过对数标度的稳健的多阵列分析(RMA,Affymetrix)进行标准化,并且在Spotfire for Genomics 4.5(Tibco Spotfire,PaloAlto,CA)中显现。差异表达的探针的生物途径富集分析针对Gene Ontology(GO)数据库(对GO生物过程的单独富集和p值<0.01)执行,使用Database for Annotation,Visualization and Integrated Discovery(DAVID v6.7)。使用完全连锁聚簇方法与欧几里得距离测量(Spotfire for Genomics 4.5),基于Log2表达水平,执行分层聚簇,以比较样品间的基因表达概况。关于聚类的探针组通过表达水平中的总体差异(><2.5倍)或限定基态或亚稳态的靶向基因列表的存在加以选择。对于X染色体基因表达比较,通过获得2^[RMA log2强度],将RMA标准化的Affymetrix基因芯片强度转换为线性表达值。线性表达比作为幼稚表达集合除以引发的表达集合进行计算。关于对X染色体作图的所有探针组的表达比在Spotfire 4.5中显现,其中大于或小于2倍富集比的探针组是突出显示的。
核型分析
通过WiCell Research Institute(Madison,WI)对二十至四十个G带中期细胞执行细胞遗传学分析。
畸胎瘤形成
以0.5和3百万个细胞/200μL溶液(100μL FMM和100μL Matrigel)浓度的单细胞解离的hiPSC皮下注射到NOD/SCID/γ裸鼠内。在5-6周(3百万个细胞注射)和7-8周(0.5百万个细胞注射)后,畸胎瘤在PBS中收获,在室温下在4%多聚甲醛中固定过夜,并且其后在室温下在70%乙醇中维持用于处理。将样品提交给UCSD Histology Core Facility用于切片以及苏木精与伊红染色。使用配备Nikon DS-Fi1照相机的Nikon Eclipse TS100显微镜,将切片检查,解释且拍照。
统计分析
斯氏t检验用于关于标准差的统计评估。StepOne Software v2.2(Life Technologies)用于测定关于qRTPCR数据的RQ最小值和最大值(误差条)。
一般而言,在下述权利要求中,所使用的术语不应解释为使权利要求限制于说明书和权利要求中公开的具体实施例,而是应解释为包括所有可能实施例连同此类权利要求赋予权力的等价物的完全范围。相应地,权利要求不受公开内容限制。
- 还没有人留言评论。精彩留言会获得点赞!