用于产生5‑羟基色氨酸的微生物途径的制作方法
背景
抑郁症是一种常见的精神障碍,威胁世界上数百万的人。中枢神经系统(CNS)中神经递质血清素不足被认为是抑郁症的重要生理因素。5-羟基色氨酸(5-HTP)在人类和动物体内是血清素的直接生物合成前体。已经示出它在治疗抑郁症中是临床有效的,伴随相对少的副作用。在大多数欧洲国家,5-HTP是用于多种治疗目的的常用的处方药;然而在北美市场中,将它作为“非处方”的膳食补充剂销售。
除了抑郁症,5-HTP已经示出在治疗失眠、纤维肌痛、肥胖症、小脑共济失调、慢性头痛等中是有效的。(博德塞奥(Birdsall),替代医学评论(Altern.Med.Rev.)1998:3(4):271-280),正如在过去二十年进行的研究所证实的,5-HTP可以在例如以下障碍的治疗中具有积极作用:纤维肌痛(卡鲁索(Caruso)等人,国际医疗研究杂志(J Int Med Res.)1990;18:201-209;普特尼(Puttini)等人,国际医疗研究杂志(J Int Med Res.)1992;20:182-189)、失眠(艾特(Attele)等人,替代医学评论(Altern.Med.Rev.)2000;5(3):249-259)、偏头痛以及头痛(里贝罗(Ribeiro),2000年6月;40(6):451-6)、进食障碍例如多食症(坎贾诺(Cangiano)等人,肥胖相关的代谢紊乱国际杂志(Int J Obes Relat Metab Disord.)1998;22:648-654;莎茜(Ceci)等人,神经传递杂志(J Neural Transm.)1989;76:109-117)(作为管理肥胖症和糖尿病的辅助手段)、以及热潮(柯西奥(Curcio)等人,替代医学评论(Altern.Med.Rev.)2005;10(3):216-21;弗里德曼(Freedman),欧洲更年期杂志(Maturitas.)2010年4月;65(4):383-5)。
5-HTP还被认为是一种潜在的农场动物的饲料添加剂,是抵抗牛的乳腺炎(杰瑞(Jury)等人,公共科学图书馆综合(PLoS One.)2015年2月17;10(2):e0117339;派(Pai)等人,国际生物医学研究(Biomed Res Int.)2015;2015:364746;豪斯曼(Horseman)等人,动物生物科学年度评论(Annu Rev Anim Biosci.)2014年2月2:353-74),以及在哺乳动物的泌乳功能调节(马歇尔(Marshall)等人,乳腺肿瘤生物学(J Mammary Gland Biol Neoplasia.)2014年3月;19(1):139-46;科利尔(Collier)等人,家畜内分泌学(Domest Anim Endocrinol.)2012年8月;43(2):161-70;赫尔南德斯(Hernandez)等人,内分泌学杂志(J Endocrinol.)2009年10月;203(1):123-31)中的一种预防性或者治疗性药剂,这样5-HTP具有大的潜力以增加所述动物的乳产量。在某些禽类中(例如:鸡),5-HTP显现与昼夜周期调节(托马斯(Thomas)等人,细胞与分子神经生物学(Cell.Mol.Neurobiol.)1991,11(5):511-527)以及其他的积极健康效应(莫内瓦(Moneva)等人,保加利亚农业科学杂志(Bulgarian J.Ag Sci.)2008 14(4):424-431)相关联,在动物生长和生产能力中有积极影响。
目前,5-HTP通过从加纳籽的种子中提取而产生,它是生长在非洲的木本的攀缘灌木。该原材料的供应依赖于季节和地区,已限制其有成本效益的生产和广泛的临床应用。此外,来自加纳籽的5-HTP被一种称为顶峰X的化合物污染,导致USDA暂时地令该补充剂在美国下架。
目前,5-HTP的大宗批发价格在400到1000美元/kg之间变动。尽管当前的生产成本高而且供应有限,5-HTP的全球市场仍然约120,000kg(整批价值50-100百万美元),每年的增长率为大约7%。5-HTP终产物甚至更贵,并且终产物的零售市场价值更高。
在2012年,北美代表约48%的市场,随后是欧洲和亚太地区,主要的市场细分是人类营养补充物。正在出现的市场细分(例如:动物营养,人类治疗辅佐剂)可能以比预测的非处方人类营养补充物快得多的速度增长。
发明概述
本发明提供了可用于微生物生产5-羟基色氨酸(5-HTP)(血清素(5-羟色胺)的前体)的化合物、组合物以及方法。将宿主菌进行代谢工程改造以表达非天然存在的酶,该酶催化色氨酸经由色氨酸的5-羟基化作用向5-HTP的转化。优选的宿主细胞是过度产生起始原料色氨酸的细胞。任选地,将该宿主细胞进一步工程化以包括辅因子再生机制,允许在不补充外源辅因子的情况下连续产生5-HTP。本发明可以导致5-HTP的改进的滴度并且允许低成本、大规模的生产,而不限于补充前体或辅酶。
在一个方面,该发明包括基因工程化的微生物细胞,例如细菌或酵母细胞,该基因工程化的微生物细胞包括细菌的苯丙氨酸-4-羟化酶(P4H),已将此酶进行修饰以示出与相应的野生型P4H相比对色氨酸增加的亲和性。该修饰的细菌酶可以基于或衍生自例如来自假单胞菌属(Pseudomonas)、色杆菌属(Chromobacterium)、罗尔斯通氏菌属(Ralstonia)或黄单胞菌(Xanthomonas)的P4H。在一个实施例中,修饰的细菌P4H包括野油菜黄单胞菌P4H的氨基酸位置98、179以及231中的任何一个、任何两个或全部三个处的氨基酸突变,或者在来自另一个物种(优选是细菌物种)的细菌P4H酶中的任何一个、任何两个或全部三个相应氨基酸位置处的氨基酸突变(参见例如图5F)。氨基酸突变的例子包括选自下组的任何一个、任何两个或全部三个突变,该组由以下各项组成:L98Y、W179F和Y231C(根据野油菜黄单胞菌P4H氨基酸序列编号)。示例的修饰的苯丙氨酸-4-羟化酶(P4H)是至少并入突变W179F的野油菜黄单胞菌的苯丙氨酸-4-羟化酶。任选的,修饰的细菌P4H进一步包括至少一个另外的突变,该另外的突变是相应于野油菜黄单胞菌P4H的氨基酸位置85、223和282的任何一个、任何两个或全部三个的位置处,或者在来自另一个物种(优选细菌物种)的细菌P4H酶中的任何一个、任何两个或全部三个相应氨基酸位置处。
任选的,该基因工程化的细菌或酵母细胞是已经被基因工程化以过度产生或积累色氨酸的细胞。
任选的,该基因工程化的细菌或酵母细胞包括辅因子再循环系统,该辅因子再循环系统包括喋呤-4α-甲醇胺脱水酶(PCD)和二氢单喋呤还原酶(dihydromonapterin reductase enzyme,DHMR)中的至少一个。优选地,该细胞包括喋呤-4α-甲醇胺脱水酶(PCD)和二氢单喋呤还原酶(DHMR)二者。在一个实施例中,二氢单喋呤还原酶(DHMR)是由大肠杆菌基因folM编码。
基因工程化的细菌或酵母细胞可以包括编码修饰的P4H、PCD和/或DHMR酶中任一个或全部的一个或多个质粒。这些酶可以由分开的质粒编码,或两种或更多种酶可以由同一质粒编码。在一些实施例中,基因工程化的细菌或酵母细胞包括第一质粒,该第一质粒包括可操作地编码修饰的细菌P4H、以及喋呤-4α-甲醇胺脱水酶(PCD)和二氢单喋呤还原酶(DHMR)中的一个或两个的多核苷酸。该第一质粒可以是低、中或高拷贝数质粒,并且优选地是中拷贝数质粒。任选地,该基因工程化细胞包含一第二质粒,该第二质粒包括可操作地编码trp操纵子的全部或部分的多核苷酸,以便导致底物色氨酸的过度产生和/或积累。该第二质粒可以是低、中或高拷贝数质粒,并且优选地是低拷贝数质粒。在一个实施例中,该trp操纵子或其部分可以包括在TrpE基因中的突变S40F。
在一些实施例中,该基因工程化的细菌细胞不包括四氢生物喋呤(BH4)辅因子。在其他实施例中,该基因工程化的细菌细胞包括内源的四氢生物喋呤(BH4)。另外地或可替代地,该基因工程化的细菌细胞可以包括内源的四氢单喋呤(MH4)辅因子。
示例性基因工程化的细菌细胞包括基因工程化的大肠杆菌细胞、基因工程化的枯草芽孢杆菌细胞、或基因工程化的谷氨酸棒状杆菌细胞。
制造和使用这些基因工程化细胞的方法也被包含在本发明中。
在另一方面,本发明包括制造5-羟基色氨酸(5-HTP)的方法。该方法涉及在一定条件下以及持续足以产生5-HTP的时间来培养本发明的基因工程化的微生物细胞(优选基因工程化的细菌细胞)。任选地,可以将5-HTP进行分离和/或纯化。该方法可以进一步包含将5-HTP并入食物产品中。该食物产品可以适合人类食用和/或可以是动物饲料或饮料。该方法可以包含包装5-HTP或供出售的食物产品并且可任选地向作为食品添加剂、食品补充剂或营养食品的5-HTP或食物产品提供使用说明书。在一个实施例中,该食品添加剂、食品补充剂或营养食品被包装作为动物饲料或饮料使用。
词语“优选的”和“优选地”指可以在某些环境下提供某些益处的本发明实施例。然而,在相同或其他环境下,其他实施例也可以是优选的。另外,对一个或多个优选实施例的描述不暗示其他实施例是无用的,并且不意图从本发明的范围中排除其他实施例。
术语“包括”及其变体,在这些术语在本说明书和权利要求书中出现的情况下,不具有限制性含义。
除非另外说明,“一个(a)”、“一种(an)”、“该(the)”、和“至少一个(at least one)”可互换地使用并且意指一个或多于一个。
并且在此,通过端点详述的数值范围包括该范围内所归纳的所有数值(例如1至5包括1、1.5、2、2.75、3、3.80、4、5等)。
对于本文中披露的、包括分离步骤的任何方法,这些步骤可以按任何可行顺序实施。并且,如果适宜,两个或更多个步骤的任何组合可以同时实施。
本发明的以上概述不意在描述本发明的每个所披露的实施例或每一个实施方式。以下本说明书更加具体地示例了示意性实施例。贯穿本申请,在几个地方中,通过一系列实例提供指导,这些实例能以多种组合形式使用。在每种情况下,所述系列仅作为代表性群组发挥作用并且不应当解释为排他性系列。
附图简要说明
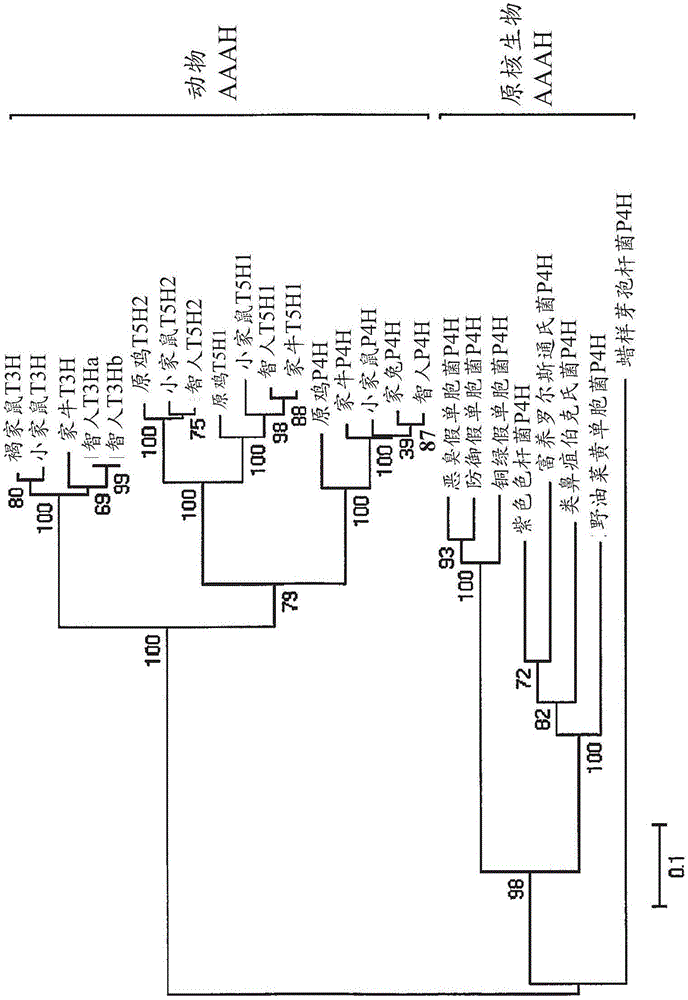
图1示出原核的苯丙氨酸-4-羟化酶(P4H)和动物的芳香族氨基酸羟化酶(AAAH)的系统进化关系;使用ClustalX 2.1进行蛋白序列比对;使用邻接法用MEGA 5.02构建进化树;拔靴法(bootstrapping method)用于系统进化测试(1000次重复);与分支相关联的数字指代代表每个氨基酸残基取代频率的自展值。
图2示出(A)原核的P4H活性在大肠杆菌中的重建;其中黑色和灰色的箭头分别指示大肠杆菌天然途径和异源反应;加粗箭头指代过表达步骤;灰色框指示被引入的MH4再循环系统,并且缩写如下:GTP,鸟嘌呤核苷-5'-三磷酸;PCD,喋呤-4α-甲醇胺脱水酶;DMHR,二氢单喋呤还原酶;P4H,苯丙氨酸-4-羟化酶;以及(B)修饰的细菌的P4H活性引入(A)的大肠杆菌中,进一步允许5-羟基色氨酸(5-HTP)从例如糖类的简单碳源的从头生产。
图3示出XcP4H通过蛋白工程的修饰;(A),在XcP4H(L98、W179和Y231)、来自人类的P4H(HumP4H;PDB条目1MMK)以及来自人类的T5H1(HumT5H;PDB条目3HF6)结构中3个关键残基的位置的比较性说明;(B),野生XcP4H和其突变体的体内活性,其中灰色和黑色条分别指示对色氨酸和苯丙氨酸的活性;(C),色氨酸向5-HTP的全细胞生物转化,其中实线和虚线分别指示5-HTP生产和细胞密度的时间历程,并且黑色和灰色的线分别指示在30℃和37℃下的特征,并且其中所有的数据均报告为三次独立实验的平均值±s.d.并且误差棒定义为s.d.。
图4示出5-HTP从葡萄糖的从头生产;(A),完整的5-HTP生物合成途径的示意图,其中黑色和灰色箭头分别指示大肠杆菌天然途径和异源反应;(B)在30℃和37℃下色氨酸从葡萄糖的生产,其中数据报告为两次独立实验的平均值±s.d.;(C),两种宿主菌株BWΔtnaA(灰色)和QH4ΔtnaA(黑色)的细胞生长和5-HTP从葡萄糖生产的曲线,其中所有的数据均报告为三次独立实验的平均值±s.d.并且误差棒定义为s.d.。
图5示出(A),来自铜绿假单胞菌的P4H的氨基酸序列(SEQ IDNO:2)(B),来自荧光假单胞菌的P4H的氨基酸序列(SEQ ID NO:3);(C)来自恶臭假单胞菌的P4H的氨基酸序列(SEQ ID NO:4);(D),来自富养罗尔斯通氏菌的P4H的氨基酸序列(SEQ ID NO:5);(E),来自野油菜黄单胞菌的P4H的氨基酸序列(SEQ ID NO:1),其中从(A)到(E),*指代蛋白序列的结束;(F)来自铜绿假单胞菌(SEQ ID NO:2)、荧光假单胞菌(SEQ ID NO:3)、恶臭假单胞菌(SEQ ID NO:4)、富养罗尔斯通氏菌(SEQ ID NO:5)和野油菜黄单胞菌(SEQ ID NO:1)的P4H酶的氨基酸序列比对,其中括号[]指示从序列的图形描述中省略的氨基酸的数量以有利于比对,包括在序列结尾的终止标志符*,并且其中候选突变位点在L98、W179和Y231处指示出(框中的残基),根据野油菜黄单胞菌的P4H序列编号;(G)动物AAAH智人T5H2(SEQ ID NO:6),小家鼠T5H2(SEQ ID NO:7),原鸡T5H2(SEQ ID NO:8),家牛T5H1(SEQ ID NO:9),智人T5H1(SEQ ID NO:10),小家鼠T5H1(SEQ ID NO:11);原鸡T5H1(SEQ ID NO:12),智人P4H(SEQ ID NO:13),家兔P4H(SEQ ID NO:14),小家鼠P4H(SEQ ID NO:15),家牛P4H(SEQ ID NO:16),原鸡P4H(SEQ ID NO:17);以及XcP4H(SEQ ID NO:1)的氨基酸序列比对;被圈住的箭头指示如在(F)中的在L98、W179和Y231处的候选突变位点;未被圈住的箭头指示在相应于野油菜黄单胞菌Q85、L223、以及L282的氨基酸位置处的另外的候选突变位点。
说明性实施方案的详细说明
本发明提供了可用于微生物生产5-羟基色氨酸(5-HTP)的化合物、组合物以及方法。本发明涉及代谢工程改造微生物宿主细胞以表达非天然存在的羟化酶,该羟化酶优选是微生物来源的,其催化色氨酸经由色氨酸的5-羟基化作用向5-HTP转化。当基因工程针对代谢途径的扰动或改变从而引起细胞的新陈代谢的改变时,基因工程化的细胞在此称为“代谢工程化的”细胞。
优选的微生物宿主细胞是过度生产起始材料色氨酸的细胞。任选地,将该微生物宿主细胞进一步工程化以包括辅因子再生机制,这样允许在不补充外源辅因子的情况下连续产生5-HTP。
催化色氨酸经由色氨酸的5-羟基化作用向5-HTP的转化的微生物酶(称为色氨酸羟化酶,“TPH”或“T5H”酶)尚未已知。一些动物具有能够催化这个反应的色氨酸羟化酶(使用喋呤辅因子,典型地四氢生物喋呤,还称为“B4H”);然而由于例如低溶解度、低稳定性、以及翻译后修饰机制的无效或缺乏等因素,已证明在微生物系统中真核5-羟化酶的表达是有问题的。一些微生物具有催化苯丙氨酸向酪氨酸转化的4-羟化酶(“P4H”酶),但是该酶对底物色氨酸具有很少或没有5-羟化酶活性。
本发明的这种独特的生物技术生产过程结合蛋白质工程和代谢工程以实现5-HTP的微生物生产。利用例如定点突变的蛋白质工程以产生一种有效的、非天然存在的有效地催化色氨酸向5-HTP转化的羟化酶,使用一种天然存在的微生物酶如苯丙氨酸-4-羟化酶(P4H)的定点突变。将突变的天然存在的微生物酶在此称为“修饰的”酶,例如修饰的细菌苯丙氨酸-4-羟化酶(P4H)。“衍生自”特定生物的修饰的酶意指一种已经通过突变由该生物所产生的野生型酶的氨基酸序列,例如通过在特定氨基酸位置处的一个或多个位点突变而创造的修饰的酶。该工程化或“修饰的”微生物来源酶比它的真核生物中相对应的酶更适于在微生物宿主细胞中使用。使用代谢工程以改变涉及细胞内色氨酸生产或积累的一种或多种代谢途径,和/或以将异源辅因子再生系统并入宿主细胞中。能通过异源辅因子再生系统再循环的细菌辅因子包括四氢喋呤,如四氢单喋呤(MH4)和四氢生物喋呤(BH4)。例如四氢单喋呤(MH4)辅因子再生系统并入大肠杆菌细胞中允许内源的大肠杆菌MH4用作有效的氢供体。
本发明提供了有成本效益的用于从廉价碳源例如色氨酸和葡萄糖有效生产5-HTP的微生物方法。预期该技术可以促进生物催化平台的构建以将廉价的原料转化为高纯度的产物5-HTP,这与常规的提取方法相比将显著降低其生产成本,极大地改善其对于未经良好治疗病人的可用性,以及进一步扩大其市场。
宿主細胞
本发明使得在宿主细胞(优选如细菌或酵母细胞的微生物宿主细胞)中的5-HTP的生产成为可能。典型的细菌宿主细胞包括大肠杆菌、芽孢杆菌属(如枯草芽孢杆菌)、乳杆菌属(如嗜酸乳杆菌)、双歧杆菌属以及棒状杆菌属(如谷氨酸棒状杆菌)。示例性的酵母细胞包括来自酵母菌属(例如,酿酒酵母)和毕赤酵母属的酵母菌。酵母细胞可以包含内源辅因子,BH4;在某些实施例中,除在此描述的MH4辅因子再循环系统外或代替MH4辅因子再循环系统,将BH4辅因子再循环系统引入宿主酵母细胞中。
在优选的实施例中,本发明提供了将细菌P4H活性通过引入来自不同微生物(例如,并且不限于假单胞菌属、色杆菌属、罗尔斯通氏菌属或黄单胞菌属)的修饰的细菌P4H而向细菌细胞例如大肠杆菌或枯草芽孢杆菌(尚未示出包含天然的P4H酶)的引入,其中修饰的酶有利地或出人意料地能够利用大肠杆菌内源辅因子MH4(典型地,该喋呤辅因子BH4与AAAH酶是相关联的)。在另一个优选的实施例中,将大肠杆菌细胞进一步工程化以包含如在此描述的用以再循环MH4的再循环系统。
任选地,将宿主细胞基因工程化以增加细胞内的色氨酸的含量,即过度产生和/或积累用于5-HTP生物合成的起始材料色氨酸。5-HTP的过度产生或积累可以通过各种方法实现。在一个实施例中,色氨酸的过度产生或积累可以通过敲除参与色氨酸降解的一种或多种酶实现。例如,细胞中色氨酸的量可以通过敲除色氨酸酶(tnaA)的基因增加,已报道该色氨酸酶是一种催化色氨酸和5-HTP降解的蛋白。可替代地或另外地,可以将pheA、pheLA、和/或tyrA下调或敲除以增加细胞内色氨酸的含量。
在另一个实施例中,通过增加色氨酸的生物合成可以实现色氨酸的过度产生或积累。例如,可以将宿主细胞工程化以过表达trp操纵子或其部分。当基因产物在代谢工程化的细胞中表达水平高于其在可比的野生型细胞中的表达水平时,基因产物例如酶或调节蛋白在代谢工程化的细胞中“过表达”。在并非内源性地表达具体基因产物的细胞中,该基因产物在细胞中的任何表达水平被视为该基因产物为了本发明的目的的“过表达”。典型地,作为从trp操纵子过表达一种或多种基因产物的手段,将trp操纵子的另外拷贝以质粒、粘粒或其他DNA或RNA载体引入细胞中。在一个实施例中,将宿主细胞工程化以过表达完整的trp操纵子,包括trpEDCBA。在另一个实施例中,将宿主细胞工程化以过表达trp操纵子的仅部分,例如trp ED或trpE。
任选地,将trp操纵子工程化以减少或消除反馈抑制。例如,在氨基酸位置S40处的突变(例如,突变S40F)可以并入TrpE中以减少或消除反馈抑制。
在另一个实施例中,通过改变宿主细胞的内源性色氨酸表达可以实现色氨酸的过度产生或积累。例如,色氨酸的过度产生或积累可以通过改变色氨酸转录阻遏蛋白(TrpR)的表达、使该色氨酸转录阻遏蛋白下调或失活来实现。
在另一个实施例中,通过过度产生色氨酸生物合成前体例如分支酸可以实现色氨酸的过度产生或积累。可以将宿主细胞工程化以表达或过表达增加分支酸利用度的一种或多种酶。在分支酸的生产中已知并能操纵几个限速步骤以产生生产更多分支酸的微生物。增加碳流向分支酸的酶包括例如莽草酸激酶、磷酸烯醇式丙酮酸合酶、转羟乙醛酶、以及3-脱氧-D-阿拉伯糖基-庚酮糖酸-7-磷酸合酶,优选地是反馈-抑制抗性的3-脱氧-D-阿拉伯糖基-庚酮糖酸-7-磷酸合酶、3-脱氢奎尼酸合酶、3-脱氢奎尼酸脱水酶、莽草酸脱氢酶、3-磷酸莽草酸1-羧基乙烯基转移酶、以及分支酸合酶。酶的例子包括但不限于AroL、AroF、AroH、AroG、PpsA、以及TktA。在一些实施例中,AroL、AroF、AroH、AroG酶中的一个或多个可以处于反馈-抑制抗性(fbr)的酶的形式。编码优选的酶的示例多核苷酸分别是aroL、ppsA、tktA、以及aroGfbr。在一个实施例中,大肠杆菌宿主细胞可以表达aroL、ppsA、tktA、以及aroGfbr以增加分支酸利用度。示例的酶还描述于林(Lin)等人,代谢工程(Metab Eng.)2014,23:62-9;林(Lin)等人,自然通讯(Nat.Commun.)2013,4:2603;以及2014年12月18日出版的美国专利申请公开号2014/0370557中;将这些文献各自通过引用结合在此。
在另一个实施例中,色氨酸的过度产生或积累可以通过色氨酸转录阻遏蛋白(TrpR)的失活来实现。在再另一个实施例中,色氨酸的过度产生或积累可以通过转录阻遏蛋白TrpR的失活来实现。
可以使用任何已知的用于色氨酸过度生产或积累的方法,包括例如在美国专利号5,756,345和中国专利CN 102453691B中描述的方法;还参见赵(Zhao)等人,工业微生物学和生物技术杂志(J.Ind.Microbiol.Biotechnol.),2011,39:1921-1929。
任选地,可以组合一种或多种过度产生或积累技术。例如,可以敲除色氨酸降解途径,而宿主细胞可以过表达整个trp操纵子。作为另一个例子,宿主细胞可以过表达完整的trp操纵子以及用以增加色氨酸前体分支酸的产生的一种或多种酶。当将宿主细胞工程化以表达或过表达多种酶时,可以使用如一个质粒的单一外源构建体或者可以使用如多个质粒的多个外源构建体,如在此更详细地描述的。可替代地或另外地,基因工程可以通过使用染色体添加、缺失或突变来完成。
工程化的羟化酶
在本发明中,有利地使用修饰的细菌羟化酶而不是真核生物羟化酶(参见例如WO 2013127914A1)以催化色氨酸向5-HTP的转化。在细菌宿主细胞中修饰的细菌羟化酶的使用允许可以包含MH4和/或BH4的内源细菌辅因子的使用,并且可以避免与使用真核生物酶相关联的限制,包括低溶解度、低稳定性以及翻译后修饰机制和/或辅因子的失效或缺乏(参见,例如麦金尼(McKinney)等人,(2004),蛋白表达和纯化(Protein Expr.Purif.)33(2):185-194;马丁内斯(Martinez)等人,(2001)现代医药化学(Curr.Med.Chem.)8(9):1077-1091)。相比于已经截短以改进溶解度的动物5-羟化酶(参见例如WO 2013/127914A1),本发明的修饰的细菌4-羟化酶证实了增加的催化效率。
天然存在的细菌苯丙氨酸-4-羟化酶(P4H)具有对色氨酸的很少的活性。本发明涉及细菌羟化酶在宿主细胞内的表达,优选4-羟化酶,更优选已经经修饰以增加对底物色氨酸的5-羟化酶活性的苯丙氨酸4-羟化酶。优选地,通过定点突变实现修饰。不是所有的细菌都包含P4H酶,但是可以根据本发明将任何细菌P4H酶进行修饰以提高它对色氨酸的活性。可以根据该发明进行修饰以提高其对色氨酸活性的适合的细菌P4H酶包括而不限于来自假单胞菌属、色杆菌属、罗尔斯通氏菌属、伯克氏菌属、黄单胞菌属、芽孢杆菌属、寡养单胞菌属、胞菌属(Arenimonas)、溶杆菌属、戴氏菌属(Dyella)、罗思河小杆菌属(Rhodanobacter)、贪铜菌属、鞘脂菌属、极单胞菌属、云母弧菌属(Micavibrio)、柄细菌属等的P4H酶。典型的物种包括紫色色杆菌、恶臭假单胞菌、防御假单胞菌、铜绿假单胞菌、富养罗尔斯通氏菌、类鼻疽伯克氏菌、野油菜黄单胞菌以及蜡样芽孢杆菌。优选的细菌P4H酶包括来自铜绿假单胞菌(PaP4H)、恶臭假单胞菌(PpP4H)、荧光假单胞菌(PfP4H)、富养罗尔斯通氏菌(ReP4H)、以及野油菜黄单胞菌(XcP4H)的那些。优选的细菌P4H酶是XcP4H。细菌P4H可以由基因phhA编码。
细菌P4H酶在一个或多个残基处突变以产生对色氨酸有更大活性的修饰的P4H酶。例如,XcP4H可以在残基W179、L98、Y231、Q85、L223、和/或L282处突变。在一个实施例中,XcP4H在残基W179、L98、以及Y231处突变。在其他实施例中,XcP4H只在单一残基处,例如只在残基W179处、只在残基L98处或只在残基Y231处突变。在其他实施例中,XcP4H在两个或更多个残基处,例如在残基W179和L98处;或在W179和Y231处;或在L98和Y231处突变。在优选的实施例中,W179被氨基酸苯丙氨酸(F)替代。在另一个实施例中,L98被酪氨酸(Y)替代。在再另一个实施例中,Y231被半胱氨酸(C)替代。在一个实施例中,XcP4H包括在下列残基处的每一个处的突变:W179F、L98Y、和Y231C。在其他实施例中,XcP4H包括下列突变:W179F和L98Y;或W179F和Y231C;或L98Y和Y231C。还可以将在细菌P4H酶PaP4H、PpP4H、PfP4H、和ReP4H(参见例如图5F)或任何其他的微生物或动物P4H酶(参见例如图5G)中的一个或多个相应残基在一个或多个相应氨基酸位置处突变以产生对色氨酸有增强的偏好性的修饰的P4H酶。优选地,将细菌P4H酶(由在图5F中的序列举例说明)修饰以生成修饰的P4H酶。然而,还可以使用动物的酶。图5G示出和来自野油菜黄单胞菌的细菌P4H比对的示例性动物P4H和T5H氨基酸序列;相应于XcP4H位置W179、L98Y、和Y231C的氨基酸位置用被圈住的箭头指示,并且相应于XcP4H位置Q85、L223、和L282的氨基酸位置用未被圈住的箭头指示。这些位置中的任意一个、一些或全部是用于突变以产生本发明的修饰的P4H酶的候选点。
辅因子再循环
任选地,本发明进一步为修饰的P4H酶提供了辅因子的增加的生产和/或再循环。该辅因子可以是喋呤,例如四氢生物喋呤(BH4)或四氢单喋呤(MH4)。优选地,修饰的P4H酶使用的辅因子对于宿主细胞是内源的。在优选的实施例中,辅因子是细菌MH4,例如大肠杆菌MH4。
有利地,可以将辅因子再生机制引入宿主细胞中以促进内源喋呤辅因子(例如MH4或BH4)的再循环并且由此促进增加的5-HTP的过度产生或积累。为此,优选地将宿主细胞工程化以表达喋呤4α-甲醇胺脱水酶(PCD)、二氢单喋呤还原酶(DHMR)或两者,以便允许被P4H酶使用的MH4或BH4喋呤辅因子的再循环。该PCD和/或DHMR酶对于宿主细胞可以是天然的(在这种情况中将细胞工程化以过表达该酶)或者它们对于宿主细胞可以是异源的(外来的)。在某些实施例中,这些酶中的一个是天然的,另一个是外源的。这些酶优选地是细菌的酶,但可以是真核生物的酶。优选的PCD是来自铜绿假单胞菌,但是适合的PCD可以从任何便利的原核生物或真核生物中获得,优选地是从具有内源P4H酶的细菌或酵母中获得。优选的DHMR是来自大肠杆菌,但是适合的DHMR可以从任何原核生物或真核生物中获得。
质粒
修饰的细菌P4H酶、任选的涉及再循环其辅因子的酶、以及任选的trp操纵子或trp操纵子的部分以及任何其他感兴趣的酶可以通过引入一个或多个包含可操作地编码该一种或多种酶的多核苷酸的质粒来在宿主细胞内表达或过表达。适合的示例性质粒描述于实例1中,并且包含但不限于pZE12-luc、pCS27、和pSA74。本领域普通技术人员将理解也可以使用具有不同启动子、抗生素抗性、以及复制起点(ori)的另外的质粒。
此外,应该指出,如果希望的话,使用熟知的基因工程技术和方案,可操作地编码在此描述的酶的任何或所有核苷酸序列可以代之以基因水平上整合到细菌的基因组。
质粒可以是高拷贝数、中拷贝数或低拷贝数的质粒。尽管与本领域公认的命名“高”、“中”、以及“低”拷贝数有关的边界是不同并且在实践中可能重叠,一般而言,高拷贝数的质粒的特征是一个细胞内的拷贝数,例如,大于50或60拷贝,中拷贝数的质粒的特征是一个细胞内的拷贝数,例如,10和60之间的拷贝(例如,15-20拷贝),而低拷贝数的质粒的特征是一个细胞内的拷贝数,例如,小于10或15拷贝(例如,3-8拷贝)。质粒pZE12-luc、pCS27、pSA74分别举例说明了高、中和低拷贝数质粒。在一些实施例中,pZE12-luc具有大约60-70的拷贝数,pCS27具有大约15-20的拷贝数,并且pSA74具有大约5-10的拷贝数。
P4H,优选修饰的P4H的表达可以通过将质粒引入宿主细胞内来实现,该质粒包括编码修饰的P4H的phhA,优选地phhA已经突变以编码对底物色氨酸有更大活性的修饰的P4H,如在此所述。编码修饰的P4H的phhA可以从任何合适的生物中获得,例如像而不限于如在此描述的铜绿假单胞菌(图5A,SEQ ID NO:2)、荧光假单胞菌(图5B,SEQ ID NO:3)、恶臭假单胞菌(图5C,SEQ ID NO:4)、富养罗尔斯通氏菌(图5D,SEQ ID NO:5)以及野油菜黄单胞菌(图5E,SEQ ID NO:1)。
涉及辅因子再循环的一种或多种酶如PCD和/或DHMR的表达可以通过在宿主细胞中引入包含例如phhB(编码来自例如铜绿假单胞菌的PCD)和/或folM(编码来自例如大肠杆菌的DHMR)的质粒来实现。编码PCD和DHMR的多核苷酸序列可以从任何合适的生物中获得,例如它们可以从内源性地表达P4H的微生物中获得。
在一个实施例中,将phhA(被突变以编码对色氨酸有更大活性的修饰的P4H)、phhB和folM克隆到两个或更多个分开的质粒中。在优选的实施例中,将phhA(如描述被突变)、phhB和folM克隆到同一个质粒中。优选地,将基因克隆在中拷贝数质粒例如PCS27中,但可以使用高拷贝数质粒和低拷贝数质粒。
借助于质粒,还可以将trp操纵子或trp操纵子的部分表达或过表达于宿主细胞中。trp操纵子可以包含突变,包括但不限于在TrpE中的突变S40F。在一个示例性实施例中,将包含突变S40F的trp操纵子克隆到低拷贝数质粒如pSA74中,以制得pSA-TrpEDCBA,但可以使用中拷贝数质粒和高拷贝数质粒。
制造5-HTP的方法
如在此描述的表达修饰的细菌P4H和其他特征例如辅因子再循环系统和/或色氨酸过度产生或积累的微生物宿主细胞可以有利地在包含简单碳源如葡萄糖或甘油的培养基中生长。其他适合的碳源包括木糖、阿拉伯糖以及其他可再生糖类,如在植物或木质纤维素水解液中的糖类。任选地,该培养基补充有色氨酸。为了优化细胞生长以及生产效率,可以将宿主细胞在包括但是不限于以下的温度下孵育:21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃、41℃、42℃、43℃、44℃、45℃、46℃。在一个实施例中,将宿主细胞在30℃下孵育。在可替代的实施例中,将宿主细胞在37℃下孵育。优选地将葡萄糖用作碳源以用于细胞生长和维持(例如0.1-100g/L);任选地,可以添加柠檬酸盐以促进细胞生长和增加滴度(例如0.1-100g/L);任选地,可以添加例如胰蛋白胨的其他生长补充剂。
任选的,将5-HTP从宿主细胞中分离。可以对所分离的5-HTP进行纯化。纯化的5-HTP可以被用作起始材料用于其他化学或酶促反应以生产其他感兴趣的生化制品,例如褪黑素。
任选地,分离的5-HTP作为食品添加剂、食品补充剂或营养食品被并入到食物产品中。例如,分离的5-HTP可以被并入到动物饲料中,例如家畜或农畜的饲料。补充5-HTP对于钙代谢可以具有有益作用,并且尤其适合用于怀孕与泌乳农畜,例如奶牛。因此,该制造5-HTP的方法任选地包括包装和/或推广5-HTP作为动物食品补充剂、添加剂或营养食品,以及将5-HTP并入到食物产品(例如,动物饲料或饮料)中。
有利地,在已经如在此描述的被工程化以包含辅因子再循环系统的宿主细胞中,不需要添加昂贵的喋呤辅酶或前体;细胞可以利用简单的可再生的碳源。因此该方法在5-HTP的大规模生产中有巨大潜力。
本发明通过以下实例来阐明。应该理解地是,具体实例、材料、量和程序应根据如本文所阐述的本发明的范围和精神来宽泛地解释。
实例
实例1.对细菌苯丙氨酸4-羟化酶进行工程化以用于人类神经递质前体5-羟基色氨酸的微生物合成
5-羟基色氨酸(5-HTP)是对抗抑郁症、失眠、肥胖症、小脑共济失调、慢性头痛等的临床有效药物。由于缺少合成方法,它只能通过从加纳籽中提取而进行商业生产。在此,我们报道了通过组合的蛋白质和代谢工程方法对5-HTP的有效微生物生产。代替使用比较不易驾驭的动物色氨酸5-羟化酶,我们尝试修饰一种细菌苯丙氨酸4-羟化酶(P4H)以改变它的底物特异性。首先我们在大肠杆菌中重构和筛选了原核生物的苯丙氨酸4-羟化酶(P4H)活性。然后,我们使用基于序列和结构的蛋白质工程以显著的改变其底物偏好性,允许色氨酸向5-HTP的有效转化。重要地,当引入外来的MH4再循环机制后,能够将大肠杆菌内源的四氢单喋呤(MH4)用做辅酶。全细胞生物转化可以在摇瓶中实现从色氨酸高水平生产5-HTP(1.1-1.2g l-1)。进一步进行代谢工程努力以实现从葡萄糖从头合成5-HTP。参见林(Lin)等人,ACS合成生物学(ACS Synth.Biol.),2014,3(7),第497-505页。该过程不需要昂贵的喋呤辅酶或前体的补充,并且能够利用可再生的碳源。该工作不仅具有大规模生产的潜力,而且证实了扩展微生物天然代谢的一种策略。
引言
世界卫生组织(WHO)报道抑郁症是一种常见的精神障碍,它在全球内影响着超过3.5亿的人。每年它导致大约一百万的自杀。不幸的是,全世界超过50%的受害者(在一些地区超过90%)从未接受过医学治疗1。认为血清素(5-羟色胺)代谢的改变对于抑郁症是一种重要的生理因素2。在中枢神经系统(CNS)中的血清素能机制的机能失调牵涉抑郁症的病因学3。然而通过口服给药的血清素的供应对抑郁症没有临床效应,因为它不能穿过血脑屏障。不像常规的致力于使血清素损失最小化的抗抑郁药(例如选择性血清素再摄取抑制剂),5-羟基色氨酸(5-HTP)作为直接前体起作用以增加血清素供应。5-HTP口服给药可以容易地穿过血脑屏障,无需转运分子。然后通过内源的脱羧酶,它可以在CNS中有效地转化为血清素3。详细的临床试验已经证实了它在缓解抑郁症症状中的功效。同时,5-HTP的治疗性给药已经示出在治疗失眠、纤维肌痛、肥胖症、小脑共济失调以及慢性头痛中是有效的4。重要地,在治疗中,相对少的不良作用与它的使用相关联2。在大多数欧洲国家中,5-HTP是一种用于多种治疗目的的常用的处方药;而在北美,它被作为“非处方的”膳食补充剂销售。
由于在通过化学途径的色氨酸的区域选择性羟基化中的困难,5-HTP的商业生产只依赖于从加纳籽中分离,其是一种生长在非洲西部和中部的木本攀缘灌木3,4。该原材料的供应依赖于季节和地区,一直很大地限制其有成本效益的生产和广泛的临床应用。与基础遗传学、生物化学和生物信息学相结合的代谢工程和蛋白质工程的最新发展正在提供新的策略以使用微生物系统合成天然和非天然分子。基于对目标产物的天然生物合成机制的积累的知识,尤其是所涉及的酶的遗传和生物化学信息,可以将异源的酶促反应在遗传上较优的微生物宿主内重构、修饰并且优化以实现自然中缺乏的在药学上重要的化合物的有效生产5-11。
5-HTP在人类和动物中从L-色氨酸通过色氨酸5-羟化酶(T5H)被天然生产,并且然后在正常的生理条件下被转化为神经递质血清素4。T5H属于喋呤依赖性的芳香族氨基酸羟化酶(AAAH)类别,该类别还包括另外两个亚类:苯丙氨酸4-羟化酶(P4H)和酪氨酸3-羟化酶(T3H)。AAAH因其和例如苯丙酮尿症、帕金森病和神经精神障碍的人类疾病的密切关系而在动物中被广泛鉴定并进行了扩展研究12。这些酶由三个结构域组成,为N端调节结构域、中心催化结构域以及涉及到四聚体形成的C端结构域,并且这些酶通常使用四氢生物喋呤(BH4)作为辅酶(或者共底物)13。证实动物T5H不稳定并且很难在微生物宿主中功能性地表达14,15。一个最近的专利报道了来自家兔的截短的T5H1的使用,在大肠杆菌中从色氨酸产生了多达0.9mM(相当于198mg l-1)的5-HTP。为了供应喋呤辅酶,与再生系统偶联的动物BH4生物合成途径(包括总计五种酶)需要在大肠杆菌中共表达16。然而,该生产效率仍然不满足大规模生产。
在细菌如假单胞菌属和色杆菌属物种中还发现一些AAAH17,18。目前为止,将它们的全部鉴定为对色氨酸羟基化作用具有很低活性的P4H,但是报道当将突变引入来自紫色色杆菌的P4H中时这种活性在体外增强19。原核生物的P4H由相应于动物AAAH的催化结构域的仅一个结构域组成13。最近实验证据指示细菌P4H可以使用四氢单喋呤(MH4)代替BH4作为天然喋呤辅酶20,因为BH4并非天然存在于大多数细菌中。有趣的是,在大肠杆菌中MH4是喋呤的主要形式,虽然它的功能尚不清楚。在该工作中,我们报道了通过大肠杆菌内源MH4的使用和再循环而在大肠杆菌中重构了细菌P4H活性。组合的生物探究和蛋白质工程方法可以实现对色氨酸到5-HTP转化具有高度活性的P4H突变体的开发,这允许通过进一步的代谢工程努力来确立有效的5-HTP生产平台。该从头方法不需要补充昂贵的喋呤辅因子或前体,而是仅使用可再生的简单碳源,这使5-HTP在微生物中的大规模生产具有巨大潜力。
结果和讨论
芳香族氨基酸羟化酶(AAAH)的系统进化分析。和包括三个亚类的动物AAAH相比,将它们的原核生物对应物全部仅鉴定或注释为P4H。之前的生物化学和结构研究揭示出除了中心催化结构域外,动物AAAH通常由两个另外的结构域组成,为N端的调节结构域和C端涉及到四聚体形成的结构域;而原核生物的AAAH(例如来自紫色色杆菌的P4H)是只有一个单一结构域的单体,该单一结构域与动物AAAH的催化结构域具有中等序列相似度(大约30%)21。为了探索在AAAH之间的进化关系,随机选择25个来自原核生物和动物两者的氨基酸序列,并且基于邻接法使用MEGA 5.02构建系统进化树(图1)22。该进化树反映了在原核生物和动物的AAAH之间的显著的进化分离。动物AAAH的三个亚族(P4H、T5H、和T3H)也被明显地分离,其中P4H示出了与T5H(相比于T3H)更亲密的系统进化关系。这些结果符合之前对AAAH的系统进化研究23。
结合功能多样性的发展考虑系统进化证据,我们推断动物AAAH是从原核生物P4H通过复制和变异进化而来。因此,我们猜测甚至在长期的进化过程之后,原核生物和动物的P4H可以仍然共享一些保守的氨基酸残基,这些保守的氨基酸残基决定它们对于苯丙氨酸的底物偏好性。同时,动物P4H和T5H具有高度序列相似性,表明底物偏好性从苯丙氨酸到色氨酸的互换可以仅涉及少数残基的取代。基于这些假设,我们推测通过进行动物AAAH和原核生物P4H的序列的综合比对分析,我们可以从后一组中鉴定底物决定残基并且人工地将它们进化为T5H。
在大肠杆菌中对原核生物P4H的生物探究和重构。在探索底物决定残基之前,我们从不同的微生物(铜绿假单胞菌、恶臭假单胞菌、荧光假单胞菌、富养罗尔斯通氏菌和野油菜黄单胞菌)中挑选五种P4H以验证和比较它们的活性和底物特异性,因为大多数原核生物P4H仍然是推测的酶,而没有对它们功能的实验性证明。来自铜绿假单胞菌的P4H(PaP4H)之前在体外被鉴定并且它的晶体结构已经被解析24。一些遗传和生物化学证据表明PaP4H使用MH4代替BH4作为天然的喋呤辅酶20。因此,我们首先选择它作为原型来确立它在大肠杆菌中的体内活性,因为MH4是大肠杆菌产生的主要喋呤(图2)。为了实现PaP4H的表达,将它的基因phhA从铜绿假单胞菌的基因组DNA中扩增,并且在IPTG诱导的启动子PLlacO1的控制下克隆进高拷贝数质粒中。将所得的表达质粒pZE-PaphhA引入大肠杆菌菌株BW25113ΔtnaA(缩写为BWΔtnaA)中。因为报道了由tnaA编码的色氨酸酶催化色氨酸以及5-HTP的降解25,将该基因从本研究中所用的所有菌株中敲除。我们发现携带pZE-PaphhA的BWΔtnaA的细胞生长被显著抑制。它的OD600值在8小时培养后仅达到了0.8-1.0,显著低于OD600值为5.5-6.0的对照菌株(携带空载体的BWΔtnaA)OD600值。在之前的研究中观察到类似的作用26。当细胞用苯丙氨酸(500mg l-1)孵育时,几乎检测不到羟化产物(酪氨酸)。确实,铜绿假单胞菌具有负责二氢单喋呤(MH2)再生的喋呤4α-甲醇胺脱水酶(PCD,由phhB编码),该二氢单喋呤可以被进一步还原为MH4。但是大肠杆菌天然地并不具有这种机制。为了建立人工的MH4再循环系统(图2),将来自铜绿假单胞菌的phhB和来自大肠杆菌的folM(编码二氢单喋呤还原酶,DHMR)与phhA使用载体pZE-PaABM共表达。有趣的是,具有此质粒的大肠杆菌菌株大幅改进了细胞活力,该细胞活力是可以和对照菌株相比的。它的OD600值在8个小时的培养后达到了4.5-5.5。当收集这些细胞并用苯丙氨酸孵育时,以83.50μM/h/OD600的速率产生大量的酪氨酸,如在体内测定中所示的(表1)。这些结果指示MH4再循环系统的引入不仅恢复了细胞的生长而且可以实现大肠杆菌菌株将苯丙氨酸转化为酪氨酸。此外,该菌株能够将色氨酸转化为5-HTP(表1),但产率(0.19μM/h/OD600)非常低,只相当于对苯丙氨酸的产率的0.23%。
表1,来自不同微生物的P4H的体内活性
a所有的数据报告为三次独立实验的平均值±s.d.。
在此基础上,还将另外四个P4H通过用它们对应的基因替代在pZE-PaABM上的PaP4H基因进行测试。如表1中所示的,所有鉴定的P4H在大肠杆菌中示出对苯丙氨酸的高活性和强的底物偏好性。在它们之间,来自野油菜黄单胞菌的P4H(XcP4H)展现出对苯丙氨酸和色氨酸两者的最高活性。来自假单胞菌属物种的三个示出最相似的催化特性,这和它们亲密的系统进化关系相一致。因此,我们确认所有测试的P4H可以通过在再循环系统的存在下使用大肠杆菌内源的喋呤辅酶MH4来很好地发挥功能。
通过蛋白质工程修饰XcP4H底物偏好性。选择XcP4H进行蛋白质工程,因为它具有较好的催化潜力。为了研究底物决定氨基酸残基,将它的序列与动物P4H和T5H进行比对。仅动物P4H和T5H的序列的比较导致一些在每个组内保守但在组间变化的残基的鉴定。然而,当将这些残基和XcP4H的序列进行比对时,发现其中的仅六个在P4H中是保守的,并且可能对底物选择性是关键的,它们是Q85、L98、W179、L223、Y231、和L282,根据野油菜黄单胞菌编号系统进行编号(图5G,六个箭头)。为了进一步研究在酶结构中的它们的位置,使用来自紫色色杆菌的P4H的晶体结构(PDH码3TK2)作为模板建立了同源模型。保守残基与在人类P4H(PDB码1MMK)和T5H1(PDB码3HF6)的晶体结构中的那些良好地匹配,指示该模型的可靠性。在该结构中,W179位于催化口袋内部,就在预测的苯丙氨酸结合位点处,而L98和Y231接近口袋的入口,更接近于辅酶MH4结合位点(图3A)。然而,Q85、L223和L282并非位于接近催化口袋处,表明这些残基和酶的底物选择不太相关。因此,我们选择W179、L98和Y231作为靶标进行进一步突变分析。我们假设如果这些残基分别被它们对应的在T5H中的残基即F、Y和C替代,则突变体可能展现对色氨酸更强的偏好性。因此,和野生型(WT)酶相比,XcP4H的W179F突变体在色氨酸羟基化活性上展现出17.4倍的增加;同时它对于苯丙氨酸的活性降低了大约20%。对苯丙氨酸相对于对色氨酸的底物偏好性从33.5转变为1.5(表2)。当L98Y或Y231C的突变和W179F突变组合时,底物偏好性进一步向着色氨酸转变,但它们对色氨酸的活性并没有单独W179F的情况下高。三重突变体对这两个底物示出几乎相同的偏好性(图3B)。如所提及的,L98和Y231更接近于MH4结合位点,表明这两个残基可能不会贡献于芳香族氨基酸底物选择。
表2 XcP4H突变体的体内活性和底物偏好性
aR.A.,相对活性,设置WT XcP4H的R.A.为100%
b所有的数据报告为三次独立实验的平均值±s.d.。
为了进一步探索XcP4H突变体W179F对于全细胞生物催化的潜力,通过将预培养的具有pZE-XcABMW179F的大肠杆菌细胞(初始OD600值=12-13)与2.0g l-1色氨酸孵育来进行摄入实验。如图3C示出的,虽然细胞在37℃下生长略快,但初始转化率在30℃和37℃下是相似的。然而,在30℃下的生产效率在5小时后明显变得更高。到16小时结束时,在30℃和37℃下的培养物分别消耗了1503.2mg l-1和1417.1mg l-1的色氨酸而积累了1114.8mg l-1和758.3mg l-1的5-HTP。同时,我们观察到培养物的颜色在5小时后逐渐变黑,尤其是在37℃下,可能是由于在有氧条件下5-HTP和色氨酸的氧化。
5-HTP通过代谢工程的从头微生物合成。在实现了色氨酸向5-HTP的有效生物转化后,我们继续构造5-HTP生产菌株,该生产菌株允许使用从简单碳源产生的内源性色氨酸(图4A)。我们的初次尝试集中于色氨酸过度生产者的构建。在大肠杆菌中,色氨酸生物合成是从莽草酸途径在分支酸处通过trp调节子的作用分出的(图4A),并且被色氨酸转录抑制因子(TrpR)响应于细胞内色氨酸水平负调控。为了规避在转录水平上的固有调节,将包含trpEDCBA的完整的trp操纵子克隆进低拷贝质粒中,处于IPTG诱导型启动子的控制下。同时,为了消除反馈抑制效应,将突变S40F根据之前的研究27并入到TrpE中,产生了质粒pSA-TrpEDCBA。当将该质粒引入大肠杆菌BWΔtnaA时,所产生的菌株在37℃下在24小时培养后产生292.2mg l-1色氨酸;然而在48h后滴度大幅降低(74.4mg l-1),可能是由于氧化降解28。当生长温度变为30℃时,该问题解决了(图4B)。除BWΔtnaA外,我们还尝试使用QH4ΔtnaA作为宿主以通过莽草酸途径提高碳通量,因为QH4是pheLA和tyrA被破坏的良好开发的苯丙氨酸过度生产者ATCC31884的衍生菌,并且在我们之前的研究29,30中已经被成功的工程化以用于加强咖啡酸、水杨酸和已二烯二酸的生产。然而,在本研究中,具有pSA-TrpEDCBA的QH4ΔtnaA并没有显著改进色氨酸的生产,但是和BWΔtnaA宿主相比示出在30℃下略微改进的滴度。到48小时结束时,产生高达304.4mg l-1的色氨酸(图4B)。没有过表达trp操纵子的对照菌株QH4ΔtnaA在任一温度下都没有积累色氨酸。
由于色氨酸生产和色氨酸向5-HTP的生物转化的实现以及对于两种情况都在30℃下更好的进行,我们进一步的努力是针对在该温度下通过整合这两个模块建立5-HTP从头生物合成。当pZE-XcABMW179F和pSA-TrpEDCBA一起共转入大肠杆菌BWΔtnaA和QH4ΔtnaA时,所产生的菌株分别只产生19.9mg l-1和11.5mg l-1的5-HTP,在培养物中没有色氨酸的积累。清楚地,和亲本菌株相比,使用高拷贝数质粒引入5-羟基化反应对通过色氨酸的碳流量有负影响。我们推测XcP4H突变体和MH4再循环系统的过多表达可能已经导致代谢不平衡并且妨碍了向色氨酸的碳通量。为了测试这个假设,我们将XcP4H突变体W179F、PCD和DHMR的编码序列克隆进代替高拷贝数质粒的中拷贝数质粒中,产生质粒pCS-XcABMW179F。有趣的是,我们观察到具有pCS-XcABMW179F的BWΔtnaA和QH4ΔtnaA两者在5-HTP生产上的大幅改进;到48小时结束时,这两个菌株分别产生128.6mg l-1和152.9mg l-1的5-HTP(图4C),分别消耗了8.5g l-1和9.7g l-1葡萄糖。同时我们检测到两个菌株的166.3mg l-1和339.7mg l-1浓度的色氨酸积累,指示向色氨酸的碳通量完全恢复。还检测到了其他副产物,如表3中描绘的。5-HTP生产菌株遵从生长依赖型的生产模式(图4C)。
表3由5-HTP生产菌株产生的中间体和副产物
a两个宿主菌株都含有质粒pSA-TrpEDCBA和pCS-XcABMW179F。
b所有的数据报告为3次独立实验的平均值±s.d.。误差棒定义为s.d.
讨论。药物高价已经成为全世界的家庭主要负担。高价格确实剥夺了低收入人群对一些难获得且昂贵的药物的使用。该问题的原因是从自然资源中分离这些药物的低效率或它们化学合成的高成本。微生物生物合成和生物催化为药学上有价值的化合物的生产提供了一种容易可得且环境友好的方式。代谢工程和合成生物学工具的发展使得在所希望的宿主菌株中定制组装异源的人工途径以用于目标产物的生物合成成为可能31。
缺乏适合的酶是微生物的途径工程中最频繁面临的问题之一。真核生物酶的功能性表达经常是有问题的,是因为它们的低溶解度、低稳定性和/或对翻译后修饰的需要。例如,已经了解色氨酸5-羟基化反应很长时间了,并且已经从人类和动物中鉴定并表征了许多T5H。然而,动物AAAH难以在大肠杆菌中以可溶解且稳定的形式表达14,32。另外,它们的活性通常受磷酸化作用和它们的产物调节33。虽然截短的或融合蛋白的使用可以帮助获得可溶性且有活性的酶32,但是在大肠杆菌中使用截短的动物T5H生产5-HTP中催化效率显现仍然是低的16。在最近几年,蛋白质工程已经成为用于酶修饰以获得所希望的催化特性的有力工具34。在我们的研究中,将使用MH4的高活性的P4H成功地工程化以催化色氨酸5-羟基化反应。另外一个团队最近报道在大肠杆菌中用来自紫色色杆菌的突变体P4H生产5-HTP35。然而,它的功能不得不依赖于外源喋呤辅酶6,7-二甲基-5,6,7,8-四氢喋呤盐酸盐的补充35,这在经济可行性方面是不利的。
辅因子(包括粗酶和共底物)的自身供应或再生对于全细胞生物合成和生物催化是最大的优点之一。在大肠杆菌宿主中,许多这样的分子可以伴随着细胞生长而天然的产生,如FMN/FMNH2、FAD/FADH2、NAD(P)+/NAD(P)H、辅酶A、乙酰辅酶A、丙二酰辅酶A、MH4等。虽然使用这些内源的辅因子是更便利和经济的,但是有时异源的酶需要并非由宿主菌株产生的一种或多种辅因子。为了解决这种问题,一种途径是在培养基中补充外源辅因子。但是应注意大部分辅因子如四氢喋呤是很贵的以至于它们的补充对于商业生产不是经济可行的。另一种途径是将辅因子生物合成机制和/或再生机制引入宿主菌株中。正如本研究中使用动物T5H生产5-HTP,将从GTP的BH4生物合成途径引入到大肠杆菌中16。同时,BH4再生系统对于实现连续生产是必须的。最近,一项有趣的研究报道小鼠的T3H还可以在BH4再生系统的存在下使用大肠杆菌MH4,但是证实效率是低的36。在本工作中,在宿主菌株代谢的最小修饰的情况下,原核生物P4H和突变体能够使用和再循环大肠杆菌内源MH4和NAD(P)H(图2A和B)。
结论:本工作在5-HTP的生物生产中同时解决了两个问题,这两个问题涉及酶的相容性和辅因子的自我供应。据我们所知,本工作中从色氨酸产生的5-HTP的滴度(1.1-1.2g l-1)显著高于在之前研究中的滴度,示出大的大规模潜力。此外,本工作还证实了在无需补充前体和辅酶的情况下从头生产5-HTP。由于已经实现色氨酸在大肠杆菌37,内的高水平生产(高达48.7g l-1),因此预期将5-羟基化反应在色氨酸过度生产者中的引入和优化会导致5-HTP的有效和低成本生产。
材料与方法
实验材料。将大肠杆菌XL1-Blue用作宿主菌株以用于克隆和质粒扩增;将大肠杆菌BW25113ΔtnaA用作宿主菌株以用于体内酶测定、摄入实验、以及色氨酸和5-HTP的从头合成。之前QH4是通过从苯丙氨酸生产者大肠杆菌ATCC31844中破坏pheLA和tyrA而构建29。将包含10g l-1胰蛋白胨、5g l-1酵母提取物和10g l-1NaCl的卢里亚-贝塔尼(LB)培养基用于细胞培养和酶表达。将包含5g l-1甘油、6g l-1Na2HPO4、0.5g l-1NaCl、3g l-1KH2PO4、1g l-1NH4Cl、246.5mg l-1MgSO4·7H2O、14.7mg l-1CaCl2和27.8mg l-1FeSO4·7H2O的M9基本培养基用于P4H的体内测定。将改造的M9(M9Y)培养基用于色氨酸和5-HTP的从头生产。M9Y培养基包含10g l-1葡萄糖、6g l-1Na2HPO4、0.5g l-1NaCl、3g l-1KH2PO4、1g l-1NH4Cl、246.5mg l-1MgSO4·7H2O、14.7mg l-1CaCl2、27.8mg l-1FeSO4·7H2O、2g l-1酵母提取物和2g l-1二水柠檬酸钠。当需要时,将卡那霉素、氨苄青霉素和/或氯霉素分别以50mgl-1、100mgl-1和34mgl-1的终浓度补充进培养基。pZE12-luc、pCS27、pSA74分别是高、中和低拷贝数质粒30,用于在大肠杆菌内表达酶。在本研究中所用的菌株和质粒的细节在表4中描述。
表4在本研究中所用的菌株和质粒
DNA操作。大肠杆菌BW25113ΔtnaA::kan(JW3686-7)购买自杆菌遗传股份中心(Coli Genetic Stock Center,CGSC)。卡那霉素抗性标记物根据报道的方案缺失38。从QH4中缺失tnaA基因是使用报道的Red破坏方法进行38。质粒pZE-PaphhA是通过使用限制性酶切位点Acc65I和XbaI在pZE12-luc中插入从铜绿假单胞菌扩增的phhA基因来构建。pZE-PaABM是通过多片段连接使用Acc65I/NdeI、NdeI/HindIII和HindIII/XbaI在pZE12-luc中插入来自铜绿假单胞菌的phhA和phhB以及来自大肠杆菌的folM来构建。pZE-PpABM、pZE-PfABM、pZE-ReABM和pZE-XcABM是使用相同的方法构建,其中用对应的phhA基因替代来自铜绿假单胞菌的phhA基因。pSA-trpEDCBA是通过使用Acc65I和BamHI在pSA74中插入来自大肠杆菌的trpEDCBA的DNA片段来构建。定点突变通过重叠PCR进行。质粒pZE-XcABMW179F、pZE-XcABM2Ma、pZE-XcABM2Mb、pZE-XcABM3M是通过用对应的突变体基因替代野生型的来自于野油菜黄单胞菌的phhA基因来构建(表4)。
系统进化树的构建和同源建模。使用“苯丙氨酸4-羟化酶”、“酪氨酸3-羟化酶”和“色氨酸5-羟化酶”作为搜索关键字随机地从GenBank选择AAAH序列。AAAH氨基酸序列的比对是通过使用ClustalX 2.1进行。系统进化树是使用邻接法通过5.02版本的分子进化遗传分析(MEGA)来构建22。进行拔靴测试以评价可靠性(1000次重复)。所有其他所用的参数是软件的默认值。XcP4H的同源模型是以来自于紫色色杆菌的P4H的晶体结构(PDB码3TK2)为模板用SWISS-MODEL在线服务器建立的。
野生型和突变体P4H的体内测定。将携带pZE-PaABM的大肠杆菌BW25113ΔtnaA接种于含有0.5mM IPTG和100μgml-1氨苄青霉素的50mL LB液体培养基中,并且在37℃下有氧生长大约8h,直到OD600达到4.5-5.5。然后将细胞收获,并且重悬浮到M9基本培养基中(OD600=4.5-5.5)。在20分钟的适应后,将苯丙氨酸或色氨酸添加到细胞悬浮液中,达到500mgl-1的终浓度。同时,添加1mM抗坏血酸以避免产物氧化。将摇瓶在37℃下摇动(300rpm)1小时进行培养。接下来,通过移除细胞球粒取得样品,并且将产物(酪氨酸和色氨酸)用HPLC进行定量测量。相同的方法用于测量其他P4H和XcP4H突变体的体内活性。P4H的体内活性以μM/min/OD600表示。
色氨酸向5-HTP的生物转化。将大肠杆菌菌株BW25113ΔtnaA用质粒pZE-XcABMW179F转化。将单克隆接种于含有0.5mM IPTG的50mL LB培养基中,并且在37℃下有氧生长大约8h,直到OD600达到大约5.0。将细胞收获,重悬浮到20mL包含2g l-1色氨酸的M9Y培养基中(OD600=12-13时),并且让其在30℃和37℃下生长。将样品在2h、5h、10h和16h时取得。将生产的5-HTP的浓度通过HPLC进行分析。
色氨酸和5-HTP的从头合成。将生产菌株的过夜LB培养物以2%接种于含有合适抗生素的M9Y培养基中,并且在30℃和37℃下在300rpm摇动下培养。在0h时,将IPTG添加到培养物中达到0.5mM的总浓度。每12小时取出样品。测量OD600值并且通过HPLC分析产物、中间体和副产物的浓度。
HPLC分析。将L-酪氨酸(来自西格玛奥德里奇公司(SIGMA ALDRICH))、L-色氨酸(来自西格玛奥德里奇公司)和5-HTP(来自安可乐斯有机物公司(Acros Organics))用作标准品。将标准品和样品两者通过HPLC进行定量(安装有Ultimate 3000光电二级管阵列检测器以及反相ZORBAX SB-C18柱的Dionex Ultimate 3000)。根据我们之前的研究39使用梯度洗脱方法。色氨酸、酪氨酸和5-HTP的定量是基于在特定波长(276nm)下的峰面积。使用之前描述的方法40对葡萄糖、乙酸盐和丙酮酸盐进行定量。
参考文献
1.WHO.(2012)世界卫生组织关于抑郁症的情况说明书(World Health Organization Fact Sheet on Depression),http://www.who.int/mediacentre/factsheets/fs369/en/index.html。
2.拜尔利,E.F.(Byerley,W.F.),朱迪,L.L.(Judd,L.L.),瑞姆赫,F.W.(Reimherr,F.W.),和格瑞斯,B.I.(Grosser,B.I.)(1987)5-羟基色氨酸:它的抗抑郁功效和不良反应的综述(5-Hydroxytryptophan:a review of its antidepressant efficacy and adverse effects),临床精神药理学杂志(J.Clin.Psychopharmacol)7,127-137。
3.特纳,E.H.(Turner,E.H.),洛夫蒂斯,J.M.(Loftis,J.M.),和布莱克威尔,A.D.(Blackwell,A.D.)(2006)照单血清素:补充血清素前体5-羟基色氨酸(Serotonin a la carte:supplementation with the serotonin precursor 5-hydroxytryptophan),药理学与治疗学(Pharmacol.Ther.)109,325-338。
4.博德塞奥,T.C.(Birdsall,T.C.)(1998)5-羟基色胺酸:一种临床有效的血清素前体(5-Hydroxytryptophan:a clinically-effective serotonin precursor),替代医学评论(Altern.Med.Rev.)3,271-280。
5.阿吉库玛,P.K.(Ajikumar,P.K.),肖,W.H.(Xiao,W.H.),东京,K.E.J.(Tyo,K.E.J.),王,Y.(Wang,Y.),西蒙,F.(Simeon,F.),莱纳德,E.(Leonard,E.),穆莎,O.(Mucha,O.),方,T.H.(Phon,T.H.),普法依费尔,B.(Pfeifer,B.),和斯特凡诺普洛斯,G.(Stephanopoulos,G.)(2010)类异戊二烯途径优化用于在大肠杆菌中紫杉醇前体的过度生产(Isoprenoid Pathway Optimization for Taxol Precursor Overproduction in Escherichia coli),科学(Science)330,70-74。
6.莱纳德,E.(Leonard,E.),阿吉库玛,P.K.(Ajikumar,P.K.),塞耶,K.(Thayer,K.),肖,W.H.(Xiao,W.H.),墨,J.D.(Mo,J.D.),都铎,B.(Tidor,B.),斯特凡诺普洛斯,G.(Stephanopoulos,G.),和普拉瑟,K.L.J.(Prather,K.L.J.)(2010)萜类化合物生物合成途径的组合代谢和蛋白质工程用以用于过度生产和选择性控制(Combining metabolic and protein engineering of a terpenoid biosynthetic pathway for overproduction and selectivity control),美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)107,13654-13659。
7.安东尼,J.R.(Anthony,J.R.),安东尼,L.C.(Anthony,L.C.),诺阿伍兹,F.(Nowroozi,F.),科温,G.(Kwon,G),纽曼,J.D.(Newman,J.D.),和凯瑟琳,J.D.(Keasling,J.D.)(2009)基于甲羟戊酸的类异戊二烯生物合成途径在大肠杆菌中的优化用以生产抗疟疾药物前体紫穗槐-4,11-二烯(Optimization of the mevalonate-based isoprenoid biosynthetic pathway in Escherichia coli for production of the anti-malarial drug precursor amorpha-4,11-diene),代谢工程(Metab.Eng.)11,13-19。
8.茹,R.A.(Ro,D.K.),派尔戴兹,E.M.(Paradise,E.M.),欧莱特,M.(Ouellet,M.),费希尔,K.J.(Fisher,K.J.,),纽曼,J.D.(Newman,J.D.),恩当沽,J.M(Ndungu,J.M.),候,K.A.(Ho,K.A.),伊修丝,R.A.(Eachus,R.A.),汉姆,T.S.(Ham,T.S.),克尔拜,J.(Kirby,J.),常,M.C.(Chang,M.C.,),威瑟斯,S.T.(Withers,S.T.),施巴,T.(Shiba,Y.),萨尔蓬,R.(Sarpong,R.),和凯瑟琳,J.D.(Keasling,J.D.)(2006)抗疟疾药前体青蒿酸在工程化的酵母中的生产(Production of the antimalarial drug precursor artemisinic acid in engineered yeast),自然(Nature)440,940-943。
9.张,K.(Zhang,K.),李,H.(Li,H.),赵,K.M.(Cho,K.M.),和廖,J.C.(Liao,J.C.)(2010)用于非自然氨基酸L-均聚丙氨酸的全生物合成的延伸代谢(Expanding metabolism for total biosynthesis of the nonnatural amino acid L-homoalanine),美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)107,6234-6239。
10.利姆,C.G.(Lim,C.G.),福勒,Z.L.(Fowler,Z.L.),怀勒,T.(Hueller,T.),谢弗,S.(Schaffer,S.),和卡夫斯,M.A.G.(Koffas,M.A.G.)(2011)在工程化的大肠杆菌中高产量白藜芦醇生产(High-Yield Resveratrol Production in Engineered Escherichia coli),应用和环境微生物学(Appl.Environ.Microbiol.)77,3451-3460。
11.林,Y.(Lin,Y.),沈,X.(Shen,X.),元,Q.(Yuan,Q.),和闫,Y.(Yan,Y.)(2013)抗凝血剂前体4-羟基香豆素的微生物生物合成(Microbial biosynthesis of the anticoagulant precursor 4-hydroxycoumarin),自然通讯(Nat.Commun.)4,2603。
12.泰根,K.(Teigen,K.),麦金尼,J.A.(McKinney,J.A.),哈威克,J.(Haavik,J.),和马丁内斯,A.(Martinez,A.)(2007)用于配体结合到芳香族氨基酸羟化酶的选择性和亲和性决定物(Selectivity and affinity determinants for ligand binding to the aromatic amino acid hydroxylases),当代医药化学(Curr.Med.Chem.)14,455-467。
13.菲茨帕特里克,P.F.(Fitzpatrick,P.F.)(2003)芳香族氨基酸羟基化作用机制(Mechanism of aromatic amino acid hydroxylation),生物化学(莫斯科)(Biochemistry(Mosc.))42,14083-14091。
14.麦金尼,J.(McKinney,J.),卡纳普斯科,P.M.(Knappskog,P.M.),佩雷拉,J.(Pereira,J.),厄尔,T.(Ekern,T.),托斯卡,K.(Toska,K.),科威特,B.B.(Kuitert,B.B.),莱文,D.(Levine,D.),格隆恩伯恩,A.M.(Gronenborn,A.M.),马丁内斯,A.(Martinez,A.),和海威克,J.(Haavik,J.)(2004)人类色氨酸羟化酶从大肠杆菌和毕赤酵母中的表达和纯化(Expression and purification of human tryptophan hydroxylase from Escherichia coli and Pichia pastoris),蛋白表达纯化(Protein Expr.Purif.)33,185-194。
15.马丁内斯,A.(Martinez,A.),卡纳普斯科,P.M.(Knappskog,P.M.),和哈威克,J.(Haavik,J.)(2001)人类色氨酸羟化酶的结构探讨以及它对于血清素生物合成调控的影响(A structural approach into human tryptophan hydroxylase and its implications for the regulation of serotonin biosynthesis),当代医药化学(Curr.Med.Chem.)8,1077-1091。
16.奈特,E.M.(Knight,E.M.),朱,J.(Zhu,J.),福斯特,J.和罗,H.(Luo,H.)(2013)用于5-羟基色氨酸生产的微生物(Microorganisms for the production of 5-hydroxytryptophan);Int’l.Pat.Pub.WO 2013/127914A1,6月9日,2013,用于5-羟基色氨酸生产的微生物(Microorganisms for the production of 5-hydroxytryptophan)。
17.中田,H.(Nakata,H.),山内,T.(Yamauchi,T.),和藤泽,H.(Fujisawa,H.)(1979)来自紫色色杆菌的苯丙氨酸羟化酶.纯化和表征(Phenylalanine hydroxylase from Chromobacterium violaceum.Purification and characterization),生物化学杂志(J.Biol.Chem.)254,1829-1833。
18.赵,G.(Zhao,G.),夏,T.(Xia,T.),宋,J.(Song,J.),和杰森,R.A.(Jensen,R.A.)(1994)铜绿假单胞菌具有作为一个三组分基因簇部分的哺乳动物苯丙氨酸羟化酶和4α-甲醇胺脱水酶/DCoH的同系物(Pseudomonas aeruginosa possesses homologues of mammalian phenylalanine hydroxylase and 4alpha-carbinolamine dehydratase/DCoH as part of a three-component gene cluster),美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)91,1366-1370。
19.吉纳,K.(Kino,K.),哈茹,R.(Hara,R.),和野泽,A.(Nozawa,A.)(2009)通过来自紫色色杆菌的L-苯丙氨酸4-羟化酶的基于结构的修饰来增强L-色氨酸5-羟基化活性(Enhancement of L-tryptophan 5-hydroxylation activity by structure-based modification of L-phenylalanine 4-hydroxylase from Chromobacterium violaceum),生物科学和生物工程杂志(Journal of bioscience and bioengineering)108,184-189。
20.普瑞拜特,A.(Pribat,A.),布莱比,I.K.(Blaby,I.K.),拉瑞-努涅斯,A.(Lara-Nunez,A.),格雷戈里,J.F.(Gregory,J.F.),3rd,帝克雷西-加达,V.(3rd,de Crecy-Lagard,V.),和汉森,A.D.(Hanson,A.D.)(2010)FolX和FolM对于四氢单喋呤在大肠杆菌和铜绿假单胞菌中的合成是至关重要的(FolX and FolM are essential for tetrahydromonapterin synthesis in Escherichia coli and Pseudomonas aeruginosa),细菌学杂志(J.Bacteriol.)192,475-482。
21.埃兰森,H.(Erlandsen,H.),吉米,J.Y.(Kim,J.Y.),派弛,M.G(Patch,M.G.).,韩,A.(Han,A.),瓦尔内,A.(Volner,A.),阿布-欧玛,M.M.(Abu-Omar,M.M.),和斯蒂文,R.C.(Stevens,R.C.)(2002)细菌和人类离子依赖型苯丙氨酸羟化酶的结构比较:相似的折叠,不同的稳定性和反应速率(Structural comparison of bacterial and human iron-dependent phenylalanine hydroxylases:similar fold,different stability and reaction rates),分子生物学杂志(J.Mol.Biol.)28,2731-2739。
22.塔穆拉,K.(Tamura,K.),皮特森,D.(Peterson,D.),皮特森,N.(Peterson,N.),斯特克,G.(Stecher,G.),奈,M.(Nei,M.),和库玛,S.(Kumar,S.)(2011)MEGA5:使用最大似然、进化距离和最大简约法的分子进化遗传学分析(MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods),分子生物学进化(Mol.Biol.Evol.)28,2731-2739。
23.曹,J.(Cao,J.),史,F.(Shi,F.),刘,X.(Liu,X.),黄,G.(Huang,G.),和周,M.(Zhou,M.)(2010)芳香族氨基酸羟化酶的系统进化分析和进化(Phylogenetic analysis and evolution of aromatic amino acid hydroxylase),欧洲生化学会联合会快报(FEBS Lett.)584,4775-4782。
24.埃克斯特龙,F.(Ekstrom,F.),斯特,G.(Stier,G.),伊顿,J.T.(Eaton,J.T.),和索尔,U.H.(Sauer,U.H.)(2003)来自于革兰氏阴性机会致病菌铜绿假单胞菌的包含细菌非血红素离子的苯丙氨酸羟化酶的晶体结构和X射线分析(Crystallization and X-ray analysis of a bacterial non-haem iron-containing phenylalanine hydroxylase from the Gram-negative opportunistic pathogen Pseudomonas aeruginosa),晶体学报D部分生物晶体学(Acta Crystallogr.D Biol.Crystallogr.)59,1310-1312。
25.巩,F.(Gong,F.),伊藤,K.(Ito,K.),中村,Y.(Nakamura,Y.),和亚诺夫斯基,C.(Yanofsky,C.)(2001)色氨酸酶操纵子表达的色氨酸诱导机制:色氨酸抑制释放因子介导的TnaC-肽基-tRNA(Pro)的裂解(The mechanism of tryptophan induction of tryptophanase operon expression:tryptophan inhibits release factor-mediated cleavage of TnaC-peptidyl-tRNA(Pro),),美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)98,8997-9001。
26.宋,J.(Song,J.),夏,T.(Xia,T.),和杰森,R.A.(Jensen,R.A.)(1999)PhhB,哺乳动物蝶呤4a-甲醇胺脱水酶/DCoH的铜绿假单胞菌同系物,没有在转录水平调节苯丙氨酸羟化酶的表达(PhhB,a Pseudomonas aeruginosa homolog of mammalian pterin 4a-carbinolamine dehydratase/DCoH,does not regulate expression of phenylalanine hydroxylase at the transcriptional level),细菌学杂志(J.Bacteriol.)181,2789-2796。
27.赵,Z.J.(Zhao,Z.J.),邹,C.(Zou,C.),朱,Y.X.(Zhu,Y.X.),戴,J.(Dai,J.),陈,S.(Chen,S.),武,D.(Wu,D.),武,J.(Wu,J.)和陈,J.(Chen,J.)(2011)通过大肠杆菌内限定的基因改造来开发L-色氨酸生产菌株(Development of L-tryptophan production strains by defined genetic modification in Escherichia coli),工业微生物学和生物技术杂志(J.Ind.Microbiol.Biotechnol.)38,1921-1929。
28.斯玛特,T.J.(Simat,T.J.),和斯坦哈特,H.(Steinhart,H.)(1998)在肽和蛋白质中游离色氨酸以及色氨酸残基的氧化(Oxidation of Free Tryptophan and Tryptophan Residues in Peptides and Proteins),农业食品化学杂志(J.Agric.Food Chem.)46,490-498。
29.黄,Q.(Huang,Q.),林,Y.(Lin,Y.),和闫,Y.(Yan,Y.)(2013)通过改造过度生产苯丙氨酸的大肠杆菌菌株增强咖啡酸生产(Caffeic acid production enhancement by engineering a phenylalanine over-producing Escherichia coli strain),生物技术和生物工程(Biotechnol.Bioeng.)110,3188-3196。
30.林,Y.(Lin,Y.),孙,Y.(Sun,X.),元,Q.(Yuan,Q.),和闫,Y.(Yan,Y.)(2014)用于在大肠杆菌中生产己二烯二酸和它的前体水杨酸的延伸莽草酸途径(Extending shikimate pathway for the production of muconic acid and its precursor salicylic acid in Escherichia coli),代谢工程(Metab.Eng.)23C,62-69。
31.莫拉-派勒,M.(Mora-Pale,M.),桑切斯-罗德里格斯,S.P.(Sanchez-Rodriguez,S.P.),林哈特,R.J.(Linhardt,R.J.),多迪克,J.S.(Dordick,J.S.),和卡夫斯,M.A.G.(Koffas,M.A.G.)(2014)用于增强具有药效潜力的天然产品的体内生产的生物化学策略(Biochemical strategies for enhancing the in vivo production of natural products with pharmaceutical potential),当代生物技术观点(Curr.Opin.Biotechnol.)25C,86-94。
32.希金斯,C.A.(Higgins,C.A.),弗米尔,L.M.(Vermeer,L.M.),多伦,J.A.(Doorn,J.A.),和罗马,D.L.(Roman,D.L.)(2012)作为在大肠杆菌内的融合蛋白的重组人类酪氨酸羟化酶的表达和纯化(Expression and purification of recombinant human tyrosine hydroxylase as a fusion protein in Escherichia coli),蛋白表达纯化(Protein Expr.Purif.)84,219-223。
33.多布内,S.C.(Daubner,S.C.),劳里亚诺,C.(Lauriano,C.),嗨克可,J.W.(Haycock,J.W.),和菲茨帕特里克,P.F.(Fitzpatrick,P.F.)(1992)大鼠酪氨酸羟化酶的丝氨酸40的定点突变.多巴胺和cAMP依赖性磷酸化对于酶活性的影响(Site-directed mutagenesis of serine 40of rat tyrosine hydroxylase.Effects of dopamine and cAMP-dependent phosphorylation on enzyme activity),生物化学杂志(J.Biol.Chem.)267,12639-12646。
34.马尔凯斯基,R.J.(Marcheschi,R.J.),格罗恩格伯,L.S.(Gronenberg,L.S.),和廖,J.C.(Liao,J.C.)(2013)用于代谢工程的蛋白质工程:当下和下一代工具(Protein engineering for metabolic engineering:current and next-generation tools),生物技术杂志(Biotechnol.J.)8,545-555。
35.哈茹,R.(Hara,R.),和吉纳,K.(Kino,K.)(2013)通过四氢喋呤再生来增强5-羟基-l-色氨酸的合成(Enhanced synthesis of 5-hydroxy-l-tryptophan through tetrahydropterin regeneration),AMB出版(AMB Express)3,70。
36.佐藤,Y.(Satoh,Y.),田岛,K.(Tajima,K.),麦秋,M.(Munekata,M.),凯瑟琳,J.D.(Keasling,J.D.),和李,T.S.(Lee,T.S.)(2012)在大肠杆菌中L-酪氨酸氧化和羟基酪醇的微生物生产的工程化(Engineering of L-tyrosine oxidation in Escherichia coli and microbial production of hydroxytyrosol),代谢工程(Metab.Eng)14,603-610。
37.王,J.(Wang,J.),程,L.K.(Cheng,L.K.),王,J.(Wang,J.),刘,Q.(Liu,Q.),沈,T.(Shen,T.),和陈,N.(Chen,N.)(2013)大肠杆菌的基因工程以增强L-色氨酸的生产(Genetic engineering of Escherichia coli to enhance production of L-tryptophan),应用微生物学和生物技术(Appl.Microbiol.Biotechnol.)97,7587-7596。
38.达森口,K.A.(Datsenko,K.A.),和万纳,B.L.(Wanner,B.L.)(2000)使用PCR产物在大肠杆菌K-12中将染色体基因一步敲除(One-step inactivation of chromosomal genes in Escherichia coli K-12using PCRproducts),美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)97,6640-6645。
39.林,Y.(Lin,Y.)和闫,Y.(Yan,Y.)(2012)将咖啡酸使用其内源的羟化酶复合物在大肠杆菌中进行生物合成(Biosynthesis of caffeic acid in Escherichia coli using its endogenous hydroxylase complex),微生物细胞工厂(Microb Cell Fact)42。
40.沈,X.(Shen,X.),林,Y.(Lin,Y.),杰恩,R.(Jain,R.),元,Q.(Yuan,Q.),和闫,Y.(Yan,Y.)(2012)乙酸积累的抑制导致增强的大肠杆菌内的(R,R)-2,3-丁二醇从甘油的生产(Inhibition of acetate accumulation leads to enhanced production of(R,R)-2,3-butanediol from glycerol in Escherichia coli),工业微生物学和生物技术杂志(J.Ind.Microbiol.Biotechnol.)39,1725-1729。
实例II。5-羟基色氨酸作为动物饲料补充物
产乳热(又名临产低血钙症)是一种代谢障碍,经常在产犊时期左右频繁地发生在农场动物中。大约0-10%的奶牛经历产乳热(临床低血钙症),然而这个数字可在产犊母牛中增至25%(迪格瑞斯(DeGaris)等人,2008,兽医杂志(Vet.J.)176,58-69)。此外,大部分奶牛展现不同程度的亚临床低血钙症。产乳热对奶农造成大量的经济损失,包括母牛死亡(大约5%的受到影响的母牛)、生产生命期的减少(每个受影响的母牛3.4年)、牛奶产量的下降、繁殖性能的退化以及预防和治疗该疾病的花费。平均起来,与产乳热相关的花费被评估为大约每次发生为334美元(高夫(Goff)等人,2003,中国兽医杂志增刊(Acta Vet.Scand.Suppl.)97,145-147)。联合国食品和农业组织(FAO)已经报道在2011年世界上有2.6亿奶牛(世界奶牛数量,2014,可在万维网dairyco.org.uk/market-information/farming-data/cow-numbers/world-cow-numbers/#.VH0dds6wXxr获得)。相应地,评估的由产乳热引起的损失在全球为大约43.4亿美元(假定严重的产乳热的发生率是5%)。相比之下,通过过渡期没有疾病的母牛通常示出更高的机会以具有生产泌乳期、以及更好的繁殖性能(赫尔南德斯(Hernandez),2011,在过渡期奶牛中的钙稳态,可在万维网reeis.usda.gov/web/crisprojectpages/0227299-calcium-homeostasis-in-transition-dairy-cattle.html获得)。
广泛的研究已经示出在干乳期血清素水平的升高可以增加钙水平并且预防产乳热。目前实践主要集中于在不产奶的母牛的饮食中饮食的阴阳离子差异的操纵。然而,这些饮食对于动物来说是不好吃的且花费非常多(Id.)。因此,令人希望的是开发新的策略以控制产乳热,该策略既对动物来说是好吃的又对大规模实践来说是廉价的。一项最近的USDA资助的标题为“过渡期奶牛中的钙稳态”研究揭示5-HTP的补充导致从妊娠到泌乳过渡的动物体内的提高的钙动员,这是可以有效预防产乳热的机制(Id.)。豪斯曼(Horseman)等人称5-HTP的补充对于临产低血钙症在泌乳的雌性哺乳动物中的预防和/或治疗是有效的(WO 2013112873A2)。应注意的是产乳热不仅在母牛中发生也在许多其他农场哺乳动物中发生。然而,通过当前植物提取生产的5-HTP的高价格和限制性供应妨碍了它在农场动物饲料中的使用。我们的新技术将减少生产成本多达90%,这将使得使用5-HTP作为动物饲料添加剂或补充物以预防产乳热在经济上是可行的。
仅出于清楚理解起见给出以上详细说明和实例。不应将其理解成不必要的限制。本发明不限于所示和所述的精确细节,因为将在权利要求书限定的本发明内包含对于本领域技术人员而言显而易见的变体。
除非另外指明,所有表示组分、分子量的数字,以及在说明书和权利要求书中使用的等要理解为在所有情况下由术语“约”进行修饰。因此,除非另外相反地指明,在本说明书和权利要求书中阐述的数值参数是近似值,这些近似值可以取决于本发明所寻求获得的所希望的特性而不同。最低限度并且不试图限制等效物原则应用到本权利要求书的范围,每一个数值参数至少应该按照报告的有效数字的数量以及通过应用普通的舍入方法来解释。
虽然阐述本发明的广泛范围的数字范围和参数是近似值,但是在具体实例中阐述的数值被尽可能地精确地报道。然而,全部数值内在地含有因其相应的检验度量中存在的标准偏差而必然产生的范围。
在本申请的披露内容和通过引用方式结合在此的任何文献的披露内容之间存在任何不一致性的情况下,本申请的披露内容应当占据主导。
全部标题旨在方便读者并且不应当用来限制该标题后续文本的意思,除非如此说明。
在此引用的所有专利、专利申请(包括临时专利申请)、以及出版物(包括专利出版物和非专利出版物)和电子可得材料(包括,例如,提交到例如,GenBank和RefSeq中的核苷酸序列,以及提交到例如,SwissProt、PIR、PRF、PDB中的氨基酸序列,以及来自GenBank和RefSeq中的注释编码区的翻译)的完整披露通过引用结合。
序列表
<110> 乔治亚大学研究基金公司(UNIVERSITY OF GEORGIA RESEARCH FOUNDATION, INC.)
闫亚军(YAN, Yajun)
林宇恒(LIN, Yuheng)
<120> 用于产生5-羟基色氨酸的微生物途径
<130> 235.02480201
<150> US 61/994,413
<151> 2014-05-16
<160> 17
<170> PatentIn 3.5版
<210> 1
<211> 296
<212> PRT
<213> 野油菜黄单胞菌
<400> 1
Met Asn Thr Ala Pro Arg Arg Val Glu Asn Gln Leu Thr Asp Lys Gly
1 5 10 15
Tyr Val Pro Val Tyr Thr Thr Ala Val Val Glu Gln Pro Trp Asp Gly
20 25 30
Tyr Ser Ala Asp Asp His Ala Thr Trp Gly Thr Leu Tyr Arg Arg Gln
35 40 45
Arg Ala Leu Leu Val Gly Arg Ala Cys Asp Glu Phe Leu Gln Ala Gln
50 55 60
Asp Ala Met Gly Met Asp Asp Thr Gln Ile Pro Arg Phe Asp Ala Leu
65 70 75 80
Asn Ala Val Leu Gln Ala Thr Thr Gly Trp Thr Leu Val Gly Val Glu
85 90 95
Gly Leu Leu Pro Glu Leu Asp Phe Phe Asp His Leu Ala Asn Arg Arg
100 105 110
Phe Pro Val Thr Trp Trp Ile Arg Arg Pro Asp Gln Ile Asp Tyr Ile
115 120 125
Ala Glu Pro Asp Leu Phe His Asp Leu Phe Gly His Val Pro Leu Leu
130 135 140
Met Asn Pro Leu Phe Ala Asp Phe Met Gln Ala Tyr Gly Arg Gly Gly
145 150 155 160
Val Lys Ala His Gly Ile Gly Pro Asp Ala Leu Gln Asn Leu Thr Arg
165 170 175
Leu Tyr Trp Tyr Thr Val Glu Phe Gly Leu Ile Ala Thr Pro Gln Gly
180 185 190
Leu Arg Ile Tyr Gly Ala Gly Ile Val Ser Ser Lys Gly Glu Ser Leu
195 200 205
His Ser Leu Glu Ser Ala Ala Pro Asn Arg Val Gly Phe Asp Leu Gln
210 215 220
Arg Val Met Arg Thr Arg Tyr Arg Ile Asp Ser Phe Gln Lys Thr Tyr
225 230 235 240
Phe Val Ile Asp Ser Phe Thr Gln Leu Met Asp Ala Thr Ala Pro Asp
245 250 255
Phe Thr Pro Ile Tyr Ala Ala Leu Ala Gln Gln Pro Gln Val Pro Ala
260 265 270
Gly Glu Val Leu Ala Thr Asp His Val Leu Gln Arg Gly Ser Gly Glu
275 280 285
Gly Trp Ser Arg Asp Gly Asp Val
290 295
<210> 2
<211> 262
<212> PRT
<213> 铜绿假单胞菌
<400> 2
Met Lys Thr Thr Gln Tyr Val Ala Arg Gln Pro Asp Asp Asn Gly Phe
1 5 10 15
Ile His Tyr Pro Glu Thr Glu His Gln Val Trp Asn Thr Leu Ile Thr
20 25 30
Arg Gln Leu Lys Val Ile Glu Gly Arg Ala Cys Gln Glu Tyr Leu Asp
35 40 45
Gly Ile Glu Gln Leu Gly Leu Pro His Glu Arg Ile Pro Gln Leu Asp
50 55 60
Glu Ile Asn Arg Val Leu Gln Ala Thr Thr Gly Trp Arg Val Ala Arg
65 70 75 80
Val Pro Ala Leu Ile Pro Phe Gln Thr Phe Phe Glu Leu Leu Ala Ser
85 90 95
Gln Gln Phe Pro Val Ala Thr Phe Ile Arg Thr Pro Glu Glu Leu Asp
100 105 110
Tyr Leu Gln Glu Pro Asp Ile Phe His Glu Ile Phe Gly His Cys Pro
115 120 125
Leu Leu Thr Asn Pro Trp Phe Ala Glu Phe Thr His Thr Tyr Gly Lys
130 135 140
Leu Gly Leu Lys Ala Ser Lys Glu Glu Arg Val Phe Leu Ala Arg Leu
145 150 155 160
Tyr Trp Met Thr Ile Glu Phe Gly Leu Val Glu Thr Asp Gln Gly Lys
165 170 175
Arg Ile Tyr Gly Gly Gly Ile Leu Ser Ser Pro Lys Glu Thr Val Tyr
180 185 190
Ser Leu Ser Asp Glu Pro Leu His Gln Ala Phe Asn Pro Leu Glu Ala
195 200 205
Met Arg Thr Pro Tyr Arg Ile Asp Ile Leu Gln Pro Leu Tyr Phe Val
210 215 220
Leu Pro Asp Leu Lys Arg Leu Phe Gln Leu Ala Gln Glu Asp Ile Met
225 230 235 240
Ala Leu Val His Glu Ala Met Arg Leu Gly Leu His Ala Pro Leu Phe
245 250 255
Pro Pro Lys Gln Ala Ala
260
<210> 3
<211> 263
<212> PRT
<213> 荧光假单胞菌
<400> 3
Met Lys Gln Thr Gln Tyr Val Ala Arg Glu Pro Asp Ala Gln Gly Phe
1 5 10 15
Ile Asp Tyr Pro Pro Glu Glu His Ala Val Trp Asn Thr Leu Ile Thr
20 25 30
Arg Gln Leu Lys Val Ile Glu Gly Arg Ala Cys Gln Glu Tyr Leu Asp
35 40 45
Gly Ile Asp Lys Leu Gly Leu Pro His Asp Arg Ile Pro Gln Leu Gly
50 55 60
Glu Ile Asn Lys Val Leu Gly Glu Thr Thr Gly Trp Gln Val Ala Arg
65 70 75 80
Val Pro Ala Leu Ile Pro Phe Gln Thr Phe Phe Glu Leu Leu Ala Ser
85 90 95
Lys Arg Phe Pro Val Ala Thr Phe Ile Arg Thr Arg Glu Glu Leu Asp
100 105 110
Tyr Leu Gln Glu Pro Asp Ile Phe His Glu Ile Phe Gly His Cys Pro
115 120 125
Leu Leu Thr Asn Pro Trp Phe Ala Glu Phe Thr His Thr Tyr Gly Lys
130 135 140
Leu Gly Leu Gln Ala Thr Lys Glu Glu Arg Val Tyr Leu Ala Arg Leu
145 150 155 160
Tyr Trp Met Thr Ile Glu Phe Gly Leu Val Asp Thr Pro Ala Gly Arg
165 170 175
Arg Ile Tyr Gly Gly Gly Ile Leu Ser Ser Pro Lys Glu Thr Val Tyr
180 185 190
Ser Leu Ser Glu Glu Pro Glu His Gln Ala Phe Asp Pro Leu Glu Ala
195 200 205
Met Arg Thr Pro Tyr Arg Ile Asp Ile Leu Gln Pro Ile Tyr Phe Thr
210 215 220
Leu Pro Asn Leu Lys Arg Leu Phe Asp Leu Ala His Glu Asp Ile Met
225 230 235 240
Ala Leu Val His Gln Gly Met Gln Leu Gly Leu His Ala Pro Lys Phe
245 250 255
Pro Pro Lys Pro Lys Ala Ala
260
<210> 4
<211> 262
<212> PRT
<213> 恶臭假单胞菌
<400> 4
Met Lys Gln Thr Gln Tyr Val Ala Arg Glu Pro Asp Ala His Gly Phe
1 5 10 15
Ile Asp Tyr Pro Gln Gln Glu His Ala Val Trp Asn Thr Leu Ile Thr
20 25 30
Arg Gln Leu Lys Val Ile Glu Gly Arg Ala Cys Gln Glu Tyr Leu Asp
35 40 45
Gly Ile Asp Gln Leu Lys Leu Pro His Asp Arg Ile Pro Gln Leu Gly
50 55 60
Glu Ile Asn Lys Val Leu Gly Ala Thr Thr Gly Trp Gln Val Ala Arg
65 70 75 80
Val Pro Ala Leu Ile Pro Phe Gln Thr Phe Phe Glu Leu Leu Ala Ser
85 90 95
Lys Arg Phe Pro Val Ala Thr Phe Ile Arg Thr Pro Glu Glu Leu Asp
100 105 110
Tyr Leu Gln Glu Pro Asp Ile Phe His Glu Ile Phe Gly His Cys Pro
115 120 125
Leu Leu Thr Asn Pro Trp Phe Ala Glu Phe Thr His Thr Tyr Gly Lys
130 135 140
Leu Gly Leu Ala Ala Thr Lys Glu Gln Arg Val Tyr Leu Ala Arg Leu
145 150 155 160
Tyr Trp Met Thr Ile Glu Phe Gly Leu Met Glu Thr Ala Gln Gly Arg
165 170 175
Lys Ile Tyr Gly Gly Gly Ile Leu Ser Ser Pro Lys Glu Thr Val Tyr
180 185 190
Ser Leu Ser Asp Glu Pro Glu His Gln Ala Phe Asp Pro Ile Glu Ala
195 200 205
Met Arg Thr Pro Tyr Arg Ile Asp Ile Leu Gln Pro Val Tyr Phe Val
210 215 220
Leu Pro Asn Met Lys Arg Leu Phe Asp Leu Ala His Glu Asp Ile Met
225 230 235 240
Gly Met Val His Lys Ala Met Gln Leu Gly Leu His Ala Pro Lys Phe
245 250 255
Pro Pro Lys Val Ala Ala
260
<210> 5
<211> 309
<212> PRT
<213> 富养罗尔斯通氏菌
<400> 5
Met Ser Ile Ala Thr Ala Thr Glu Ala Pro Gly Ala Phe Gln Gly Thr
1 5 10 15
Leu Thr Asp Lys Leu Lys Glu Gln Phe Asp Ala Gly Leu Leu Ser Gly
20 25 30
Gln Glu Leu Arg Pro Asp Phe Thr Ile Ala Gln Pro Val His Arg Tyr
35 40 45
Thr Ser Thr Asp His Ala Ile Trp Arg Lys Leu Tyr Glu Arg Gln Ala
50 55 60
Ala Met Leu Gln Gly Arg Val Ser Asp Glu Phe Leu Gln Gly Leu Ala
65 70 75 80
Thr Leu Gly Met Asp Lys Asp Arg Val Pro Asp Phe Asp Gln Leu Asn
85 90 95
Glu Thr Leu Met Arg Ala Thr Gly Trp Gln Val Val Ala Val Pro Gly
100 105 110
Leu Val Pro Asp Gln Val Phe Phe Glu His Leu Ala Asn Arg Arg Phe
115 120 125
Pro Ala Ser Trp Trp Met Arg Lys Pro Glu Gln Leu Asp Tyr Leu Gln
130 135 140
Glu Pro Asp Cys Phe His Asp Val Phe Gly His Val Pro Leu Leu Ile
145 150 155 160
Asn Pro Val Phe Ala Asp Tyr Met Glu Ala Tyr Gly Lys Gly Gly Leu
165 170 175
Lys Ala Asn Gly Leu Gly Ala Leu Asp Met Leu Ser Arg Leu Tyr Trp
180 185 190
Tyr Thr Val Glu Phe Gly Leu Ile Arg Thr Ala Gln Gly Leu Arg Ile
195 200 205
Tyr Gly Ala Gly Ile Leu Ser Ser Gln Gly Glu Ser Ile Tyr Ser Leu
210 215 220
Asp Ser Ala Ser Pro Asn Arg Ile Gly Phe Asp Val Arg Arg Ile Met
225 230 235 240
Arg Thr Arg Tyr Arg Ile Asp Thr Phe Gln Lys Thr Tyr Phe Val Ile
245 250 255
Asp Ser Phe Glu Gln Leu Phe Asp Ala Thr Arg Pro Asp Phe Ala Pro
260 265 270
Leu Tyr Glu Glu Leu Arg Ala Gln Pro Thr Leu Gly Ala Gly Asp Val
275 280 285
Ala Pro Gly Asp Gln Val Leu Asn Val Gly Thr Arg Glu Gly Trp Ala
290 295 300
Asp Thr Glu Asp Ile
305
<210> 6
<211> 490
<212> PRT
<213> 智人
<400> 6
Met Gln Pro Ala Met Met Met Phe Ser Ser Lys Tyr Trp Ala Arg Arg
1 5 10 15
Gly Phe Ser Leu Asp Ser Ala Val Pro Glu Glu His Gln Leu Leu Gly
20 25 30
Ser Ser Thr Leu Asn Lys Pro Asn Ser Gly Lys Asn Asp Asp Lys Gly
35 40 45
Asn Lys Gly Ser Ser Lys Arg Glu Ala Ala Thr Glu Ser Gly Lys Thr
50 55 60
Ala Val Val Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Val Lys Ala
65 70 75 80
Leu Arg Leu Phe Gln Glu Lys Arg Val Asn Met Val His Ile Glu Ser
85 90 95
Arg Lys Ser Arg Arg Arg Ser Ser Glu Val Glu Ile Phe Val Asp Cys
100 105 110
Glu Cys Gly Lys Thr Glu Phe Asn Glu Leu Ile Gln Leu Leu Lys Phe
115 120 125
Gln Thr Thr Ile Val Thr Leu Asn Pro Pro Glu Asn Ile Trp Thr Glu
130 135 140
Glu Glu Glu Leu Glu Asp Val Pro Trp Phe Pro Arg Lys Ile Ser Glu
145 150 155 160
Leu Asp Lys Cys Ser His Arg Val Leu Met Tyr Gly Ser Glu Leu Asp
165 170 175
Ala Asp His Pro Gly Phe Lys Asp Asn Val Tyr Arg Gln Arg Arg Lys
180 185 190
Tyr Phe Val Asp Val Ala Met Gly Tyr Lys Tyr Gly Gln Pro Ile Pro
195 200 205
Arg Val Glu Tyr Thr Glu Glu Glu Thr Lys Thr Trp Gly Val Val Phe
210 215 220
Arg Glu Leu Ser Lys Leu Tyr Pro Thr His Ala Cys Arg Glu Tyr Leu
225 230 235 240
Lys Asn Phe Pro Leu Leu Thr Lys Tyr Cys Gly Tyr Arg Glu Asp Asn
245 250 255
Val Pro Gln Leu Glu Asp Val Ser Met Phe Leu Lys Glu Arg Ser Gly
260 265 270
Phe Thr Val Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg Asp Phe Leu
275 280 285
Ala Gly Leu Ala Tyr Arg Val Phe His Cys Thr Gln Tyr Ile Arg His
290 295 300
Gly Ser Asp Pro Leu Tyr Thr Pro Glu Pro Asp Thr Cys His Glu Leu
305 310 315 320
Leu Gly His Val Pro Leu Leu Ala Asp Pro Lys Phe Ala Gln Phe Ser
325 330 335
Gln Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser Asp Glu Asp Val Gln
340 345 350
Lys Leu Ala Thr Cys Tyr Phe Phe Thr Ile Glu Phe Gly Leu Cys Lys
355 360 365
Gln Glu Gly Gln Leu Arg Ala Tyr Gly Ala Gly Leu Leu Ser Ser Ile
370 375 380
Gly Glu Leu Lys His Ala Leu Ser Asp Lys Ala Cys Val Lys Ala Phe
385 390 395 400
Asp Pro Lys Thr Thr Cys Leu Gln Glu Cys Leu Ile Thr Thr Phe Gln
405 410 415
Glu Ala Tyr Phe Val Ser Glu Ser Phe Glu Glu Ala Lys Glu Lys Met
420 425 430
Arg Asp Phe Ala Lys Ser Ile Thr Arg Pro Phe Ser Val Tyr Phe Asn
435 440 445
Pro Tyr Thr Gln Ser Ile Glu Ile Leu Lys Asp Thr Arg Ser Ile Glu
450 455 460
Asn Val Val Gln Asp Leu Arg Ser Asp Leu Asn Thr Val Cys Asp Ala
465 470 475 480
Leu Asn Lys Met Asn Gln Tyr Leu Gly Ile
485 490
<210> 7
<211> 488
<212> PRT
<213> 小家鼠
<400> 7
Met Gln Pro Ala Met Met Met Phe Ser Ser Lys Tyr Trp Ala Arg Arg
1 5 10 15
Gly Leu Ser Leu Asp Ser Ala Val Pro Glu Asp His Gln Leu Leu Gly
20 25 30
Ser Leu Thr Gln Asn Lys Ala Ile Lys Ser Glu Asp Lys Lys Ser Gly
35 40 45
Lys Glu Pro Gly Lys Gly Asp Thr Thr Glu Ser Ser Lys Thr Ala Val
50 55 60
Val Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Val Lys Ala Leu Arg
65 70 75 80
Leu Phe Gln Glu Lys His Val Asn Met Leu His Ile Glu Ser Arg Arg
85 90 95
Ser Arg Arg Arg Ser Ser Glu Val Glu Ile Phe Val Asp Cys Glu Cys
100 105 110
Gly Lys Thr Glu Phe Asn Glu Leu Ile Gln Leu Leu Lys Phe Gln Thr
115 120 125
Thr Ile Val Thr Leu Asn Pro Pro Glu Ser Ile Trp Thr Glu Glu Glu
130 135 140
Asp Leu Glu Asp Val Pro Trp Phe Pro Arg Lys Ile Ser Glu Leu Asp
145 150 155 160
Arg Cys Ser His Arg Val Leu Met Tyr Gly Thr Glu Leu Asp Ala Asp
165 170 175
His Pro Gly Phe Lys Asp Asn Val Tyr Arg Gln Arg Arg Lys Tyr Phe
180 185 190
Val Asp Val Ala Met Gly Tyr Lys Tyr Gly Gln Pro Ile Pro Arg Val
195 200 205
Glu Tyr Thr Glu Glu Glu Thr Lys Thr Trp Gly Val Val Phe Arg Glu
210 215 220
Leu Ser Lys Leu Tyr Pro Thr His Ala Cys Arg Glu Tyr Leu Lys Asn
225 230 235 240
Leu Pro Leu Leu Thr Lys Tyr Cys Gly Tyr Arg Glu Asp Asn Val Pro
245 250 255
Gln Leu Glu Asp Val Ser Met Phe Leu Lys Glu Arg Ser Gly Phe Thr
260 265 270
Val Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg Asp Phe Leu Ala Gly
275 280 285
Leu Ala Tyr Arg Val Phe His Cys Thr Gln Tyr Val Arg His Gly Ser
290 295 300
Asp Pro Leu Tyr Thr Pro Glu Pro Asp Thr Cys His Glu Leu Leu Gly
305 310 315 320
His Val Pro Leu Leu Ala Asp Pro Lys Phe Ala Gln Phe Ser Gln Glu
325 330 335
Ile Gly Leu Ala Ser Leu Gly Ala Ser Asp Glu Asp Val Gln Lys Leu
340 345 350
Ala Thr Cys Tyr Phe Phe Thr Ile Glu Phe Gly Leu Cys Lys Gln Glu
355 360 365
Gly Gln Leu Arg Ala Tyr Gly Ala Gly Leu Leu Ser Ser Ile Gly Glu
370 375 380
Leu Lys His Ala Leu Ser Asp Lys Ala Cys Val Lys Ser Phe Asp Pro
385 390 395 400
Lys Thr Thr Cys Leu Gln Glu Cys Leu Ile Thr Thr Phe Gln Asp Ala
405 410 415
Tyr Phe Val Ser Asp Ser Phe Glu Glu Ala Lys Glu Lys Met Arg Asp
420 425 430
Phe Ala Lys Ser Ile Thr Arg Pro Phe Ser Val Tyr Phe Asn Pro Tyr
435 440 445
Thr Gln Ser Ile Glu Ile Leu Lys Asp Thr Arg Ser Ile Glu Asn Val
450 455 460
Val Gln Asp Leu Arg Ser Asp Leu Asn Thr Val Cys Asp Ala Leu Asn
465 470 475 480
Lys Met Asn Gln Tyr Leu Gly Ile
485
<210> 8
<211> 489
<212> PRT
<213> 原鸡
<400> 8
Met Gln Pro Ala Met Met Met Phe Ser Ser Lys Tyr Trp Ala Arg Arg
1 5 10 15
Gly Phe Ser Leu Asp Ser Ala Leu Pro Glu Glu Arg Pro Gly Gly Leu
20 25 30
Thr Ile Asn Arg Ser Ser Ser Gly Lys Asn Glu Asp Lys Lys Gly Asn
35 40 45
Lys Gly Asn Gly Lys Gly Glu Ser Val Ser Glu Gly Gly Lys Thr Ala
50 55 60
Val Val Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Val Lys Ala Leu
65 70 75 80
Arg Leu Phe Gln Glu Lys His Val Ser Met Val His Ile Glu Ser Arg
85 90 95
Lys Ser Lys Arg Arg Asn Ser Glu Val Glu Ile Phe Val Asp Cys Asp
100 105 110
Cys Ser Lys Lys Glu Phe Asn Glu Leu Ile Gln Leu Leu Lys Phe Gln
115 120 125
Thr Asn Ile Val Ser Leu Asn Pro Pro Glu Asn Ile Trp Thr Asp Glu
130 135 140
Glu Asp Leu Asp Cys Val Pro Trp Phe Pro Arg Lys Ile Ser Glu Leu
145 150 155 160
Asp Lys Cys Ser Gln Arg Val Leu Met Tyr Gly Ser Glu Leu Asp Ala
165 170 175
Asp His Pro Gly Phe Lys Asp Asn Val Tyr Arg Gln Arg Arg Lys Tyr
180 185 190
Phe Val Asp Val Ala Met Ser Tyr Lys Tyr Gly Gln Pro Ile Pro Arg
195 200 205
Val Glu Tyr Thr Ala Glu Glu Ile Lys Thr Trp Gly Val Val Phe Arg
210 215 220
Glu Leu Ser Lys Leu Tyr Pro Thr His Ala Cys Arg Glu Tyr Leu Lys
225 230 235 240
Asn Phe Pro Leu Leu Thr Lys Tyr Cys Gly Tyr Arg Glu Asp Asn Val
245 250 255
Pro Gln Leu Glu Asp Val Ser Ile Phe Leu Lys Glu Arg Ser Gly Phe
260 265 270
Thr Val Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg Asp Phe Leu Ala
275 280 285
Gly Leu Ala Tyr Arg Val Phe His Cys Thr Gln Tyr Val Arg His Gly
290 295 300
Ser Asp Pro Leu Tyr Thr Pro Glu Pro Asp Thr Cys His Glu Leu Leu
305 310 315 320
Gly His Val Pro Leu Leu Ala Asp Pro Lys Phe Ala Gln Phe Ser Gln
325 330 335
Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser Asp Glu Asp Val Gln Lys
340 345 350
Leu Ala Thr Cys Tyr Phe Phe Thr Ile Glu Phe Gly Leu Cys Lys Gln
355 360 365
Glu Gly Gln Leu Arg Ala Tyr Gly Ala Gly Leu Leu Ser Ser Ile Gly
370 375 380
Glu Leu Lys His Ala Leu Ser Asp Lys Ala Lys Val Lys Thr Phe Asp
385 390 395 400
Pro Lys Thr Thr Cys Leu Gln Glu Cys Leu Ile Thr Thr Phe Gln Glu
405 410 415
Ala Tyr Phe Val Ser Glu Ser Phe Glu Glu Ala Lys Glu Lys Met Arg
420 425 430
Asp Phe Ala Lys Ser Ile Asn Arg Pro Phe Ser Val Tyr Phe Asn Pro
435 440 445
Tyr Thr Gln Ser Ile Glu Ile Leu Lys Asp Thr Arg Ser Ile Glu Asn
450 455 460
Val Val Gln Asp Leu Arg Ser Asp Leu Asn Thr Val Cys Asp Ala Leu
465 470 475 480
Ser Lys Met Asn Arg Tyr Leu Gly Ile
485
<210> 9
<211> 444
<212> PRT
<213> 家牛
<400> 9
Met Ile Glu Asp Asn Lys Glu Asn Lys Asp His Ser Phe Glu Arg Gly
1 5 10 15
Arg Ala Thr Leu Ile Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Ile
20 25 30
Lys Ala Leu Lys Ile Phe Gln Glu Lys His Val Asn Leu Leu His Ile
35 40 45
Glu Ser Arg Lys Ser Lys Arg Arg Ser Ser Glu Phe Glu Ile Phe Val
50 55 60
Asp Cys Asp Ile Ser Arg Glu Gln Leu Asn Asp Ile Phe His Leu Leu
65 70 75 80
Lys Ser His Ser Asn Ile Leu Ser Val Asn Leu Pro Asp Asn Phe Thr
85 90 95
Val Lys Glu Asp Gly Met Glu Thr Val Pro Trp Phe Pro Lys Lys Ile
100 105 110
Ser Asp Leu Asp His Cys Ala Asn Arg Val Leu Met Tyr Gly Ser Glu
115 120 125
Leu Asp Ala Asp His Pro Gly Phe Lys Asp Asn Val Tyr Arg Lys Arg
130 135 140
Arg Lys Tyr Phe Ala Asp Leu Ala Met Asn Tyr Lys His Gly Asp Pro
145 150 155 160
Ile Pro Arg Val Glu Phe Thr Glu Glu Glu Ile Arg Thr Trp Gly Thr
165 170 175
Val Phe Arg Glu Leu Asn Lys Leu Tyr Pro Thr His Ala Cys Arg Glu
180 185 190
Tyr Leu Lys Asn Leu Pro Leu Leu Ser Lys Tyr Cys Gly Tyr Arg Glu
195 200 205
Asp Asn Ile Pro Gln Leu Glu Asp Val Ser Asn Phe Leu Lys Glu Arg
210 215 220
Thr Gly Phe Ser Ile Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg Asp
225 230 235 240
Phe Leu Ser Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Val
245 250 255
Arg His Ser Ser Asp Pro Leu Tyr Thr Pro Glu Pro Asp Thr Cys His
260 265 270
Glu Leu Leu Gly His Val Pro Leu Leu Ala Glu Pro Ser Phe Ala Gln
275 280 285
Phe Ser Gln Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser Glu Glu Ala
290 295 300
Val Gln Lys Leu Ala Thr Cys Tyr Phe Phe Thr Val Glu Phe Gly Leu
305 310 315 320
Cys Lys Gln Glu Gly Gln Leu Arg Val Phe Gly Ala Gly Leu Leu Ser
325 330 335
Ser Ile Ser Glu Leu Lys His Ala Leu Ser Gly His Ala Lys Val Lys
340 345 350
Pro Phe Asp Pro Lys Ile Thr Cys Lys Gln Glu Cys Leu Ile Thr Thr
355 360 365
Phe Gln Asp Val Tyr Phe Val Ser Glu Ser Phe Glu Asp Ala Lys Glu
370 375 380
Lys Met Arg Glu Phe Thr Lys Thr Ile Lys Arg Pro Phe Gly Val Lys
385 390 395 400
Tyr Asn Pro Tyr Thr Arg Ser Ile Gln Ile Leu Lys Asp Thr Arg Ser
405 410 415
Ile Thr Ser Ala Met Asn Glu Leu Gln His Glu Leu Asp Val Val Ser
420 425 430
Asp Ala Leu Ala Lys Val Ser Arg Gln Leu Ser Ile
435 440
<210> 10
<211> 444
<212> PRT
<213> 智人
<400> 10
Met Ile Glu Asp Asn Lys Glu Asn Lys Asp His Ser Leu Glu Arg Gly
1 5 10 15
Arg Ala Ser Leu Ile Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Ile
20 25 30
Lys Ala Leu Lys Ile Phe Gln Glu Lys His Val Asn Leu Leu His Ile
35 40 45
Glu Ser Arg Lys Ser Lys Arg Arg Asn Ser Glu Phe Glu Ile Phe Val
50 55 60
Asp Cys Asp Ile Asn Arg Glu Gln Leu Asn Asp Ile Phe His Leu Leu
65 70 75 80
Lys Ser His Thr Asn Val Leu Ser Val Asn Leu Pro Asp Asn Phe Thr
85 90 95
Leu Lys Glu Asp Gly Met Glu Thr Val Pro Trp Phe Pro Lys Lys Ile
100 105 110
Ser Asp Leu Asp His Cys Ala Asn Arg Val Leu Met Tyr Gly Ser Glu
115 120 125
Leu Asp Ala Asp His Pro Gly Phe Lys Asp Asn Val Tyr Arg Lys Arg
130 135 140
Arg Lys Tyr Phe Ala Asp Leu Ala Met Asn Tyr Lys His Gly Asp Pro
145 150 155 160
Ile Pro Lys Val Glu Phe Thr Glu Glu Glu Ile Lys Thr Trp Gly Thr
165 170 175
Val Phe Gln Glu Leu Asn Lys Leu Tyr Pro Thr His Ala Cys Arg Glu
180 185 190
Tyr Leu Lys Asn Leu Pro Leu Leu Ser Lys Tyr Cys Gly Tyr Arg Glu
195 200 205
Asp Asn Ile Pro Gln Leu Glu Asp Val Ser Asn Phe Leu Lys Glu Arg
210 215 220
Thr Gly Phe Ser Ile Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg Asp
225 230 235 240
Phe Leu Ser Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Val
245 250 255
Arg His Ser Ser Asp Pro Phe Tyr Thr Pro Glu Pro Asp Thr Cys His
260 265 270
Glu Leu Leu Gly His Val Pro Leu Leu Ala Glu Pro Ser Phe Ala Gln
275 280 285
Phe Ser Gln Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser Glu Glu Ala
290 295 300
Val Gln Lys Leu Ala Thr Cys Tyr Phe Phe Thr Val Glu Phe Gly Leu
305 310 315 320
Cys Lys Gln Asp Gly Gln Leu Arg Val Phe Gly Ala Gly Leu Leu Ser
325 330 335
Ser Ile Ser Glu Leu Lys His Ala Leu Ser Gly His Ala Lys Val Lys
340 345 350
Pro Phe Asp Pro Lys Ile Thr Cys Lys Gln Glu Cys Leu Ile Thr Thr
355 360 365
Phe Gln Asp Val Tyr Phe Val Ser Glu Ser Phe Glu Asp Ala Lys Glu
370 375 380
Lys Met Arg Glu Phe Thr Lys Thr Ile Lys Arg Pro Phe Gly Val Lys
385 390 395 400
Tyr Asn Pro Tyr Thr Arg Ser Ile Gln Ile Leu Lys Asp Thr Lys Ser
405 410 415
Ile Thr Ser Ala Met Asn Glu Leu Gln His Asp Leu Asp Val Val Ser
420 425 430
Asp Ala Leu Ala Lys Val Ser Arg Lys Pro Ser Ile
435 440
<210> 11
<211> 447
<212> PRT
<213> 小家鼠
<400> 11
Met Ile Glu Asp Asn Lys Glu Asn Lys Glu Asn Lys Asp His Ser Ser
1 5 10 15
Glu Arg Gly Arg Val Thr Leu Ile Phe Ser Leu Glu Asn Glu Val Gly
20 25 30
Gly Leu Ile Lys Val Leu Lys Ile Phe Gln Glu Asn His Val Ser Leu
35 40 45
Leu His Ile Glu Ser Arg Lys Ser Lys Gln Arg Asn Ser Glu Phe Glu
50 55 60
Ile Phe Val Asp Cys Asp Ile Ser Arg Glu Gln Leu Asn Asp Ile Phe
65 70 75 80
Pro Leu Leu Lys Ser His Ala Thr Val Leu Ser Val Asp Ser Pro Asp
85 90 95
Gln Leu Thr Ala Lys Glu Asp Val Met Glu Thr Val Pro Trp Phe Pro
100 105 110
Lys Lys Ile Ser Asp Leu Asp Phe Cys Ala Asn Arg Val Leu Leu Tyr
115 120 125
Gly Ser Glu Leu Asp Ala Asp His Pro Gly Phe Lys Asp Asn Val Tyr
130 135 140
Arg Arg Arg Arg Lys Tyr Phe Ala Glu Leu Ala Met Asn Tyr Lys His
145 150 155 160
Gly Asp Pro Ile Pro Lys Ile Glu Phe Thr Glu Glu Glu Ile Lys Thr
165 170 175
Trp Gly Thr Ile Phe Arg Glu Leu Asn Lys Leu Tyr Pro Thr His Ala
180 185 190
Cys Arg Glu Tyr Leu Arg Asn Leu Pro Leu Leu Ser Lys Tyr Cys Gly
195 200 205
Tyr Arg Glu Asp Asn Ile Pro Gln Leu Glu Asp Val Ser Asn Phe Leu
210 215 220
Lys Glu Arg Thr Gly Phe Ser Ile Arg Pro Val Ala Gly Tyr Leu Ser
225 230 235 240
Pro Arg Asp Phe Leu Ser Gly Leu Ala Phe Arg Val Phe His Cys Thr
245 250 255
Gln Tyr Val Arg His Ser Ser Asp Pro Leu Tyr Thr Pro Glu Pro Asp
260 265 270
Thr Cys His Glu Leu Leu Gly His Val Pro Leu Leu Ala Glu Pro Ser
275 280 285
Phe Ala Gln Phe Ser Gln Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser
290 295 300
Glu Glu Thr Val Gln Lys Leu Ala Thr Cys Tyr Phe Phe Thr Val Glu
305 310 315 320
Phe Gly Leu Cys Lys Gln Asp Gly Gln Leu Arg Val Phe Gly Ala Gly
325 330 335
Leu Leu Ser Ser Ile Ser Glu Leu Lys His Ala Leu Ser Gly His Ala
340 345 350
Lys Val Lys Pro Phe Asp Pro Lys Ile Ala Cys Lys Gln Glu Cys Leu
355 360 365
Ile Thr Ser Phe Gln Asp Val Tyr Phe Val Ser Glu Ser Phe Glu Asp
370 375 380
Ala Lys Glu Lys Met Arg Glu Phe Ala Lys Thr Val Lys Arg Pro Phe
385 390 395 400
Gly Leu Lys Tyr Asn Pro Tyr Thr Gln Ser Val Gln Val Leu Arg Asp
405 410 415
Thr Lys Ser Ile Thr Ser Ala Met Asn Glu Leu Arg Tyr Asp Leu Asp
420 425 430
Val Ile Ser Asp Ala Leu Ala Arg Val Thr Arg Trp Pro Ser Val
435 440 445
<210> 12
<211> 445
<212> PRT
<213> 原鸡
<400> 12
Met Ile Glu Asp Asn Lys Glu Asn Lys Asp His Ala Pro Glu Arg Gly
1 5 10 15
Arg Thr Ala Ile Ile Phe Ser Leu Lys Asn Glu Val Gly Gly Leu Val
20 25 30
Lys Ala Leu Lys Leu Phe Gln Glu Lys His Val Asn Leu Val His Ile
35 40 45
Glu Ser Arg Lys Ser Lys Arg Arg Asn Ser Glu Phe Glu Ile Phe Val
50 55 60
Asp Cys Asp Ser Asn Arg Glu Gln Leu Asn Glu Ile Phe Gln Leu Leu
65 70 75 80
Lys Ser His Val Ser Ile Val Ser Met Asn Pro Thr Glu His Phe Asn
85 90 95
Val Gln Glu Asp Gly Asp Met Glu Asn Ile Pro Trp Tyr Pro Lys Lys
100 105 110
Ile Ser Asp Leu Asp Lys Cys Ala Asn Arg Val Leu Met Tyr Gly Ser
115 120 125
Asp Leu Asp Ala Asp His Pro Gly Phe Lys Asp Asn Val Tyr Arg Lys
130 135 140
Arg Arg Lys Tyr Phe Ala Asp Leu Ala Met Asn Tyr Lys His Gly Asp
145 150 155 160
Pro Ile Pro Glu Ile Glu Phe Thr Glu Glu Glu Ile Lys Thr Trp Gly
165 170 175
Thr Val Tyr Arg Glu Leu Asn Lys Leu Tyr Pro Thr His Ala Cys Arg
180 185 190
Glu Tyr Leu Lys Asn Leu Pro Leu Leu Thr Lys Tyr Cys Gly Tyr Arg
195 200 205
Glu Asp Asn Ile Pro Gln Leu Glu Asp Val Ser Arg Phe Leu Lys Glu
210 215 220
Arg Thr Gly Phe Thr Ile Arg Pro Val Ala Gly Tyr Leu Ser Pro Arg
225 230 235 240
Asp Phe Leu Ala Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr
245 250 255
Val Arg His Ser Ser Asp Pro Leu Tyr Thr Pro Glu Pro Asp Thr Cys
260 265 270
His Glu Leu Leu Gly His Val Pro Leu Leu Ala Glu Pro Ser Phe Ala
275 280 285
Gln Phe Ser Gln Glu Ile Gly Leu Ala Ser Leu Gly Ala Ser Asp Glu
290 295 300
Ala Val Gln Lys Leu Ala Thr Cys Tyr Phe Phe Thr Val Glu Phe Gly
305 310 315 320
Leu Cys Lys Gln Glu Gly Gln Leu Arg Val Tyr Gly Ala Gly Leu Leu
325 330 335
Ser Ser Ile Ser Glu Leu Lys His Ser Leu Ser Gly Ser Ala Lys Val
340 345 350
Lys Pro Phe Asp Pro Lys Val Thr Cys Lys Gln Glu Cys Leu Ile Thr
355 360 365
Thr Phe Gln Glu Val Tyr Phe Val Ser Glu Ser Phe Glu Glu Ala Lys
370 375 380
Glu Lys Met Arg Glu Phe Ala Lys Thr Ile Lys Arg Pro Phe Gly Val
385 390 395 400
Lys Tyr Asn Pro Tyr Thr Gln Ser Val Gln Ile Leu Lys Asp Thr Lys
405 410 415
Ser Ile Ala Ser Val Val Asn Glu Leu Arg His Glu Leu Asp Ile Val
420 425 430
Ser Asp Ala Leu Ser Lys Met Gly Lys Gln Leu Glu Val
435 440 445
<210> 13
<211> 452
<212> PRT
<213> 智人
<400> 13
Met Ser Thr Ala Val Leu Glu Asn Pro Gly Leu Gly Arg Lys Leu Ser
1 5 10 15
Asp Phe Gly Gln Glu Thr Ser Tyr Ile Glu Asp Asn Cys Asn Gln Asn
20 25 30
Gly Ala Ile Ser Leu Ile Phe Ser Leu Lys Glu Glu Val Gly Ala Leu
35 40 45
Ala Lys Val Leu Arg Leu Phe Glu Glu Asn Asp Val Asn Leu Thr His
50 55 60
Ile Glu Ser Arg Pro Ser Arg Leu Lys Lys Asp Glu Tyr Glu Phe Phe
65 70 75 80
Thr His Leu Asp Lys Arg Ser Leu Pro Ala Leu Thr Asn Ile Ile Lys
85 90 95
Ile Leu Arg His Asp Ile Gly Ala Thr Val His Glu Leu Ser Arg Asp
100 105 110
Lys Lys Lys Asp Thr Val Pro Trp Phe Pro Arg Thr Ile Gln Glu Leu
115 120 125
Asp Arg Phe Ala Asn Gln Ile Leu Ser Tyr Gly Ala Glu Leu Asp Ala
130 135 140
Asp His Pro Gly Phe Lys Asp Pro Val Tyr Arg Ala Arg Arg Lys Gln
145 150 155 160
Phe Ala Asp Ile Ala Tyr Asn Tyr Arg His Gly Gln Pro Ile Pro Arg
165 170 175
Val Glu Tyr Met Glu Glu Glu Lys Lys Thr Trp Gly Thr Val Phe Lys
180 185 190
Thr Leu Lys Ser Leu Tyr Lys Thr His Ala Cys Tyr Glu Tyr Asn His
195 200 205
Ile Phe Pro Leu Leu Glu Lys Tyr Cys Gly Phe His Glu Asp Asn Ile
210 215 220
Pro Gln Leu Glu Asp Val Ser Gln Phe Leu Gln Thr Cys Thr Gly Phe
225 230 235 240
Arg Leu Arg Pro Val Ala Gly Leu Leu Ser Ser Arg Asp Phe Leu Gly
245 250 255
Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Ile Arg His Gly
260 265 270
Ser Lys Pro Met Tyr Thr Pro Glu Pro Asp Ile Cys His Glu Leu Leu
275 280 285
Gly His Val Pro Leu Phe Ser Asp Arg Ser Phe Ala Gln Phe Ser Gln
290 295 300
Glu Ile Gly Leu Ala Ser Leu Gly Ala Pro Asp Glu Tyr Ile Glu Lys
305 310 315 320
Leu Ala Thr Ile Tyr Trp Phe Thr Val Glu Phe Gly Leu Cys Lys Gln
325 330 335
Gly Asp Ser Ile Lys Ala Tyr Gly Ala Gly Leu Leu Ser Ser Phe Gly
340 345 350
Glu Leu Gln Tyr Cys Leu Ser Glu Lys Pro Lys Leu Leu Pro Leu Glu
355 360 365
Leu Glu Lys Thr Ala Ile Gln Asn Tyr Thr Val Thr Glu Phe Gln Pro
370 375 380
Leu Tyr Tyr Val Ala Glu Ser Phe Asn Asp Ala Lys Glu Lys Val Arg
385 390 395 400
Asn Phe Ala Ala Thr Ile Pro Arg Pro Phe Ser Val Arg Tyr Asp Pro
405 410 415
Tyr Thr Gln Arg Ile Glu Val Leu Asp Asn Thr Gln Gln Leu Lys Ile
420 425 430
Leu Ala Asp Ser Ile Asn Ser Glu Ile Gly Ile Leu Cys Ser Ala Leu
435 440 445
Gln Lys Ile Lys
450
<210> 14
<211> 466
<212> PRT
<213> 家兔
<400> 14
Met Ser Ala Val Val Leu Glu Asn Gly Gly Leu Ser Arg Lys Phe Ser
1 5 10 15
Asp Phe Gly Gln Glu Thr Ser Tyr Ile Glu Asp Asn Ser Asn Glu Asn
20 25 30
Ser Ala Ile Ser Leu Ile Phe Ser Leu Lys Glu Glu Val Gly Ala Leu
35 40 45
Ala Lys Val Leu Arg Leu Phe Glu Glu Asn Asp Ile Asn Leu Thr His
50 55 60
Ile Glu Ser Arg Pro Ser Arg Leu Lys Lys Asp Glu Tyr Glu Phe Phe
65 70 75 80
Thr Tyr Leu Asp Lys Arg Ser Met Pro Ala Leu Glu Asp Ile Ile Gln
85 90 95
Ile Leu Arg His Asp Ile Gly Ala Thr Val His Glu Leu Ser Arg Asp
100 105 110
Lys Lys Lys Asp Thr Val Pro Trp Phe Pro Arg Thr Ile Gln Glu Leu
115 120 125
Asp Arg Phe Ala Asn Gln Ile Leu Ser Tyr Gly Ala Glu Leu Asp Ala
130 135 140
Asp His Pro Gly Phe Lys Asp Pro Val Tyr Arg Ala Arg Arg Lys Gln
145 150 155 160
Phe Ala Asp Ile Ala Tyr Asn Tyr Arg His Gly Gln Pro Ile Pro Arg
165 170 175
Val Glu Tyr Thr Glu Glu Glu Lys Lys Thr Trp Gly Thr Val Phe Lys
180 185 190
Thr Leu Lys Ser Leu Tyr Lys Thr His Ala Cys Tyr Glu Tyr Asn His
195 200 205
Ile Phe Pro Leu Leu Glu Lys Tyr Cys Gly Phe Arg Glu Asp Asn Ile
210 215 220
Pro Gln Leu Glu Asp Val Ser Gln Phe Leu Gln Thr Cys Thr Gly Phe
225 230 235 240
Arg Leu Arg Pro Val Ala Gly Leu Leu Ser Ser Arg Asp Phe Leu Gly
245 250 255
Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Ile Arg His Gly
260 265 270
Ser Lys Pro Met Phe Thr Pro Glu Pro Asp Ile Cys His Glu Leu Leu
275 280 285
Gly His Val Pro Leu Phe Ser Asp Arg Ser Phe Ala Gln Phe Ser Gln
290 295 300
Glu Ile Gly Leu Ala Ser Leu Gly Ala Pro Asp Glu Tyr Ile Glu Lys
305 310 315 320
Leu Ala Thr Ile Tyr Trp Phe Thr Val Glu Phe Gly Leu Cys Lys Gln
325 330 335
Gly Asp Ser Ile Lys Ala Tyr Gly Ala Gly Leu Leu Ser Ser Phe Gly
340 345 350
Glu Leu Gln Tyr Cys Leu Ser Gly Lys Pro Lys Leu Leu Pro Leu Glu
355 360 365
Leu Glu Lys Thr Ala Ile Gln Glu Tyr Pro Val Thr Glu Phe Gln Pro
370 375 380
Leu Tyr Tyr Val Ala Glu Ser Phe Met Asp Ala Lys Glu Lys Val Arg
385 390 395 400
Asn Phe Ala Ala Thr Ile Pro Arg Pro Phe Ser Val Arg Tyr Asp Pro
405 410 415
Tyr Thr Gln Arg Ile Glu Ile Leu Asp Asn Thr Gln Gln Leu Lys Ile
420 425 430
Leu Ala Asp Ser Ile Asn Ser Glu Val Gly Ile Leu Cys Asn Ala Leu
435 440 445
Gln Lys Asn Lys Ser Glu Ala Ile Tyr Arg Ile Gly Leu Ser Thr Asp
450 455 460
His Cys
465
<210> 15
<211> 453
<212> PRT
<213> 小家鼠
<400> 15
Met Ala Ala Val Val Leu Glu Asn Gly Val Leu Ser Arg Lys Leu Ser
1 5 10 15
Asp Phe Gly Gln Glu Thr Ser Tyr Ile Glu Asp Asn Ser Asn Gln Asn
20 25 30
Gly Ala Val Ser Leu Ile Phe Ser Leu Lys Glu Glu Val Gly Ala Leu
35 40 45
Ala Lys Val Leu Arg Leu Phe Glu Glu Asn Glu Ile Asn Leu Thr His
50 55 60
Ile Glu Ser Arg Pro Ser Arg Leu Asn Lys Asp Glu Tyr Glu Phe Phe
65 70 75 80
Thr Tyr Leu Asp Lys Arg Ser Lys Pro Val Leu Gly Ser Ile Ile Lys
85 90 95
Ser Leu Arg Asn Asp Ile Gly Ala Thr Val His Glu Leu Ser Arg Asp
100 105 110
Lys Glu Lys Asn Thr Val Pro Trp Phe Pro Arg Thr Ile Gln Glu Leu
115 120 125
Asp Arg Phe Ala Asn Gln Ile Leu Ser Tyr Gly Ala Glu Leu Asp Ala
130 135 140
Asp His Pro Gly Phe Lys Asp Pro Val Tyr Arg Ala Arg Arg Lys Gln
145 150 155 160
Phe Ala Asp Ile Ala Tyr Asn Tyr Arg His Gly Gln Pro Ile Pro Arg
165 170 175
Val Glu Tyr Thr Glu Glu Glu Arg Lys Thr Trp Gly Thr Val Phe Arg
180 185 190
Thr Leu Lys Ala Leu Tyr Lys Thr His Ala Cys Tyr Glu His Asn His
195 200 205
Ile Phe Pro Leu Leu Glu Lys Tyr Cys Gly Phe Arg Glu Asp Asn Ile
210 215 220
Pro Gln Leu Glu Asp Val Ser Gln Phe Leu Gln Thr Cys Thr Gly Phe
225 230 235 240
Arg Leu Arg Pro Val Ala Gly Leu Leu Ser Ser Arg Asp Phe Leu Gly
245 250 255
Gly Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Ile Arg His Gly
260 265 270
Ser Lys Pro Met Tyr Thr Pro Glu Pro Asp Ile Cys His Glu Leu Leu
275 280 285
Gly His Val Pro Leu Phe Ser Asp Arg Ser Phe Ala Gln Phe Ser Gln
290 295 300
Glu Ile Gly Leu Ala Ser Leu Gly Ala Pro Asp Glu Tyr Ile Glu Lys
305 310 315 320
Leu Ala Thr Ile Tyr Trp Phe Thr Val Glu Phe Gly Leu Cys Lys Glu
325 330 335
Gly Asp Ser Ile Lys Ala Tyr Gly Ala Gly Leu Leu Ser Ser Phe Gly
340 345 350
Glu Leu Gln Tyr Cys Leu Ser Asp Lys Pro Lys Leu Leu Pro Leu Glu
355 360 365
Leu Glu Lys Thr Ala Cys Gln Glu Tyr Thr Val Thr Glu Phe Gln Pro
370 375 380
Leu Tyr Tyr Val Ala Glu Ser Phe Asn Asp Ala Lys Glu Lys Val Arg
385 390 395 400
Thr Phe Ala Ala Thr Ile Pro Arg Pro Phe Ser Val Arg Tyr Asp Pro
405 410 415
Tyr Thr Gln Arg Val Glu Val Leu Asp Asn Thr Gln Gln Leu Lys Ile
420 425 430
Leu Ala Asp Ser Ile Asn Ser Glu Val Gly Ile Leu Cys His Ala Leu
435 440 445
Gln Lys Ile Lys Ser
450
<210> 16
<211> 451
<212> PRT
<213> 家牛
<400> 16
Met Ser Ala Leu Val Leu Glu Ser Arg Ala Leu Gly Arg Lys Leu Ser
1 5 10 15
Asp Phe Gly Gln Glu Thr Ser Tyr Ile Glu Gly Asn Ser Asp Gln Asn
20 25 30
Ala Val Ser Leu Ile Phe Ser Leu Lys Glu Glu Val Gly Ala Leu Ala
35 40 45
Arg Val Leu Arg Leu Phe Glu Glu Asn Asp Ile Asn Leu Thr His Ile
50 55 60
Glu Ser Arg Pro Ser Arg Leu Arg Lys Asp Glu Tyr Glu Phe Phe Thr
65 70 75 80
Asn Leu Asp Gln Arg Ser Val Pro Ala Leu Ala Asn Ile Ile Lys Ile
85 90 95
Leu Arg His Asp Ile Gly Ala Thr Val His Glu Leu Ser Arg Asp Lys
100 105 110
Lys Lys Asp Thr Val Pro Trp Phe Pro Arg Thr Ile Gln Glu Leu Asp
115 120 125
Asn Phe Ala Asn Gln Val Leu Ser Tyr Gly Ala Glu Leu Asp Ala Asp
130 135 140
His Pro Gly Phe Lys Asp Pro Val Tyr Arg Ala Arg Arg Lys Gln Phe
145 150 155 160
Ala Asp Ile Ala Tyr Asn Tyr Arg His Gly Gln Pro Ile Pro Arg Val
165 170 175
Glu Tyr Thr Glu Glu Glu Lys Lys Thr Trp Gly Thr Val Phe Arg Thr
180 185 190
Leu Lys Ser Leu Tyr Lys Thr His Ala Cys Tyr Glu His Asn His Ile
195 200 205
Phe Pro Leu Leu Glu Lys Tyr Cys Gly Phe Arg Glu Asp Asn Ile Pro
210 215 220
Gln Leu Glu Glu Val Ser Gln Phe Leu Gln Ser Cys Thr Gly Phe Arg
225 230 235 240
Leu Arg Pro Val Ala Gly Leu Leu Ser Ser Arg Asp Phe Leu Gly Gly
245 250 255
Leu Ala Phe Arg Val Phe His Cys Thr Gln Tyr Ile Arg His Gly Ser
260 265 270
Lys Pro Met Tyr Thr Pro Glu Pro Asp Ile Cys His Glu Leu Leu Gly
275 280 285
His Val Pro Leu Phe Ser Asp Arg Ser Phe Ala Gln Phe Ser Gln Glu
290 295 300
Ile Gly Leu Ala Ser Leu Gly Ala Pro Asp Glu Tyr Ile Glu Lys Leu
305 310 315 320
Ala Thr Ile Tyr Trp Phe Thr Val Glu Phe Gly Leu Cys Lys Gln Gly
325 330 335
Asp Ser Ile Lys Ala Tyr Gly Ala Gly Leu Leu Ser Ser Phe Gly Glu
340 345 350
Leu Gln Tyr Cys Leu Ser Asp Lys Pro Lys Leu Leu Pro Leu Glu Leu
355 360 365
Glu Lys Thr Ala Val Gln Glu Tyr Thr Ile Thr Glu Phe Gln Pro Leu
370 375 380
Tyr Tyr Val Ala Glu Ser Phe Asn Asp Ala Lys Glu Lys Val Arg Asn
385 390 395 400
Phe Ala Ala Thr Ile Pro Arg Pro Phe Ser Val His Tyr Asp Pro Tyr
405 410 415
Thr Gln Arg Ile Glu Val Leu Asp Asn Thr Gln Gln Leu Lys Ile Leu
420 425 430
Ala Asp Ser Ile Ser Ser Glu Val Glu Ile Leu Cys Ser Ala Leu Gln
435 440 445
Lys Leu Lys
450
<210> 17
<211> 446
<212> PRT
<213> 原鸡
<400> 17
Met Asp Ala Gln His Cys Lys Met Asn Gly Asp Ser Phe Gln Glu Ser
1 5 10 15
Thr Tyr Thr Glu Glu Pro Ser Asn Lys Asn Gly Val Ile Ser Leu Ile
20 25 30
Phe Ser Leu Lys Glu Glu Val Gly Ala Leu Ala Lys Val Leu Arg Thr
35 40 45
Phe Glu Glu Lys Gly Ile Asn Leu Thr His Ile Glu Ser Arg Pro Ser
50 55 60
Arg Leu Asn Lys Asp Glu Tyr Glu Phe Phe Ile Asn Leu Glu Gly Lys
65 70 75 80
Asn Val Pro Ala Leu Asp Lys Ile Ile Lys Ser Leu Arg Asn Asp Ile
85 90 95
Gly Val Thr Val His Glu Leu Ser Arg Thr Lys Lys Lys Asp Thr Val
100 105 110
Pro Trp Phe Pro Arg Ser Ile Gln Glu Leu Asp Arg Phe Ala Asn Gln
115 120 125
Ile Leu Ser Tyr Gly Ala Glu Leu Asp Ala Asp His Pro Gly Phe Lys
130 135 140
Asp Pro Val Tyr Arg Ala Arg Arg Lys Glu Phe Ala Asp Ile Ala Tyr
145 150 155 160
Asn Tyr Arg His Gly Gln Pro Ile Pro Arg Val Thr Tyr Thr Glu Glu
165 170 175
Glu Lys Lys Thr Trp Gly Thr Val Phe Arg Glu Leu Lys Asn Leu Tyr
180 185 190
Pro Thr His Ala Cys Tyr Glu His Asn His Val Phe Pro Leu Leu Glu
195 200 205
Lys Tyr Cys Gly Tyr Arg Glu Asp Asn Ile Pro Gln Leu Glu Asp Val
210 215 220
Ser Lys Phe Leu Gln Thr Cys Thr Gly Phe Arg Leu Arg Pro Val Ala
225 230 235 240
Gly Leu Leu Ser Ser Arg Asp Phe Leu Ala Gly Leu Ala Phe Arg Val
245 250 255
Phe His Ser Thr Gln Tyr Ile Arg His Ala Ser Lys Pro Met Tyr Thr
260 265 270
Pro Glu Pro Asp Ile Cys His Glu Leu Leu Gly His Val Pro Leu Phe
275 280 285
Ala Asp Pro Ser Phe Ala Gln Phe Ser Gln Glu Ile Gly Leu Ala Ser
290 295 300
Leu Gly Ala Pro Asp Asp Phe Ile Glu Lys Leu Ala Thr Val Tyr Trp
305 310 315 320
Phe Thr Val Glu Phe Gly Leu Cys Lys Glu Gly Asp Ser Leu Lys Ala
325 330 335
Tyr Gly Ala Gly Leu Leu Ser Ser Phe Gly Glu Leu Gln Tyr Cys Leu
340 345 350
Ser Gly Lys Pro Glu Ile Arg Pro Leu Val Leu Glu Asn Thr Ser Val
355 360 365
Gln Lys Tyr Ser Val Thr Glu Phe Gln Pro Thr Tyr Phe Val Ala Glu
370 375 380
Ser Phe Asn Asp Ala Lys Glu Lys Leu Arg Lys Phe Ala Gln Thr Ile
385 390 395 400
Pro Arg Pro Phe Ser Val Arg Tyr Asn Pro Tyr Thr Gln Arg Ile Glu
405 410 415
Val Leu Asp Asn Ala Lys Gln Leu Lys Asn Leu Ala Asp Thr Ile Asn
420 425 430
Ser Glu Met Gly Ile Leu Cys Asn Ala Leu Gln Lys Ile Lys
435 440 445
- 还没有人留言评论。精彩留言会获得点赞!