培养藻类的方法与流程
发明领域
本说明书涉及从藻类生产脂质的领域。其提供可用于生产具有高脂质含量和低叶绿素含量的藻类和藻类生物质的新方法。通过本发明方法生产的藻类生物质对培养用于生物燃料生产或其它精炼产品的藻类特别有用。
背景
在我们的全世界经济中藻类被看作是最有前途的生物质和生物燃料原材料生产者之一。据估计藻类油的区域生产潜能在世界上最佳的那些之中:现实估计显示藻类油可以以20-30t/ha/年产量大规模生产。这可与其它植物油的生产力相比较,其范围从低于1到至多6t/ha/年(例如菜籽油、棕榈油)。另外,藻类培养可位于不肥沃的、低质量的土地区域。除了土地使用益处之外,温室气体减少潜能高:计算显示与化石燃料相比来自基于藻类油的生物燃料的排放可低于70-80%。认识到这些益处是重要的,因为生物燃料工业始终以更加可持续的原材料和土地使用以及发现新方法以减少温室排放为目标。因此,所有的新原材料选项必须在进入大规模生产之前仔细评估。
虽然藻类被充分理解为用于生物燃料原材料生产的潜在和环境友好的选项,但至今资本费用和运行费用对于低价值的燃料市场太高。因此所有方法步骤需要实现总资本需求缩减的新的创新。资本费用主要由油生产力水平所驱动。术语“油生产力”的更深入分析显示其由两部分组成:生物质生产和脂质生产。这些性质之间的权衡在科学文献中有良好记载,并且油生产力可通过仔细选择品系、通过选择正确的培养方案以及通过优化收获时间改善。为了降低资本投资,增加油生产力的方法是最重要的。
当从藻类生物质中提取油时,细胞叶绿素倾向于进入油级分并且叶绿素的浓度在最终的油中可高达1-3%。在植物油处理中,30-100ppm的叶绿素浓度已被认为是高的并且已观察到在预处理和在油的催化加工中引起问题。叶绿素不能通过脱胶从油中除去并且漂白也是不经济的(甚至在植物油处理中),因为其需要增加的量的漂白粘土,导致大量油损失。在油的精炼步骤中,叶绿素强烈吸附在催化剂的孔隙入口,其导致较慢的氢化速率。因此开发用于在短时间内生产足够大量脂质的经济上可行的藻类脂质生产方法是困难的。
先前增加藻类脂质含量的方法通常使用氮限制,其也已被报道减少细胞叶绿素水平。脂质累积发生在细胞分裂和碳固定不平衡的应激条件期间,并且通常氮限制被认为是脂质累积的主要原因。当氮限制开始时,无新的含氮蛋白质可被代谢并且其它化合物,例如脂质和烃的生产增加。
光驯化为一种普遍注意到的现象,其中光合色素在强光下减少以平衡收获的光量与细胞可利用的能量的量。传统上藻类研究集中于探索不同光水平中的生长速率和评估不同光条件下的光合效率。
藻类中的高脂质生产力迄今已通过两步培养方法达到:首先生产包含藻类的生物质,然后驱使细胞缺乏一些无机物(氮、磷或二氧化硅)。在该饥饿阶段期间,细胞开始在其细胞内储存脂质或淀粉,因为它们生产正常生物质的能力受限。
饥饿阶段在具有高藻类生物质的培养中不容易达到并且其耗费长时间,从数天到数周。已经评估肥育(fattening)期(脂质累积期间)从藻类培养的饥饿开始可耗费几天到几周,这对于培养藻类用于燃料生产太久。先前的方法并未成功将藻类细胞足够迅速地从生长期转变至油生产期以提供用于生物燃料生产的富含脂质的藻类生物质。
wo2012/006302公开了培养微藻类chlorococcumpamirum和增加油生产的方法。油累积通过氮或磷缺乏培养基或通过在整个培养期间用具有高于至少200µmolm-2s-1(p.5-6)的强度的光连续照射微藻类细胞诱导。用这些方法,藻类油含量可在一周至十天内增加。在整个培养阶段期间将氮缺乏与恒定的高强度光照组合进一步增加油累积的速率但不增加最终的油含量(实施例3)。
us2012/0077253公开了在光生物反应器中用最佳和恒定的生长速率培养藻类持续更长时期的方法[0054-0056]。藻类细胞物质(cellmass)在培养期间进行监测和控制以通过增加或减少光暴露和/或藻类物质(algalmass)保持发射光子与细胞密度的比率在定义的范围内。所述方法仅通过在藻类品系的理想的特定光照射范围内培养和通过避免光辐照度中的高峰值提供最佳油生产[0066]。在生长期期间,必须维持期需的特定照射水平[0067]。
脂质累积为培养藻类生物质中的重要步骤,因为贮存脂质通常为中性脂质,例如甘油三酯,其可在生物燃料处理中容易地用作原料。相反,结构脂质主要为极性脂质,例如磷脂和糖脂。因此在饥饿期间细胞的中性脂质的绝对量增加并且中性对极性脂质的份额增加。
因此本发明的一个目标为解决或减轻现有技术的至少一些上述问题。
发明概述
本发明人意外发现,通过耗尽细胞的营养物,特别是氮至引起营养物应激的水平,和基本上同时暴露细胞于高强度光,藻类细胞中叶绿素的量可减少并且脂质含量可增加。采用本发明方法,至脂质累积期的改变比采用常规方法更迅速地达到,其缩短培养和脂质生产所需的总时间,并且使得本发明方法对生产用于生物燃料生产的富含脂质的藻类特别有用并且经济上可行。
根据本发明的第一个方面,提供生产藻类细胞的方法,包括以下步骤:
a.在支持生长的培养条件和光量下培养藻类细胞;
b.耗尽藻类细胞的至少一种无机营养物;和
c.连续暴露藻类细胞于比步骤a.中更高的光量;
其中步骤b.和步骤c.基本上同时开始。
所述方法具有培养的藻类细胞从生物质到脂质累积期较快转换的优点。因此,本发明方法可用于生产用于生物燃料生产的藻类生物质。
其它优点为藻类细胞的脂质与叶绿素比率显著增加。遭受到创新的营养物饥饿和强光处理的细胞快速地,甚至在几小时内从生长阶段转变至脂质生产阶段,它们包含比用传统培养方法(但是通常在几天至几周期间)达到的多140%的脂质和较低的叶绿素含量,这将它们的脂质:叶绿素比率提高17倍。
根据本发明的第二个方面,提供使用上述方法生产的藻类。
包含本发明藻类细胞的藻类和藻类物质含有比使用至今已知的现有方法培养的相应藻类细胞更多的脂质和更少的叶绿素。
根据上述方法生产的藻类特别适用于生物燃料生产。包含采用本发明方法生产的藻类细胞的生物质可在较短的培养时间内生产,并且藻类细胞富含脂质和包含比用现有技术方法可达到的更少的叶绿素。
根据本发明的第三个方面,提供可通过从使用本发明方法生产的藻类提取脂质获得的脂质提取物。脂质提取可使用本领域已知的从藻类细胞提取脂质的任何方法进行。
根据本发明的第四个方面,提供可通过将来自藻类(其使用上述方法生产)的脂质和/或上述脂质提取物转化为生物燃料获得的生物燃料。
根据本发明的第五个方面,提供本发明的藻类和/或本发明的脂质提取物在燃料生产中的用途。由于增加的脂质含量和减少的叶绿素含量,以及从生长期到脂质生产期的较快转换,该用途特别有利,因为其缩短燃料生产中的总体处理时间并且通过减少对去除叶绿素的需求而简化生产。
根据第六个方面,提供生产可再生生物燃料的方法,包括:根据本发明方法培养藻类细胞、从培养的藻类中分离脂质组分和使分离的脂质组分经受化学反应以生成烃或脂肪酸的烷基酯,由此生产可再生生物燃料。
根据第七个方面,提供增加藻类细胞中的中性脂质与叶绿素比率的方法,包括
a.在支持生长的培养条件和光量下培养藻类细胞;
b.耗尽藻类细胞的至少一种无机营养物;和
c.连续暴露藻类细胞于比步骤a.中更高的光量;
其中步骤b.和步骤c.基本上同时开始。
根据第八个方面,提供脂质提取物减少生物燃料转化单元中催化剂阻塞的用途,其中将藻类油转化为生物燃料组分。本发明脂质提取物也可用于改善脂质到生物燃料的催化转化。本发明脂质提取物通过改善藻类脂质到生物燃料转化所需的催化剂的性能在生物燃料生产中特别有用,因为根据本发明方法所生产的藻类脂质叶绿素含量较低并且中性脂质含量较高。
不限于上述优势,本发明方法,产品和用途相对于可用现有培养方法所实现的得到改善,因为本发明方法更迅速地将藻类细胞从生长阶段改变到脂质生产阶段,并且产生具有增加的脂质与叶绿素比率的藻类。
本发明的不同实施方案将仅关于本发明的一些方面说明或已经仅关于本发明的一些方面说明。技术人员理解,本发明一个方面的任何实施方案可应用于本发明的相同方面或本发明的其它方面。
附图简述
图1公开第一个光实验期间叶绿素和硝酸盐(no3-n)浓度的进展。日变化是因为用新鲜的培养基稀释。在12和17天时,将培养物用无氮培养基稀释,引起no3浓度下降。当子样品已经采集用于不同光处理时,光偏移实验期以灰色条带示出。将叶绿素分析测量或从荧光估计。硝酸盐在11-15天时测量。
图2公开了光偏移实验期期间的光剂量和取样时间的安排。对于夜晚期将光关闭。
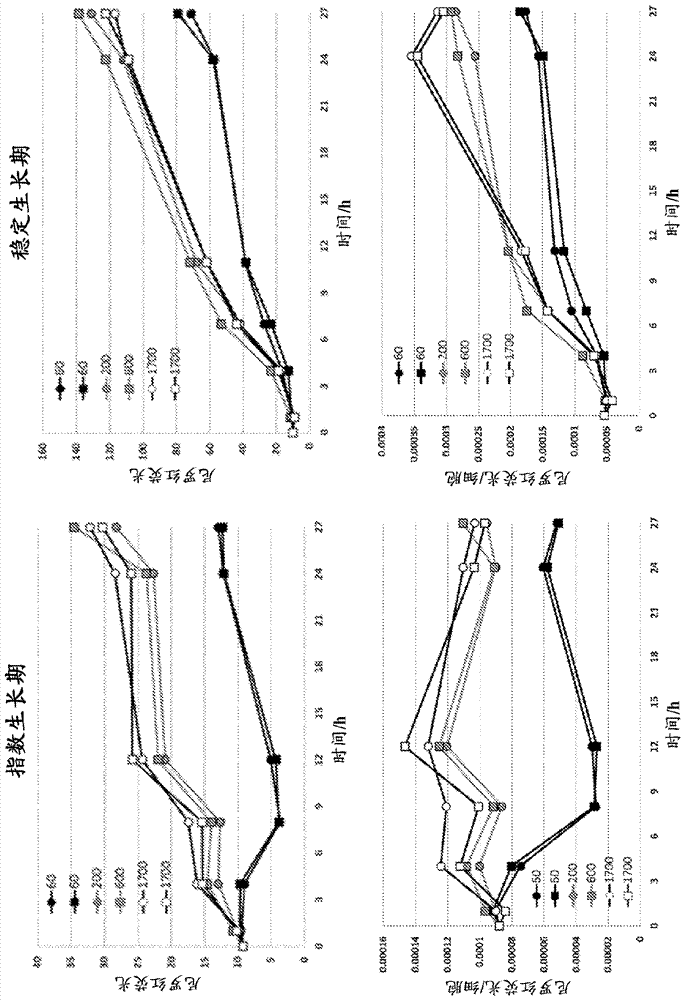
图3公开了光实验1。不同光水平下指数和稳定生长期(氮饥饿)二者中三角褐指藻(p.tricornutum)ccap1055/1细胞数、chl(叶绿素)荧光(相对的)、尼罗红荧光(相对的)、细胞特异性尼罗红荧光、光合效率qy(相对的)、干重和硝酸盐的进展。注意y刻度的不同。
图4公开了光实验1的生长速率。左上角:指数期(0-27小时)细胞数目的增长;右上角:稳定期(0-11小时)细胞数目的增长;左下角:指数期(0-27小时)脂质(作为尼罗红)的增长;右下角:稳定期(0-11小时)脂质的增长。注意y标度差异。
图5公开了指数和稳定期期间光实验中脂质与叶绿素比率的进展。下图中将实验开始时的值按比例调节为1。稳定期的按比例调节结果显示由于强光处理所致脂质:chl比超过14-17倍的增加。
图6公开了光实验2。在34h的时间段期间在不同光水平/处理中氮饥饿下三角褐指藻ccap1055/1细胞数目、chl荧光、尼罗红荧光、细胞特异性尼罗红荧光、光合效率、脂质(尼罗红)与叶绿素浓度比、干重和硝酸盐的进展。
图7公开了光实验3。在37h的时间段期间在两个不同的光水平中氮饥饿下普通小球藻(c.vulgaris)细胞数目、chl荧光、尼罗红荧光、细胞特异性尼罗红荧光和作为叶绿素浓度指示的叶绿素吸收的进展。
图8公开了光实验3。从指数期到稳定期转变期间光实验中脂质与叶绿素比率的进展。
详述
在本发明方法中支持生长的培养条件为在其中藻类细胞生长和分裂的培养条件。可以使用通常用于藻类培养的任何生长培养基。支持生长的光量为藻类细胞接收的光强度,其足以允许细胞在所选的支持藻类细胞生长的条件下生长和分裂并且不抑制藻类细胞物质的累积。
无机营养物的耗尽可通过在达到期需的生物质浓度之后不用无机营养物补充生长培养基实现,借此无机营养物被藻类细胞耗尽。或者,细胞可通过离心或通过其它适合从生长培养基中分离活细胞的方法收获,并转移至新的耗尽至少一种无机营养物的生长培养基。然而,任何合适的方法可用于达到其中细胞处在不含至少一种无机营养物的培养基中的情况。
在本发明某些实施方案中,无机营养物耗尽的水平足够低以在藻类细胞中诱导营养物应激。耗尽的无机营养物可为氮并且诱导营养物应激的水平可为din=0(din=溶解的无机氮),其可通过本领域已知的方法测定。该水平可与无机氮的检测水平一样低,或din=0。
步骤c.中连续暴露藻类细胞于高于步骤a.中用于培养细胞的光量可使用任何光源进行,所述光源能够提供足够的光以达到本发明的目标。
步骤b.与步骤c.基本上同时开始。优选地,光暴露步骤c.在当细胞培养基中溶解的无机营养物在检测限之下的时间之前的一次细胞分裂和之后的一次细胞分裂期间发生的时间点开始。在一个实施方案中光暴露恰在大多数藻类细胞在无机营养物耗尽前分裂最后一次之前开始。如本领域所熟知的,一次细胞分裂的时期可根据培养条件而不同并且一次细胞分裂的时期可根据本领域已知的方法测定。因此,开始步骤c.的光处理的适当时间点可通过测量无机营养物的浓度和细胞分裂活性的时期很容易地测定。因此,技术人员能够基本上同时开始步骤b.和c.,即距无机营养物的量下降或经估计下降到低于检测限的时间点不早于且不晚于一次细胞分裂。
本发明方法提供具有高脂质含量和低叶绿素含量的藻类细胞生物质。这种生物质在生物燃料生产中有利,因为其减少从生物质中去除叶绿素的需要并且提供更多的脂质以转化成生物燃料。
在一个实施方案中,上述方法用于增加藻类中或产自藻类的脂质提取物中的中性脂质与叶绿素比率。
在一个示例性实施方案中,本发明方法中耗尽的无机营养物可为氮、磷或二氧化硅。耗尽无机氮是优选的,因为其为在藻类细胞中诱导脂质累积的普遍使用并且非常有效的方法。然而,其它营养物,例如磷或二氧化硅,也可用于诱导脂质累积。
在一个示例性实施方案中,上述步骤c.持续至少3小时。步骤c.也可进行长于3小时,例如3.5h、4h、4.5h、6h、6.5h、7h、7.5h、8h、9h、9.5h、10h、10.5h、11h、11.5h、12h或更长。然而,与对照藻类相比,3小时足以增加脂质含量和减少叶绿素含量至使藻类适合于生物燃料生产的水平。
在一个示例性实施方案中,藻类细胞在诱导营养物耗尽之后12h或更久采集。在一个优选的示例性实施方案中,藻类细胞在诱导营养物耗尽后12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35或36h采集。
在另一个示例性实施方案中,藻类细胞在诱导营养物耗尽之后1、2、3、4、5、6或7天采集。
在一个示例性实施方案中,步骤c.中藻类细胞暴露的光量相应于或超过ek,即光合作用不再受光限制的辐照度的量。光饱和参数ek作为ek=µmax/α给出,其中α为对于给定的藻类在生长速率与辐照度之间关系的起始斜率。在某一辐照度水平,生长速率达到平稳期。光饱和的生长速率表示为µmax。技术人员能够容易地使用本领域已知的方法测定任何藻类物种的ek。在一个实施方案中,步骤c.通过暴露藻类于具有相应于或超过所述藻类的ek、1.5xek、2xek或3xek的光水平的强度的光量下进行。优选地光量在步骤c.中具有等于或低于在µmax时所需的强度。
在一个示例性实施方案中,步骤c.中光量可为至少100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、300、350、400、450、500、550、600、560、600、650、700、750、800、850、900、950、900、950、1000、1100、1200、1300、1400、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000µmol光子m-2s-1。
在一个实施方案中,步骤a.中细胞暴露的光量具有低于所述藻类的ek的强度。
在一个示例性实施方案中,培养使用昼夜光周期进行。本发明昼夜光周期的实例为12h光照期和12h黑暗期(12-12周期)、11-13周期、8-16周期或任何天然存在的光-暗期,或模拟白天和黑夜之间的正常周期性的周期。光暴露期在步骤c.中给予并且包括在光照期中以保持本发明方法期间的总周期长度不变。
在一个示例性实施方案中,强光处理在白天时期开始时给予并且光量在其余的白天时期中保持基本恒定。优选地,细胞接收的光量在光处理期间保持在基本恒定的高水平并在其余的白天时期中保持在基本恒定的较低水平。
在一个示例性实施方案中,上述步骤c.在每一连续的白天时期开始时重复,只要方法继续并直至收获藻类生物质。
藻类细胞优选在其尚未进入稳定生长期时开始暴露于光处理。然而,在细胞已达到稳定期的情况下用本发明方法也可增加脂质含量和减少叶绿素含量。在任何一种情况下光处理均直至营养物耗尽开始才给予。
实施例
提供下述实施例以说明本发明的各个方面。其不意在限制本发明,本发明由所附的权利要求定义。
藻类细胞中的光和饥饿作用在活跃生长的藻类细胞(指数生长)和达到稳定期的藻类细胞二者中均进行研究。检验四种光水平,即60、200、600和1700µmol光子m-2s-1,其代表穿透藻类培养至2.2、1.4、0.7和0cm深处的正常日光水平(假设藻类生物质浓度为1gdwl-1,叶绿素含量为1%dw)。基础光水平60µmol光子m-2s-1为参考对照值,增加的光的影响与其比较。因为水平200光子m-2s-1足够高以在作为脂质生产者的藻类细胞生理学和行为中观察到明显作用,所以我们能够鉴定导致强影响的最小光水平与物种特异性生长-辐照度关联的关系。单独实验用连续光剂量和用秒或分钟标度的脉冲运行。当额外光连续给予至少3小时时,获得最佳结果,即最快改变至脂质累积期和最高的藻类细胞的脂质:叶绿素比率。
藻类生物质以最大特定生长速率生产,并且小心监测氮水平以便当培养基中无机氮在检测限之下时立即开始光活化实验。实验的细胞密度是有意低的以避免细胞遮蔽以及在整个培养时间期间为所有细胞提供相同的光条件。
使用本发明方法生产的藻类比参考条件下获得的藻类具有高脂质含量和更低的叶绿素含量。本发明藻类在用于生物燃料生产时特别有用,因为,除高脂质含量外,藻类细胞包含较少的叶绿素,叶绿素在脂质生产中引起问题并且难以从藻类生物质中去除。
实施例1
第一个实施例使用三角褐指藻ccap1055/1进行,因为其具有高生长速率,易于培养并且叶绿素分析可靠。将细胞在n-充满的培养基中使用6psu(8.12mgno3-n)的盐度培养。将藻类在60μmolqm-2s-1培养并且通过用营养物充满的培养基稀释保持在指数期。将藻类浓度保持较低以避免自遮蔽。每日稀释使叶绿素水平保持相对低(大约100-200μgl-1),因此培养单元内部的光条件在整个实验中保持相似(图1)。在这些叶绿素水平下,大致80-90%的氮处于无机形式(no3),仅10-20%在细胞中吸收。培养体积在实验期间逐渐增加,从开始的1.8l到实验时期的15-17l。这允许我们具有几个单元(每一1.5l)用于光偏移实验。光偏移实验在12天(指数生长期)时和在17天(稳定生长期)时开始(图1)。在实验中,将藻类培养物分成几个子样品,在不同光处理下孵育。持续27小时的光处理使用四种光水平(60、200、600&1700μmolqm-2s-1,led光源sl3500,光子系统仪器(photonsystemsinstruments))进行,最低的和最高的光水平具有重复培养物。在所有光实验中,光在夜晚关闭(在12h测量后关闭并且打开取样用于24h测量)(图2)。将培养物保持在2l聚碳酸酯瓶子中,连续充气(空气泵容量550ml/h),当使用这样的低生物质时其足以保持ph和无机碳水平恒定。使用高通风,将大部分溶解的氧除去并掺入足够的二氧化碳以保证在我们的试验中co2不是生长限制因素。无机磷在光偏移实验期间测量,并且其总是超过0.4mgl-1,因此对于藻类生长是过量的。第一个测量时期在指数期进行。第二个测量时期发生在向稳定期转变时,营养物限制开始时。对于该目的,将部分原始培养物在60μmolqm-2s-1培养直至no3耗尽(图1)。
在实验中,测量细胞的量(flowcam)、脂质累积(尼罗红)和细胞的光生理学(aquapen)。光生理学测量包括光吸收、chl含量和光化学活性(使用可变荧光技术)。后者使用荧光-辐照度曲线技术(快速光曲线,suggett等人2003)测量。对于该分析,从每一培养物获取子样品,对于其它分析,荧光诱导曲线使用各种光水平测量。从荧光响应对光水平曲线中计算典型的生产-光合作用参数(macintyre等人2002)。
在指数期,光剂量影响生长速率,但显然生长在200μmolqm-2s-1处已经饱和(图3&4)。在最低的光下细胞数目增加2.5倍,而在较高的辐照度下增加3倍。营养物分析显示平均硝酸盐和磷酸盐浓度为7600和590μgl-1。这些值是非常高的,而且在实验期间几乎没有观察到任何减少(图3)。基于可变荧光测量,在最高光水平下生长的细胞稍微被过量的光应激。在那种光水平下,fv/fm(或qy)值为大约0.50,而其它培养物显示大约0.60的值,其对于非应激细胞是典型的(seppälä2009)。作为强光驯化,叶绿素浓度或荧光没有像细胞数目一样改变那么多(图3&5)。虽然细胞在强光中比在弱光中分裂更快,但是它们在强光中不制造任何新的叶绿素。这在细胞叶绿素含量的结果中明显可见,其显示叶绿素含量在一天内减少50%(图5)。叶绿素与干重比(图5)没有显示叶绿素含量的相似减少,但是必须指出干重测量并不是非常可靠,特别对于在指数期第一个小时获取的样品。部分过量的光能量用于制造脂质,并且在较强光下细胞的脂质含量是60μmolqm-2s-1下的脂质含量的2倍(图3)。当将此与叶绿素含量减少相结合时,脂质与叶绿素比率迅速增加,并且与辐照度在60μmolqm-2s-1的生长相比,在饱和辐照度水平下为2.5-3.5倍(图3)。当着眼于脂质生产的速率时,培养物之间的许多差别看起来是由于在最弱光下降低的脂质生产速率所致(图4)。在其它培养物中脂质生产速率比细胞生长速率略高,如同样在大致20-40%的其脂质/细胞增加值中见到的。
稳定期开始时,细胞生长在最低光水平下与在指数期相当相似。在较高光水平下生长甚至比第一部分实验期间更高。营养物结果表明氮在第二部分实验开始时消耗,因此并未在很大程度限制生长(图3)。作为氮限制的第一个标志,叶绿素含量不以与细胞数目相同的速率增加,引起更迅速的细胞叶绿素含量减少,甚至在最低的光水平下。可变荧光水平对于第一个光照期相当高,除了最高的光处理,其指示比指数生长期期间更高的光应激。最高的值接近理论最大值0.65-0.70,其可在健康细胞中获得(seppälä2009)。在那些样品中叶绿素荧光也下降,表明荧光通过非光化学猝灭减少。在最强光下,与最低光水平相比,叶绿素浓度在24小时期间减少35%。因为在稳定期实验结束时细胞数目在最低和最高光水平下相当相似,由于强光处理细胞叶绿素份额也减少大致30%(图3)。
脂质在氮耗尽后开始迅速增加。在11小时内尼罗红荧光与时期开始时相比为4-7倍(图3),导致比细胞生长速率高得多的生产速率(图4)。连同叶绿素含量的减少,脂质与叶绿素比率的改变甚至更显著。该增加持续整个实验过程,并且结束时观察到多达17倍的比率增加(图5和表1)。
在稳定期,看起来营养物应激组合强光应激减少生长,引起chl荧光(非光化学猝灭或光损伤)的很大减少和光化学活性的减少。然而,脂质增加在所有强光物中相等。当在强光下生长时,细胞中叶绿素的相对减少没有损害脂质生产。
表1.光实验1期间尼罗红荧光和尼罗红荧光与叶绿素浓度之间比率的相对增加
实施例2
第二个实验部分重复第一个实验,但是仅使用光水平60和200μmolqm-2s-1并且测量期仅在向稳定期转变时。另外我们检验了以不同脉冲供给光的模式是否对脂质累积和光生理学有作用。这通过在测量期间应用脉冲光进行。脉冲以秒-分钟标度(45秒弱光,15秒强光)或分钟-小时标度(45min弱光,15min强光)进行。光水平为弱光=60μmolqm-2s-1并且强光=600μmolqm-2s-1。对于两种脉冲光处理,累积的光剂量等于200μmolqm-2s-1连续水平的累积光剂量。
细胞生长在200μmolqm-2s-1恒定光时最高(图6)。相似地,最高的脂质产量(绝对的,每细胞或每叶绿素)使用这种处理获得。根据生长曲线看起来很明显,细胞不能使用由光脉冲提供的额外能量。细胞数目在脉冲光下甚至比弱光下略低。在实验期间脉冲或特别是较高的光水平降低光合效率。
细胞的叶绿素含量(图7)如第一个实验中减少,但是再次,脉冲处理看起来不影响细胞叶绿素含量。光处理对光谱吸收的作用低于第一个实验。同样的,在光-荧光关系中,参数在弱和强光中和在脉冲光条件下具有十分相似的范围。这表明在该实验期间细胞非常低的动态光驯化能力,正如第一个实验的后半部分。色素沉着和脂质含量在第一个和第二个实验之间的轻微差异可通过细胞营养物状态的轻微偏移解释。当着眼于氮浓度时,在第二个实验的起始阶段所观察到的相似值(大约30μgno3-nl-1)在第一个实验的2-3小时发现。因为no3吸收在黑暗期可较低,氮限制进展之间的实际差异可比该时间差异稍微长些。结果表明第二个实验开始的值与第一个实验的4-11小时(稳定期)的值十分相似。因此我们可认为第二个实验显示其中营养物限制已比第一个实验中稍微进一步进展的情况。这可部分解释为什么在第二个实验中响应比在第一个实验中弱;在第二个实验中细胞已受到更多的氮限制。
根据此处收集的实验数据,很可能用于色素和脂质累积改变的时间标度为从数小时到数天,因为较短的分钟或秒标度光脉冲不引起这种强驯化。
实施例3
实验使用绿色藻类普通小球藻(chlorellavulgaris)进行。基于先前的实验,我们仅使用两种光处理,并且样品在光照期开始和结束时采集,持续两天。在实验的11至24小时之间,细胞处于黑暗中,而在其它时间在给定辐照度下。如同对于先前的实验,首先将细胞在最低辐照度(此处,80µmolqm-2s-1)下培养。在由于氮耗尽从指数期到稳定期的开始时,将培养物分成四瓶。
普通小球藻在强光时在细胞数目和脂质两方面显示高生长(图8)。脂质增加的时间发生在细胞生长已停止之后,在氮限制条件期间第一个光照期之后。细胞生长的停止非常迅速并且细胞脂质的增加为2倍。较高的光剂量导致稍微高的脂质与叶绿素比率。虽然强光下在最后的样品中注意到蓝与红吸收比的轻微增加,但是色素沉着不响应于光水平的增加。
前述说明通过本发明具体实施方式和实施方案的非限制性实施例,提供了发明人目前考虑的用于实施本发明的最佳方式的完整和提供信息的描述。然而对于本领域技术人员清楚的是,本发明不受前文呈现的实施方案的细节限制,而是其可在其它实施方案中使用等同方法或以实施方案的不同组合实现,而不偏离本发明的特征。
此外,本发明前面公开的实施方案的一些特征可用于无其它特征的相应使用而获益。正因如此,前述说明应该被认为仅仅是本发明原理的说明,而非其限制。因此,本发明的范围仅受所附的专利权利要求书限制。
- 还没有人留言评论。精彩留言会获得点赞!