一种新型季铵盐类荧光探针及其应用的制作方法
本发明属于化学分析检测技术领域,具体涉及一种新型季铵盐类荧光探针及其应用。
背景技术:
一氧化氮分子(no)是生物体内一种重要的信使小分子,参与了体内多个系统的生理功能的调控。目前很多证据显示一氧化氮也与多种疾病相关,如糖尿病、帕金森症和阿兹海默症等。因此no供体药物作为潜在的心血管、抗肿瘤、新型抗炎和抗阿尔兹海默病药物,引起了广泛的关注。no作为气体自由基在生物体内极不稳定,浓度很低,容易扩散,容易被氧气及其他氧化物氧化,因此在生物体内检测no的方法一直是相关研究的一个的热点,建立一种有灵敏度高、选择性强的检测一氧化氮的方法是非常必要的。
no的检测方法有电化学法、化学发光法等,与这几种no的检测方法相比,荧光探针法对no的选择性好、空间和时间响应性高。作为一种常规的检测手段,荧光探针法具有需样量少、取样容易、操作简便易行等优点,被认为是最有应用前景的检测技术。
目前,应用较好的一类探针为邻苯二胺类,但其因检测极限较高、必须在氧气存在下才能检测到与no,使其应用受到限制。因此,研究一种能直接与no作用,不受氧化剂和生理条件下ph的影响、溶解性好,检测生物体内外no、no供体药物释放的一氧化氮、食品中亚硝酸盐含量的荧光探针迫在眉睫。
亚硝酸盐作为一种常用的食品添加剂广泛存在于肉类及咸菜等腌制食品中。但是,当人体摄入过量的亚硝酸盐以后,会对人体健康构成危害。因此,食品中亚硝酸盐的含量测定方法研究具有重要的意义。
技术实现要素:
本发明的目的在于提供一种季铵盐荧光探针。
本发明的目的还在于提供一种选择性强、灵敏度高、能够用于细胞内外no检测的方法。
本发明的目的还在于提供一种选择性强、灵敏度高、在酸性条件下能够用季铵盐类荧光法检测和分析食品中及环境中的亚硝酸盐的方法。
本发明的目的还在于提供一种季铵盐类荧光光度法测定no供体药物含量的测定方法。
一种季铵盐荧光探针,所述荧光探针的分子结构如下述通式i或通式ii所示:
式中,r为甲基,乙基,异丙基,丙基;r’为氯、溴或碘;n=2-6。
上述的季铵盐荧光探针在细胞内外no的检测中的应用。
上述的季铵盐荧光探针在分析食品和环境中亚硝酸盐中的应用。
上述的季铵盐荧光探针在荧光光度法测定no供体药物含量中的应用。
上述的季铵盐为off-on型季铵盐类。
本发明的荧光探针分子的应用方法如下,将探针分子溶解在去离子水中,当其捕捉到一氧化氮后或者在酸性条件下和亚硝酸根离子反应后,二氢吡啶单元被芳香化为吡啶单元。使得荧光得以恢复。探针分子与亚硝酸根离子的作用如下所示:
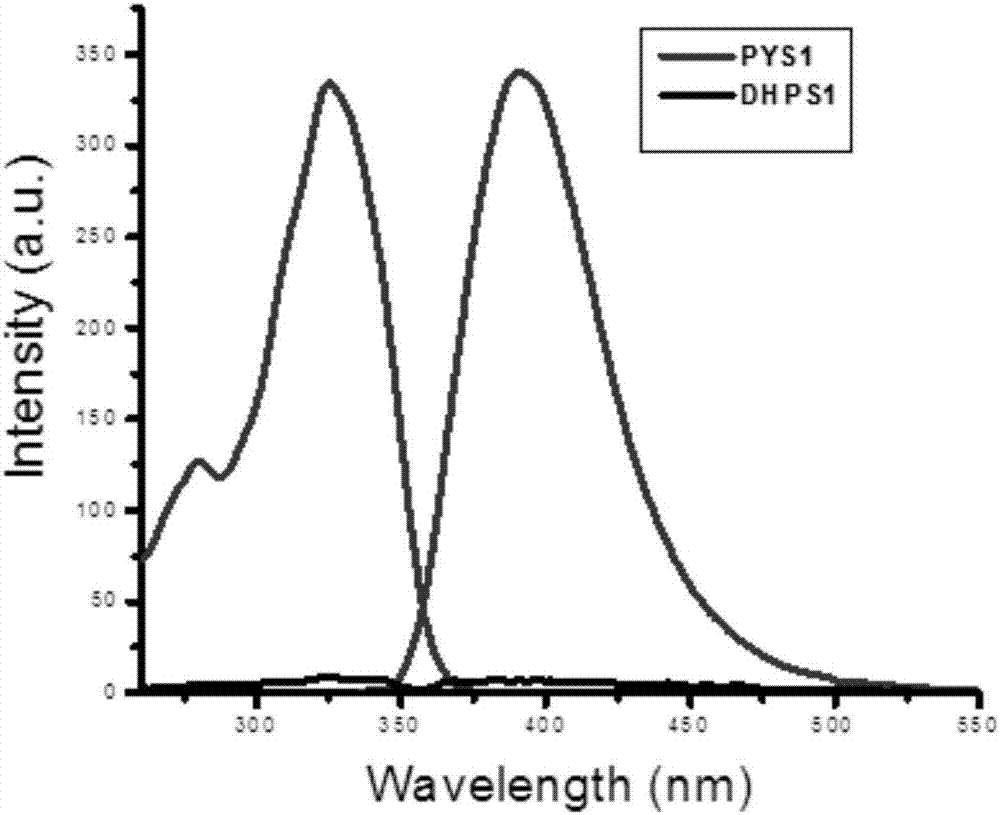
本发明的探针分子本身无明显的发射峰,但是当探针捕捉到no或在酸性条件下与亚硝酸根离子反应后,就会出现明显的发射峰,荧光强度明显增强(如图1所示,dhps1(cdhps1=5.0×10-6mol·l-1)在盐酸(chcl=0.18mol·l-1)条件下,与不同浓度的亚硝酸根离子作用后的荧光光谱图,反应温度,75℃;反应时间,30min)。
与现有技术相比,本发明具有如下有益效果:本发明的季铵盐类荧光探针法具有灵敏度高、选择性好、检测限低、仪器设备简单、操作简便等诸多优点。应用季铵盐类荧光探针建立的no供体药物含量测定方法准确可靠,建立的细胞内外no检测方法灵敏,还可应用于食品中亚硝酸盐的检测方法,用途广泛。
附图说明
图1为探针分子dhps1和dhps1与no反应后pys1的紫外吸收图谱。
图2为探针分子dhps1和dhps1与no反应后pys1的荧光激发和发射图谱。
图3为为探针分子dhps1分别与no(2equiv.)和其他干扰性离子(100equiv.)在同等条件下反应。横坐标为干扰性离子,纵坐标为荧光强度的增强值。
图4为探针分子dhps1和dhps1与no反应后pys1的荧光强度和溶液ph的关系。横坐标为ph值,纵坐标为荧光强度。
图5为为探针分子dhps1与no反应荧光强度随时间的变化。横坐标为时间,纵坐标为荧光强度的增强值。
图6为荧光强度和no当量之间的线性关系图。横坐标为一氧化氮当量值,纵坐标为荧光强度。
图7为dhps1和不同当量no反应的荧光发射光谱图。横坐标为波长,纵坐标为荧光强度。
图8为在亚硝酸根离子浓度为4×10-7mol·l-1时,在0.18mol·l-1盐酸条件下,本发明荧光探针的浓度与荧光强度的增强度之间的关系,横坐标为探针的浓度(2×10-5mol·l-1-8×10-5mol·l-1),纵坐标为荧光强度的增强值。
图9为本发明荧光探针dhps1(5×10-6mol·l-1)在60℃和30min条件下,在不同浓度的盐酸条件下与亚硝酸根离子(4×10-7mol·l-1)作用后的荧光强度增强值得变化,横坐标为盐酸的浓度(0.10mol·l-1-0.22mol·l-1),纵坐标为荧光强度的增强值。
图10为本发明荧光探针dhps1(5×10-6mol·l-1)在0.18mol·l-1盐酸条件下,与亚硝酸根离子(4×10-7mol·l-1)作用后的荧光强度随时间和温度的变化,横坐标为时间,纵坐标为荧光强度的增强值。
图11为本发明荧光探针dhps1(5×10-5mol·l-1)在0.18mol·l-1盐酸条件下,与不同浓度的亚硝酸根离子(0-8×10-7mol·l-1)作用后的荧光光谱的变化,横坐标为波长,纵坐标为荧光强度增强值。
图12为本发明荧光探针dhps1(5×10-6mol·l-1)在0.18mol·l-1盐酸条件下,与亚硝酸根离子作用后的荧光光谱的变化与亚硝酸根离子浓度(0-8×10-7mol·l-1)的线性关系,横坐标为亚硝酸根离子的浓度,纵坐标为荧光强度的增强值。
图13为探针dhps1在raw264.7细胞中对一氧化氮的检测成像:明场(上)和相应的荧光(下);(左)只加探针(10μm)培养8h;(右)先加lps(0.5μg/ml)培养4h,再加探针(10μm)培养8h。
具体实施方式
下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
实施例1探针分子dhps1的合成
合成路线如下所示:
将化合物4-丙醛基-7甲氧基香豆素溶于乙醇溶液中,再加入3当量的醋酸铵,3当量的乙酰乙酸四氯丁醇酯,加热回流4h,柱层析分离,真空干燥得到淡黄色固体产物dhp-a1hnmr(400mhz,cdcl3)δ7.41(d,j=8.8hz,1h),6.81(m,2h),6.11(s,1h),5.84(s,1h),4.24–4.03(m,5h),3.85(s,3h),3.56(t,j=6.2hz,4h),2.63–2.67(t,=8hz2h),2.34(s,6h),1.93–1.64(m,10h).13cnmr(101mhz,cdcl3)δ167.04,161.97,161.11,156.56,/154.98,145.55,124.69,112.40,111.77,109.80,101.60,100.51,76.84,76.52,76.20,62.66,55.22,43.96,34.45,32.57,28.90,26.89,25.75,18.99.esi-mscalculated579.2,found602.2[m+na]+。
将上述产物dhp-a和三甲胺醇溶液溶于乙醇中,加热回流12h,加有机溶剂处理析出淡黄色固体,抽滤,用有机溶剂洗涤3次,真空条件下干燥12-36h得黄色固体,黄色固体即为探针分子dhps1.1hnmr(400mhz,d2o)δ7.12(d,j=8.9hz,1h),6.71–6.69(d,j=8.9hz,1h),6.57(d,j=2.0hz,1h),5.80(s,1h),4.01(t,j=6.1hz,4h),3.77(s,3h),3.73(s.1h)3.35–3.24(m,4h),3.04(s,18h),2.34(m,2h),2.09(s,6h),1.84–1.41(m,10h).13cnmr(100mhz,d2o)δ169.44,163.64,162.33,159.38,154.31,148.71,125.52,112.55,112.50,108.56,100.98,99.99,66.09,63.60,59.49,56.00,52.90,33.36,32.67,26.21,25.04,19.51,18.27.esi-mscalculated[m]2+313.9,found(c35h53n3o7)2+313.4.
实施例2季铵盐荧光探针用于细胞内外no的检测
为证明该探针能够检测细胞内外的no,我们做了如下实验,首先我们考察探针dhps1与no反应前后紫外光谱和荧光光谱的变化如图1和图2所示,dhps1和其与no反应产物pys1的紫外吸收峰位移没有发生很大变化,但是荧光强度明显增强。同时我们考察了探针dhps1对no的选择性和灵敏度、对ph耐受性、以及与no响应快慢。如图3所示,探针dhps1只在no存在的条件下,荧光强度才发生明显的变化,而在其他活性氮化物和活性氧化物aa、no-2、no-3、h2o2、oono-、clo-、1o2存在的条件下,荧光强度相对于空白的变化可以忽略不计,说明荧光探针dhps1对no的选择性强;同时良好的荧光探针还需要对ph具有强的耐受性,如图4所示,在ph为4-10范围变化,荧光探针dhps1和其产物pys1的荧光强度稳定,说明探针对ph的耐受性良好;良好的荧光探针应与no作用迅速,我们考察了dhps1在2当量的no的条件下,荧光强度在10min就达到最大且稳定(如图5-7所示),说明荧光探针dhps1能很快与no响应,符合良好探针应具备的性质。所以我们将其应用检测raw264.7细胞在lps刺激下产生的内源性no。
将培养好的raw264.7细胞在显微镜下观察,待其生长状态良好,将其消化分装到1ml的共聚焦培养皿中,放入培养箱培养12h,待其完全贴壁。用不同的方式培养:1,加入一定的探针,培养8h。2,先加入lps(0.5μg/ml)(刺激raw264.7产生no)培养4h,再加探针(10μm)培养8h。先加入一定的lps刺激细胞产生no后,再加入探针培养,可以观察到明显的荧光现象,而没有lps刺激的,只加探针的荧光现象不明显。由此可推断dhps1可以测定内源性no。
实施例3季铵盐荧光探针用于分析食品和环境中的亚硝酸盐
探针dhps1在酸性条件下与亚硝酸盐反应生成pys1,荧光强度大大增强。基于此建立为一种能够准确检测亚硝酸盐的含量的方法,我们对该方法进行条件优化,选择探针的浓度、盐酸的浓度、反应的温度和时间、共存影响离子的考察。在其他三种条件(盐酸的浓度、反应的温度和时间)固定的条件下,改变荧光探针dhps1的浓度,如图8所示,当荧光探针的浓度在3×10-5mol·l-1-8×10-5mol·l-1,体系的荧光强度稳定,所以选择5×10-5mol·l-1为最佳探针浓度;在其他三种条件(探针的浓度、反应的温度和时间)固定的条件下,改变盐酸的浓度(如图9所示),当盐酸的浓度在0.18mol·l-1时,体系的荧光强度最大,所以选择0.18mol·l-1为最佳盐酸浓度;在其他两种条件(探针的浓度、盐酸的浓度)固定的条件下,通过改变体系反应的时间和温度,得出荧光强度与温度和时间的关系曲线,如图10所示,为了使该方法更具有应用价值,我们选在最佳温度75℃和最佳反应时间为30min。
在上述几种反应条件固定的条件下,我们向反应体系中分别加入下列干扰物质nacl、nabr、ch3coona、nh4cl、cacl2、ki、nahco3、na2co3、cacl2、nh4cl、kcl,当荧光强度的改变值与不加干扰离子的荧光强度相比,误差不超过5%时,体系中所允许的最大浓度的干扰离子。如表1所示。探针分子dhps1表现出很好的抗干扰能力,对于食品中和环境中亚硝酸根离子的检测和分析具有一定的应用价值。
表1dhps1的抗干扰能力,亚硝酸根离子与其他离子共存,与荧光探针在盐酸条件下作用
我们在上述几种实验条件固定条件下,分别取0.00,0.04,0.08,0.1,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6ml的5.0×10-6mol·l-1亚硝酸钠标准使用溶液于10个10ml比色管中,加入1.00ml探针溶液,1.00mlhcl,去离子水定容到5.00ml,在最佳条件下反应,定容。以325nm为激发波长,测在393nm荧光强度。得到随着亚硝酸钠浓度升高的一系列荧光发射光谱(如图11)和亚硝酸钠浓度一荧光强度增强值的关系曲线(见图12)。在最佳实验条件下,当亚硝酸钠的浓度在0.2×10-7mol/l-8×10-7mol/l。两者线性关系良好。标准曲线方程为y=106.9c-3.7(y为荧光强度增强值,c为亚硝酸钠的浓度10-7mol/l),相关系数r2=0.9991。
向6只10ml的比色管中加入各加入1ml5.0×10-5mol·l-1的探针溶液,其中三只加入相同量的腌菜的提取液,另外三只做空白对照。向六只比色管中加入1ml0.18mol·l-1的盐酸溶液,分别加入去离子水稀释至5ml,于75℃的水浴锅中反应30min,取出比色管,使用冰水迅速将其冷却至室温。用0.1m的磷酸二氢钠-磷酸氢二钠(ph=7.4)缓冲溶液稀释至刻度,以325nm为激发波长,测定溶液在393nm的荧光强度,与空白试验对比,计算荧光强度的增强值。根据线性方程求出腌制咸菜的亚硝酸含量。如表2所示。
表2
以上公开的仅为本发明的具体实施例,但是,本发明并非局限于此,任何本领域的技术人员能思之的变化都应落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!