蛋鸡输卵管膨大部上皮细胞培养及氧化应激模型建立方法与流程
本发明属于细胞毒理技术领域,具体地说,涉及一种蛋鸡输卵管膨大部上皮细胞的培养方法,还涉及一种蛋鸡输卵管膨大部上皮细胞氧化应激模型的建立方法。
背景技术:
鸡蛋作为人类所需蛋白质的主要来源。鸡蛋品质的改变,可能伴随着鸡蛋安全问题。随着生活水平提高,人们越来越重视鸡蛋的品质安全问题,而现代工业的快速发展,加剧了环境的污染,随之鸡蛋等人类常见食品的安全受到威胁。这不仅对蛋鸡行业甚至整个畜牧业有着致命打击,也对人类健康产生一定影响。鸡蛋除了蛋黄外,其余均在输卵管部位形成。蛋鸡输卵管分为漏斗部、膨大部、峡部、子宫和阴道部,其中漏斗部输送卵黄,膨大部形成蛋清,峡部形成蛋壳膜,子宫形成蛋壳,阴道部输送鸡蛋到泄殖腔,最后排出体外。其中蛋清主要由输卵管膨大部上皮细胞的内质网中合成和储存,并分泌到官腔,包裹在蛋黄外面,形成卵白层。输卵管膨大部上皮细胞分布在膨大部黏膜褶皱中。鸡蛋的安全品质,主要包含蛋重,蛋壳强度,厚度,蛋白高度,哈弗单位等,其中蛋清品质易受外来环境影响,主要表现为蛋白高度降低,蛋清液变稀,哈弗单位下降。而蛋清主要由输卵管膨大部上皮细胞的内质网中合成和储存,并分泌到官腔,包裹在蛋黄外面,形成卵白层。输卵管膨大部上皮细胞分布在膨大部黏膜褶皱中。目前,在蛋鸡行业生产上,蛋鸡易受外界环境影响,如饲料中的霉菌毒素(黄曲霉毒素,镰刀菌毒素),重金属(钒,铜,镉)以及饲养环境恶化(舍内温度,环境应激)等,都可能通过影响输卵管膨大部的形态(褶皱高度)而影响卵白形成过程中的运动,以及影响决定蛋清品质(卵白高度和HU)浓厚卵白中卵粘蛋白(Ovomucin,OVW)的分泌,从而导致卵白品质的降低。氧化应激是由于体内产生过多的自由基,不能及时清除,造成机体氧化和抗氧化失衡。许多研究也证明这可能是由于蛋鸡机体受到外来环境刺激,使蛋鸡输卵管膨大部上皮细胞产生氧化应激,进而造成结构和功能的紊乱,影响分泌的蛋清,但此研究仅仅限于在蛋鸡活体上,通过饲粮或者饮水的方式添加钒,而钒是否能达到输卵管膨大部,及其影响输卵管结构和功能的有效剂量也缺乏统一的结论,且蛋鸡输卵管膨大部上皮细胞的原代培养国内外鲜有报道,且细胞分离及培养方法不成熟,培养的细胞易受成纤维细胞污染,且大多未经鉴定成功,因此在输卵管上皮细胞上证明其机制的直接模型证据显得十分的必要。
同时,氧化应激的模型的建立,也是研究需要其它疾病机制的有力手段。许多疾病与氧化应激有关,肥胖患者体内氧化应激水平会升高;体内产生过多的氧自由基(ROS)可直接损伤胰岛素β细胞,造成糖尿病;血管产生过多的ROS造成低密度脂蛋白(LDL)在动脉内膜的沉积,引起动脉粥样硬化;随着年龄增长,机体抗氧化能力减弱引起阿尔兹海默症等。目前,已经有通过许多添加重金属、过氧化氢等方式建立氧化应激模型的先例,但是钒,其化合价位于-1到+5价之间,是一种强氧化剂,也是许多磷酸激酶的抑制剂,在医学上也用于胰岛素的替代物,但近年来的研究逐步发现其对肝脏、肺脏细胞的毒性,因此用钒来建立一个氧化应激模型,也是十分必要的。
因此,鉴于上述原因,为了进一步探究氧化应激造成蛋清品质下降的具体机制,有必要建立蛋鸡输卵管膨大部上皮细胞的体外氧化应激模型。
技术实现要素:
有鉴于此,本发明针对现有方法培养的蛋鸡输卵管膨大部上皮细胞易受成纤维细胞污染的问题,且为了进一步探究外来环境引起蛋清品质下降的具体机制,提供了一种蛋鸡输卵管膨大部上皮细胞培养及氧化应激模型建立方法。
为了解决上述技术问题,本发明公开了一种蛋鸡输卵管膨大部上皮细胞的培养方法,具体包括以下步骤:
步骤1,将蛋鸡处死后,在无菌条件下取出整段输卵管浸泡于PBS中,并去除系膜、结缔组织和血液;
步骤2,将输卵管的膨大部剪下,用PBS清洗后剪碎成组织块,并用PBS清洗组织块;
步骤3,将清洗后的组织块转移至胶原酶IV中,于37℃消化一定时间;
步骤4,将消化后的消化液过滤,滤液进行离心,离心后弃上清液得细胞,向细胞中加入完全培养基,使细胞重悬,最后将细胞转移至培养瓶中,置于体积浓度为5%的二氧化碳、37℃的条件下培养。
进一步地,还包括:在培养2.5~3h后,采用差数贴壁法,将培养瓶中的液体转移至新的培养瓶中,重复此操作1~2次。
进一步地,所述胶原酶IV的浓度为1mg/ml;所述消化的时间为70min。
进一步地,所述组织块的大小为1mm3;所述离心的转速为700rpm、时间为20min;所述培养的时间优选72h。
进一步地,所述完全培养基组成为:91%的DMEM/F12基础培养基,5%胎牛血清,2%鸡血清,1%非必需氨基酸,5ug/ml胰岛素,20IU/ml的肝素,2mM的L-谷氨酰胺,15ng/ml表皮生长因子,1%青链霉素。
本发明还公开了一种蛋鸡输卵管膨大部上皮细胞氧化应激模型的建立方法,具体包括以下步骤:
步骤1,培养蛋鸡输卵管膨大部上皮细胞;
步骤1.1,将蛋鸡处死后,在无菌条件下取出整段输卵管浸泡于PBS中,并去除系膜、结缔组织和血液;
步骤1.2,将输卵管的膨大部剪下,用PBS清洗后剪碎成组织块,并用PBS清洗组织块;
步骤1.3,将清洗后的组织块转移至胶原酶IV中,于37℃消化一定时间;
步骤1.4,将消化后的消化液过滤,滤液进行离心,离心后弃上清液得细胞,向细胞中加入完全培养基,使细胞重悬,最后将细胞转移至培养瓶中,置于体积浓度为5%的二氧化碳、37℃的条件下培养。
步骤2,采用培养的蛋鸡输卵管膨大部上皮细胞,通过MTT法分别测试不同浓度的重金属和不同的作用时间下的细胞活力,根据测试结果确定重金属作用时间点;
步骤3,以步骤2确定的时间点,设计不同的重金属浓度梯度,测定细胞凋亡、胞内活性氧的生成、细胞超氧化物歧化酶、乳酸脱氢酶的释放情况,选取最适合的重金属浓度,从而建立细胞氧化应激模型。
进一步地,所述步骤1还包括:在培养2.5~3h后,采用差数贴壁法,将培养瓶中的液体转移至新的培养瓶中,重复此操作1~2次。
进一步地,所述胶原酶IV的浓度为1mg/ml;所述消化的时间为70min。
进一步地,所述组织块的大小为1mm3;所述离心的转速为700rpm、时间为20min;所述培养的时间优选72h。
进一步地,所述完全培养基组成为:91%的DMEM/F12基础培养基,5%胎牛血清,2%鸡血清,1%非必需氨基酸,5ug/ml胰岛素,20IU/ml的肝素,2mM的L-谷氨酰胺,15ng/ml表皮生长因子,1%青链霉素。
与现有技术相比,本发明可以获得包括以下技术效果:
(1)本发明通过培养蛋鸡输卵管膨大部上皮细胞;然后测试不同浓度的重金属和不同的作用时间下的细胞活力,确定作用时间点;再以此时间点设计不同的重金属浓度梯度,测定细胞凋亡等情况,从而建立细胞氧化应激模型,以进一步探究外来环境引起蛋清品质下降的具体机制;
(2)本发明通过培养蛋鸡输卵管膨大部上皮细胞,建立膨大部上皮细胞氧化应激模型,为以后研究蛋清品质下降的具体机制提供基础,减少蛋鸡行业由于蛋鸡自身氧化应激造成蛋品质下降所造成的损失;
(3)本发明的蛋鸡输卵管膨大部上皮细胞培养方法科学合理,克服了现有方法培养的蛋鸡输卵管膨大部上皮细胞易受成纤维细胞污染的问题,原代细胞培养成功,细胞纯度达到95%以上,且成功建立了蛋鸡输卵管膨大部上皮细胞氧化应激模型。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明实施例蛋鸡输卵管膨大部上皮细胞图片,其中(a)和(b)均为细胞在72h后于荧光倒置显微镜下(200×)的图片;
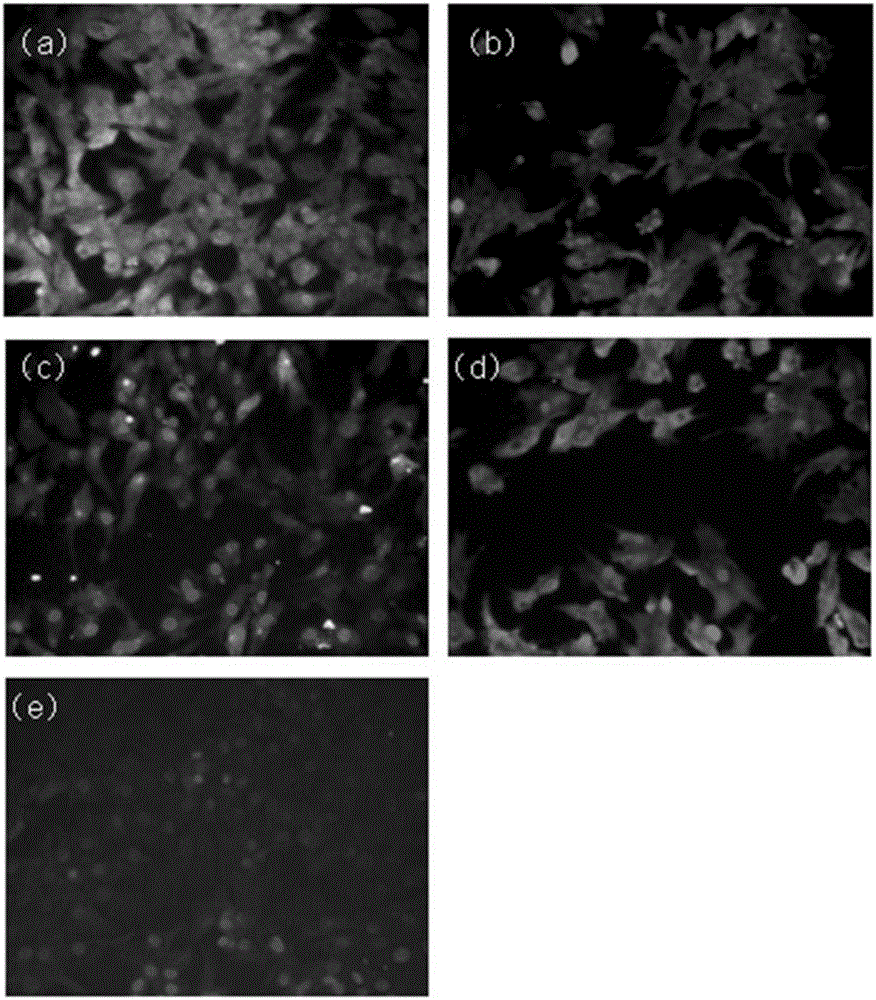
图2是本发明实施例蛋鸡输卵管膨大部上皮细胞免疫荧光染色图片,其中(a)为抗CK18图片,(b)为抗ESR1图片,(c)为抗OVA图片,(d)为抗PGR图片,(e)为抗Vimentin图片;
图3是本发明实施例在不同时间下细胞活力随钒浓度的变化曲线图;
图4是本发明实施例不同钒浓度下处理12h后细胞图片,其中(a)钒浓度0μmol/ml,(b)钒浓度25μmol/ml,(c)钒浓度50μmol/ml,(d)钒浓度100μmol/ml,(e)钒浓度250μmol/ml,(f)钒浓度1000μmol/ml;
图5是本发明实施例利用流式细胞仪测试得到的不同钒浓度下细胞的凋亡图,其中(a)钒浓度0μmol/ml,(b)钒浓度25μmol/ml,(c)钒浓度50μmol/ml,(d)钒浓度100μmol/ml,(e)钒浓度250μmol/ml,(f)钒浓度1000μmol/ml;
图6是本发明实施例不同钒浓度下细胞的凋亡率图;
图7是本发明实施例利用流式细胞仪测试得到的不同钒浓度下细胞内FITC荧光强度图;
图8是本发明实施例不同钒浓度下细胞内FITC荧光强度平均值图;
图9是本发明实施例不同钒浓度下细胞超氧化物歧化酶图;
图10是本发明实施例不同钒浓度下细胞脂质过氧化物图;
图11是本发明实施例不同钒浓度下细胞过氧化氢酶的活性图;
图12是本发明实施例不同钒浓度下细胞乳酸脱氢酶释放图。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本发明蛋鸡输卵管膨大部上皮细胞的培养方法,采用罗曼蛋鸡为试验动物,具体包括以下步骤:
步骤1,将蛋鸡处死后,在无菌条件下取出整段输卵管浸泡于PBS中,然后于生物安全柜中去除系膜、结缔组织和血液;
步骤2,将输卵管的膨大部位剪下,用37℃预热的磷酸盐缓冲溶液(PBS)(Hyclone)内外清洗两遍,随后用眼科剪剪碎膨大部至1mm3左右的组织块,期间用37℃预热的PBS清洗组织块,直至清洗后的液体变澄清;
步骤3,将清洗后的组织块转移至1mg/ml的胶原酶IV中,置于37℃水浴消化70min;选择此时间是因为能够较大程度的将上皮细胞消化下来,时间过长可能消化下来的成纤维细胞比较多。
其中,胶原酶IV(Sigma)用于将目的细胞从组织上消化下来,形成单个细胞。选择1mg/ml的胶原酶IV,是由于此浓度酶作用下,在能将细胞消化下来的情况下,对细胞损伤较小,消化下来的细胞较容易贴壁和生长。
步骤4,消化后的消化液用40nm尼龙过滤网过滤,将滤液700r离心20min,弃上清液得细胞,向细胞中加入完全培养基,轻轻吹打使细胞重悬,最后将细胞转移至培养瓶中,置于体积浓度为5%的二氧化碳、37℃条件下培养72h,细胞图片如图1所示。
700r离心20min可以将单细胞去除,进一步纯化细胞。
细胞培养72h后,可铺满底部80%以上,此时细胞活力较强,可用作后一步试验处理。
进一步地,所述完全培养基组成为:91%的DMEM/F12基础培养基(Hyclone),5%胎牛血清(Gibco),2%鸡血清(Gibco),1%非必需氨基酸(Sigma),5ug/ml胰岛素(Gibco),20IU/ml的肝素,2mM的L-谷氨酰胺(Ameresco),15ng/ml表皮生长因子(Peprotech),1%青链霉素(Hyclone)。
其中,添加非必需氨基酸既能够促进培养细胞生长,又可以延长培养细胞存活时间,并减少细胞的体外生物合成负荷;选用低浓度的胎牛血清(5%),能够一定程度抑制成纤维细胞生长;胰岛素和表皮生长因子能促进上皮细胞的贴壁;肝素能抑制成纤维细胞的增殖;L-谷氨酰胺是细胞合成核酸和蛋白质的重要原材料,有利于细胞的增殖。
进一步地,为了进一步减少成纤维细胞的污染,在培养2.5~3h后,采用差数贴壁法,将培养瓶中的液体转移至新的培养瓶中,重复此操作1~2次,目的细胞可达到95%以上的纯度。
本发明蛋鸡输卵管膨大部上皮细胞氧化应激模型的建立方法,包括以下步骤:
步骤1,培养蛋鸡输卵管膨大部上皮细胞;
步骤1.1,将蛋鸡处死后,在无菌条件下取出整段输卵管浸泡于PBS中,然后于生物安全柜中去除系膜、结缔组织和血液;
步骤1.2,将输卵管的膨大部位剪下,用37℃预热的磷酸盐缓冲溶液(PBS)(Hyclone)内外清洗两遍,随后用眼科剪剪碎膨大部至1mm3左右的组织块,期间用37℃预热的PBS清洗组织块,直至清洗后的液体变澄清;
步骤1.3,将清洗后的组织块转移至1mg/ml的胶原酶IV中,置于37℃水浴消化70min;
其中,胶原酶IV(Sigma)用于将目的细胞从组织上消化下来,形成单个细胞。
步骤1.4,消化后的消化液用40nm尼龙过滤网过滤,将滤液700r离心20min,弃上清液得细胞,向细胞中加入完全培养基,轻轻吹打使细胞重悬,最后将细胞转移至培养瓶中,置于体积浓度为5%的二氧化碳、37℃条件下培养72h,细胞图片如图1所示;
进一步地,所述完全培养基组成为:91%的DMEM/F12基础培养基(Hyclone),5%胎牛血清(Gibco),2%鸡血清(Gibco),1%非必需氨基酸(Sigma),5ug/ml胰岛素(Gibco),20IU/ml的肝素,2mM的L-谷氨酰胺(Ameresco),15ng/ml表皮生长因子(Peprotech),1%青链霉素(Hyclone)。
进一步地,为了进一步减少成纤维细胞的污染,在培养2.5~3h后,采用差数贴壁法,将培养瓶中的液体转移至新的培养瓶中,重复此操作1~2次,目的细胞可达到95%以上的纯度。
步骤2,采用培养的蛋鸡输卵管膨大部上皮细胞,通过MTT法分别测试不同浓度的重金属和不同的作用时间下的细胞活力,根据测试结果确定重金属作用时间点;
所述重金属以不同的化合价态形成化合物,高价态金属向低价态,如铁,铜,铬,钒通过氧化还原产生ROS,造成氧化应激。钒是动物生长发育所必需的微量元素,常见的化合价有+2,+3,+4和+5,而+5价的高价态钒作为一种还原剂,具有强烈的氧化性,易使细胞产生氧化应激。因此,优选采用+5价的重金属钒。
步骤3,以步骤2确定的时间点,设计不同的重金属钒浓度梯度,利用流式细胞仪测定细胞凋亡和胞内活性氧(ROS)的生成、细胞超氧化物歧化酶(SOD)、脂质过氧化物(MDA)、过氧化氢酶(CAT)的活性和乳酸脱氢酶(LDH)的释放情况,选取最适合的重金属钒浓度,从而建立细胞氧化应激模型。
下面结合具体的实验来说明本发明的有益效果:
1、通过细胞免疫荧光技术,鉴定所培养的蛋鸡输卵管膨大部上皮细胞及细胞纯度:
(1)试验方法:将输卵管膨大部上皮细胞以1×105密度接种于6孔板,待细胞密度达到70%时首先用PBS清洗细胞3次,然后用1000ul的4%多聚甲醛室温固定10min,PBS清洗细胞3次,每次5min;加入1000ul的0.5%的曲拉通X100(TritonX-100)室温放置20min,PBS清洗细胞3次,每次5min;加入1000ul的1%的山羊血清白蛋白封闭液,室温封闭1h。弃封闭液,各自加入兔抗细胞角蛋白-18(CK-18,Boster)、兔抗波形蛋白(Anti-Vimentin,LSBio)、抗卵清蛋白(ovalbumin,OVA,Acis)、兔抗雌激素受体1(ESR1,NOVUS)和鼠抗孕酮受体(PGR,NOVUS)600ul于5个不同的孔中,4℃过夜孵育,PBS清洗细胞3次,每次5min;加入600ul 488nm标记的山羊抗兔IgG(CST)和555nm标记的山羊抗兔IgG(CST),37℃避光孵育1h,PBS清洗细胞3次,每次5min。加入500ul的4',6-二脒基-2-苯基吲哚(DAPI),室温复染10min,PBS洗6次,加入1000ul的50%甘油抗淬灭剂,倒置荧光显微镜下室温避光观察染色结果。
(2)试验结果:通过免疫荧光显示,参见图2,细胞抗CK18,OVA,PGR以及ESR1呈阳性,而抗vimentin呈阴性,表明培养的细胞是蛋鸡输卵管膨大部上皮细胞,且纯度达到95%以上。
2、利用培养的蛋鸡输卵管膨大部上皮细胞,采用5×6因子试验设计,分为30个处理,设计6个钒浓度梯度(0、25、50、100、250、1000μmol/ml)和5个时间点(1、4、12、24、48h),通过MTT法测细胞活力。
测试结果:如图3所示,在12h,50μmol/L和100μmol/L的钒浓度下,细胞活力在70%左右,说明对细胞产生了一定影响,其他时间点的钒浓度对细胞损伤过小或达到不可逆损伤,因此确定钒作用时间点为12h。
3、选定钒作用时间点为12h,运用单因子试验设计,分为6个处理,每个处理对应一个钒浓度梯度,每个处理6个重复,利用流式细胞仪测定细胞凋亡和胞内活性氧(ROS)的生成,细胞超氧化物歧化酶(SOD),脂质过氧化物(MDA),过氧化氢酶(CAT)的活性以及细胞上清液中乳酸脱氢酶(LDH)的释放量,结果如下:
(1)细胞状态:如图4所示,细胞在各个钒浓度处理12h后,细胞在倒置荧光显微镜下的细胞状态。250、1000μmol/L钒处理12h对细胞伤害较大,细胞呈圆形甚至漂浮于培养基中,而100μmol/L钒处理12h,较多的细胞能维持本身较好的形态,但仍可见漂浮的细胞破碎物;25、50μmol/L钒处理12h,有少量细胞破碎物,但绝大部分细胞能维持正常的形态;0μmol/L钒处理12h,仅可见少量的细胞代谢产物漂浮,细胞形态正常。
(2)细胞凋亡:如图5和图6所示,细胞凋亡百分比随着钒添加量的增多而升高,且差异显著;250μmol/L和1000μmol/L的钒使细胞凋亡率达到70%以上;100μmol/L的钒细胞凋亡率为38.22%,显著高于对照组。
(3)胞内活性氧(ROS)的生成:通过FITC荧光强度反应细胞内ROS的生产量,FITC值越大,ROS生成越多,如图7所示,100和250μmol/L钒处理组的曲线向右偏移,说明FITC值增大,总体细胞中ROS的量增多;如图8所示,100μmol/L和250μmol/L钒处理组的FITC值显著高于0μmol/L钒处理组,说明总体细胞内产生的ROS量显著增多,25μmol/L和50μmol/L钒与0μmol/L钒处理组相比差异不显著。由于1000μmol/L钒处理组造成细胞大量死亡,检测到其FITC的值显著低于0μmol/L钒处理组。
(4)细胞超氧化物歧化酶(SOD):如图9所示,细胞内SOD含量随着不同浓度钒的添加变化较大,50μmol/L钒SOD的含量显著低于对照组,100μmol/L钒SOD的含量较对照组低;50μmol/L和100μmol/L钒的SOD含量与对照组差异不显著;50μmol/L和100μmol/L钒的SOD含量显著低于对照组。
(5)脂质过氧化物(MDA):如图10所示,与0μmol/L钒处理组相比,50μmol/L钒处理组MDA含量差异不显著,但100μmol/L钒处理组的MDA含量显著升高,100μmol/L钒处理组MDA含量高于0μmol/L钒处理组2.4倍。
(6)过氧化氢酶(CAT)的活性:如图11所示,与0μmol/L钒处理组相比,50μmol/L和100μmol/L钒处理组细胞CAT活性显著下降。
(7)乳酸脱氢酶(LDH)释放量:如图12所示,各处理组LDH释放量差异显著,随着钒浓度的增加,LDH的释放量呈线性增加;100μmol/L钒处理组LDH的释放量是0μmol/L钒处理组的2.04倍。
上述方法通过+5价的重金属钒使细胞产生氧化应激,原代细胞培养成功,细胞纯度达到95%以上,利用100μmol/L的钒作用12h,细胞活力维持在65%左右,引起细胞凋亡以及胞内ROS的生成显著增加,且引起抗氧化酶活相应变化,说明建立起膨大部上皮细胞氧化应激模型。
如在说明书及权利要求当中使用了某些词汇来指称特定成分或方法。本领域技术人员应可理解,不同地区可能会用不同名词来称呼同一个成分。本说明书及权利要求并不以名称的差异来作为区分成分的方式。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明本发明的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 多功能转录调控因子CTCF的DNA结合位点CTCF_33的应用的制造方法与工艺
- 一种生物活性多肽SKHSSLDCVL及其制备方法和应用与制造工艺
- 一种生物活性多肽TIASGEPT及其制备方法和应用与制造工艺
- 一种猪流行性腹泻病毒及其应用的制造方法与工艺
- 一种结肠上皮间淋巴细胞的分离方法与制造工艺
- 一种新型羧基末端肽及长效白介素7的制造方法与工艺
- 一种水溶液中短链脂肪酸的分析方法及应用与制造工艺
- 氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑十四酰基‑1,4‑苯二胺及其制备方法与制造工艺
- 氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑十六酰基‑1,4‑苯二胺及其制备方法与制造工艺
- 芳胺氮芥衍生物N,N‑二(2‑氯乙基)‑N′‑乙酰基‑1,4‑苯二胺及其制备方法与制造工艺