小麦TaSAP1基因的内含子TaSAP1in1序列及其应用的制作方法
本发明涉及分子生物学领域,具体是一种小麦TaSAP1基因的内含子TaSAP1in1序列及其应用。
背景技术:
作物转基因育种面临的一个基本问题是如何精细地调控外源基因的表达。植物在长期进化过程中,形成一套复杂精细的基因调控网络,能够在转录、转录后、翻译及翻译后等多水平调控基因的表达。因此,若要精细地调控外源基因的表达,须在多个水平实施调控。真核生物内含子可以在转录、转录后和翻译等多个水平影响基因表达,是优化外源基因表达的重要元件。
真核生物绝大多数基因是由不连续DNA序列组成的断裂基因,内含子是断裂基因中的非编码序列,在形成成熟mRNA过程中被精确切除。内含子的一个基本功能是通过选择性剪接丰富蛋白质的多样性,该现象最早在研究猿猴病毒(SV40)时发现,研究人员通过构建类似的病毒体系发现内含子的剪接还可显著影响mRNA表达水平。在植物中,内含子介导基因表达的增强作用也受到广泛关注,例如玉米Hsp82、Sh1、Adh1、GapA1 1(Callis et al.1987;Clancy and Hannah2002;Donath et al.1995;Sinibaldi and Mettler 1992;Wang et al.2008)和Ub1,水稻OsPB-73、rubi3、OsTub6(Chen and Wang 2004;Giani et al.2009;Samadder et al.2008),拟南芥MHX、PUX7、PYM、PhADF1(Akua and Shaul 2013;Gallois et al.2013;Mufarrege et al.2011)等。不同内含子增强基因表达的程度差异较大,普遍在2-10倍,但也有例外,如玉米基因sh1第一内含子在玉米和水稻原生质体中可增强报告基因表达约100倍(Maas et al.1991)。内含子增强基因表达效应的大小与其所处位置相关,一般认为靠近基因编码区5′端的内含子增强效应较大,如基因的第一内含子和5′非翻译区内含子。内含子增强基因表达的调控方式为人们研究其功能提供了新的切入点,同时也为在转基因育种中优化外源基因的表达提供了新途径。
在基因工程研究中,目的基因表达的强弱可能会对受体植株的表型产生巨大影响,因此,对基因表达强弱的控制往往是基因工程实验成败的关键因素之一。外源基因嵌入新的受体植物后,受不同遗传背景的影响,并不总能高效率的表达,内含子原则上可以对此进行调节,而利用内源性的内含子是最佳选择,目前,小麦中可用于调节基因表达的内含子很少,因此,发掘这类内含子对于转基因的精细调控及转基因安全性都具有重要意义。
植物SAP(Stress Associatied Protein)家族指的是一类具有A20/AN1锌指结构域的逆境相关蛋白。目前,许多植物中都有关于这类基因的研究报道,如水稻、拟南芥、番茄、蒺藜苜蓿、香蕉等。小麦TaSAP1基因参与了小麦对低温、干旱、盐胁迫等逆境的响应,在拟南芥中过量表达可以增强植株抵抗干旱、高盐和渗透剂等胁迫的能力(王彩香,2011)。
技术实现要素:
本发明的目的是提供一种增强外源基因表达的内含子序列及其用途,即分离自小麦TaSAP1基因5’非翻译区的内含子TaSAP1in1,所述内含子TaSAP1in1与启动子组合后,使外源基因能够在植物组织中高效表达。
本发明内含子TaSAP1in1的核苷酸序列,如SEQ No.1所示,序列长度为152bp,AT含量为38.16%。
本发明所述的内含子TaSAP1in1还包括SEQ No.1所示的核苷酸序列经替换、缺失或增加一个或几个核苷酸所衍生的具有相同功能的核苷酸序列。
本领域技术人员可将本发明内含子TaSAP1in1序列用于构建表达载体。可将内含子TaSAP1in1序列置于启动子上游,构建得到表达盒,然后将该表达盒插入植物表达载体中,获得含有本发明内含子TaSAP1in1的表达载体。因此,本发明还包括由上述内含子构建的表达盒或表达载体。
本发明内含子TaSAP1in1序列可用于转基因植物的制备。例如,利用农杆菌介导、花粉管通道以及基因枪法将整合有本发明内含子序列的表达盒导入受体植物,其中表达盒中的目的基因可以是抗虫、抗旱或其他逆境相关的外源或内源基因。受体植物可为双子叶植物(拟南芥)或单子叶植物,优选植物为单子叶植物,如小麦、水稻、玉米、高粱等。
本发明还提供了所述内含子TaSAP1in1与启动子组合后在转基因植物中驱动外源基因高效表达的应用。具体实验为:将本发明内含子TaSAP1in1序列与CaMV35S启动子搭配,并于下游GUS基因融合构建成表达载体,并转化拟南芥。GUS组织化学染色和GUS酶活性测定表明本发明提供的内含子TaSAP1in1序列能够增强CaMV35S启动子活性约3倍,是一种新的可用于植物基因工程中增强外源基因表达的内含子序列。所述的植物为单子叶植物或双子叶植物,优选为拟南芥、小麦、水稻、玉米或高粱。
附图说明
图1 TaSAP1 5’非翻译区内含子TaSAP1in1的克隆。图中箭头所示为内含子TaSAP1in1片段。
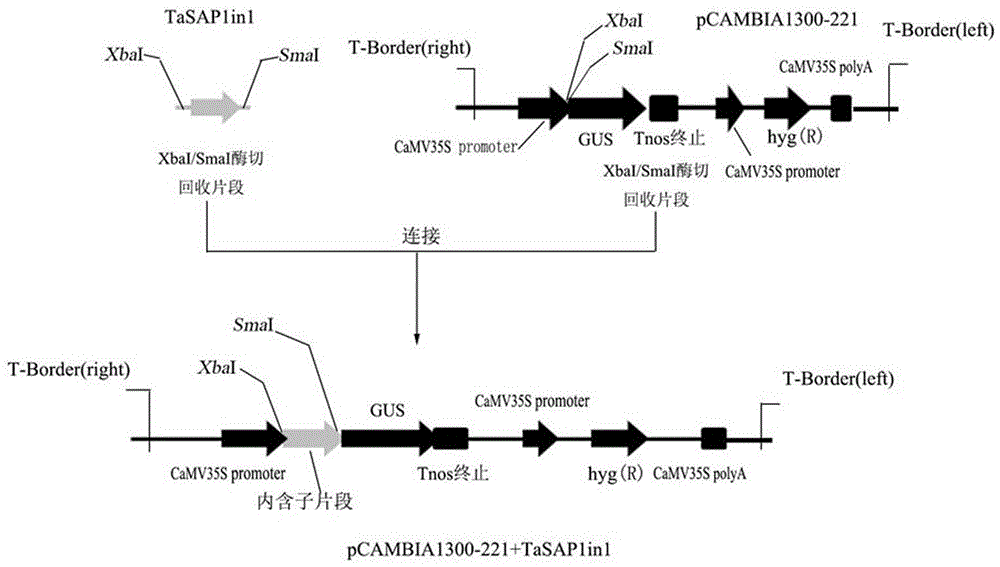
图2 TaSAP1 5’非翻译区内含子TaSAP1in1表达载体的构建过程示意图。
图3 TaSAP1 5’非翻译区内含子TaSAP1in1载体构建片段酶切检测图。箭头所示为从载体上酶切下来的内含子TaSAP1in1片段。
图4 拟南芥阳性植株的筛选图。图中箭头所示为经潮霉素B筛选后获得的阳性植株。
图5 转基因拟南芥幼苗GUS染色分析结果对比图。图中1表示野生型拟南芥;2表示的拟南芥含有pCAMBIA1300-221(含CaMV35S启动子)表达载体;3表示的拟南芥含有pCAMBIA1300-221+TaSAP1in1(含TaSAP1in1+CaMV35S启动子)表达载体.由图可知:转pCAMBIA1300-221+TaSAP1in1的GUS组织化学染色要明显深于转pCAMBIA1300-221的拟南芥植株,表明TaSAP1in1增强了CaMV35S的启动活性。
图6 TaSAP1 5’非翻译区内含子TaSAP1in1对CaMV35S启动子活性的增强作用(整株比较)。
图7 TaSAP1 5’非翻译区内含子TaSAP1in1对CaMV35S启动子活性的增强作用(不同组织器官比较)
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明实质的情况下,对本发明的方法、步骤或条件所作的修改或替换,均属于本发明的保护范围。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所使用的试剂如无特殊说明,均为常规配方。
小麦TaSAP1 5’非翻译区内含子TaSAP1in1的克隆
根据已有的TaSAP1 5’非翻译区序列,利用Primer Premier5.0设计引物,正向引物(TaSAP1in1F):5'AGCTGTTAGTACCCCTACCCTCCCC 3',反向引物(TaSAP1in1R):5'ACGCTGCAGAGAGACCCAACAAAAA3',引物中加粗部分为保护碱基,下划线部分为引入的酶切位点,分别为XbaI和SmaI,以含有本发明内含子TaSAP1in1序列的质粒载体(TaSAP1in1序列来自小麦旱选10号,详见文献Chang et al.,(2013),Planta 263:1495-1508,质粒由本课题组保存)为模版,PCR获得包含有酶切位点的内含子TaSAP1in1序列(图1),PCR产物回收后,连接到克隆载体pEAZY-Blunt simple vector上,转入大肠杆菌,过夜培养,提取质粒后,通过酶切和测序获得正确重组子。
表1 PCR反应体系
PCR反应程序:95℃预变性5min;95℃变性1min,60℃退火45s,72℃延伸1min,32个循环;72℃延伸2min。
载体构建
经酶切和测序检测正确的重组质粒再用XbaI和SmaI双酶切,回收酶切获得的启动子片段和经相同限制性内切酶处理过的pCAMBIA1300-221载体片段进行连接,构建pCAMBIA1300-221+TaSAP1in1重组质粒(图2),T4连接酶反应体系如表2,连接产物通过热激转入大肠杆菌,过夜培养,提取质粒,通过酶切(图3)和测序获得正确重组子。
表2 T4连接酶反应体系
拟南芥遗传转化
拟南芥培养
将适量种子放入2.0mL离心管中,加入含有0.01%TWEEN-20的10%(v/v)NaClO溶液消毒约15min,然后在超净台中用灭菌水清洗3~5遍,洗净消毒液。用移液枪将消毒后的种子转移到MS培养基上,均匀铺开,吸干多余水分,密封,4℃冰箱中春化处理2~4天,移入人工气候箱内(22℃,光周期12h),种子萌发后,在培养基中生长约一周后移苗。用保鲜膜覆盖塑料盒,2~3天后揭膜。在拟南芥2片真叶长出之前,要尽量避免干旱,保持充足的水分;真叶长出后,适当控制浇水次数,以免滋生真菌和虫害;花期拟南芥需水骤增,此时要确保水分供应。
籽粒收获:当角果完全变成褐色,且用手指按压不会变形,此时种子完全成熟,应该立即收获;但为了减少种子损失,当种子完全变黄时,即可收获部分种子,但此时的种子发芽率较低,收获后需放置1周后熟。
农杆菌感受态GV3101制备
取1μL构建好的重组质粒加入20μL GV3101感受态中,电击转化。加入500μL YEB液体培养基,28℃、250rpm恢复培养3h,取100μL涂板(含Rif 50mg/L,Kan 50mg/L)。挑取阳性菌斑加入5mL含Rif(50mg/L)和Kan(50mg/L)的YEB液体培养基中培养24~36h,菌液PCR检测,将阳性菌液转接至100ml含同样抗生素的YEB液体培养基中,培养至OD600=0.8。
拟南芥转化
拟南芥长至花期且有大量未开放的花蕾时为农杆菌浸染最佳时机。将上述100ml菌液室温下离心(7500rpm)10min,弃上清,用等体积拟南芥转化液(5%蔗糖,0.02%Silwet)重悬。将拟南芥花序浸入转化液中,约3min后取出,在避光的条件下放置培养48h后,恢复正常条件培养,约1个月后收获种子。
拟南芥阳性植株筛选
将收获的T1代种子消毒后平铺于含潮霉素B(25mg/L)的MS固体培养基上,4℃冰箱中放置2d,然后转入人工气候箱中生长约1周,在含有潮霉素B的平板上能够正常生长(根系发育正常、植株直立、叶片鲜绿)的植株(图4),初步确定为转基因阳性植株,将这些植株移入营养钵(蛭石:营养土=1:2)中生长。
纯系转基因植株的获得
取T1代阳性植株叶片提取DNA,进行PCR检测。阳性植株的种子分单株收获,标记为T1代。取T1代种子在含潮霉素B的培养基中继续进行抗性筛选,选择抗性分离比例为3:1的T2代植株单株收获,种子标记为T2代。对T2代种子继续筛选,标记全部为抗性植株的株系,收获后的种子记为转基因纯系种子。
GUS组织化学染色分析
依据Jefferson的方法(Jefferson,1987),转基因拟南芥叶片或其他组织放入1.5mL离心管中,加入X-GLUC染色液(50mmol/L磷酸钠缓冲液,pH 7.0,1mmol/L X-gluc,0.1%Triton X-100,0.1mmol/L亚铁氰化钾,0.1mmol/L铁氰化钾,20%甲醇),37℃保温过夜,次日取出脱色:分别用30%、50%、70%和100%乙醇漂洗5min,再用100%乙醇脱色至背景无色为止,脱色后的材料可以放在70%乙醇中保存或照相。
转基因阳性拟南芥植株染色结果表明TaSAP1in1能增强CaMV35S启动子的活性(图5)。
GUS荧光定量分析
为了研究内含子片段TaSAP1in1在不同组织的增强作用,分别取转pCAMBIA1300z-221+TaSAP1in1和pCAMBIA1300-221拟南芥阳性植株的叶片、茎、花、根和荚;为了研究TaSAP1in1对CaMV35S增强作用,选取转pCAMBIA1300z-221+TaSAP1in1和pCAMBIA1300-221拟南芥各3个株系,整株取样。将样品在液氮里研成粉末后,加入蛋白提取缓冲液(10Mm EDTA,1%SDS,50mM磷酸钠,0.1%Trition X-100,10mMβ-巯基乙醇,25μg/ml PMSF,pH8.0),用漩涡仪混匀,12000rpm离心10min,收集上清液用于GUS酶活分析。上清与底物MUG(4-甲基伞形酮酰-β-D-葡糖醛酸苷)反应,用荧光分光光度计测定反应物的荧光强度,通过公式计算GUS酶活力。结果显示TaSAP1in1可增强CaMV35S启动子活性约3倍(图6),不同组织活性分析表明,TaSAP1in1在拟南芥叶片、茎、花、根和荚中均可以不同程度增强CaMV35S的启动子活性(图7),其中叶片中的增强作用最大,约3倍,茎中的增强作用活性最小约2倍。
<110>山西省农业科学院旱地农业研究中心
<120>小麦TaSAP1基因的内含子TaSAP1in1序列及其应用
<160>1
<210>1
<211>152
<212> DNA
<213>小麦(Triticum aestivum)
<222>(1)…(152)
<400>1
GTTAGTACCC CTACCCTCCC CCCCGGATTC CGCCACGGGT CGCCCTCTCC 50
CCCGGATCCG TCTCCAGATT TAGGGCTCCG GCTCGGCCGA TCCGGGCTCG 100
TTTCCCCCCA TAACTTTTCG TCGCTGATGA TTTTTGTTGG GTCTCTCTGC 150
AG 152
- 还没有人留言评论。精彩留言会获得点赞!