小鼠前列腺癌循环肿瘤细胞系及前列腺癌循环肿瘤细胞分离和培养方法与流程
本发明属于生物技术领域,具体涉及小鼠前列腺癌循环肿瘤细胞分离及培养方法。
背景技术:
中晚期前列腺癌患者常伴有肿瘤骨转移,这也是前列腺癌最主要的死亡原因。前列腺癌发生骨转移的机制尚未明确,但血行播散是其中一个重要原因。国内外研究证实:50~70%前列腺癌转移患者血液中存在循环肿瘤细胞(CTC)数目显著提高,这一现象也提示了CTC在临床肿瘤转移研究中的重大意义。大量研究表明病人外周血液中出现循环肿瘤细胞与临床不良预后密切相关,而活检是一种侵入性的检查,给病人带来很大创伤和痛苦。CTC的分离和体外培养是实验室内研究CTC的关键环节。
目前为止,尚未见到前列腺癌循环肿瘤细胞分离、培养方法的报道。
技术实现要素:
本发明的目的在于提供一种小鼠前列腺癌循环肿瘤细胞系及前列腺癌循环肿瘤细胞分离和培养方法。
为达到上述目的,本发明采用了以下技术方案:
一种小鼠前列腺癌循环肿瘤细胞系,该前列腺癌循环肿瘤细胞系为原位前列腺癌NOD/SCID鼠的循环肿瘤细胞MPC2013,保藏编号为CCTCC C201601。
一种前列腺癌循环肿瘤细胞分离和培养方法,该分离和培养方法包括以下步骤:
1)取原位前列腺癌动物模型的外周血,用红细胞裂解液处理所述外周血,待体系变成透明的红色后于800~1400rpm离心5~8分钟(离心转速较低更有利于提高目标细胞的分离效率),用PBS液洗涤离心得到的细胞;
2)经过步骤1)后,将离心得到的细胞悬浮于含有5~15%FBS的1640培养液中,然后置于CO2细胞培养箱中进行培养,培养20~28小时后更换一次培养液,之后每30~48小时更换一次培养液(每次更换的培养液与悬浮细胞的培养液相同),通过更换培养液将悬浮生长的细胞清除,得到贴壁生长的细胞,即前列腺癌循环肿瘤细胞。
所述用红细胞裂解液处理所述外周血具体包括以下步骤:将所述外周血与红细胞裂解液按照1:10的体积比混匀后于4~25℃静置。(静置时的温度较低更有利于提高目标细胞的分离效率)
所述分离和培养方法还包括以下步骤:待贴壁生长的前列腺癌循环肿瘤细胞覆盖培养容器底部面积70~85%时进行传代。
所述传代具体包括以下步骤:以0.25%的胰蛋白酶溶液于20~26℃消化贴壁生长的前列腺癌循环肿瘤细胞,消化后以含有5~15%FBS的1640培养液重悬,然后置于CO2细胞培养箱进行培养,培养20~28小时后更换一次培养液,之后每30~48小时更换一次培养液(每次更换的培养液与悬浮细胞的培养液相同)。
所述动物模型采用的实验动物为SPF级NOD/SCID小鼠。
所述原位前列腺癌动物模型的建立方法包括以下步骤:将扩增得到的0.8~1.2×107个前列腺癌细胞系PC-3细胞用PBS液制成体积为80μL的细胞悬液,将细胞悬液注射至小鼠的前列腺,注射位置为前列腺左右及前后腹侧叶包膜下,然后饲喂7~10天。
所述前列腺癌循环肿瘤细胞的冻存和复苏方法包括以下步骤:
冻存:将细胞以冻存液重悬后于-20℃冻存1~2小时,然后于-80℃冻存8~12小时,然后置于液氮中保存;
复苏:将液氮中保存的细胞在38~42℃水浴中融化。
所述冻存液由新生牛血清(FBS)和二甲基亚砜(DMSO)组成,新生牛血清:二甲基亚砜的体积比=9:1。(冻存液有利于降低低温对细胞的损伤,提高冻存的效率)
本发明的有益效果体现在:
本发明分离并培养获得的循环肿瘤细胞质量均一,经免疫荧光及划痕和穿膜实验鉴定符合循环肿瘤细胞的特性,具有较强的转移和侵袭能力,是实验室研究前列腺肿瘤转移机制的良好实验工具,也为临床预防前列腺癌转移提供了研究模型。本发明的循环肿瘤细胞分离及培养方法简单易操作,分离的细胞可稳定传代,方便实验室研究循环肿瘤细胞特性等实验。本发明在研究肿瘤转移方面将会有广泛的应用。
附图说明
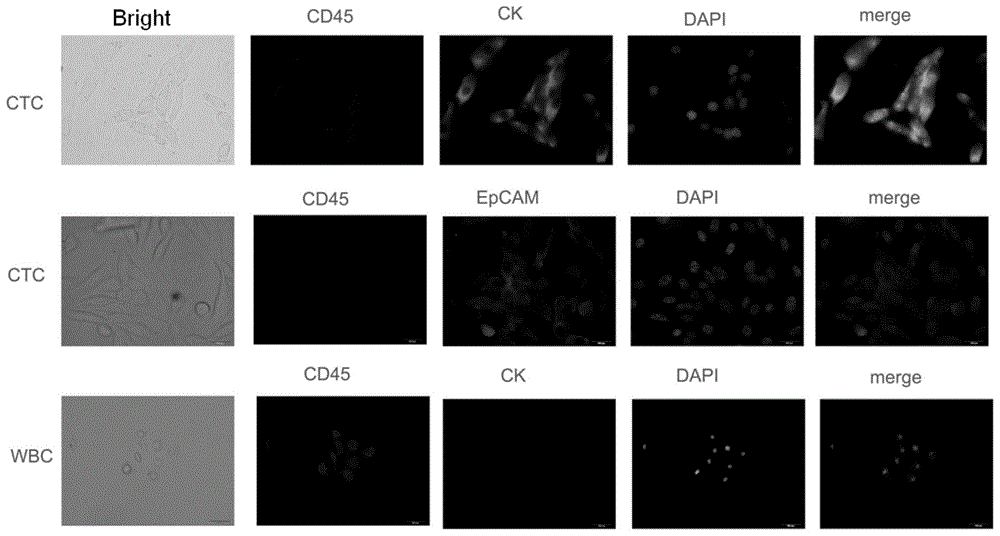
图1为免疫荧光鉴定循环肿瘤细胞(CTC)结果。
图2为获得的循环肿瘤细胞(CTC)与其母代PC-3细胞(PC3)的增殖能力比较;其中,A为两种细胞生长曲线比较,B为两种细胞皮下致瘤能力比较。
图3为获得的循环肿瘤细胞(CTC)与其母代PC-3细胞(PC3)迁移和侵袭能力比较;其中,A为划痕实验,B为侵袭实验。
具体实施方式
下面结合附图和实施例对本发明做详细说明。
本发明提出一种小鼠前列腺癌循环肿瘤细胞分离及培养方法,并由此方法首次分离、培养获得了原位前列腺癌NOD/SCID鼠的循环肿瘤细胞MPC2013,其已保藏于中国典型培养物保藏中心(中国,武汉,武汉大学),保藏日期为2015年12月22日,保藏编号为CCTCC NO:C201601。
(一)本实施例涉及的相关溶液
(1)1000mL 10×红细胞裂解液储存液:
NH4Cl 88.26g(Sigma A9434)、KHCO3 10.01g(Sigma P9144)及EDTA 0.37g(Sigma E5134)加入蒸馏水中,1M HCl调pH至7.2,室温保存。稀释10倍使用。
(2)1640培养基(美国GIBCO)
(3)含有10%FBS的1640培养液:1640培养基与新生牛血清(FBS)按体积比9:1混合。
(4)PBS液(0.01M):
8.0g NaCl、0.2g KCl、1.56g Na2HPO4·12H2O以及0.2g KH2PO4溶于1L蒸馏水中,1M HCl调pH值至7.4,高压灭菌后4℃保存。
(5)消化酶液:0.25g胰蛋白酶粉(美国GIBCO)溶于PBS液中,配制成质量分数为0.25%的胰蛋白酶溶液,过滤除菌,4℃保存。
(6)细胞冻存液:10mL DMSO(美国GIBCO)与90mL新生牛血清混合,4℃保存。
(二)原位前列腺癌动物模型建立
1.1实验鼠和细胞系准备
(1)扩增前列腺癌细胞系PC-3。
(2)购买SPF级NOD/SCID小鼠(Mus musculucs),五只一组。在第四军医大学动物中心动物房的SPF环境中按照SPF级动物饲养标准进行饲养,自由饮水。
1.2原位细胞注射
1.2.1材料准备:医用胶布,医用缝合针线,医用手套、口罩,高压灭菌的手术器械,手术架,0.1%戊巴比妥,青链霉素,酒精,碘酊。
1.2.2步骤:
(1)细胞计数,保证细胞数量足够每只小鼠1×107个细胞。将扩增的PC-3细胞以PBS液按照80μL/只进行稀释,混匀,得细胞悬液。
(2)以适量0.1%戊巴比妥将小鼠深度麻醉,固定于手术架上。
(3)将小鼠下腹部以碘酊消毒,剪开切口,显露膀胱和左右精囊腺,找到前列腺,在其前列腺左右及前后腹侧叶包膜下分四个点分别注入20μL混匀的细胞悬液。
(4)以注射器在伤口处滴少量青链霉素。
(5)以医用消毒缝合针线分层缝合腹壁切口。
(6)以碘酊对伤口进行清洗和消毒,待复苏后放回鼠笼。
继续饲喂7~10天后,NOD/SCID小鼠出现极度消瘦、衰竭状态,准备取血。
(三)红细胞裂解及循环肿瘤细胞培养过程
(1)取血之前,准备10个1.5mL的离心管,分别加入1×红细胞裂解液1mL。
(2)心脏取血,每取100μL血样加入一个加了1×红细胞裂解液的离心管中,以保证血样和红细胞裂解液的体积比为1:10。
(3)将上述装血样的离心管上下颠倒几次混匀,4℃下静置10分钟,直到混合液变成透明的红色。
(4)室温下离心,800rpm 5分钟,弃上清。
(5)5mL PBS液洗涤细胞(室温下离心,800rpm 2分钟,弃上清)。
(6)重复步骤5一次。
(7)洗涤后的细胞转移至含有10%FBS的1640培养液中,轻轻吹打混匀,细胞悬液移入细胞培养瓶中,在37℃、CO2体积浓度为5%、湿度为95%的细胞培养箱中以含有10%FBS的1640培养液进行培养,为防止真菌感染,培养液中可加入双抗:①100U/mL的青霉素和②5μg/mL的两性霉素B或0.1mg/mL的链霉素。
(8)培养24小时后更换一次含有10%FBS的1640培养液,之后隔天(48小时)换一次含有10%FBS的培养液。自第一次更换培养液起7~10天左右,细胞培养瓶中悬浮生长的白细胞通过换液会逐步被清除干净,肿瘤细胞会大量增殖(贴壁),形成克隆。待克隆(第一代细胞)较多并覆盖瓶底70%左右,进行第一次传代培养:弃掉培养液,以0.25%的胰蛋白酶溶液(加入量以可覆盖细胞为标准)于室温下进行消化2~3分钟,当细胞缩小变圆时,及时加入含有10%FBS的1640培养液中和(约为2倍胰蛋白酶溶液体积),800rpm离心5分钟,弃上清,消化后以含有10%FBS的1640培养液重悬,细胞悬液移入细胞培养瓶中,重悬时多吹打几次,将形成克隆的细胞团吹打成单个细胞,继续于37℃、CO2体积浓度为5%、湿度为95%的细胞培养箱进行培养,培养24小时后更换一次培养液,之后隔天(48小时)换一次培养液,待细胞覆盖瓶底70%左右时可进行下一次传代培养。
(9)关于冻存及复苏
冻存:将细胞以冻存液(FBS:DMSO体积比=9:1)重悬,0.5mL分装冻存管中后于-20℃冻存1~2小时,再于-80℃冻存过夜,冻存管置于液氮罐中保存。
复苏:将液氮中的细胞在42℃水浴中融化。
复苏后,将细胞移至离心管中离心,弃上清,细胞沉淀以含有10%FBS的1640培养液重悬,移至细胞培养瓶中,用与传代培养相同的培养方法和条件继续进行培养。
实验结果表明:细胞可以正常传代、冻存。分离的细胞可稳定传代7次以上。
(四)循环肿瘤细胞鉴定
根据文献报道,以EpCAM、CK、CD45和DAPI四种分子鉴定循环肿瘤细胞。
利用免疫荧光鉴定所培养的细胞和其母代PC-3细胞中EpCAM、CK、CD45和DAPI的表达。由于DAPI为蓝色荧光,CD45的抗体带红色荧光,CK和EpCAM均为绿色荧光,所以CK和EpCAM无法同时染色,故将这两种抗体分两次进行实验,参见图1,结果第一行表明该细胞CK呈阳性,第二行表明该细胞EpCAM呈阳性,两次实验均表明该细胞中CD45呈阴性。即结果显示,所培养的细胞EpCAM、CK、DAPI为阳性,CD45为阴性,符合循环肿瘤细胞特性。
(五)循环肿瘤细胞转移相关的增殖、迁移和侵袭能力研究(三次重复,n=15)
(1)比较获得的循环肿瘤细胞与其母代PC-3细胞的生长曲线和皮下呈瘤能力。
将1×104个的循环肿瘤细胞与其母代PC-3细胞分别种于两块六孔板的各孔中,每隔24小时消化收集其中一个孔中的细胞并计数,计数六次形成各自生长曲线。循环肿瘤细胞与其母代PC-3细胞按3×106个/只分别接种于裸鼠皮下,待形成肿瘤后,隔天测量肿瘤大小,绘制肿瘤的生长曲线。
结果显示,所获得的循环肿瘤细胞较其母代PC-3细胞无论在体内(﹡﹡表示P<0.01)还是在体外(﹡表示P<0.05)均具有更强的增殖能力(图2A、B)。
(2)比较获得的循环肿瘤细胞与其母代PC-3细胞的迁移和侵袭能力
划痕实验:将1×106个上述两种细胞种于直径3cm的培养皿中,第二天细胞长满皿底,完全融合。在超净工作台内以1mL枪头在铺满细胞的皿底均匀划直线,PBS液洗涤细胞,加培养液继续培养,显微镜下拍照。24小时后更换培养液,再次拍照。三次重复。
侵袭实验:CORNING transwell上室底部铺上基质胶,水化后将1×105个上述两种细胞种于transwell的上室,以100μL 1640培养基培养,下室加入500μL的含有10%FBS的1640培养液。16小时后取出上室,以棉签清除上室底部的细胞,并将上室底部浸入结晶紫的甲醛溶液中,37℃固定并染色20分钟。显微镜下拍照并统计每个视野中染色的细胞的个数,统计学分析两种细胞侵袭能力的差异。
实验结果显示,循环肿瘤细胞较其母代PC-3细胞具有更强的迁移和侵袭能力(图3A、B)。
另外,为保持循环肿瘤细胞特性,多冻存前两代细胞。
综合以上本发明的实验结果,可以证实,本发明首次分离培养得到了一种小鼠前列腺癌循环肿瘤细胞,描述为“原位前列腺癌NOD/SCID鼠的循环肿瘤细胞MPC2013”。本发明的分离和培养方法简单易操作,方便实验室对循环肿瘤细胞特性等实验的开展,在研究肿瘤转移等方面将会有广泛的应用。
- 还没有人留言评论。精彩留言会获得点赞!