表达神经退行性疾病保护肽的AAV9-CIP病毒及其制备方法与流程
本发明涉及医疗领域,具体地说是一种表达神经退行性疾病保护肽的AAV9-CIP病毒及其制备方法。
背景技术:
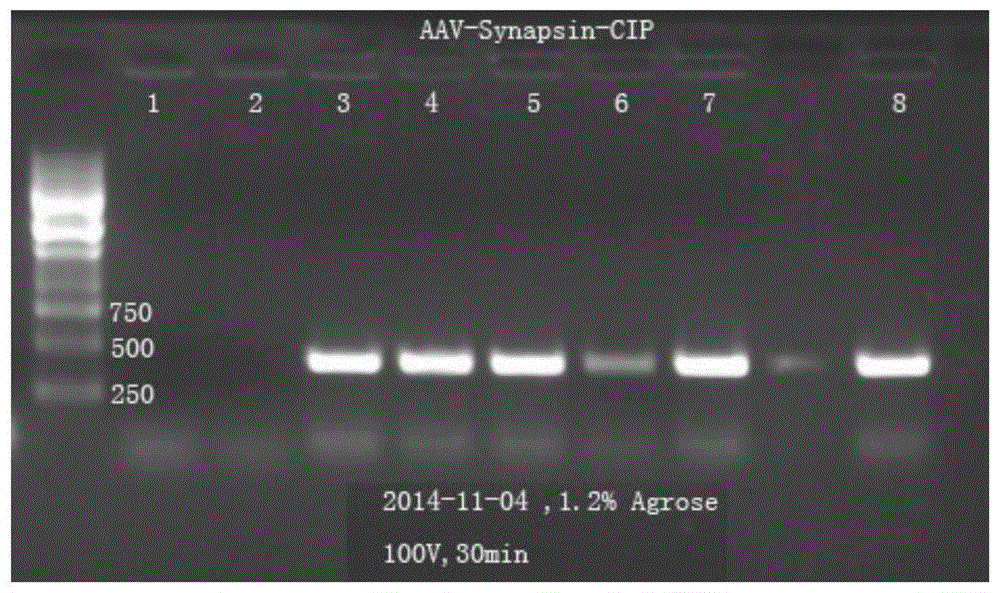
:目前人体及动物实验研究证明CDK5/p25的高活性在神经退行性疾病如阿尔兹海默病、帕金森病疾病、脊髓侧索硬化、卒中等神经元损伤过程中起到重要病理作用。CIP为p25末端的125个氨基酸残基片段,在体外神经元的保护实验及CIP转基因鼠和阿尔兹海默病疾病鼠模型杂交研究发现CIP肽能特异抑制CDK5/p25的毒性而对神经元起保护作用。但因CIP分子量过大(13.8kDa),不能通过血脑屏障,因此难以用于临床转化。技术实现要素:本发明的目的在于提供一种表达神经退行性疾病保护肽的AAV9-CIP病毒,建立用于神经系统退行性疾病如阿尔兹海默病等的通过AAV病毒表达的抑制CDK5/p25的肽CIP,同时本发明还公开了一种表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法。本发明的具体的技术方案为:一种表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法,包括以下步骤:步骤1:设计Myc-CIP引物,以pcDNA3.1-C-p35为模板通过PCR反应得到Myc-CIP基因片段;步骤2:将Myc-CIP基因片段插入到pCR2.1TOPO载体中,通过连接反应得到质粒pCR2.1-Myc-CIP;步骤3:将Myc-CIP基因片段以内切酶从pCR2.1-Myc-CIP切出并插入到pEGFP-C2载体的多克隆位点,得到质粒pEGFP-C2-Myc-CIP;步骤4:将GFP-Myc-CIP基因片段从质粒pEGFP-C2-Myc-CIP中切出,替代pAAV-hSynapsin-eGFP质粒的eGFP基因片段,得到质粒pAAV-hSynapsin-GFP-Myc-CIP;步骤5:将病毒表达质粒pAAV-hSynapsin-GFP-Myc-CIP、腺相关病毒包装质粒pAAV2/9和辅助质粒pHelper共转染到人胚肾293(HEK293)细胞中,转染72小时后收集含有病毒的细胞及培养液,对后者进行纯化分离得到AAV9-CIP病毒。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,步骤1中设计Myc-CIP引物具体为:在PCR反应管中加入:10×ExTaqBuffer(Mg2+Plus)体积为5体积份;dNTPMixture(各2.5mM)体积为4体积份;DNA聚合酶TaKaRaExTaq(浓度为5U/μl)体积为0.5体积份;Myc-CIP-5’端引物(100uM)体积为1.5体积份;Myc-CIP-3’端引物(100uM)体积为1.5体积份;pcDNA3.1-C-p35质粒模板(100ng/ul)体积为1体积份;加水至步骤1中的体积为50体积份;按照TaKaRaExTaqPCR反应试剂盒条件进行PCR扩增,得到Myc-CIP基因片段。从其原理上来说:先按照基因p35序列(全长1-924碱基对,见附加说明)对应的CIP序列位置(第460-837碱基)设计PCR扩增CIP基因片段的5’和3’端引物,5’引物序列除开与CIP序列第460-479碱基)完全相同的序列外,并在5’引物端引进了限制性内切酶ECORI酶切点和Myc序列,3’引物序列除开与CIP序列末端完全互补,并在其3’端加XbaI的酶切点序列,外源性的两个酶切位点加入是为了后续的克隆,Myc序列的引进是为了方便后续在细胞内检测CIP的表达,可以用抗Myc的抗体。5’和3’端引物均在Invitrogen公司合成。详细见后面的序列说明。TaKaRaExTaqPCR反应试剂盒条件具体为:将以上PCR管放置在ABI9600PCR仪中进行反应,选择PCR反应条件为:变性:94℃温度5min一次(使DNA模板完成变性),然后进行短暂变性(94℃,30秒);在94度加热使pcDNA3.1-C-p35质粒DNA模板完全变性,或使新合成的DNA双链全部打开,以利于引物按照特异碱基互补原则与DNA模板配对。退火(56℃,15秒);引物按照特异碱基互补原则与DNA模板配对和DNA模板自动配对,才能引导新的DNA片段合成;延伸:(72℃,30秒);循环:25次,最后一次延长合成时间72℃为10min。PCR反应体系中的DNA聚合酶会按照DNA模板的序列在已经配对的引物后面合成相对应的DNA系列。新合成的链完全和模板DNA序列互补,形成双链DNA片段。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,所述的步骤2中得到得到质粒pCR2.1-Myc-CIP具体为:将PCR产物进行DNA凝胶电泳分析,用刀片切割回收含有440bp大小的Myc-CIP目的片段,台式离心机离心,吸取含有Myc-CIP目的片段的溶液。将1体积份的Myc-CIP基因片段、1体积份的连接缓冲液、1体积份的pCR2.1载体、3体积份的水用pCR2.1-TOPO试剂盒构建pCR2.1-Myc-CIP质粒DNA,反应条件参照pCR2.1-TOPO试剂盒说明书的使用条件,质粒DNA经过常规方法转化大肠杆菌DH5a,扩增并用Sanger测序法进行序列鉴定。即取连接反应液5ul全部转化到自制的50ul感受态细菌DH5a中,冰上放置半小时后加LB细菌培养基37度水浴一小时后,取200ul细菌液铺在含有氨苄培养基的固体LB平皿上37度培养过夜,获得细菌所含的质粒序列经过Sanger测序确认。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,所述的步骤3中得到质粒pEGFP-C2-Myc-CIP具体为:S31:以EcoRI和XbaI酶切pCR2.1-Myc-CIP质粒,DNA电泳、胶切割回收含有440bp大小的Myc-CIP目的片段;S32:以EcoRI和XbaI酶切pEGFP-C2质粒,DNA电泳、胶切割回收含有4.7kb大小的pEGFP-C2/EcoRI+XbaI载体片段;S33:将Myc-CIP目的片段和载体片段用T4连接酶14℃连接,得到质粒pEGFP-C2-Myc-CIPDNA。即取连接反应液5ul全部转化到自制的50ul感受态细菌DH5a中,冰上放置半小时后加LB细菌培养基37度水浴一小时后,取200ul细菌液铺在含有氨苄培养基的固体LB平皿上37度培养过夜,获得细菌所含的质粒序列经过Sanger测序确认。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,所述的步骤4得到质粒pAAV-hSynapsin-GFP-Myc-CIP具体为:S41:以AgeI和HindIII酶切pEGFP-C2-Myc-CIP质粒,DNA电泳、胶切割回收含有722bp大小的EGF-Myc-CIP基因片段;pEGFP-C2-Myc-CIP质粒从美国美国宾夕法尼亚大学大学的PennVectorCore–GeneTherapyProgram公司购买。S42:以AgeI和HindIII酶切pAAV-hSynapsin-eGFP质粒,DNA电泳、胶回收刀片切割回收含有5.4kb大小的pAAV-hSynapsin载体片段S43:将回收的EGF-Myc-CIP基因片段和pAAV-hSynapsin载体片段用T4连接酶14℃连接,得到质粒pAAV-hSynapsin-GFP-Myc-CIPDNA。取连接反应液5ul全部转化到自制的50ul感受态细菌DH5a中,冰上放置半小时后加LB细菌培养基37度水浴一小时后,取200ul细菌液铺在含有氨苄培养基的固体LB平皿上37度培养过夜,获得细菌所含的质粒序列经过Sanger测序确认。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,所述的步骤5中的转染操作具体为:S51:转染细胞前24小时,将HEK-293T细胞传代,以1.5x107传代至15cm培养皿孔中;S52:转染前2小时,更换新鲜的DMEM-10%FBS培养液。S53:将pHelper、pAAV2/9和表达载体质粒pAAV-hSynapsin-GFP-Myc-CIP按2:1:1的比例与1.5ml不含胎牛血清的DMEM混合;pHelper、pAAV2/9这两种质粒均从美国美国宾夕法尼亚大学大学的PennVectorCore–GeneTherapyProgram公司购买。S54:按PEI:DNA=2:1比例的确定PEI的用量。将PEI加入到不含胎牛血清的DMEM中,总量至1.5ml;S55:将含质粒DNA的DMEM与含PEI的DMEM混合,室温下静置15min;S56:将混合液加入1.5ml不含血清的DEMEM中,替换6孔板中的培养液,置于37℃5%CO2细胞培养箱中;S57:转染后72小时,荧光显微镜下观察HEK-293T细胞,并分别收集细胞及培养液。在上述的表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法中,步骤5中纯化分离的具体操作为:S501:将S57收集的细胞及培养液于3500g离心10分钟,培养液转移至干净的培养瓶备用,离心后细胞及细胞碎片加入5ml细胞溶解液后,转移至50ml离心管;S502:经干冰-酒精、37℃反复冻融3次,破碎细胞释放病毒;S503:50U/mlDNA酶及10U/mlRNA酶加入到冻融后溶液中,37℃孵育30分钟;S504:加入0.5%脱氧胆酸钠,37℃孵育30分钟;S505:2500G离心10min,去除细胞碎片,收集上清;S506:加入40%PEG8000和2.5NNaCl到离心后上清液及步骤2)收集的培养液中,使PEG8000和NaCl终浓度分别为8%和0.5N;S507:冰上静置1hr,2000g离心30min;S508:弃上清,将含病毒的沉淀用10mlHEPES缓冲液重悬;S509:加入等体积的氯仿,室温下剧烈震荡2min;S510:370xg离心5min;S511:蒸发氯仿30min,留上清;S512:加入40%的PEG8000和50%硫酸铵,使终浓度为10%PEG8000和13.2%硫酸铵,室温下剧烈震荡2min,然后静置15-30min;S513:为了快速分离可溶性蛋白,室温下3000xg离心15min,此时蛋白盐析沉淀在底部,或两层之间析出。病毒集中在上层的PEG8000中;S514:将上层含病毒的PEG液小心吸出,加入5-10体积的病毒保存液至含病毒的PEG8000液中,使PEG8000稀释至在离心时能顺利经超滤管滤出。混合后病毒液转移至超滤管中,7000g反复离心,直至去除PEG8000;S515:最后,超滤管中残留浓缩的病毒液加入病毒保存液至总体积1ml,分装后置于-80℃保存备用。同时,本发明还公开了通过上述的方法制备得到的一种表达神经退行性疾病保护肽的AAV9-CIP病毒。与现有技术相比,本发明的有益效果在于:本方案采用现今基因治疗领域最有前景的腺相关病毒(adenoassociatedvirusAAV)作为载体。AAV是微小病毒科(Parvoviridae)家族的成员之一,是一种微小、无被膜及具有二十面体结构的非致病性病毒。rAAV作为表达载体具有以下优点:1、非致病性,安全性好;2、可以长期稳定表达;3、有不同的血清型,可以在全身不同器官的内表达;4、部分血清型病毒可透过血脑屏障,如rAAV-2/rAAV-9;5、自身免疫原性低,活体内不易导致排斥反应及药物耐。正因为rAAV作为表达载体具有无可比拟的优势,我们利用能在中枢神经系统表达AAV-9载体来表达CIP,制备AAV9-CIP病毒。在动物实验中AAV9-CIP病毒能通过鼠尾静脉注射而进入血脑屏障,保护帕金森病疾病鼠模型及阿尔兹海默病疾病鼠模型的神经元的损伤,因此有潜力作为系统性治疗神经退行性疾病靶向药物。附图说明图1是本发明实施例1的菌落的PCR反应图谱;图2是本发明实施例1的pAAV-hSynapsin-GFP-Myc-CIP(4)号菌液样本的测序结果;图3是本发明实施例1的pAAV-hSynapsin-GFP-Myc-CIP(5)号菌液样本的测序结果;图4是本发明实施例1的表达质粒在HEK293T细胞转染后的荧光效果;图5是本发明实施例1的表达质粒在HEK293T细胞转染后Western-blot分析的结果;图6是本发明实施例1的转染后的显微镜下的荧光效果;图7是本发明实施例1的病毒纯化前后的蛋白条带;图8是本发明实施例1的pAAV-hSynapsin-eGFP病毒qPCR的标准曲线图;图9是本发明实施例1的小鼠大脑在活体荧光成像仪下的荧光效果;图10是本发明实施例1的小鼠组织在活体荧光成像仪下的荧光效果;图11是本发明实施例1的rAAV-9-hSynapsin-eGFP-CIP病毒在神经退行性疾病鼠中的神经保护的行为学实验结果。图12是拓扑异构酶的载体质粒的图谱;图13是pEGFP-C2图谱。具体实施方式下面结合具体实施方式,对本发明的技术方案作进一步的详细说明,但不构成对本发明的任何限制。实施例在阐述本发明的方法之前对以下简称进行解释和描述:Myc-CIP引物:引物的5'端设计引进了一个限制性内切酶EcoRI酶切位点及c-Myc-tag的特异序列,EcoRI酶切位点的引进用于后续的Myc-CIP基因克隆到其它载体中,Myc序列和CIP保持同一个阅读框,将会在CIPN端加Myc的10个肽,以使表达的融合Myc-CIP融合蛋白能被c-Myc单克隆抗体所识别,可用于后续工作中体内CIP蛋白的鉴定识别,又由于Myc肽短,常用于帮助其它蛋白识别作用而不影响其它蛋白的功能。Myc-CIP引物:引物的5'端设计有c-Myc-tag的特异序列,以使表达的CIP蛋白能被c-Myc单克隆抗体所识别,可用于后续工作中体内CIP蛋白的鉴定识别。设计的引物中引进了Myc多肽位点及两个限制性内切酶酶切位点,用大写字母并划线表示。5’和3’引物中对应CIP基因片段的特异序列以斜体小写表示,5’引物中的GGATTC为EcoRI切点序列,3’引物中的TCTAGA为XbaI酶切位点;Myc多肽位点位于序列表中CIP5’端引物序列(序列表中的序列4)中第26-56位,具体序列为“ATGCAGAAGCTGATCTCAGAGGAGGACCTG”。酶切位点位于序列4第5-11位,具体序列为“GGATCC”。CIP3’端引物XbaI酶切位点,位于CIP3’端引物(序列表中序列5)第5-10位,具体序列为“TCTAGA”。pcDNA3.1-HIsC-p35:真核表达质粒pCDNA3.1-HisC插入了p35基因片段(序列表中序列1的基因序列,1-924碱基对),用于CIP的PCR模板(CIP序列位于p35的C-末端第460-837碱基序列),质粒pcDNA3.1-HIsC-p35由NIHHarishPant教授赠送(NIHHarishPant教授发表的CIP文献见下面三篇文章1.2002.EurJBiochem269:4427–4434.Apeptidederivedfromcyclin-dependentkinaseactivator(p35)specificallyinhibitsCdk5activityandphosphorylationoftauproteinintransfectedcells.(从p35衍生的肽能在体外培养的细胞中特异性抑制CDK5激酶活性及tau蛋白的磷酸化。)2.2.2005.EMBOJ24:209–220.ACdk5inhibitorypeptidereducestauhyperphosphorylationandapoptosisinneurons.(Cdk5抑制肽能在神经元细胞中抑制Tau蛋白的高磷酸化活性并预防神经元凋亡)3.3.2013.ThejournalofNeuroscience,2013-33(1):334-343;specificinhibitionofp25/cdk5activitybythecdk5inhibitorypeptidereducesneurodegenerationInvivo(p25/cdk5特异抑制肽在体内能减少神经退行性变)Myc序列见序列表中序列2的基因序列;CIP序列见序列表中序列3的基因序列。融合蛋白为:Myc-CIP,140个氨基酸残基,约15.4kDa,Myc肽序列为划线部分,其它为CIP序列。该融合蛋白由携带有Myc-CIP基因片段的表达质粒在真核细胞中翻译而成MASMQKLISEEDLMCLGEFLCRRCYRLKHLSPTDPVLWLRSVDRSLLLQGWQDQGFITPANVVFLYMLCRDVISSEVGSDHELQAVLLTCLYLSYSYMGNEISYPLKPFLVESCKEAFWDRCLSVINLMSSKMLQINADPpCR2.1TOPO:用于PCR克隆的原核表达载体,两端有测序引物,适合克隆序列的测序鉴定,从invitrogen购买。大小为3.9Kb,使用拓扑异构酶的载体质粒,其图谱如图12所示。pCR2.1-Myc-CIP:插入了Myc-CIP的基因片段pCR2.1TOPO质粒,自制;pEGFP-C2:真核表达载体含有绿色荧光基因片段,其C端含有多克隆位点,外源基因插入后可融合表达,从Clontech公司购买。pEGFP-C2图谱如图13。pEGFP-C2-Myc-CIP:Myc-CIP插入到EGFP的C端,保持相同的阅读框,能表达融合蛋白EGFP-Myc-CIP,自制。也可以从美国美国宾夕法尼亚大学大学的PennVectorCore–GeneTherapyProgram公司购买得到。pAAV-hSynapsin-eGFP:AAV真核表达质粒,携带有人神经元细胞表达的启动子synapsin,在神经元细胞中表达绿色荧光,pAAV-hSynapsin-eGFP购自宾夕法尼亚大学大学基因中心。pHelper:AAV病毒包装的辅助质粒,购自宾夕法尼亚大学大学PennVectorCore–GeneTherapyProgram公司;pAAV2/9:AAV病毒的外壳蛋白表达质粒,购自宾夕法尼亚大学大学PennVectorCore–GeneTherapyProgram公司;pAAV-hSynapsin-GFP-Myc-CIP:AAV真核表达质粒,携带有人神经元细胞表达的启动子synapsin,在神经元细胞中表达携带有绿色荧光的Myc-CIP融合蛋白,自制。在本发明中表达神经退行性疾病保护肽的AAV9-CIP病毒的制备方法具体为:步骤1:设计Myc-CIP引物,以pcDNA3.1-C-p35为模板通过PCR反应得到Myc-CIP基因片段;具体来说,将TaKaRaExTaq、10×ExTaqBuffer(Mg2+Plus)、dNTPMixture(各2.5mM)、Myc-CIP-5’端引物、Myc-CIP-3’端引物、pcDNA3.1-C-p35质粒、H2O在PCR仪中进行反应,反应条件为:退火温度分别设定为56度:94℃5min,(94℃15s-56℃30S-72℃48S)共25个循环,最后72℃10min。具体组分如下表1:表1组分体积TaKaRaExTaq(5U/μl)0.5ul10×ExTaqBuffer(Mg2+Plus)5uldNTPMixture(各2.5mM)4ulMyc-CIP-5’端引物1.5ulMyc-CIP-3’端引物1.5ulpcDNA3.1-C-p35质粒1ulH2O加至50ul步骤1中得到Myc-CIP基因片段具体为:先按照基因p35序列(全长1-924碱基对,见附加说明)对应的CIP序列位置(第460-837碱基)设计PCR扩增CIP基因片段的5’和3’端引物,5’引物序列除开与CIP序列第460-479碱基)完全相同的序列外,并在5’引物端引进了限制性内切酶ECORI酶切点和Myc序列,3’引物序列除开与CIP序列末端完全互补,并在其3’端加XbaI的酶切点序列,外源性的两个酶切位点加入是为了后续的克隆,Myc序列的引进是为了方便后续在细胞内检测CIP的表达,可以用抗Myc的抗体。5’和3’端引物均在Invitrogen公司合成。详细见后面的序列说明。将PCR产物进行DNA凝胶电泳分析,用刀片切割回收含有440bp大小的Myc-CIP目的片段。步骤2:将Myc-CIP基因片段插入到pCR2.1TOPO载体中,通过连接反应得到质粒pCR2.1-Myc-CIP质粒DNA;步骤2具体为:将PCR产物进行DNA凝胶电泳分析,用刀片切割回收含有440bp大小的Myc-CIP目的片段,台式离心机离心,吸取含有Myc-CIP目的片段的溶液。将1体积份的Myc-CIP基因片段、1体积份的连接缓冲液、1体积份的pCR2.1载体、3体积份的水用pCR2.1-TOPO试剂盒构建pCR2.1-Myc-CIP质粒DNA,反应条件参照pCR2.1-TOPO试剂盒说明书的使用条件。反应后置于4℃的冰箱中过夜。按CaCl2法制备DH5α大肠杆菌感受态菌,所制备的感受态菌的转化效率为1x108PFU/ml。取以上连接反应液2ul加入感受态细菌中进行质粒的转化。取全部菌液涂于含卡那霉素的LB培养基,12小时后观察结果。挑取阳性菌落,置于含氨卡那霉素的LB培养液中,37℃240rpm振荡培养箱中摇菌过夜,取1ml菌液用基因测序。测序结果提示pCR2.1-Myc-CIP克隆成功,为反向连接,全部序列正确。步骤3:将Myc-CIP基因片段以内切酶从pCR2.1-Myc-CIP切出并插入到pEGFP-C2载体的多克隆位点,得到质粒pEGFP-C2-Myc-CIP,带有绿色荧光标记;S31:以EcoRI和XbaI酶切pCR2.1-Myc-CIP质粒,DNA电泳、胶切割回收含有440bp大小的Myc-CIP目的片段;S32:以EcoRI和XbaI酶切pEGFP-C2质粒,DNA电泳、胶切割回收含有4.7kb大小的pEGFP-C2/EcoRI+XbaI载体片段;S33:将Myc-CIP目的片段和载体片段用T4连接酶14℃连接,得到质粒pEGFP-C2-Myc-CIPDNA。S34:取连接液5ul转化DH5α大肠杆菌感受态菌,取全部菌液涂于含卡那霉素的LB培养基,12小时后观察结果。取克隆用EcoRI和XbaI双酶切,获得4.7kb载体及440bp目的基因两个正确大小片段,确定克隆成功。步骤4:将GFP-Myc-CIP基因片段从质粒pEGFP-C2-Myc-CIP中切出,替代pAAV-hSynapsin-eGFP质粒的eGFP基因片段,得到质粒pAAV-hSynapsin-GFP-Myc-CIP;步骤4具体为:S41:以AgeI和HindIII酶切pEGF-Myc-CIP质粒,DNA电泳、胶回收刀片切割回收含有722bp大小的EGF-Myc-CIP基因片段;需要说明的是:AgeI和HindIII均为限制性核酸内切酶;S42:以AgeI和HindIII酶切pAAV-hSynapsin-eGFP质粒,DNA电泳、胶切割回收含有5.4kb大小的pAAV-hSynapsin载体片段;S43:将回收的EGF-Myc-CIP基因片段和pAAV-hSynapsin载体片段用T4连接酶14℃连接,得到质粒pAAV-hSynapsin-GFP-Myc-CIPDNA。取连接液5ul转化DH5α大肠杆菌感受态菌,取全部菌液涂于含卡那霉素的LB培养基,12小时后观察结果。S44:取克隆用AgeI和HindIII双酶切,获得5.4kb载体及722bp目的基因两个正确大小片段;确定克隆成功。S45:用lipofectamine2000试剂盒转染pAAV-hSynapsin-GFP-Myc-CIP质粒,观察荧光表达情况,72h后收集293T细胞,处理后做western-blot,观察CIP蛋白表达情况。步骤5:将病毒表达质粒pAAV-hSynapsin-GFP-Myc-CIP、腺相关病毒包装质粒pAAV2/9和辅助质粒pHelper共转染到人胚肾293细胞中,转染72小时后收集含有病毒的细胞及培养液,对后者进行纯化分离得到AAV9-CIP病毒。步骤5中的转染操作具体为:S51:转染细胞前24小时,将HEK-293细胞传代,以1.5x107传代至15cm培养皿孔中;S52:转染前2h,更换新鲜的DMEM-10%FBS培养液。S53:将辅助质粒pHelper、腺相关病毒外壳包装质粒pAAV2/9和病毒表达质粒pAAV-hSynapsin-GFP-Myc-CIP按2:1:1的比例与1.5ml不含胎牛血清的DMEM混合;需要说明的是,DMEM是一种含各种氨基酸和葡萄糖的培养基;S54:按PEI:DNA=2:1比例的确定PEI的用量。将PEI加入到不含胎牛血清的DMEM中,总量至1.5ml;(聚乙烯亚胺(Polyethylenimine,PEI),购于美国Polysciences试剂公司)DNA为辅助质粒pHelper、腺相关病毒包装质粒pAAV2/9和病毒表达质粒pAAV-hSynapsin-GFP-Myc-CIP的总含量S55:将含质粒DNA的DMEM与含PEI的DMEM混合,室温下静置15min;S56:将S55得到的混合液加入1.5ml不含血清的DEMEM中,替换培养皿中的培养液,置于37℃5%CO2细胞培养箱中;S57:转染后72小时,荧光显微镜下观察293T细胞,并分别收集细胞及培养液。步骤5中纯化分离的具体操作为依次进行的如下步骤:S501:将S57收集的细胞及培养液于3500g离心10分钟,培养液转移至干净的培养瓶备用,离心后细胞及细胞碎片加入5ml细胞溶解液后,转移至50ml离心管;S502:经干冰-100%纯度酒精混合液(酒精的量加到淹没过干冰的体积即可)、37℃水浴融化反复冻融3次,破碎细胞释放病毒;S503:50U/mlDNA酶及10U/mlRNA酶加入到经S502处理后的冻融后溶液中,37℃孵育30分钟;S504:加入0.5%脱氧胆酸钠,37℃孵育30分钟;S505:2500G离心10min,去除细胞碎片,收集上清;S506:加入40%(PEG8000溶液的重量百分比浓度)PEG8000和2.5摩尔当量的NNaCl到离心后上清液及步骤S57)收集的培养液中,使PEG8000和NaCl终浓度分别为8%和0.5N;S507:冰上静置1hr,2000g离心30min;S508:弃上清,将含病毒的沉淀用10mlHEPES缓冲液重悬;S509:加入等体积的氯仿,室温下剧烈震荡2min;S510:370xg(xg指离心机的转速单位)离心5min;S511:蒸发氯仿30min,留上清;S512:加入40%的PEG8000和50%硫酸铵,使终浓度为10%PEG8000和13.2%硫酸铵,室温下剧烈震荡2min,然后静置15-30min;S513:为了快速分离可溶性蛋白,室温下3000xg离心15min,此时蛋白盐析沉淀在底部,或两层之间析出。病毒集中在上层的PEG8000中;S514:将上层含病毒的PEG液小心吸出,加入5-10体积的病毒保存液至含病毒的PEG8000液中,使PEG8000稀释至在离心时能顺利经超滤管滤出。混合后病毒液转移至超滤管中,7000g反复离心,直至去除PEG8000;S515:最后,超滤管中残留浓缩的病毒液加入病毒保存液至总体积1ml,分装后置于-80℃保存备用。测试部分:Part1:pAAV-hSynapsin-eGFP-CIP的测定1.1、最后克隆pAAV-hSynapsin-eGFP-Myc-CIP如图1表示获得的8个可疑阳性菌落中有7个克隆的菌液以Myc-CIP的引物做PCR反应,3-8号样本均出现大小约为450bp的Myc-CIP片段,提示pAAV-hSynapsin-eGFP-Myc-CIP的3-8号样本可能克隆成功。1.2、测序鉴定取以上pAAV-hSynapsin-GFP-Myc-CIP(4)-(5)号菌液样本送Invitrogen公司测序,测序结果显示CIP序列正确。图2为pAAV-hSynapsin-eGFP-Myc-CIP(5)号菌液样本送Invitrogen公司测序结果,图3为pAAV-hSynapsin-eGFP-Myc-CIP(5)号菌液样本送Invitrogen公司测序结果,结果显示Myc-CIP序列完全正确,提示pAAV-hSynapsin-eGFP-Myc-CIP表达质粒构建成功。1.3、鉴定pAAV-hSynapsin-eGFP-Myc-CIP表达载体在真核细胞中表达目的蛋白。本实验利用脂质体转染法将以上表达载体转入HEK293T细胞中,以观察目的蛋白能否正确表达。因表达载体中CIP是和GFP融合表达的,因此,pAAV-hSynapsin-eGFP-Myc-CIP表达质粒在293T细胞转染后,如图4所示,24h后未见明显荧光,48h可见少量绿色荧光,72h后绿色荧光较为明显。结果提示pAAV-hSynapsin-eGFP-Myc-CIP质粒能在细胞内正常表达。1.4、pAAV-hSynapsin-eGFP-Myc-CIP转化后的细胞经过Western-blot分析,能正确表达大约42kDa的融合表达蛋白。如图5所示,pAAV-hSynapsin-eGFP-Myc-CIP质粒的样本箭头处有明显的大小约42Kda的特异性条带(EGFP+Myc+CIP),而做为阴性对照的转染pAAV-hSynapsin-eGFP载体的样本处只出现26kDa的条带(EGFP),另一组作为阴性对照的未转染质粒的293T细胞也未见条带,提示pAAV-hSynapsin-eGFP-Myc-CIP质粒构建成功,能在293T细胞内能正常表达特异性融合蛋白GFP-Myc-CIP。附图5中,一抗:GFP-tag,1:3000;二抗:羊抗兔IgG,1:10000(第一抗体使用抗GFP的抗体,能识别样本中GFP或含有GFP的融合蛋白,稀释度使用1:3000.第二抗体使用羊血清抗兔IgG,识别GFP的IgG的Fc末端,用于底物显色,在荧光扫描仪下可见条带,如图。)1.5、AAV-9-CIP病毒包装和纯化经过PEI共转染法将病毒表达质粒pAAV-hSynapsin-eGFP-Myc-CIP、腺相关病毒包装质粒pAAV2/9和辅助质粒pHelper共转染到人胚肾293细胞中。如图6所示,转染后72小时,荧光显微镜下观察293T细胞,图6中图6A为普通光镜下细胞密度几乎100%致密度,图6B为在荧光显微镜下可见有些细胞表达了绿色荧光。荧光亮度强弱不一。收集细胞及培养液按前面描述PEG8000/(NH4)2SO4双水相萃取法纯化AAV病毒。Part2:AAV-9-CIP病毒鉴定2.1.rAAV病毒特异性衣壳蛋白VP1/VP2/VP3表达的检测腺相关病毒cap基因编码三个结构蛋白质VP1、VP2和VP3,分子量分别为87、73和61kDa,通过检测病毒纯化前后衣壳蛋白VP1、VP2和VP3,可以反应病毒纯化的效果。如图7所示病毒纯化前的蛋白条带多(B),多为细胞裂解后的蛋白杂带,无法分清VP1、VP2和VP3蛋白。纯化后的病毒可见明显的VP1、VP2和VP3三条蛋白带(A),提示病毒纯化效果好。2.2.Real-timePCR法测定病毒基因组DNA滴度采用Real-TimePCR使用ABI公司7500型RealtimePCR扩增仪,使用Takara公司PremixExTaq(TliRNaseHPlus)试剂盒。我们首先在pAAV-hSynapsin-eGFP表达载体的bGH区设计real-timePCR的引物,随后以pAAV-hSynapsin-eGFP载体质粒作为标准品,计算其拷贝数,依据按拷贝数按10的倍数梯度稀释通过qPCR反应得出各梯度浓度样本质粒的△Ct值。依据标准样本质粒的△Ct值,做出标准曲线,得出标准曲线函数:y=-0.2324x+11.255(R2=0.9957),其中X轴为拷贝数的log值,Y轴为qPCR的△Ct值。再依据测得的rAAV-9病毒样本△Ct值,代入函数公式中,从而算得rAAV-9病毒滴度。计算标准品拷贝数(copies)将rAAV-9病毒的表达载体pAAV-hSynapsin-eGFP质粒作为标准品,计算其基因拷贝数。基因拷贝数计算公式为:(Copies/ul)=浓度(ng/ul)x10-9x6.02x1023(阿伏伽德罗常数)/分子量(碱基对数bpx660)。根据pAAV-hSynapsin-eGFP质粒浓度为385ng/ul,大小为5397bp,得出计算pAAV-hSynapsin-eGFP的拷贝数的算式为:Copies/ul=385(ng/ul)×10-9×6.02×1023(阿伏伽德罗常数)/(5397bp×660)=6.5067x1010制作标准曲线将pAAV-hSynapsin-eGFP质粒按10的倍数梯度稀释,浓度依次为6.5067x108至6.5067x10,通过qPCR得出各梯度浓度质粒的△Ct值,见表3-2-2。表3-2-2pAAV-hSynapsin-eGFP标准品qPCR结果依据标准品的△Ct值,做出标准曲线如图8;X轴:qPCR的△Ct值;Y轴:copies的log值计算病毒滴度,如表2将3个相同样本的△Ct值,得出△Ct平均值,代入函数y=-0.232x+11.25中,计算出X值,而滴度值=10xcopies/ul。表2Part3AAV-9-CIP病毒动物保护实验鉴定3.1AAV-9-hSynapsin-GFP-Myc-CIP病毒在小鼠体内表达分布本实验采用尾静脉注射法将rAAV-9-Synapsin-eGFP-CIP病毒注射至小鼠体内,观察病毒在颅内及其它器官的表达情况。小鼠尾静脉注射AAV病毒1x1012copie或以PBS100ul作为阴性对照。下图9左侧为小鼠脑实体图,右侧为活体荧光成像仪下荧光图,结果可见,注射AAV9病毒的小鼠大脑在活体荧光成像仪下可见明显绿色荧光(B),而未注射病毒但与注射病毒后小鼠一起饲养的小鼠(A)脑内无绿色荧光,刚从动物中心取回未做处理的小鼠(C)脑内也无绿色荧光表现。如图10所示,取注射病毒后的各组织检测荧光,小鼠脑组织及肝脏、肾脏较未注射病毒的小鼠荧光强度明显增强,尤其以脑组织内绿色荧光增强最为明显。图10中,A为未注射AAV9-Synapsin-GFP-Myc-CIP病毒的小鼠体内各器官,B为注射AAV9-Synapsin-GFP-Myc-CIP病毒7天后的小鼠体内器官。1-大脑,2-心脏,3-肺,4-肝脏,5、肾脏,6-肌肉。3.2AAV-9-hSynapsin-GFP-Myc-CIP病毒在神经退行性疾病鼠中的神经元保护实验用MPTP方法制造帕金森病(PD)动物实验模型,实验动物分组,分别为对照组(Control),MPTP的PD组,PD加AAV9-Synapsin-GFP-Myc-CIP病毒治疗组(AAV-9-CIP),PD加病毒对照组(AAV-9-GFP)。每组动物各10只,病毒注射剂量同上。病毒注射一周后开始MPTP注射造模,共注射MPTP5周,获得慢性PD,如图11所示,表现为多巴胺神经元损害,运动协调功能下降(滚筒实验A),出现焦虑(旷场试验B,和高架十字迷宫实验C和D)。但治疗组明显改善了运动和焦虑功能。其中图11中,横坐标代表四个组别A:Rotarod实验:检测小鼠的运动协调功能,纵坐标代表小鼠在滚筒上不掉落的持续时间的比较,MPTP组运动协调功能差,在滚筒上停留时间受损,AAV9-GFP-CIP治疗组有显著性改善,与对照组相比有显著性差异(P<0.05);B:OpenField实验:观察焦虑功能。MPTP组的小鼠从周边往中心爬行的距离明显减少,AAV9-GFP-CIP治疗组有明显改善,与对照组相比有显著性差异(P<0.05);C和D:高架十字迷宫实验,观察焦虑探索功能:C小鼠进入开臂次数的比较,D为小鼠在开臂内活动时间的比较。MPTP组与正常对照组相比有明显减少,经过AAV9-GFP-CIP治疗后症状显著改善,与MPTP组对比有显著性差异(P<0.05);图中Control:野生小鼠对照组;MPTP:小鼠注射MPTP后的帕金森病模型鼠(不注射AAV9-GFP-Myc-CIP或AAV9-GFP);AAV9-GFP-CIP治疗组:帕金森病模型鼠注射AAV9-GFP-Myc-CIP;AAV9-GFP对照组:帕金森病模型鼠注射AAV-9-GFP作为空病毒对照。总结:1.本方案成功制备了能通过静脉注射而在中枢神经系统表达的AAV-9-CIP病毒。2.AAV-9-CIP在PD疾病鼠慢性模型中提供的神经功能保护。以上所述的仅为本发明的较佳实施例,凡在本发明的精神和原则范围内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1