一种昆虫来源的多结构域内切几丁质酶、其相关的生物材料及其应用的制作方法
本发明属于生物技术领域,具体涉及一种昆虫来源的多结构域内切几丁质酶、其相关的生物材料及其应用。
背景技术:
几丁质是由β-N-乙酰氨基葡萄糖通过β-(1,4)糖苷键聚合而成的直链线性高聚物,主要存在于真菌细胞壁,虾蟹壳以及昆虫的外骨骼中。它是在自然界中含量仅次于纤维素的天然多糖,年产量至少100亿吨,是重要的可再生能源。其衍生物及水解产物几丁质寡糖具有抗菌、抗肿瘤等活性,在医学、食品、能源、农业等领域具有广泛的应用前景。
自然界中,几丁质的降解主要是由属于18家族糖苷水解酶的几丁质酶实现的。其主要分布在以几丁质为碳源的微生物以及将几丁质作为结构成分的真菌,甲壳类动物和昆虫中。研究发现,几丁质酶可以分为内切几丁质酶和外切几丁质酶两类,内切几丁质酶能够随机的切断几丁质糖链,而外切几丁质酶能够从一端切割几丁质糖链。
目前研究的几丁质酶多数对于酸碱热处理后的胶体几丁质具有较高的活性。通过内切和外切几丁质酶的协同作用就可以实现几丁质的高效水解。然而,天然的几丁质结构是十分致密的,几丁质酶只能作用在几丁质的表面,效率很低,并不能破坏几丁质的致密结构,这严重的影响了几丁质的水解效率。通过酸碱热处理的方法尽管能够使几丁质变蓬松,但是存在需要消耗大量的能源且污染环境的问题。如何将结构致密的几丁质变蓬松,使几丁质链释放出来,有利于几丁质酶的水解,是几丁质的降解过程中面临的难题。
技术实现要素:
通过蛋白质组学研究,申请人发现昆虫负责降解表皮几丁质的蜕皮液中存在一种独特的几丁质酶ChtII。它的一个酶分子中具有多个几丁质结合结构域和催化结构域,与已知报道的具有几丁质降解活性的酶具有很大的差别。它水解几丁质能够使几丁质的致密结构变得蓬松,这种昆虫中特有的新型几丁质酶对于开发利用几丁质资源具有重要意义。
首先,本发明公开一种蛋白质,具体是一种昆虫来源的多结构域内切几丁质酶,其为1a)~4a)中的一种:
1a)具有如SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.6所示氨基酸序列的蛋白质;
2a)在SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.6所示氨基酸序列的N端和/或C端连接标签得到的融合蛋白质;
3a)将SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.6所示的氨基酸序列经过1个、2个、3个、4个或多个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质;
4a)含有序列表中SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.6所示的氨基酸序列的具有相同功能的蛋白质。
本发明的另一个目的是提供与上述蛋白质相关的生物材料。
本发明提供的与上述蛋白质相关的生物材料为下述1b)-4b)中的任一种;
1b)编码上述蛋白质的核酸;
2b)含有1b)所述核酸分子的表达盒;
3b)含有1b)所述核酸分子的重组载体或含有2b)所述表达盒的重组载体;
4b)含有1b)所述核酸分子的重组菌或含有2b)所述表达盒的重组菌或含有3b)所述重组载体的重组菌。
本发明另一个目的是提供一种上文所述相关生物材料中,1b)所述核酸分子为如下1c)、2c)或3c)的DNA分子:
1c)如SEQ ID NO.2、SEQ ID NO.5或SEQ ID NO.7所示的DNA分子;
2c)与1c)限定的DNA序列至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性编码所述蛋白质的DNA分子;
3c)在严格条件下与1c)或2c)限定的DNA序列杂交且编码所述蛋白质的DNA分子。
优选的情况下,本发明上文4b)所述的重组菌是将氨基酸序列如SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.6所示的几丁质酶的编码基因导入宿主菌中得到的,
本发明上文所述重组菌中,所述几丁质酶的编码基因是通过重组载体导入宿主菌的;
本发明上文所述重组载体是将编码权利要求1所述蛋白质的核酸分子插入表达载体,得到表达权利要求1所述蛋白质的载体;本发明实施例中选用的表达载体是pPIC9。
本发明上文所述几丁质酶的编码基因的序列如序列表中SEQ ID NO.2、SEQ ID NO.5或SEQ ID NO.7所示。
本发明上文所述重组菌中,所述宿主菌为巴斯德毕赤酵母GS115.
本发明的另一个目的是提供一种制备几丁质酶方法。
本发明提供的制备几丁质酶方法包括如下步骤:发酵培养上述重组菌,得到几丁质酶。
上述蛋白质在作为几丁质酶中的应用也属于本发明的一个目的。
本发明还有一个目的是提供上述蛋白质或上述相关生物材料的新用途。
本发明提供了上述蛋白质或上述相关生物材料在水解固体几丁质,胶体几丁质和/或几丁寡糖的产品中的应用。
本发明还提供了上述蛋白质或上述相关生物材料在制备几丁寡糖中的应用。
本发明克隆了一种只在昆虫中具有的多结构域内切几丁质酶基因并进行了异源表达、重组酶纯化及其性质研究,通过对截短蛋白几丁质酶ChtII-B4C1的实验证明:该几丁质酶在水解几丁质过程中能够使几丁质底物变得蓬松,具有特殊的作用方式,目前在其它种类的几丁质酶中还没有被发现。由于全长ChtII比截短蛋白几丁质酶ChtII-B4C1具有更多的几丁质结合结构域和催化结构域,因此有理由相信其全长蛋白具有比几丁质酶ChtII-B4C1更好的水解几丁质的效果。其特殊的作用方式可用于几丁质寡糖的生产,与其它几丁质酶协同作用可以实现对几丁质的高效水解,其产物在医学、食品、能源、农业等领域具有广泛的应用前景,具有重要的意义和应用价值。
附图说明
图1.亚洲玉米螟2家族几丁质酶ChtII的基因获取。A:同源获取PCR产物D1凝胶电泳图;B:第一次3′RACE扩增产物3-1凝胶电泳图;C:第二次3′RACE扩增产物3-2凝胶电泳图;D:第一次5′RACE扩增产物5-1凝胶电泳图;E:第二次同源获取产物D2凝胶电泳图;F:SMARTer 5ˊRACE扩增产物5-2凝胶电泳图(目的条带为箭头所示);G:第一次RACE Walking扩增产物5-3凝胶电泳图(目的条带为箭头所示);H:第二次RACE Walking PCR产物5-4凝胶电泳图(目的条带为箭头所示);I:第三次RACE Walking PCR产物5-5凝胶电泳图(目的条带为箭头所示);J:第三次5′RACE扩增产物5-6凝胶电泳图;K:RACE验证扩增产物ChtII凝胶电泳图。
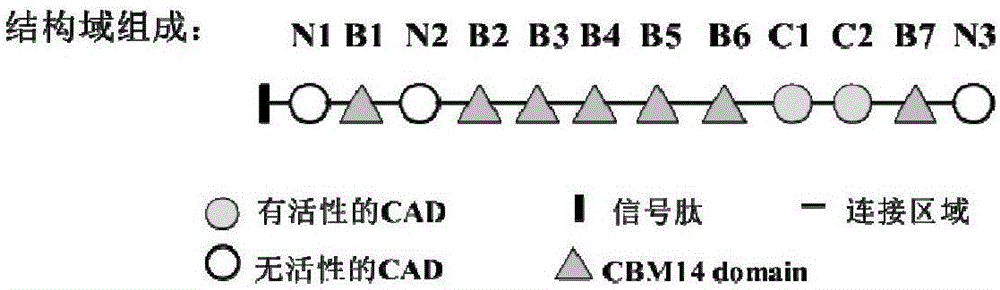
图2.几丁质酶ChtII的结构域组成;
图3.纯化后的重组蛋白几丁质酶ChtII-C1,几丁质酶ChtII-B4C1的电泳图;
图4.几丁质酶ChtII-C1对pNP-(GlcNAc)2底物的最适pH;
图5.几丁质酶ChtII-C1对pNP-(GlcNAc)2底物的最适温度;
图6.几丁质酶ChtII-C1对pNP-(GlcNAc)2底物的酶动力学曲线;
图7.几丁质酶ChtII-C1,ChtII-B4C1对胶体几丁质底物的酶动力学双倒数曲线;
图8.几丁质酶ChtII-C1,ChtII-B4C1对胶体几丁质底物的朗缪尔等温吸附曲线;
图9.几丁质酶ChtII-C1,ChtII-B4C1对胶体几丁质底物水解随时间变化;
图10.几丁质酶ChtII-B4C1对固体几丁质底物水解随时间变化;CK:对照;
图11.几丁质酶ChtII-B4C1对固体几丁质底物水解后的扫描电子显微镜观察;
图12.几丁质酶ChtII-B4C1对固体几丁质底物水解后的透射电子显微镜观察。
具体实施方式
下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。实施例中所用的实验方法如无特殊说明,均为常规的方法,所使用的材料,试剂如无特殊说明,均可以从商业途径得到。
本发明实施例1所用引物均由商业途径合成,相关信息如下:
D1-F-outer:5′-CTTGGGCGATAGACTTGGACGAC-3′,
D1-R-inner:5′-TGTGAGAAGTTCTACGTTTGCGTGA-3′,
D1-F-outer:5′-GGRTACTCCCAGTSGAKGTC-3′,
D1-R-inner:5′-CCAGTSGAKGTCCAKYCCGTCRAA-3′,
3R1-outer:5′-TGCAACTCAACGATGAAGTTCCT-3′,
3R1-inner:5′-GTACGCAATGCTCCCGACTGACT-3′,
3R2-outer:5′-AGTGCCAGTTTTAGCTCGCCTTCT-3′,
3R2-inner:5′-CCAACGGCCTTAATATTCCTGTC-3′,
5R1-outer:5′-AGACGGGTTTTGTAGGCTTAGAGG-3′,′
5R1-inner:5′-GAGTTGCATAGAGGTAGATTCCC-3′,
D2-F-outer:5′-GGAMHGACTCVSHAGGVGAYAARTA-3′,
D2-F-inner:5′-TTGGAACTATCCCGTTTGCTGGC-3′,
D2-R-outer:5′-TAGTGGTGGTCGTGCTGGGCGT-3′,
D2-R-inner:5′-CACAGCAGCGGTTGTTGAAGTC-3′,
5R2-outer:5′-CGCCACCTTTTAGAAGAGCTTTGAT-3′,
5R2-inner:5′-CAGGAACAAGTGGGGTATGATGCC-3′,
5R3-outer:5′-CATAATTCGCCTTATCGGACGCTG-3′,
5R3-inner:5′-GAAGTTGTGCATGCGCAGGAAAGGTA-3′,
5R4-outer:5′-CCCAATCCAAGGAGTACTTTGACG-3′,
5R4-inner:5′-GTCGGTCCTCTTCGCACAGCATT-3′,
5R5-outer:5′-ATACACTTAGCGACATCCAAATGACC-3′,
5R5-inner:5′-CGTTGAAATGGTGCTCAGTATTGGGA-3′,
5R6-outer:5′-GTCGAATAATGCGAATGAATTGCCAG-3′,
5R6-inner:5′-TGCCAGCTTCATCGAATGCAACCAC-3′,
ChtII-F-outer:5′-TCGCGACACGCACGGCCTAAACGCA-3′,
ChtII-F-inner:5′-ACGGCCTAAACGCAGGCGCATCTTC-3′,
ChtII-R-outer:5′-GCAAGTACCTATATTGAACG-3′,
ChtII-R-inner:5′-GCTAGCGTGGCTATTCCTAGTCTAA-3′,
C1-F:5′-aagcttacgtagaattctccttgcttaattctaggta-3′;
C1-R:5′-ggcgaattaattcgcggccgcttaatggtgatgatgatggtgactagtaggcttatgtggcttctgct-3′;
B4C1-F:5′-aagcttacgtagaattctcgggagacaatccgttcga-3′;
B4C1-R:5′-ggcgaattaattcgcggccgcttaatggtgatgatgatggtgactagtaggcttatgtggcttctgct-3′。
实施例1.亚洲玉米螟Group II几丁质酶基因同源获取
1.保守序列的获得
对文献中各种生物的Group II几丁质酶基因使用ClustalW2进行分组比对,根据保守序列设计简并引物D1-F-outer,D1-R-inner,D1-F-outer,D1-R-inner。以处于预蛹时期的亚洲玉米螟Ostrinia furnacalis(Guenee)(来自于中国农业科学院植物保护研究所)为材料,采用RNAiso plus试剂(购自大连TaKaRa公司)提取总RNA,并采用PrimeScript Reverse Transcriptase试剂盒(购自大连TaKaRa公司)反转录成cDNA作为模板。利用上述设计的引物,采用LA-Taq DNA聚合酶(购自大连TaKaRa公司)进行巢式PCR反应,扩增第一个片段。PCR扩增产物电泳鉴定结果如图1A所示。扩增产物片段长度252bp,其核苷酸序列如SEQ ID NO.1所示。该序列与参考序列相似度很高,可以确定是亚洲玉米螟Group Ⅱ几丁质酶基因同源序列。
2.3′RACE
根据之前同源获取得到的已知序列(252bp),设计3′RACE引物:3R1-outer、3R1-inner。分别以上述引物采用3′RACE试剂盒进行扩增,得到PCR扩增产物电泳鉴定结果如图1B所示。对3′RACE产物切胶回收,并对其测序,发现未达到3′末端,根据已知序列设计引物3R2-outer,3R2-inner进行第二次3′RACE,分别以上述引物采用3′RACE试剂盒进行扩增,PCR扩增产物电泳鉴定结果如图1C所示。对3′RACE产物切胶回收,并对其测序和序列比对,确定得到的3′RACE PCR产物是亚洲玉米螟Group Ⅱ几丁质酶基因3′端序列,已经到达终止密码子。
2.5′RACE
根据同源获取得到的已知序列设计,设计引物:5R1-outer、5R1-inner;分别以上述引物采用5′RACE试剂盒进行扩增,PCR扩增产物电泳鉴定结果如图1D所示。对5′RACE产物切胶回收,并对其测序和序列比对,所得序列为目的序列,但未到达5′端。
3.第二次同源获取
根据现有的已知序列设计引物以及同源序列的保守区域设计引物D2-F-outer、D2-F-inner、D2-R-outer、D2-R-inner,采用上述引物进行巢式PCR,获取的PCR产物电泳鉴定结果如图1E所示,对每个产物切胶回收,并对其测序和序列比对,获得ChtII的同源序列。
4.SMARTer 5ˊRACE
在步骤3同源获取得到的序列基础上,使用SMARTerTM RACE cDNA Amplification Kit进行5′RACE。根据已知序列设计引物5R2-outer、5R2-inner,分别以上述引物采用SMARTerTM RACE cDNA Amplification Kit试剂盒进行扩增,PCR扩增产物电泳鉴定结果如图1F所示。对目的产物切胶回收,并对其测序和序列比对,确认所得序列为目的序列,但未到达5′端,继续进行RACE Walking。根据已知的序列设计引物5R3-outer、5R3-inner;第一次RACE Walking,PCR扩增产物电泳鉴定结果如图1G所示。对目的产物切胶回收,并对其测序和序列比对,确认所得序列为目的序列,但仍然未到达5′端,继续进行RACE Walking。根据已知的序列设计引物5R4-outer、5R4-inner;第二次RACE Walking,PCR扩增产物电泳鉴定结果如图1H所示。对目的产物切胶回收,并对其测序和序列比对,确认所得序列为目的序列,但仍然未到达5′端,继续进行RACE Walking。根据已知的序列设计引物5R5-outer、5R5-inner,第三次RACE Walking,PCR扩增产物电泳鉴定结果如图1I所示。对目的产物切胶回收,并对其测序和序列比对,确认所得序列为目的序列,但仍然未到达5′端,更换样品继续进行5′RACE。设计引物为5R6-outer、5R6-inner;PCR扩增产物电泳鉴定结果如图1J所示。对目的产物切胶回收,并对其测序和序列比对,所得序列为目的序列,序列拼接后在其5′端的起始密码子前发现终止密码子,表明获取的基因序列已到达5′端的非编码区。
5.全序列验证
根据拼接得到的序列设计引物,ChtII-F-outer、ChtII-F-inner、ChtII-R-outer、ChtII-R-inner;分别以上述引物进行巢式PCR反应,PCR扩增产物电泳鉴定结果如图1K所示。对约9k的目的产物切胶回收,并对其测序和序列比对,确认该序列为亚洲玉米螟Group Ⅱ几丁质酶基因全长序列。
其核苷酸序列如SEQ ID NO.2所示,长度为9077bp,其中CDS区8790bp,命名为OfChtII。对该OfChtII基因进行氨基酸序列分析,推测出该核苷酸序列的第157-8943位核苷酸编码2929个氨基酸,其氨基酸序列如SEQ ID NO.3所示。8944-8952位核苷酸是三联终止密码子TAGTAATAA。氨基酸序列分析表明这2929个氨基酸存在7个几丁质结合结构域:B1(AA520-571);B2(AA1100-1149);B3(AA1228-1276);B4(AA1313-1362);B5(AA1415-1463);B6(AA1494-1543);B7(AA2489-2536),(如图2)和5个几丁质酶催化结构域N1(AA145-484);N2(AA630-969);N3(AA2560-2896),C1(AA1616-1967),C2(AA2062-2403)(如图2)。通过氨基酸序列同源性分析发现,其第三个和第四个催化结构域含有所有的保守的参与催化的氨基酸,分别将这两个催化域依次命名为C1,C2;而第1,2,5个催化域其催化氨基酸存在突变,分别命名为N1,N2,N3(N1-N3,如图2几丁质酶ChtII的结构域组成)。
实施例2几丁质酶基因ChtII-C1,ChtII-B4C1的获得及克隆
1.几丁质酶基因ChtII-C1,ChtII-B4C1的获得
根据ChtII的结构域特征,本实施例2选取了单独一个具有活性的催化域C1,以及含有几丁质结合结构域和活性催化域的一段氨基酸B4C1进行表达。分别依照C1(如序列表中SEQ ID NO.4)和B4C1(如序列表中SEQ ID NO.6)的氨基酸序列,并对C1部分的密码子的偏好性进行了优化,采用全基因合成的方法,分别合成如序列表中SEQ ID NO.5和SEQ ID NO.7的碱基序列。
2.几丁质酶基因ChtII-C1,ChtII-B4C1的克隆
本发明选取毕赤酵母表达系统对ChtII截短体ChtII-C1和ChtII-B4C1进行重组表达,将目的基因克隆到表达载体pPIC9的EcoRI和NotI酶切位点中,并在重组蛋白的C端添加6个组氨酸用于分离纯化。分别设计引物如下C1-F、C1-R、B4C1-F、B4C1-R用于对相应基因片段进行PCR扩增。表达载体pPIC9首先用DNA限制性内切酶EcoRI和NotI(购自大连TaKaRa公司)进行线性化,然后通过In-fusion连接试剂盒(购自Clontech公司),将含有ChtII-C1,ChtII-B4C1基因序列的PCR产物分别连接到pPIC9中。获得的含有ChtII-C1,ChtII-B4C1基因的重组质粒命名为pPIC9-C1和pPIC9-B4C1,经过测序确定目的基因(SEQ ID NO.5和SEQ ID NO7的碱基序列)克隆到表达载体pPIC9中。
实施例3几丁质酶ChtII-C1,ChtII-B4C1的表达及纯化
1.重组毕赤酵母菌株的构建
将实施例2中得到的重组质粒pPIC9-C1,pPIC9-B4C1通过电击转化的方法,分别转化到毕赤酵母菌株GS115中,通过组氨酸缺陷型平板筛选阳性菌落。进一步通过PCR的方法鉴定重组的酵母细胞是否含有目的基因。筛选为阳性的细胞采用YPD培养活化后,加入终浓度为30%的甘油存放于-80℃冰箱保存,用于后续蛋白质的表达。
2.重组毕赤酵母菌株的表达
无菌条件下取出步骤1中保存的菌保,采用组氨酸缺陷型平板划线培养获得单菌落。挑取单菌落,将其接种于10mLYPD培养基中,30℃、200rpm条件下活化菌株。将活化后的菌株以1%的比例加入到100mLBMGY培养基中,200rpm条件下培养24h扩增,使其OD(600nm)值达到2-4。将活化的酵母细胞悬液转移到离心管中,4500rpm条件下离心收集细胞。弃上清,用少许BMMY培养基重悬菌体后将之转移至500mLBMMY培养基中。然后每100mL分装在500mL三角瓶中,于30℃、200rpm的条件下培养。每隔24h补加1%的甲醇进行诱导表达,持续诱导5天(120h)。
3.几丁质酶ChtII-C1,ChtII-B4C1的分离纯化
分别取步骤2中的发酵液,在4℃、8000rpm条件下离心收集上清。向上清中加入硫酸铵使其饱和度达到75%(476g/L),在4℃冰箱中静置过夜沉淀蛋白。在4℃、12000rpm条件下离心20min收集硫酸铵沉淀。然后将沉淀溶解在Ni-A缓冲液(20mM磷酸盐,pH7.4;500mM NaCl)中。通过金属螯合层析,采用GE公司的IMAC Sepharose(5mL)色谱柱对含有组氨酸标签的几丁质酶ChtII-C1,ChtII-B4C1进行分离纯化。首先,采用Ni-A缓冲液以1mL/min的流速预平衡色谱柱;然后,将样品以1mL/min的流速上样,上样后继续用Ni-A缓冲液清洗达到平衡;之后,分别用含有20mM咪唑的Ni-A缓冲液,和50mM咪唑的Ni-A缓冲液分别清洗非特异性结合的重组蛋白,直到平衡;最后,用含有250mM咪唑的Ni-A缓冲液进行洗脱,得到纯化后的重组蛋白几丁质酶ChtII-C1,ChtII-B4C1,分别命名为几丁质酶ChtII-C1和几丁质酶ChtII-B4C1,如图3所示。
实施例4几丁质酶的活性测定
由于ChtII的截短蛋白几丁质酶ChtII-C1和几丁质酶ChtII-B4C1含有相同的活性催化结构域,因此对于几丁质酶的模式底物pNP-(GlcNAc)2(Sigma,St Louis,MO,USA),本实施例仅列举了实施例2中分离纯化得到的几丁质酶ChtII-C1的活性测定方法。
1.最适pH的确定
测定不同pH下几丁质酶ChtII-C1的活力:采用60μL的反应体系,以pNP-(GlcNAc)2为底物,终浓度为0.1mM。分别取10μL实施例2中获得的几丁质酶ChtII-C1与48.8μL不同pH的Britton-Robinson缓冲液在96孔板中混合后加入1.2μL 5mM的pNP-(GlcNAc)2,在30℃反应30min(控制底物消耗不超过20%)。反应结束后加入60μL 0.5mM的Na2CO3终止反应,在405nm波长条件下测定吸光度。以pH为横坐标,不同pH条件下测得的产物量为纵坐标作图,确定几丁质酶ChtII-C1的最适pH在5-6之间(如图4)。
2.最适温度的确定
测定不同温度下几丁质酶ChtII-C1的活力:采用60μL的反应体系,以pNP-(GlcNAc)2为底物,终浓度为0.1mM。分别取10μL实施例2中获得的几丁质酶ChtII-C1与48.8μL pH为6.0的磷酸缓冲液混匀,在不同测试的温度预热5min。再加入1.2μL 5mM的pNP-(GlcNAc)2,反应30min。反应结束后加入60μL 0.5mM的Na2CO3终止反应,测定405nm波长光照条件下的吸光度。根据测定不同温度下的产物生成量作图,确定几丁质酶ChtII-C1对底物pNP-(GlcNAc)2的最适温度为30℃(如图5)。
3.几丁质酶ChtII-C1对pNP-(GlcNAc)2底物的动力学常数
采用60μL的反应体系,底物终浓度为0.01mM、0.02mM、0.03mM、0.04mM、0.05mM、0.06mM、0.07mM、0.08mM、0.1mM、0.15mM以及0.2mM。分别加入10μL实施例2中获得的几丁质酶ChtII-C1,剩余体积用pH 6.0的磷酸缓冲液补齐,在96孔板中混匀,30℃条件下反应30min。反应完成后加60μL 0.5M的Na2CO3终止反应,测定405nm波长条件下的吸光度。采用双倒数作图法,以底物浓度的倒数为横坐标,以产物对硝基苯酚浓度的倒数为纵坐标,作出一条直线,该直线与横坐标的交点为-1/Km,可求得几丁质酶ChtII-C1对pNP-(GlcNAc)2的Km为0.0958mM(如图6)。
实施例5几丁质酶ChtII-C1,ChtII-B4C1的性质比较
1.几丁质酶ChtII-C1,ChtII-B4C1对胶体几丁质的催化动力学常数比较
在1.5mL的离心管采用100μL的反应体系进行反应。底物终浓度分别为0.5mg/mL、0.75mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL、3.0mg/mL、4.0mg/mL,分别加入10μL实施例2中获得的几丁质酶ChtII-C1和ChtII-B4C1,剩余体积用pH 6.0的磷酸缓冲液补齐。将离心管至于30℃水浴锅中反应2h。反应结束后采用铁氰化钾测还原糖的方法测定产生的还原糖的量。向100μL反应液中加入300μL 2.0g/L的K3[Fe(CN)6],置于100℃沸水中煮沸15min。12000rpm下离心5min沉淀剩余的几丁质和变性后的蛋白,取200μL上清加入到96孔板中,测定405nm波长下的吸光度。采用双倒数作图法,以底物浓度的倒数为横坐标,以产生的还原糖浓度的倒数为纵坐标,作出一条直线,该直线与横坐标的交点为-1/Km,于是可以分别求得几丁质酶ChtII-C1和ChtII-B4C1对胶体几丁质的Km分别为1.806mg/mL和1.205mg/mL(如图7),最大反应速率Vmax分别为1.107和2.444,说明几丁质酶ChtII-B4C1对底物的亲和力更高,反应更迅速。
2.几丁质酶ChtII-C1和ChtII-B4C1与胶体几丁质结合能力比较
采用离子强度很小的10mM、pH8.0的Na2HPO4缓冲液作为平衡缓冲液以减少离子强度的影响。300μL的反应体系中几丁质酶ChtII-C1和ChtII-B4C1的蛋白终浓度的梯度范围为0.5μM、1.0μM、1.5μM、2.0μM、2.5μM,底物胶体几丁质的终浓度为3mg/mL。剩余体积用pH8.0的磷酸缓冲液补齐。采用同等浓度的BSA,在相同的条件下反应作为阴性对照。使用旋转混匀振荡器充分混匀体系,室温下反应两小时。反应后离心取上清溶液,用考马斯亮蓝法测上清中蛋白的浓度。根据上清的蛋白浓度可以得出结合的蛋白量,间接求得未结合蛋白的量。以未结合的蛋白浓度为横坐标,结合蛋白的浓度为纵坐标作图(如图8)。通过朗缪尔等温吸附方程求得几丁质酶ChtII-C1,ChtII-B4C1与胶体几丁质结合的常数Kd分别为0.5552和0.3316,说明几丁质酶ChtII-B4C1结合胶体几丁质的能力更强。
3.几丁质酶ChtII-C1和ChtII-B4C1水解胶体几丁质的活性比较
在1.5mL离心管采用300μL的反应体系进行反应。包括终浓度为5μM的酶,终浓度为2mg/mL的几丁质,剩余体积用pH6.0的磷酸盐缓冲液补齐。将1.5mL离心管水平放置在30℃的恒温培养箱中孵育,分别反应0.5h,1h,2h,4h,8h,20h。采用步骤1中的铁氰化钾法测定产物中还原糖的含量,以反应时间为横坐标,产物浓度为纵坐标作图。结果如图9所示,在加入等摩尔酶的情况下,几丁质酶ChtII-C1与ChtII-B4C1所含有的几丁质酶催化域相同。几丁质酶ChtII-B4C1水解胶体几丁质产生的产物量明显高于几丁质酶ChtII-C1,说明其活性较ChtII-C1明显提高。
通过步骤1,2,3中对于几丁质酶ChtII-C1和ChtII-B4C1的比较可以得知含有三个几丁质结合结构域的几丁质酶ChtII-B4C1对底物具有更高的亲和力和水解活性。
实施例6几丁质酶ChtII-B4C1对固体几丁质的作用
本实施例提供了以实施例2中获得的几丁质酶ChtII-B4C1水解难降解的固体几丁质的实施例。
1.几丁质酶ChtII-B4C1对固体几丁质粉末水解作用的观察
在0.2mLPCR管中采用0.2mL反应体系进行反应,包含终浓度为1μM的实施例2中几丁质酶ChtII-B4C1,浓度为4mg/mL的固体几丁质,剩余体积用0.1M pH6.0的磷酸盐缓冲液补齐。溶液混合后置于0.2mL离心管中,水平放置在30℃,200rpm的摇床中震荡进行反应。以加入同等浓度的固体几丁质粉末,不加酶作为对照组。在不同时间点取样,将离心管垂直放置,静止10min以让固体几丁质沉降,观察反应前后几丁质增加或减少的情况。由图10可以看出,与不加酶的对照组相比,随着时间的延长,加入几丁质酶ChtII-B4C1的固体几丁质体积变大,这一现象可能是由于几丁质酶ChtII-B4C1的水解导致几丁质颗粒变蓬松。
2.几丁质酶ChtII-B4C1对固体几丁质粉末的水解作用的显微观察
在2mL离心管中采用1mL的反应体系进行反应。包含终浓度为1μM的实施例2中几丁质酶ChtII-B4C1,浓度为4mg/mL的固体几丁质,剩余体积用0.1M pH6.0的磷酸盐缓冲液补齐。溶液混合后将离心管水平放置在30℃,200rpm的摇床中震荡进行反应。167小时后,通过扫描电子显微镜(美国FEI公司NOVA NanoSEM 450)和透射电子显微镜(日本JEM2000EX)观察酶水解实验组与不加酶的对照组相比固体几丁质的结构变化。
扫描电子显微镜观察条件:待反应结束后取0.1mL样品离心去除上清,加入0.5mL100%无水乙醇清洗一次,离心后弃上清,加入0.1mL的无水乙醇保存。观察时首先取10μL反应后的几丁质滴在切割好的0.4cm×0.4cm的硅片上,使其在硅片上分散开来。然后喷金,放入扫描电子显微镜中,在3.0kv条件下进行观测。结果如图11所示,ChtII-B4C1水解后几丁质颗粒的边缘不再清晰,结构变得松散,存在一些纤维从大的颗粒上脱离释放出来。
透射电子显微镜观察条件:待反应结束后取0.1mL样品离心去除上清,加入0.5mL100%无水乙醇清洗一次,离心后弃上清,加入0.1mL的无水乙醇保存。观察时首先将10μL几丁质滴在200目的普通碳膜的铜网上,在120kv条件下进行观测。结果如图12所示,B4C1水解后几丁质颗粒变松散,周围有细小的纤维存在于较大颗粒的周围。
- 还没有人留言评论。精彩留言会获得点赞!