人骨髓、脐带血、外周血干细胞分离试剂盒及其分离方法与流程
本发明涉及一种人骨髓、脐带血和外周血干细胞分离试剂盒及其分离方法,具体涉及到运用负选法原理制成的快速分离大容量人骨髓,脐带血,外周血干细胞的试剂盒,由稀释液,分离液和洗涤液组成,以适应临床干细胞治疗所需。
背景技术:
2007年步入岁末,生命科学界再次涌起波涛。日本和美国两个课题组相继运用转基因技术,在普通人的成纤维细胞导入Oct4,nanog,sox2等基因,发现成纤维细胞重新编程具备了人类胚胎干细胞的特性。这一研究成果引起了全世界震动。美国政府再接再厉,投入30亿美元资金,继续深入该课题的研究。干细胞研究的这一成果,大大缩短了将人类胚胎干细胞运用于临床的距离。
总所周知,干细胞是一类具有自我更新能力,能够分化为其他种类细胞,本身处于未分化状态的细胞。干细胞目前按照其分化能力可以分为全能,多能和定向干细胞三种。根据其来源,则可分为胚胎干细胞和成体干细胞。我们人类就是通过受精卵这个全能干细胞不断分化而来的。
1998年,美国威斯康辛麦迪逊大学的汤姆逊教授领导的课题组成功地建立了人类胚胎干细胞系,这一成果被誉为胚胎干细胞研究的里程碑,此后,干细胞领域的研究一直成为生命科学研究的前沿和热点。仁济医学院消化所经过多年的努力,于2006年成功建立了三株人类胚胎干细胞系,同时开始了将成体干细胞运用于肝脏疾病治疗的探索。干细胞的研究,正在成为人类疾病治疗的新曙光。
(一)人类胚胎干细胞研究和临床疾病的治疗
胚胎肝细胞,是具有多能性的细胞,在体外合适的诱导条件下,可以成功的诱导出各种细胞。美国UW的张素春博士,在运动神经元细胞的诱导中取得突破性进展。而威斯康辛灵长类研究所的科学家,则将猴子胚胎干细胞诱导所得的神经细胞移植到帕金森氏病候模型上,整个实验历时十年,最终获得成功,移植细胞完全治愈了病患猴子。而明尼苏达大学的丹·考夫曼博士克服了技术上的障碍,在诱导胚胎肝细胞获得能够杀伤肿瘤的免疫细胞上取得突破。仁济医院消化所干细胞实验室的蒯小铃博士运用胚胎肝细胞诱导肝脏细胞,取得了成功。在血液细胞的诱导方面,美国,英国,加拿大各国顶尖实验室,都投入大量人力,物力,全力以赴地希望获得可供移植的造血细胞。美国UW的麦克西姆博士运用一种名叫OP9的小鼠支持细胞,共培养人类胚胎干细胞,获得大量的造血干细胞。米克巴迪亚教授领导的加拿大McMaster大学肿瘤和干细胞研究所成功运动人类胚胎干细胞,建立了稳定的体外培养和诱导体系,成功地从胚胎干细胞中获得具有进一步分化潜力的造血干细胞。仁济医学院的科学家在综合上述两大顶尖实验室的基础上,建立了可从人类胚胎干细胞大规模获得可供移植的造血干细胞的体外诱导体系(见图1)。
胚胎干细胞要正真运用到临床,还有遥远的道路,其中,最主要的难点有两点,其一:如何解决免疫排斥的问题。对于这个问题,有着不同的思路,有人提出,可运用核移植的方法,将病人的体细胞去核,移植到去核的卵细胞中,然后再将杂合细胞推动到胚胎的囊胚阶段,从中分离胚胎干细胞。近期克隆猴的成功为这一思路的实现带来了希望。另有学者提出利用孤雌生殖的方式获得人类的胚胎。这方面的成果尚需进一步探讨。而上述的从皮肤细胞获得人类胚胎干细胞,是一个崭新的思路,但获得细胞的过程中导入基因的手段涉及到病毒,对于该细胞未来是否可以真正运用于临床治疗病人,还有待后续实验的进一步深入。胚胎肝细胞运用于临床疾病治疗的另一忧人之处是干细胞本身形成畸胎瘤的特性。虽然分化所得的细胞在移植中尚未发现成肿瘤的现象,但对于胚胎干细胞在体外扩增中是否存在着类似肿瘤的表观遗传的改变,是一个值得重视的命题。
(二)成体干细胞研究和临床疾病治疗
成体干细胞运用于临床疾病的治疗,如骨髓干细胞,脐血或外周血干细胞移植治疗血液病,已经报道很多。单用骨髓干细胞治疗非造血系统疾病,近年来则越来越受到重视。随着临床研究的迅速发展及安全性提高,这一技术的运用已经扩展至其他各个领域,包括治疗帕金森氏症,老年性痴呆症,骨折,股骨头坏死,骨质疏松症,心血管病,急性心肌梗塞,I型糖尿病,肌营养失调,糖尿病足,闭塞性脉管炎,肝炎,肝硬化及肿瘤的治疗、化疗后的支持疗法,都涉及了干细胞应用。例如,大量的文献报道:由于慢性糖尿病人引起的慢性肢体缺血,在经过了骨髓干细胞的移植治疗后,将近半数的患者肢体出现缺血性溃疡或坏疽的改善,提示这些肢体治疗成功。而植入一种名为CD133的骨髓干细胞,终末期慢性缺血性心肌病患者的心功能则得到了明显改善。综合我们的经验和观察,自体骨髓干细胞在肝脏再生和肝纤维化的治疗中同样具有作用。德国多赛多夫的科学家发现骨髓干细胞对于参与肝脏再生起了一定的作用,治疗组的肝的增生速度,在经干细胞移植后,比对照组快了2.5倍,提示这种新的治疗方法在临床上具有提高和促进肝脏再生的潜能。
综上所述,干细胞在生命科学领域内是当今的研究热点。在移植医学领域,由于同种供体的严重短缺,大量需要移植治疗的患者得不到及时救治,因此,异种动物和干细胞的应用就成为人们的希望。但多种原因造成异种移植未能取得突破性进展,而干细胞的研究则给各种疾病患者带来了曙光。骨髓干细胞移植已经运用于临床治疗患者,而干细胞研究的深入,使得运用干细胞生成可供移植的多种具有功能的组织和器官成为可能。细胞治疗目前可以治疗各种细胞损伤性疾病已经成为共识。开展新型干细胞分离试剂盒的研究具有广阔的市场应用前景。
众所周知,传统的分离人类单细胞核的简单而有效的方法最初是由Arne Boyum在1968年报道的,25年来商品化的淋巴细胞分离液(LymphoprepTM又名Ficoll-Isopaque)已经广泛地用于单核细胞的分离。其基本原理在于单核细胞(单核细胞和淋巴细胞)同多行核淋巴细胞(颗粒细胞)和红细胞相比具有较轻的浮力密度。大多数单核细胞的浮力密度是低于1.077g/ml。这些细胞可以通过一种密度在1.077g/ml的等渗溶液来进行分离。通过离心,形成密度梯度,红细胞和多行核淋巴细胞沉淀,而单核细胞集中在分离液等密度的交界面处。普通淋巴细胞分离液的密度为1.077g/ml并且含有一种名为Polysaccharide的成分,可以促进红细胞聚集和分层。但这也带来了两个不利的地方:(1)Polysaccharide可以结合在淋巴细胞表面,影响细胞的分裂;(2)因为红细胞聚集,所以要进一步处理红细胞的团块儿就显得十分困难。运用淋巴细胞分离液分离单核细胞,需要非常仔细地将稀释的血液样品加在分离液上,并且要保持血样和分离液之间存在清晰的界面。要做到这一步,需要良好的训练并且对于大量的样品来讲是耗时的。在经过繁琐的分离后,将单核细胞在经过免疫磁珠的分离法或者流式细胞分离法来进行干细胞的分离。整个过程耗时昂贵,细胞损失严重,活力受到明显影响。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种人骨髓、脐带血、外周血干细胞分离试剂盒及其分离方法。本技术方案应用负选收集法,可以选择性地除去红细胞,血小板,全部血浆物质,成熟的血细胞及淋巴细胞;能够收集所有的lin阴性的干/祖细胞;不需要采用动员剂,无血浆残留;可以分离大容量骨髓、脐带血和外周血,细胞回收率达到了85%。尤其合适于脐带血库和临床抽取的骨髓、脐带血和外周血样品处理。
本发明的试剂盒摒弃了将收集血样加入到类似淋巴细胞分离液这类分离液,并通过密度梯度离心收集干细胞的的思路,也摒弃了探索出一种高效快捷的可以适用于大样本骨髓、脐带血和外周血干细胞分离出造血细胞的理想方法,而是以羟乙基淀粉(HES Hydroxyethyl Starch 130/0.4)为主体,结合使用最新的“玫瑰花瓣抗体复合物”技术,采用负选收集法去除包括红细胞以及大部分非干细胞细胞群体。
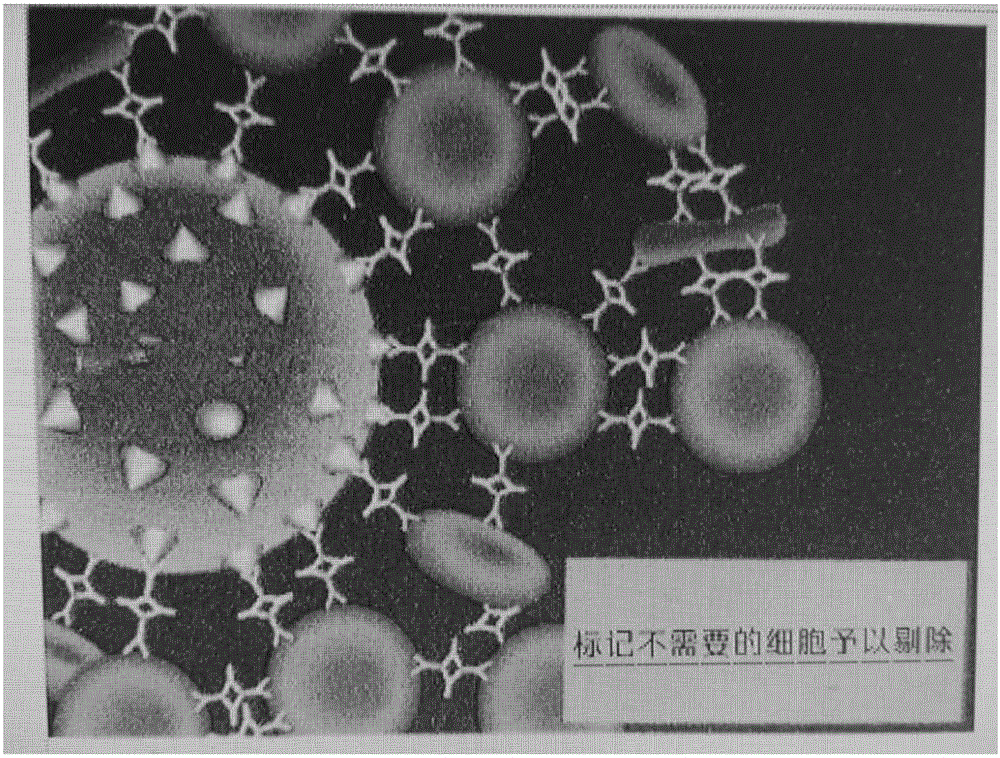
所谓的“玫瑰花瓣抗体复合物”(如图2所示)指的是通过抗体复合物将红细胞和不需要的有核细胞连接起来。具体讲,就是通过抗体(a)结合有核细胞,抗glycophorinA抗体(b)结合红细胞,复合物中的第三种抗体(c)可以结合抗体(a)和抗体(b)的Fc部分。这样,一个红细胞周围就会有好多有核细胞和红细胞彼此结合的过程,构成了红细胞-抗体a-抗体c-抗体b-目标细胞(特定单核细胞)的聚合体。由于这个聚合体呈玫瑰花瓣样,所以叫“玫瑰花瓣抗体复合物”。抗体的质量比是(a):(b):(c)=1:3:4。在本发明中,我们采用的抗体(a)是一种鸡尾酒式的组合配方,因为干细胞是不均一的细胞群体,缺乏直接的形态学特征,干细胞由于各自的生长阶段不同,其表面抗原性各异。根据表面抗原性的不同,干细胞被分为许多种类,如:CD34,CD133,sca-1,C-kit,Lin阴性等。在细胞治疗过程中哪一类干细胞在起主要作用,哪一类干细胞的可塑性最活跃,还有待于科学家进一步研究和证实。所以本试剂盒的设计思想是保留所有种类的干细胞/祖细胞。
在本发明中,我们不采用传统的密度梯度分离液将红细胞和单核细胞分离,而是采用羟乙基淀粉(HES),迅速将红细胞和造血细胞分离,因为在合适的羟乙基淀粉的浓度条件下,将羟乙基淀粉和骨髓、脐带血或外周血混匀,静止30分钟,即可以有效分离单核细胞。但是,如果不加入玫瑰花瓣抗体复合物,分离到的是单核细胞。
因此,本发明结合使用两种方案,这样,既快速从大容量血液中迅速除去大量血细胞,又得到比较纯的干细胞成分。由于本发明中的试剂不会使红细胞成块凝聚,而且羟乙基淀粉本身就是在医学上就是得到卫生部批号的作为血液容量扩充的制品,在临床应用中具有安全性。因此,经过处理的红细胞还可以回输给病人。这在临床具有很大的优点。
本发明最后设计的成分液C目的是进行密度梯度离心以去除血小板等成分。
经三步处理最终可以得到比较纯的涵盖各种干细胞的细胞群。
更具体地,本发明的目的是通过如下技术方案实现的:
第一方面,本发明提供一种人骨髓、脐带血、外周血干细胞分离试剂盒,所述分离试剂盒中包括如下试剂:试剂A、试剂B、试剂C;
试剂A:氯化钠溶液;
试剂B:含羟乙基淀粉、混合抗体的氯化钠溶液;
试剂C:淋巴细胞分离液或碘克沙醇工作液。
优选地,所述氯化钠溶液为生理盐水。
优选地,试剂B中,所述羟乙基淀粉在氯化钠溶液中的质量浓度为5-10%,所述混合抗体在氯化钠溶液中的浓度为4-12微克/毫升。
优选地,所述试剂B是通过如下步骤制备而得:
取混合抗体加入到质量浓度为5-10%的羟乙基淀粉生理盐水溶液中,得到试剂B。
优选地,试剂B中混合抗体浓缩液的制备是通过如下步骤制备而得:
S1、称取1毫克抗体(抗CD2,CD3,CD14,CD16,CD19,CD24,CD56和CD66b等);
S2、加入3毫克抗血型糖蛋白A(GlycophorinA)抗体(抗红细胞),与S1中抗体混匀;
S3、再加入4.0毫克P9抗体或者2.72毫克P9F(ab’)2抗体片段,37℃孵育过夜,使三者得到交联。
在使用过程中,混合抗体浓以1:4稀释在100毫升生理盐水中,得到混合抗体溶液,使混合抗体的浓度达到4-12微克/毫升。这样每种有核细胞的抗体的终浓度在细胞悬液中是1.0-3.0微克/毫升。
优选地,试剂C中,碘克沙醇工作液包括成分1和成分2;
成分1组成:细胞悬浮培养液pH7.4、0.85%(w/v)Nacl(氯化钠)和10毫摩尔每升Tricine-NaOH(N-三(羟甲基)甲基甘氨酸-氢氧化钠);
成分2组成:碘克沙醇注射液40%、0.85%(w/v)Nacl(氯化钠)和30毫摩尔每升Tricine-NaOH(N-三(羟甲基)甲基甘氨酸-氢氧化钠)。
优选地,10mmol/L Tricine-NaOH和30mmol/L Tricine-NaOH是通过如下步骤制备而得:
A1、将Tricine配成100mmol/L储存液,4℃保存;
A2、溶解0.85克氯化钠在50毫升水中,加10毫升的Tricine储存液,用1mol/L氢氧化钠调节体系pH至7.4,用超纯水定容至100毫升,配制得成分1中的10mmol/L Tricine-NaOH;
溶解0.85克氯化钠在50毫升水中,加30毫升的Tricine储存液,用1mol/L氢氧化钠调节体系pH至7.4,用超纯水定容至100毫升,配制得成分2中的30mmol/L Tricine-NaOH。
优选地,每个试剂盒包括:
试剂A 1瓶 500ml,
试剂B 1瓶 100ml,
试剂C 1瓶 100ml。
其中的试剂B中选用的抗体和试剂C均采用进口的材料(C为AxisShield PoC AS公司产品)。
本试剂盒中的试剂A、试剂C均为无色透明液体;试剂B为稍带粘性的澄明液体有时显轻微浮光;A,B,C三瓶试剂如出现浑浊,沉淀或者有絮状物则不能使用。
第二方面,本发明提供一种人骨髓、脐带血、外周血干细胞分离试剂盒的分离方法,包括以下步骤:
B1、将含有枸橼酸钠、肝素抗凝中一种或两种的骨髓、脐带血或外周血转移到无菌容器内,加入试剂A混匀;所述骨髓、脐带血或外周血与试剂A的体积比为1-3:0.5-2;所述无菌容器的体积为500毫升,也可根据分离的骨髓、脐带血或外周血体积决定容器的大小。
B2、将步骤B1混匀后的混合液与试剂B按1-5:0.5-3的体积比混合,充分混匀,室温静置,收集上层液a;其中,静置约20-30分钟,静置期间不得再摇动容器,红细胞沉降至最下层,用无菌移液管将上层液a(约占全容量的3/4)移至50毫升的无菌离心管中,吸至液面交界处,尽量不吸红细胞层;
B3、将上层液a离心分离(可通过离心机离心,弃上清液),收集下层物b(收集离心管底部的细胞);
B4、用试剂A冲洗下层物b(用试剂A将每个离心管内的细胞冲洗,移至一个离心管内),移至离心装置中再进行固液分离,收集下层物c;
B5、将下层物c中加入10-30毫升试剂A中,混匀后加入到20-35毫升试剂C中,离心;加入到试剂C中时,需沿离心管壁缓缓加入到装有试剂C的离心管中,注意加入速度要慢,保证两液体分界清楚;
B6、离心后吸取中间雾状的薄层加至新的离心管中,用试剂A洗涤两次,离心,收集细胞备用。
步骤B3、步骤B4、步骤B6中离心条件均为2000-3000rpm,离心3-10分钟;步骤B5中离心条件为1000-1500rpm,离心10-30分钟。
步骤B2中,室温静置后下层为红细胞层,用生理盐水洗涤红细胞后可回用。
与现有技术相比,本发明具有如下的有益效果:
1、在细胞分选的过程中,只需将试剂B和经试剂A稀释的骨髓、脐带血及外周血直接混合,就可以立即除去几乎所有的非干细胞成分,操作及其简单,尤其适合于移植实验所需。
2、经最后程序处理后,无任何试剂残留物遗留,对于输入机体体内后的安全性有绝对的保证。
3、最大程度的分离出人类骨髓、脐带血和外周血的各种干细胞,大大降低了干细胞的分离成本。
4、将无菌的60%碘克沙醇水溶液制成细胞分离介质-碘克沙醇分离液,构成了试剂C。该复合物,对于细胞的毒性,远远低于第一代的甲泛酸,尤其对于干细胞,分离后细胞存活率高,移植后效果好。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为从人类胚胎干细胞中诱导出可供移植的血液干细胞的示图;
图2为玫瑰花瓣抗体复合物的示意图;
图3为碘克沙醇iodixanol的结构式;
图4为第一代甲泛影酸Metrizoic acid的结构式。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
本发明试剂盒是专门用于从人类骨髓、脐带血、外周血中分离,纯化有核细胞,不能用于分离其他组织细胞。操作过程要求在万级洁净实验室的超净工作台内完成,以保证整个分离过程的无菌操作。必须保证操作过程使用的其他容器及所有直接接触骨髓/脐带血/外周血的物品无菌。
每一个试剂盒设计可分离纯化骨髓、脐带血或外周血200毫升。开瓶后必须一次使用,不能多次使用。
实施例
一种骨髓、脐带血、外周血干细胞分离试剂盒包括如下试剂:试剂A、试剂B、试剂C;所述试剂A为氯化钠溶液;所述试剂B为含羟乙基淀粉、混合抗体的氯化钠溶液;所述试剂C为碘克沙醇工作液或淋巴细胞分离液。其中,试剂B中,所述羟乙基淀粉的质量浓度为5-10%;所述混合抗体的浓度为4-12微克/毫升。
所述试剂B的制备步骤如下:取100微升混合抗体溶液加入到质量浓度为5-10%的羟乙基淀粉生理盐水溶液中,得到试剂B。
试剂B中混合抗体是由如下方法制备而得:
S1、称取1毫克抗体(抗CD2,CD3,CD14,CD16,CD19,CD24,CD56和CD66b等);
S2、加入3毫克抗血型糖蛋白A(GlycophorinA)抗体(抗红细胞),与S1中抗体混合均匀;
S3、再加入4.0毫克P9抗体或者2.72毫克P9F(ab’)2抗体片段,37℃孵育过夜,使三者得到交联。
混合抗体溶解在100毫升生理盐水中,得到混合抗体溶液,混合抗体的浓度达4-12微克/毫升。使用过程中,混合抗体以1:4稀释,这样每种有核细胞的抗体的终浓度在细胞悬液中是1.0-3.0微克/毫升。
所述试剂C中,碘克沙醇工作液包括成分1和成分2;
成分1组成:细胞悬浮培养液pH7.4、0.85%(w/v)Nacl(氯化钠)和10毫摩尔每升Tricine-NaOH(N-三(羟甲基)甲基甘氨酸-氢氧化钠);
成分2组成:碘克沙醇注射液40%、0.85%(w/v)Nacl(氯化钠)和30毫摩尔每升Tricine-NaOH(N-三(羟甲基)甲基甘氨酸-氢氧化钠)。
其中,10mmol/L Tricine-NaOH和30mmol/L Tricine-NaOH是通过如下步骤制备而得:
1)将Tricine配成100mmol/L储存液,4℃保存;
2)溶解0.85克氯化钠在50毫升水中,加10毫升的Tricine储存液,用1mol/L氢氧化钠调节体系pH至7.4,用超纯水定容至100毫升,配制得成分1中的10mmol/L Tricine-NaOH;
溶解0.85克氯化钠在50毫升水中,加30毫升的Tricine储存液,用1mol/L氢氧化钠调节体系pH至7.4,用超纯水定容至100毫升,配制得成分2中的30mmol/L Tricine-NaOH。
每个骨髓、脐带血、外周血干细胞分离试剂盒中包括:
试剂A 1瓶 500ml;
试剂B 1瓶 100ml;
试剂C 1瓶 100ml。
试剂B中选用的抗体和试剂C均采用进口的材料(C为AxisShield PoC AS公司产品)。本试剂盒中的试剂A、试剂C均为无色透明液体;试剂B为稍带粘性的澄明液体有时显轻微浮光;A,B,C三瓶试剂如出现浑浊,沉淀或者有絮状物则不能使用。
基于上述人骨髓、脐带血、外周血干细胞分离试剂盒的分离方法,包括以下步骤:
步骤1、将含有枸橼酸钠、肝素抗凝中一种的骨髓、脐带血或外周血转移到500毫升的无菌容器内(可根据分离的骨髓、脐带血或外周血体积决定容器的大小),骨髓/脐带血/外周血与试剂A按1-3:0.5-2的比例混匀;
步骤2、第1步后的液体体积与试剂B按1-5:0.5-3的比例加入,容器封闭后充分混匀,室温静置(静置期间不得再摇动容器),约20-30分钟;
步骤3、20-30分钟后,红细胞沉降至最下层,用无菌移液管将上层液体(约占全容量的3/4)移至50毫升的无菌离心管中,吸至液面交界处,尽量不吸红细胞层;
步骤4、弃红细胞层(如有需要可将红细胞用生理盐水洗涤,回输患者);
步骤5、将收集到离心管中的离心管,于离心机中,2000-3000rpm,离心3-10分钟;
步骤6、取第5步离心后的离心管,弃上清液,收集离心管底部的细胞;
步骤7、用试剂A将每个离心管内的细胞冲洗,移至一个离心管内,补加试剂A,2000-3000rpm,离心3-10分钟;
步骤8、取一新的50毫升的离心管,加入20-35毫升试剂C;
步骤9、弃第7步离心的上清液,加入试剂A 10-30毫升,将细胞混匀后沿离心管壁缓缓加入到装有20-35毫升试剂C的离心管中,注意加入速度要慢,保证两液体分界清楚;
第9步的离心管1000-1500rpm,离心10-30分钟;
步骤10、离心后吸取中间雾状的薄层加至新的离心管中,用试剂A洗涤两次(离心条件同第7步),收集细胞备用。
结果:
1、分离结果
干细胞/祖细胞的回收率≥85%;
分离提取的干细胞/祖细胞存活率≥96%;
分离、纯化过程能有效保留全部种类的干/祖细胞;
试剂盒能够有效除去全部的红细胞、血小板、血浆物质、能除去绝大部分成熟的白细胞、淋巴细胞;
分离出的干细胞/祖细胞的总数因人而异;
4×50毫升骨髓可获得的细胞总数一般在(0.5-5.0)×109;
4×50毫升脐带血可获得的细胞总数在(0.2-2.0)×109;
4×50毫升外周血可获得的细胞总数在(0.2-2.0)×109。
2、试剂盒保存条件:保存条件2-8℃,有效期24个月,20℃室温保存有效期一年。
3、试剂盒对设备和环境的要求:
干细胞分离、纯化要求在一万级洁净实验室进行,骨髓、脐带血、外周血和试剂移取要求在局部一百级的环境中操作;
要求一台大容量冷冻离心机,转速4000转/分中;
试剂加样和骨髓、脐带血、外周血移取尽可能使用带过滤膜的移液器移取
分离、纯化所用的,离心管、移液管必须使用一次性无菌产品。
4、分离、纯化后的干细胞检测
细胞存活率的检测:使用台盼蓝染色。
所提取细胞总数的计算:细胞计数板计数法、血球计数仪计数法
干细胞定性测定:培养扩增法、流式细胞仪检测法,用已知的抗原标记后测定。CD34+、CD117、CD133、C-kit、Sca-1。
本发明在国内首次使用负收集混合法,与传统的若干种干细胞分离法相比,具有以下特点(见表1):
表1
综上所述,本发明的创新点在于:
(一)应用创新点:简便,易操作。
本发明核心技术原理是:将代表非干细胞的已知抗体,和骨髓和血浆中的成分混合,使得非干细胞的比重由于细胞凝集而发生改变,然后采用自然沉降的方法,首先除去红细胞、血小板、全部的血浆物质,以及成熟的白细胞、淋巴细胞。保留Lin-细胞。在国内首创采用分离材料合并抗体复合物,在干细胞分离的关键技术领域取得了重大突破:
1、在细胞分选的过程中,只需将试剂B和经试剂A稀释的骨髓、脐带血及外周血直接混合,就可以立即除去几乎所有的非干细胞成分,操作及其简单,尤其适合于移植实验所需。
2、经最后程序处理后,无任何试剂残留物遗留,对于输入机体体内后的安全性有绝对的保证。
3、最大程度的分离出人类骨髓、脐带血和外周血的各种干细胞,大大降低了干细胞的分离成本。
目前国际流行的磁珠分离,需要昂贵的磁珠分离仪器,以及磁性分离柱。细胞经过分离柱过程中会有很大损失,部分细胞收到挤压而死亡。而且,目前,磁珠分离柱不合适于骨髓标本的分离。因为骨髓抽吸物中含有大量的碎片,脂肪类粘稠物,这时,细胞如何和磁珠结合过柱,细胞往往会粘在柱子上,从而导致分选纯化率很低。前者方法和后者方法相比,前者更为简单,成本低,安全,细胞得率和纯化比较高。传统的干细胞分离技术:干细胞分离在传统情况下,无法迅速将红细胞,血浆,血小板和干细胞成分一步分开。需要多个环节逐步处理,耗时长,所涉及的试剂昂贵,容易造成污染,分离后的细胞需要一段时间恢复细胞活性。特别是传统的磁珠过柱法,只能除去所有未标记的细胞,因此,只可用于选择特定的CD34,CD133细胞等,其实质丢失了很多目前尚未了解的干细胞群体。而且,整个分离代价昂贵。虽然所分离的若干种特定细胞纯度可以达到99%,但大多数情况下,对于微量存在的干细胞,磁珠的整体分离效果较差。尤其对于骨髓标本,由于骨髓含有些许纤维,骨髓片,杂质,因此,应用传统的磁珠过柱法不能获得最佳分离效果。因此,本试剂盒中各项新技术的发明,使得迅速大规模地分离人类干细胞/祖细胞成为可能,尤其适合于骨髓、脐带血和外周血标本。
(二)结构创新点:
碘克沙醇iodixanol是最新一代的非离子碘化复合物,其结构见图3;第一代甲泛影酸Metrizoic acid的结构见图4。
将无菌的60%碘克沙醇水溶液制成细胞分离介质-碘克沙醇分离液,构成了试剂C。经检验,该复合物,对于细胞的毒性,远远低于第一代的甲泛酸,尤其对于干细胞,分离后细胞存活率高,移植后效果好。同时,这些物质不会和蛋白,例如人类的血浆等结合,根据不同的比例浓度,可以形成一个连续的密度,以及较低的渗透压,使得细胞的细胞膜受损可以降到最低,而其粘稠度则比起Percoll,Ficoll则要低很多,因此,在本发明合成的试剂盒中,可以确定所要分离的细胞群的密度,再将需要除去的细胞,运用磁珠抗体结合的方法,增加其密度,就可经沉降法即可获得完美的细胞分离。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!