一种脐血Treg细胞的体外扩增方法与流程
本发明涉及生物技术领域,具体涉及一种脐血treg细胞的体外扩增方法。
背景技术:
调节性t细胞(regulatorycells,简称tregs)是近年来发现的一类能够控制体内自身免疫反应性的t细胞亚群,由于其具有免疫抑制作用,早期亦称做suppressortcells。tregs是高表达cd25且依赖il-2生存的cd4+t细胞亚群。根据tregs细胞发育的来源不同,可分为两种类型的cd4+cd25+tregs,自然tregs(ntregs)和可诱导的tregs(itregs)。ntregs在胸腺中发育,itregs在外周发育。我们通常所说的调节性t细胞是指在胸腺中发育的ntregs。到目前为止,人们对tregs的研究已有20多年的历史,尽管对于体内影响tregs发育的因素仍然不是很清楚,但tregs的免疫调节作用却已经得到证实。
目前研究发现,tregs能够抑制t细胞和b细胞增殖,并抑制抗体的产生,其发挥免疫抑制功能有多种可能机制。一是通过产生il-10等免疫抑制因子来抑制普通t细胞的活化增殖,二是通过上调自身il-2受体的表达,抑制其他t细胞与il-2的结合,从而影响其他t细胞的活化和增殖,三是通过表达ctla-4来与抗原提呈细胞表面分子cd80和cd86相结合,从而启动抑制信号。tregs还可以通过增强抗原提呈细胞的功能来抑制靶细胞。总之,tregs的抑制机制是一个相当复杂的协同机制,目前还不是很清楚上述许多机制的靶向目标是什么。但是可以确定的是,tregs发挥作用时并不是依赖单一的作用机制,而是通过多种抑制机制相结合共同发挥作用。
治疗免疫性疾病的终极目标是预防自身抗原反应性t细胞或b细胞的激活及其引起的组织损害和炎症反应,但如果所有存在于同一微环境的t细胞均能被tregs从不同的途径抑制,那么引起自身免疫反应的特异性效应t细胞也同样可以被相对应的tregs调控而达到治疗效果。因此,tregs的免疫抑制功能对免疫性疾病的防治带来了新的思路。近来的研究也表明,自身免疫性疾(如ⅰ型糖尿病、系统性红斑狼疮、甲状腺炎、自身免疫性重症肌无力)的发病与血液中tregs的数目、功能或者tregs与效应性t细胞的比率失衡有关。有文献报道,tregs还能用于治疗gvhd,输注cd4+cd25+tregs的细胞数量与cd4+的数目相当就能够抑制gvhd。其他免疫性疾病的治疗也至少需要输注1x10^9个tregs。但是机体内cd4+cd25+tregs仅占cd4+t细胞的5%~10%,占人外周血单个核细胞只有1%~2%。这样,从外周血分离提取cd4+cd25+细胞至少需要扩增50到100倍才能获得治疗需要的最小数目的tregs细胞。因此,如何在体外高效扩增tregs逐渐成为研究的热点。
最初研究者认为tregs细胞在体外处于反应状态,在体外不能扩增,但随后的研究发现tregs可以在体外扩增。目前,已报道的tregs体外扩增的方法主要是用anti-cd3/anti-28和il-2在体外与纯化后的tregs细胞混合培养,打破tregs的无反应状态,扩增倍数可达10~15倍。最近,又有研究人员报道了一种高效的扩增方法,他们在体外应用足量anti-cd3、anti-cd28和整合素2使纯化的cd4+cd25+tregs在不到两周的时间内扩增了200倍。但目前报道的这些方法均需要在体外扩增前,用免疫磁珠对细胞进行纯化,操作繁琐,同时还增加了细胞污染的可能性,不利于在临床上大规模推广应用。而且,已有研究表明,cd4+cd25-t细胞可以在白介素7、白介素15以及雌激素等的诱导下转化成cd4+cd25+tregs,然而其扩增倍数和扩增周期不理想,且也需要提前纯化,操作繁复。
此外,成体外周血tregs在临床应用中还存在其它的局限性,比如:在自身免疫性疾病患者中,可能存在细胞数量明显减少,或者功能失调,因此无法通过提取自身的tregs进行治疗。
技术实现要素:
有鉴于此,本发明的目的是提供一种脐血treg细胞的体外扩增方法,以解决了现有技术中的不足。
本发明的目的是通过以下技术方案来实现:
一种脐血treg细胞的体外扩增方法,所述提取方法包括以下步骤;
s1:从脐血中分离单个核细胞;
s2:采用培养基将单个核细胞的细胞密度调整至(0.1x106)~(10x106)/ml,然后将该密度的单个核细胞接种至培养瓶,添加灭活血浆;
第一天:向培养瓶中加入拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2;
s3:第四天:补加培养基,并添加灭活血浆、拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2并使其终浓度与步骤s2中各种成分的终浓度一致;
s4:第六天:补加培养基,并添加灭活血浆、拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2并使其终浓度均保持不变;
s5:第九天:补加培养基,并添加灭活血浆、拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2并使其终浓度均保持不变;
s6:第十二天:收集细胞,其细胞扩增倍数达250倍,细胞纯度大于80%。
进一步地,步骤s1中,分离单个核细胞的方法为:取脐血,并在600~900g/min离心10~20min,收集上层血浆,将血浆置于50~60℃灭活20~40min,2500rpm/min离心后备用;然后加入等体积pbs稀释剩余的血细胞,用常规密度梯度离心的方法分离脐血。
进一步地,步骤s2中,采用培养基将单个核细胞的细胞密度调整至1x106/ml,然后进行接种,接种后添加灭活血浆至该灭活血浆终浓度为3~7%。
进一步地,所述灭活血浆添加至其终浓度为5%为止。
进一步地,步骤s2中,所述拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2的加入量为:加入至其终浓度分别为拟雌内酯1~500ng/ml、tgf-β1~10ng/ml、cd3/cd28单克隆抗体0.5~4μg/ml和il-21000~3000u/ml为止。
进一步地,步骤s2中,所述拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2的加入量为:加入至其终浓度分别为拟雌内酯100ng/ml、tgf-β5ng/ml、cd3/cd28单克隆抗体2μg/ml和il-22000u/ml为止。
进一步地,步骤s3中,培养基的补加量为步骤s2中接种至培养瓶中体积量的0.5~0.7倍,优选0.6倍;
步骤s4中,培养基的补加量为步骤s2中接种至培养瓶中体积量的1.3~2.0倍,优选1.6倍;
步骤s5中,培养基的补加量为步骤s2中接种至培养瓶中体积量的3~5倍,优选4倍。
进一步地,步骤s3中,培养基的补加量为步骤s2中接种至培养瓶中体积量的0.6倍;
步骤s4中,培养基的补加量为步骤s2中接种至培养瓶中体积量的1.6倍;
步骤s5中,培养基的补加量为步骤s2中接种至培养瓶中体积量的4倍。
进一步地,步骤s2~s6的细胞培养中,所述的培养基为rpmi1640培养基。
进一步地,步骤s2~s6中,细胞培养均在37℃、5%co2的细胞培养箱中培养。
本发明至少具有以下有益效果:
本发明给出了一种脐血treg细胞的体外扩增方法,该方法采用拟雌内酯+tgf-β共同作用诱导单个核细胞中的cd4+cd25-t转变为cd4+cd25+tregs,增加tregs扩增的基础数目,且该方法无需预先纯化,就可以在短时间内高效扩增tregs,培养十天左右便可达到250倍左右的扩增量,纯度能够达到将近90%左右,可直接用于后续的治疗等,无需进一步纯化,极其方便。而且拟雌内酯可上调stat5的磷酸化水平从而有助于tregs扩增,tgf-β也有助于提高tregs的纯度,拟雌内酯与tgf-β共同作用便能够高效诱导扩增增tregs且无需预先进行纯化或筛选,大大简化了扩增方法、增加了扩增倍数、缩短了扩增周期,其具有重要的应用价值。
此外,本发明采用脐血来源广泛,具有免疫抑制作用,脐血来源的tregs免于移植受体的免疫排斥反应,并能在体内更好地发挥免疫抑制功能。
附图说明
图1是本发明背景技术中所述的单个核细胞中cd4+cd25-t细胞和cd4+cd25+tregs含量对比图;
图2是本发明实施例所述的tregs扩增倍数的示意图;
图3是本发明实施例所述的本发明的tregs纯度的示意图;
图4是本发明实施例所述的本发明的p-stat5的表达水平示意图;
图5是本发明实施例所述的本发明的tregs的免疫抑制率示意图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。以下提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通方法人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
分离脐血单个核细胞的过程为:新生儿脐血采自妇产科足月健康新生儿,胎儿娩出后,从胎盘脐静脉穿刺采血100ml放入含有枸橼酸抗凝剂的采血袋中,血液在采集后的4h内送至实验室处理。取脐血100ml,750g/min离心15min。收集上层血浆,将血浆置于56℃灭活30min,2500rpm/min离心后备用;加入等体积(1:1)pbs稀释剩余的血细胞,用常规密度梯度离心的方法分离单个核细胞。
实施例2
流式检测单个核细胞中的细胞比例:流式细胞术检测实施例3所分离的单个核细胞中cd4+cd25-t细胞和cd4+cd25+tregs的比例。
收集分离得到的单个核细胞,每组1x10^6个细胞,均在750g室温离心5min,弃上清;2mlpbs重复洗涤细胞3次后,用100ulpbs重悬细胞;并加入10ulapc-cd4和10ulpe-cd25抗体双染作为试验组,并设置10ulapc-cd4和10ulpe-cd25抗体单染组作荧光补偿,不染色细胞组作为阴性本底。4℃避光孵育30min。孵育结束后每管加入2mlpbs,750g室温离心5min,弃上清。并继续用2mlpbs重复洗涤2次后,加200ulpbs重悬细胞,上机检测。
结果发现:cd4+cd25-t细胞的比例为38.4%,cd4+cd25+tregs的比例仅为1.29%,含量极低,如图1所示。
实施例3
一种脐血treg细胞的体外扩增方法,所述提取方法包括以下步骤;
s1:分离单个核细胞:取脐血100ml,并在800g/min离心10min,收集上层血浆,将血浆置于54℃灭活40min,2500rpm/min离心后备用;然后加入等体积pbs稀释剩余的血细胞,用常规密度梯度离心的方法分离脐血;
s2:用rpmi1640调整细胞密度至0.5x106/ml,每瓶5ml接种至t25培养瓶;添加灭活血浆,使血浆终浓度为5.5%。
s3:第一天:加入拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2,并使各种成分的终浓度为:拟雌内酯100ng/ml、tgf-β5ng/ml、cd3/cd28单克隆抗体2μg/ml、il-22000u/ml;
s4:第四天:补加3mlrpmi1640,添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变,即拟雌内酯100ng/ml、tgf-β5ng/ml、cd3/cd28单克隆抗体2μg/ml、il-22000u/ml;
s5:第六天:补加8mlrpmi1640,并添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变;
s6:第九天:补加20mlrpmi1640,添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变;
s7:第十二天:收集细胞,计数,并进行流式检测其tregs含量,通过上述方法,在培养至第12天时细胞扩增倍数达250倍,细胞纯度约为87%左右。
上述步骤s2~s6的细胞培养中,且均在37℃、5%co2的细胞培养箱中培养。
实施例4
一种脐血treg细胞的体外扩增方法,所述提取方法包括以下步骤;
s1:分离单个核细胞:取脐血100ml,并在750g/min离心15min,收集上层血浆,将血浆置于56℃灭活30min,2500rpm/min离心后备用;然后加入等体积pbs稀释剩余的血细胞,用常规密度梯度离心的方法分离脐血;
s2:用rpmi1640调整细胞密度至1x106/ml,每瓶5ml接种至t25培养瓶;添加灭活血浆,使血浆终浓度为5%。
s3:第一天:加入拟雌内酯、tgf-β、cd3/cd28单克隆抗体和il-2,并使各种成分的终浓度为:拟雌内酯110ng/ml、tgf-β4ng/ml、cd3/cd28单克隆抗体1.5μg/ml、il-21600u/ml;
s4:第四天:补加4mlrpmi1640,添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变;
s5:第六天:补加8mlrpmi1640,并添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变;
s6:第九天:补加22mlrpmi1640,添加灭活血浆、拟雌内酯、cd3/cd28单克隆抗体、tgf-β、il-2,并使这几种成分的终浓度均保持不变;
s7:第十二天:收集细胞,计数,并进行流式检测其tregs含量,通过上述方法,在培养至第12天时细胞扩增倍数达250倍,细胞纯度约为83%左右。
上述步骤s2~s6的细胞培养中,且均在37℃、5%co2的细胞培养箱中培养。
实施例5:
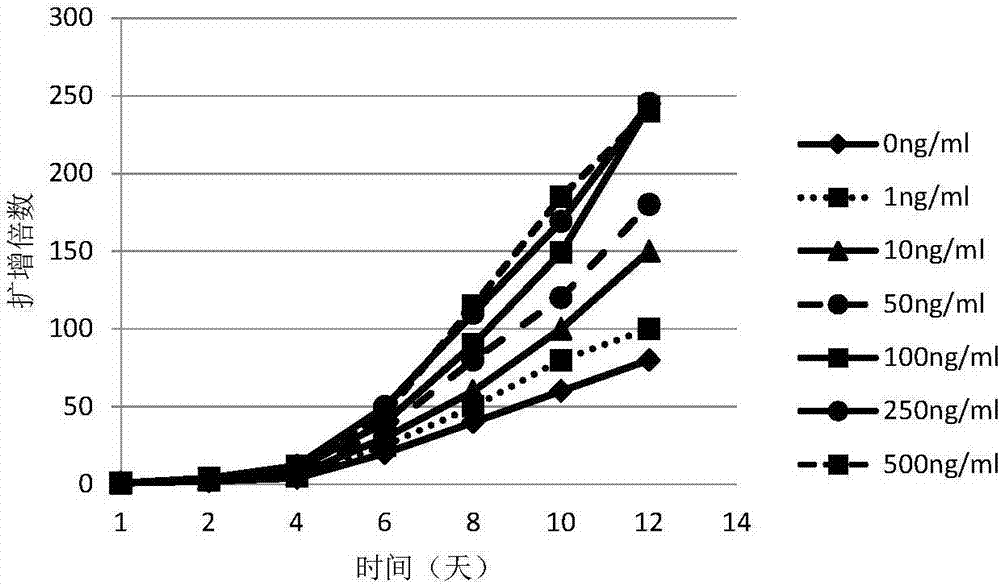
为了获知拟雌内酯的最佳浓度,将单个核细胞分为7组,记为试验1~试验7,各组中拟雌内酯的终浓度分别为:0ng/ml、1ng/ml、10ng/ml、50ng/ml、100ng/ml、250ng/ml、500ng/ml;其他的实验条件、培养基、接种量、培养基添加量、培养天数等等均与实施例4相同。各种成分的加量或中浓度如下表1所示。
表1各种成分的终浓度
第十二天收集细胞,对各组计数,并采用实施例2的方法对各试验组进行流式检测。统计结果如图2~3所示,拟雌内酯浓度为100ng/ml时,在培养至第12天时细胞扩增倍数达250倍,细胞纯度大于80%,将近90%,且其扩增倍数与tregs纯度不再随拟雌内酯浓度的增高而升高。
实施例6:stat5磷酸化水平检测
收集实施例5中试验1和试验5所培养的tregs各2×106,用4℃预冷的pbs充分洗涤3次后,加入4℃的ripa裂解缓冲液200μl重悬细胞,冰上裂解20min。离心收集上清蛋白液,并取150μl蛋白液加入37.5μl5×蛋白buffer,100℃煮沸5min,4℃保存备用。
将蛋白液加入凝胶中电泳,电压60v电泳5min后,用80v电压电泳60min。电泳结束后进行转膜,100v,2h。将膜从电转槽中取出,tbst稍加漂洗,浸没于封闭液中缓慢摇荡1h。
将含有目的蛋白的膜分别转入装有4ml一抗(rabbitphospho-stat5alpha(tyr694)monoclonalantibody)的自封袋中,水平摇床上50rpm1h,转到4℃过夜。第二天将膜取出,用tbst漂洗四次。将转有目的蛋白的膜和内参蛋白的膜分别放在2号自封袋中,加入稀释(1:5000)对应一抗的二抗(goatanti-rabbitigg(h+l)secondaryantibody),室温轻摇一小时,一抗和二抗均购自ebioscience。二抗孵育结束后,用pbst漂洗膜四次。避光加入显色剂显色拍照。
结果如图4所示,试验5所培养的细胞p-stat5的表达水平明显升高。
实施例7:tregs免疫抑制能力检测
采用混合淋巴细胞培养检测按实施例3的方法扩增后tregs的免疫抑制功能。
提取成体外周血单个核细胞(pbmc),用cfse标记为效应细胞,并给予anti-cd3/cd28磁珠的刺激。在96孔板中每孔加入1x105个pbmc,按磁珠︰pbmc为1︰3的比例加入磁珠。取实施例3中试验5培养至第12天的tregs,并按tregs细胞︰pbmc为1︰1、1︰2、1︰4、1︰8和1:16的比例依次加入treg细胞。37℃、5%co2培养4天。用bdfacscalibur流式细胞仪进行检测,分析treg细胞的体外抑制能力,结果如图5所示,当tregs细胞具有显著的免疫抑制能力,且当tregs细胞︰pbmc为1︰1时,抑制率接近100%。
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域技术人员而言,本发明可以有各种改动和变化。凡在本发明的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!