一种具有免疫调节功能的脾脏间充质干细胞及其制备方法与应用与流程
本发明涉及生物
技术领域:
,具体涉及一种具有免疫调节功能的脾脏间充质干细胞及其制备方法与应用。
背景技术:
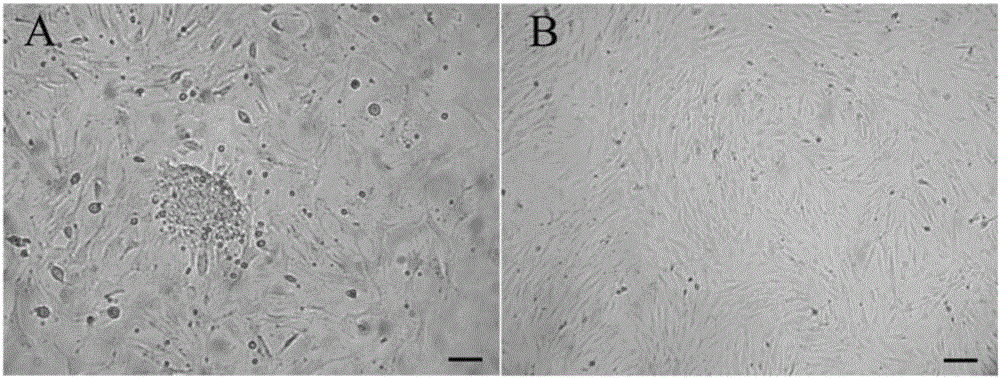
:间充质干细胞(mesenchymalstemcells,MSC)是一种具有多向分化潜能和高度自我更新能力的干细胞。MSC最早由Friedenstein等在骨髓中发现,随后研究人员陆续在骨、脐带、脂肪等多种组织中分离成功。MSC在适宜的条件下可以大量扩增,并且分化为成骨细胞、脂肪细胞、内皮细胞、神经细胞等多种组织类型的细胞,是目前组织工程领域最常用的种子细胞之一。此外,MSC还具有造血支持能力,能够调节造血干细胞分化为多种谱系的造血细胞,是造血微环境的重要组成部分。更有意义的是,MSC还能够调节多种免疫细胞的发育和功能,有助于维持机体免疫反应和免疫稳态。脾脏是人和动物体内最大的外周免疫器官。脾脏内含有多种免疫细胞如巨噬细胞、T淋巴细胞、B淋巴细胞、树突状细胞和中性粒细胞等,是免疫细胞发育和成熟的重要器官之一,更是机体的体液免疫中心和细胞免疫中心。其中,树突状细胞能够摄取机体内的肿瘤抗原或者外源入侵的抗原,加工递呈给相应的T淋巴细胞,促进相关的T淋巴细胞亚群增殖分化,并启动B淋巴细胞为主的体液免疫,实现肿瘤清除和病原清除。脾脏内免疫细胞的发育功能要受到脾脏微环境的调控。多种基质细胞混合组成的脾脏基质组织既为免疫细胞发育提供了空间依托,又表达多种活性分子调节免疫细胞功能,是脾脏微环境的重要组成部分。因此,脾脏基质组织内细胞对于免疫细胞发育和功能的调控一直是免疫学研究的热点之一。但是,以往的研究多关注于脾脏内皮源性基质细胞和成纤维细胞等成体细胞的作用,对于处于发育源头的脾脏间充质干细胞(spleenmesenchymalstemcells,Sp-MSCs)是否参与免疫调控国内外文献报道不多。因此,建立一种高效可靠的Sp-MSCs分离培养方法成为当务之急。传统的MSCs培养策略多为将组织消化为单细胞,然后培养单细胞并获得MSC。但是,该策略应用到Sp-MSCs培养时却遇到了难题,原因就是脾脏中富含有大量的造血细胞如巨噬细胞等,它们有较强的贴附于培养瓶皿的能力,难以通过传代培养去除。掺杂在Sp-MSCs中的造血细胞常常会引起免疫反应,严重影响了相关的科学研究和应用。技术实现要素:本发明的一个目的是提供一种脾脏间充质干细胞的制备方法。本发明提供的脾脏间充质干细胞的制备方法包括如下步骤:(1)碾磨离体的脾脏,去除造血细胞,得到脾脏基质组织;(2)用胶原酶液将所述脾脏基质组织进行消化处理,并在消化处理后去除所述脾脏基质组织中的造血细胞,得到消化处理后脾脏基质组织;(3)培养所述消化处理后脾脏基质组织,即可得到脾脏间充质干细胞。上述方法中,所述碾磨为用注射器柄碾磨;所述碾磨后还包括冲洗的步骤;所述冲洗的目的是去除碾磨后脾脏内的造血细胞,具体方法为用PBS冲洗碾磨后脾脏;所述冲洗的次数为3-5次。上述方法中,所述用胶原酶液将所述脾脏基质组织进行消化处理为将脾脏基质组织浸泡于胶原酶液中;所述胶原酶液中胶原酶的质量分数为0.1-0.15%。上述方法中,所述胶原酶为I型胶原酶、II型胶原酶或IV型胶原酶。上述方法中,所述胶原酶具体为II型胶原酶。上述方法中,所述胶原酶液由II型胶原酶、胎牛血清和α-MEM培养基混匀得到的培养基;所述胎牛血清在所述胶原酶液中的体积分数为15-20%。上述方法中,所述II型胶原酶在所述胶原酶液中的质量分数具体为0.1%,所述胎牛血清在所述胶原酶液中的体积分数具体为15%。上述方法中,步骤(2)中,所述去除的方法为用吸管吸取消化后的所述脾脏基质组织中的胶原酶液和消化释放出来的造血细胞。上述方法中,所述消化处理的条件为35-38℃,5%CO2条件下消化0.5-4h。上述方法中,所述培养所用的培养液为将谷氨酰胺、胎牛血清和α-MEM培养基混匀后得到的溶液,所述谷氨酰胺在所述培养液中的浓度为1-2mmol/L,所述胎牛血清在所述培养液中的体积分数为10-15%。所述谷氨酰胺在所述培养液中的浓度具体为1mmol/L,所述胎牛血清在所述培养液中的体积分数具体为10%。本发明的另一个目的是提供上述方法制备得到的脾脏间充质干细胞。本发明的最后一个目的是提供上述方法或上述脾脏间充质干细胞的新用途。本发明提供了上述方法或上述脾脏间充质干细胞在如下1)-3)中任一种中的应用:1)抑制T淋巴细胞增殖;2)抑制T淋巴细胞活化;3)抑制T淋巴细胞分泌炎性因子。上述应用中,所述炎性因子为IFN-γ和/或TNF-α和/或IL-17A。上述应用中,所述T淋巴细胞为同种异基因抗原诱导的T淋巴细胞或非特异性抗原诱导的T淋巴细胞。上述方法或上述应用中,所述脾脏为来源于小鼠、大鼠、兔、狗、豚鼠、羊、猴子等常用动物品系的离体的脾脏;所述动物的周龄可以是2~20周。本发明所具有的优点和有益效果:(1)本发明方法操作简单,方便实用;(2)本发明所获得的Sp-MSCs纯净度高,造血污染少,有利于开展免疫学相关研究和体内研究;(3)本发明方法所获得的Sp-MSCs免疫调节能力强,可以抑制非特异抗原和同种异体抗原引起的T淋巴细胞增殖、活化和炎性细胞因子释放。本发明首先采用研磨技术去除大部分的脾脏内造血细胞,减少造血细胞贴壁造成的污染;其次,胶原酶可以特异地降解脾脏基质组织中的胶原,松解组织结构帮助Sp-MSCs迁移到培养瓶中;再次,胶原酶消化后,脾脏基质组织表面残留的造血细胞释放出来,将这些造血细胞全部丢弃,仅仅培养消化后的脾脏基质组织,可以显著提高Sp-MSCs的纯度。本发明以上述发现为基础,探索了去除造血细胞-消化基质组织-传代纯化的策略,建立了一种从脾脏分离培养MSCs的方法,并分离获得了大量细胞纯净度较高的Sp-MSCs,进一步发现该群Sp-MSCs具有强大的免疫调节能力,能够抑制非特异抗原和同种异体抗原活化的T淋巴细胞增殖和活化,并抑制T淋巴细胞分泌炎性细胞因子。附图说明图1为分离消化脾脏基质组织。图1A为未消化的脾脏基质组织,图2B为胶原酶消化后的脾脏基质组织。图2为原代培养脾脏间充质干细胞。图2A为间充质干细胞从脾脏基质组织块中爬出;图2B为增殖良好的脾脏间充质干细胞。图3为脾脏间充质干细胞的流式免疫表型。其中,纵坐标代表细胞数量,横轴代表阳性率。图4为脾脏间充质干细胞多向分化。图4A为脾脏间充质干细胞成骨分化后碱性磷酸酶染色;图4B为脾脏间充质干细胞成脂肪分化后油红O染色。图5为Sp-MSCs抑制T淋巴细胞增殖。图5A为Sp-MSCs抑制LTT实验;图5B为Sp-MSCs抑制MLR反应。其中,横坐标代表荧光强度,纵坐标代表细胞数量,黑色峰代表的是未增殖的T淋巴细胞,蓝色峰代表的是加入了ConA或者异基因抗原的刺激后,显著增殖的T淋巴细胞,红色峰代表的是Sp-MSCs抑制相应的T淋巴细胞增殖。图6为Sp-MSCs抑制非特异抗原诱导的T淋巴细胞活化。图6A为ConA刺激引发T淋巴细胞活化;图6B为Sp-MSCs抑制CoA诱导的T淋巴细胞活化,(标尺等于200微米)。图7为Sp-MSCs抑制同种异基因抗原诱导的T淋巴细胞活化。图7A为同种异基因的抗原刺激引发T淋巴细胞活化;图7B为Sp-MSCs抑制同种异基因抗原诱导的T淋巴细胞活化,(标尺等于200微米)。图8为Sp-MSCs抑制非特异抗原活化的T淋巴细胞表达炎性细胞因子。图9为Sp-MSCs抑制同种异基因抗原活化的T淋巴细胞表达炎性细胞因子。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中的PBS的配方为:NaCl(BeijingChemicalWorks,cat.no.XK-13-201-0001-218)8.0g,Na2HPO4.12H2O(BeijingChemicalWorks,cat.no.10020392)2.9g,KCl(BeijingChemicalWorks,cat.no.XK-13-201-0024-217)0.2g,KH2PO4(BeijingChemicalWorks,cat.no.XK-13-201-0024-113)0.24g,溶解于1升水。下述实施例中的所用抗体及其购买处和货号为:PE-labeledanti-CD11b(eBioscience,cat.no.12-0112);PE-labeledanti-CD29(eBioscience,cat.no.12-0291);FITC-labeledanti-CD34(eBioscience,cat.no.11-0341);PE-labeledanti-CD44(eBioscience,cat.no.12-0441);FITC-labeledanti-CD45(eBioscience,cat.no.11-0451);PE-labeledanti-CD105(eBioscience,cat.no.12-1051);PE-labeledanti-stemcellantigen-1(Sca-1)(eBioscience,cat.no.12-5981);PE-labeledanti-Ia(eBioscience,cat.no.12-5321);FITC-labeledratIgG2bisotypecontrol(eBioscience,cat.no.11-4031);PE-labeledratIgG2bisotypecontrol(eBioscience,cat.no.12-4031);PE-labeledArmenianHamsterIgGisotypecontrol(eBioscience,cat.no.12-4888);FITC-labeledratIgG2aisotypecontrol(eBioscience,cat.no.11-4321);PE-labeledratIgG2aisotypecontrol(eBioscience,cat.no.12-4321)。下述实施例中的染色剂及其购买处和货号为:油红O粉剂(Sigma-Aldrich,cat.no.O0625-25G);异丙醇(Sigma-Aldrich,cat.no.I9516)。下述实施例中的同种异基因的BALB/cl小鼠和C57BL/6小鼠均为北京维通利华公司的产品,SCXK(京)2012-0001。实施例1、一种分离培养Sp-MSCs的方法一、Sp-MSCs的分离与培养1、脾脏的分离取6~8周龄健康雌性C57小鼠,脱颈处死,75%酒精浸泡3-5分钟后,无菌条件下分离脾脏,以剪刀和镊子去净表面组织,以镊子取出完整的脾脏。2、去除脾脏内造血细胞在超净台内以注射器柄将其在培养皿中充分碾磨5分钟,用PBS冲3-5遍,去除大部分的脾脏内造血细胞,获得脾脏基质组织(图1A)。3、胶原酶消化脾脏基质组织和原代培养将步骤2中分离获得的脾脏基质组织置于胶原酶液中进行消化(一毫升胶原酶液放3-5只小鼠的脾脏基质组织),37℃消化0.5小时后,得到消化后的脾脏基质组织(图1B),用吸管吸取消化后的脾脏基质组织中的胶原酶液以及消化释放出来的造血细胞,丢弃,并将消化后剩下的脾脏基质组织种于培养液中进行原代培养。上述胶原酶液是将II型胶原酶(GIBCO,cat.no.17101015)、胎牛血清(GIBCO,cat.no.12664-025)和α-MEM培养基(Hyclone,cat.no.SH30265.01B)混匀后得到的溶液,其中,II型胶原酶在胶原酶液中的质量分数为0.1%,胎牛血清在胶原酶液中的体积分数为15%。上述培养液为将谷氨酰胺(GIBCO,cat.no.35050-038)、胎牛血清和α-MEM培养基混匀后得到的溶液,其中,谷氨酰胺在培养液中的浓度为1mmol/L、胎牛血清在培养液中的体积分数为10%。4、扩增脾脏来源的MSCs(Sp-MSCs)将步骤3中消化后的脾脏基质组织在35~38℃、5%CO2条件下培养72小时后用培养液首次全量换液,去除脾脏基质组织,保留从脾脏基质组织中迁移出的Sp-MSCs,即获得Sp-MSCs。然后每隔两天用培养液半量换液。当Sp-MSCs长满70~80%培养瓶面积后消化传代,连续传代,取第4代Sp-MSCs进一步用于下述实验研究。二、Sp-MSCs的形态学检测将步骤一获得的第4代Sp-MSCs在培养液中静置培养3-5天左右,在倒置显微镜下观察到有细胞从组织块中爬出(图2A)。这些细胞为梭形贴壁生长,经过传递培养后,生长迅速,并可呈旋涡状或者纺锤状密集生长,符合经典的MSC形态和生长特点(图2B)。三、Sp-MSCs的免疫表型检测将步骤一获得的第4代Sp-MSCs进行表面标记检测,分别检测第4代Sp-MSCs的CD11b,CD29,CD34,CD44,CD45,CD105、Sca-1和Ia的表达情况。流式检测的具体步骤如下:1、准备细胞用胰酶(GIBCO,cat.no.27250-018)消化步骤一获得的第4代Sp-MSCs,制备成单细胞悬液,调整细胞数量至1×106细胞/流式管,洗净后重悬至100μLPBS/流式管。2、抗体标记按照说明书要求,分别向流式管中加入如下荧光标记的抗体及对应同型对照:CD11b、CD45、Sca-1、CD29、CD31、CD34、CD44、CD86、CD105、Ia。4℃避光孵育30分钟。MSCs免疫表型分析相关抗体及其使用浓度与对应同型对照抗体如表1所示。表1、MSCs免疫表型分析相关抗体及应用抗原荧光应用浓度对应同型对照CD11bPE0.5μg/millioncells.mL-1PE-RatIgG2bCD29PE1μg/millioncells.mL-1PE-ArmenianHamsterIgGCD34FITC1μg/millioncells.mL-1FITC-RatIgG2aCD44PE0.125μg/millioncells.mL-1PE-RatIgG2bCD45FITC0.25μg/millioncells.mL-1FITC-RatIgG2bCD105PE0.5μg/millioncells.mL-1PE-RatIgG2aSca-1PE0.5μg/millioncells.mL-1FITC-RatIgG2aIaPE0.02μg/millioncells.mL-1PE-RatIgG2bRatIgG2aisotypeantibodyPE1μg/millioncells.mL-1RatIgG2aisotypeantibodyFITC0.5μg/millioncells.mL-1RatIgG2bisotypeantibodyPE0.125μg/millioncells.mL-1RatIgG2bisotypeantibodyFITC0.5μg/millioncells.mL-13、流式分析加入荧光标记的抗体后用PBS洗细胞两遍后,4℃,300g离心8分钟,弃上清,取沉淀,上机分析。结果如图3所示。从图中可以看出,Sp-MSCs低表达造血细胞的标记CD11b,CD34,CD45,低表达共刺激分子Ia,高表达间质组织标记CD29和CD44,高表达干细胞标记CD105和Sca-1。说明步骤一分离获得的Sp-MSCs是一群间质来源的非造血干细胞,且具有较低的免疫原性,符合经典的MSC免疫表型特征。四、Sp-MSCs的多向分化能力检测1、成骨分化将步骤一获得的Sp-MSCs进行成骨分化,成骨分化后用碱性磷酸酶染色,显微镜下照相,观察结果。具体步骤如下:(1)成骨诱导收获步骤一获得的第4代Sp-MSCs,按照1×104/孔种于24孔培养板内,分别在对照培养基和成骨诱导培养基中进行诱导培养,每2-3天换液。对照组培养基为将FBS与α-MEM培养基混匀得到的培养基,其中,FBS在对照组培养基中的体积分数为10%;成骨诱导培养基为将地塞米松(Sigma-Aldrich,cat.no.D2915)、β-磷酸甘油(Sigma-Aldrich,cat.no.G6251)、维生素C磷酸盐(Sigma-Aldrich,cat.no.A8960)和α-MEM培养基混匀得到的培养基,其中,地塞米松在成骨诱导培养基中的浓度为10-7mol/L、β-磷酸甘油在成骨诱导培养基中的浓度为10mM,维生素C磷酸盐在成骨诱导培养基中的浓度为50μM。(2)碱性磷酸酶染色诱导培养的第14天,去除培养基;采用商品化的碱性磷酸酶染色试剂盒(AlkalinePhosphataseKit,Sigma-Aldrich,cat.no.85L3R)染色:向培养板内加入试剂盒自带的固定液(柠檬酸40μL+去离子水2mL+丙酮3mL)固定30秒;再向培养板内加入试剂盒自带的染色液(坚牢兰RR62.5μL+去离子水3mL+As-Mx125μL);避光反应30分钟;倒掉染液,加少量PBS,显微镜下照相。2、成脂分化收获步骤一获得的第4代Sp-MSCs进行成脂诱导分化,成脂诱导分化后用油红O(Oil-red-O)染色,显微镜下照相,观察结果。(1)成脂诱导分化收获步骤一获得的第4代Sp-MSCs,按照2×104/孔种于24孔培养板内,分别在对照培养基和成脂肪诱导培养基中诱导培养,每2-3天换液。对照组培养基为将FBS与α-MEM培养基混匀得到的培养基,其中,FBS在对照组培养体系中的体积分数为10%;成脂肪诱导培养基为将地塞米松(Sigma-AldrichcatnoD2915)、IBMX(Sigma-Aldrich,cat.no.I5879),胰岛素(Sigma-Aldrich,cat.no.I6634)和α-MEM培养基混匀得到的培养基,其中,地塞米松在成脂肪诱导培养基中的浓度为10-6mol/L、IBMX在成脂肪诱导培养基中的浓度为0.5μM,胰岛素在成脂肪诱导培养基中的浓度为10ng/mL。(2)油红O染色诱导培养的第14天,去除培养基;向培养板内加入染色液(油红O粉剂0.5g+异丙醇100mL);避光反应15分钟;倒掉染液,加少量PBS,显微镜下照相。结果如图4A所示,在成骨诱导培养基中培养的小鼠Sp-MSCs碱性磷酸酶染色阳性,该结果表明本发明制备的Sp-MSCs具有成骨分化潜能。油红O具有较好的脂肪结合能力。小鼠Sp-MSCs成脂肪诱导7天后,即可见细胞中逐渐出现大量脂肪滴,加入油红O染色液之后,可观察到脂肪滴被染为红色,该结果表明小鼠脾脏MSC具有良好的成脂肪分化能力(图4B)。五、Sp-MSCs的免疫调节能力检测为了检测本发明制备的Sp-MSCs是否具有免疫调节功能,将分离获得T淋巴细胞与步骤一获得的第4代Sp-MSCs共培养,并观察培养后的T淋巴细胞增殖、活化以及分泌炎性细胞因子的情况。1、淋巴母细胞转化实验(lymphocytetransformationtest,LTT)(1)小鼠T淋巴细胞的分离无菌条件下以注射器柄碾磨鼠脾脏(来源于C57BL/6小鼠),将获得的粗制细胞悬液过200目钢筛去除团块,然后用Ficoll分离液(天津灏洋生物,20120218)以800g离心20min,弃上清,得到脾脏免疫细胞;再以PBS洗净,将脾脏免疫细胞过填充有尼龙毛的50ml注射器,得到不贴附的细胞即为T淋巴细胞,流式检测CD3细胞比例高于80%后用于下一步实验。(2)CSFE法标记T淋巴细胞的制备CFSE是一种可以掺入细胞的荧光染料,随着细胞增殖分裂,细胞所携带的荧光强度逐渐降低。细胞增殖的速度越快,其荧光强度衰减地越快。用荧光染料CFSE标记步骤1分离获得的T淋巴细胞。具体步骤如下:将小鼠T淋巴细胞以含有体积分数为2%胎牛血清的PBS调整细胞密度为1×107个/ml,然后加入CFSE(Sigma,产品目录号为21888-25MG-F),使其浓度为10μm,避光染色20分钟,以大量含有体积分数为2%胎牛血清的PBS重悬,洗涤,终止染色,得到CFSE标记的T淋巴细胞,用于后继实验。(3)ConA刺激T淋巴细胞以含有体积分数为2%胎牛血清的PBS调整CFSE标记的T淋巴细胞的密度为1×106个/ml,然后加入ConA(Sigma,产品目录号为c2010-25MG),使其浓度为2μg/ml,得到T淋巴细胞培养体系(T淋巴细胞的密度为1×106个/2mL)。(4)T淋巴细胞的培养按照是否向步骤(3)获得的T淋巴细胞培养体系添加步骤一获得的第4代Sp-MSCs分成如下两组:1)LTT实验组:向步骤(3)获得的T淋巴细胞培养体系添加步骤一获得的第4代Sp-MSCs,使Sp-MSCs细胞的密度为1×105个/2mL,共培养48h;2)LTT对照组:不添加Sp-MSCs,培养T淋巴细胞培养体系48h。收集上述实验组和对照组的培养体系中悬浮的T淋巴细胞,用于下述实验分析。(5)结果分析1)抑制T淋巴细胞增殖采用Beckman流式仪对步骤(4)获得的LTT实验组和LTT对照组的培养体系中悬浮的T淋巴细胞进行流式分析,每管收集50000个细胞。在LTT对照组中,T淋巴细胞受到ConA刺激之后,增殖迅速,荧光强度衰减明显,而LTT实验组中Sp-MSCs存在时,T淋巴细胞衰减的速度明显减慢,表明T淋巴细胞增殖受到了抑制(图5A)。2)Sp-MSCs抑制非特异性抗原诱导的T淋巴细胞活化采用倒置相差显微镜(Nikon,21560)对步骤(4)获得的LTT实验组和LTT对照组的培养体系中悬浮的T淋巴细胞进行观察。ConA是一种非特异抗原,具有强大的活化T淋巴细胞能力。如图6A所示,LTT对照组中,ConA刺激后,T淋巴细胞显著活化,聚集成巨大的细胞团块,而LTT实验组中有Sp-MSCs存在时,这种活化作用受到显著抑制,大多数T淋巴细胞为松散的单个细胞或者小细胞团(图6B)。以上结果表明小鼠Sp-MSC可抑制非特异性抗原诱导的T淋巴细胞活化。3)抑制非特异抗原活化的T淋巴细胞分泌炎性因子为进一步观察Sp-MSCs对T淋巴细胞的免疫功能影响,用定量PCR检测了步骤(4)中各组T淋巴细胞表达的炎性细胞因子IFN-γ、TNF-α和IL-17A的水平。引物序列为:小鼠干扰素γ(IFN-γ):上游序列-5'-CTCATGGCTGTTTCTGGCTGTTA-3',下游序列5'-GACGCTTATGTTGTTGCTGATGG-3';小鼠肿瘤坏死因子α(TNF-α):上游序列5′-CACTTGGTGGTTTGCTACGA-3,下游序列5′-GCCTCCCTCTCATCAGTTCTA-3′;小鼠白细胞介素17A(IL-17A):上游序列5'-TCCAGAAGGCCCTCAGACTA-3',下游序列5'-AGCATCTTCTCGACCCTGAA-3';内参GADPH上游序列5'-AAACCCATCACCATCTTCCA-3',下游序列5'-GTGGTTCACACCCATCACAA-3'。上述引物均由上海生工生物合成。结果如图8所示,和不加Sp-MSCs相比,加入Sp-MSCs后可明显抑制LLT实验组中T淋巴细胞内IFN-γ、TNF-α和IL-17A的表达。2、混合淋巴细胞反应(mixedlymphocytesreaction,MLR)(1)混合淋巴细胞培养体系的制备按照步骤1中的方法,从同种异基因的BALB/cl小鼠中分离得到T淋巴细胞;将辐照过的(10Gy剂量的钴-60照射)同种异基因的BALB/cl小鼠的T淋巴细胞、未照射过的C57BL/6小鼠的T淋巴细胞和2mL的培养基(含有体积分数为10%的FBS的α-MEM培养基)混匀,其中,同种异基因的BALB/cl小鼠的T淋巴细胞和C57BL/6小鼠的T淋巴细胞的细胞个数比为1:10,得到混合培养体系;(2)混合淋巴细胞培养体系的培养按照是否向混合培养体系添加步骤一获得的第4代Sp-MSCs分成如下两组:1)MLR实验组:向混合培养体系中添加步骤一获得的第4代Sp-MSCs,同种异基因的BALB/cl小鼠T淋巴细胞、C57BL/6小鼠的T淋巴细胞与Sp-MSCs细胞的个数比为1:10:1,共培养48h;2)MLR对照组:不添加Sp-MSCs,培养混合培养体系48h。收集上述实验组和对照组的培养体系中悬浮的T淋巴细胞,用于下述实验分析。(3)结果分析1)抑制T淋巴细胞增殖采用Beckman流式仪对步骤(2)获得的MLR实验组和MLR对照组的培养体系中悬浮的T淋巴细胞进行流式分析,每管收集50000个细胞。在MLR对照组中,同种异基因抗原也促使T淋巴细胞显著增殖,与LLT结果相似,MLR实验组中Sp-MSCs表现出了抑制T淋巴细胞增殖能力(图5B)。2)Sp-MSCs抑制同种异基因抗原诱导的T淋巴细胞活化采用倒置相差显微镜(Nikon,21560)对步骤(2)获得的MLR实验组和MLR对照组的培养体系中悬浮的T淋巴细胞进行观察。除了非特异性抗原之外,同种异基因抗原同样可以活化T淋巴细胞。如图7A所示,MLR对照组中,同种异基因的T淋巴细胞混合在一起之后,T淋巴细胞显著活化,培养皿中可见多个巨大的细胞团块,而MLR实验组中,Sp-MSCs则可以显著抑制这种活化作用。培养皿中的T淋巴细胞无法聚合为大细胞团块,更多地变现为松散小细胞团(图7B)。以上结果表明小鼠Sp-MSCs可抑制同种异基因抗原诱导的T淋巴细胞活化。3)抑制同种异基因抗原活化的T淋巴细胞分泌炎性因子为进一步观察Sp-MSCs对T淋巴细胞的免疫功能影响,用定量PCR检测了步骤(2)中各组T淋巴细胞表达的炎性细胞因子IFN-γ、TNF-α和IL-17A的水平。引物序列同上。结果如图9所示,和不加Sp-MSCs相比,加入Sp-MSCs后可明显抑制MLR实验组中T淋巴细胞内IFN-γ、TNF-α和IL-17A的表达。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1