一种罗丹明‑胍基苯并咪唑功能化的光敏探针及其应用的制作方法
本发明涉及一种罗丹明-胍基苯并咪唑功能化的光敏探针及其在Sn(IV)检测方面的应用。
背景技术:
锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,与日常生活、工业生产、环境科学、药物和生命科学均有着千丝万缕的联系。在生产和生活中,锡常用来制造合金,应用广泛。同时,锡是人体必须的微量元素之一,Sn(IV)广泛存在于肾上腺、肝脏、脾脏、大脑及甲状腺中,与人体生长和癌症预防息息相关。今年来,锡的广泛使用带来了多种与之相关的环境和生理问题。人体缺Sn(IV)将影响生长发育、听力及疾病抵抗力,其含量过多则会引起眼睛及皮肤刺激、头痛、眩晕、呼吸困难、肝损伤、胃肠疾病如恶心、腹痛、呕吐等,严重的甚至会损伤免疫系统和染色体。因此,对环境和生物样品中Sn(IV)的实时检测已成为一项备受瞩目的工作,具有极其重要的科研和实际意义。
相比于传统的原子发射光谱、原子吸收光谱等需要大型仪器设备且操作复杂生物亲和性差的方法,荧光化学标记和功能分子探针技术以其优良的特异性识别检测性能和良好的环境生物相容性迅速占领科学研究的制高点,并被广泛用于生物体系靶向识别和环境物质定向监测,凸显出强劲的应用发展前景,已成为生命科学研究领域不可或缺的重要手段之一,开创了众多交叉科学研究的新突破。
荧光探针分子一般由具有信号输出功能的荧光团和具有反应识别作用功能团构成,当探针分子遇到特定的离子或小分子时,功能团与识别离子发生特异性识别,进而发生从识别基团向信号输出基团的信号转换而对识别离子进行识别检测。
技术实现要素:
本发明的目的之一是提供一种罗丹明-胍基苯并咪唑功能化的光敏探针。
本发明的另一目的是提供上述探针对生物样品中Sn(IV)检测方面的应用。
本发明的实现过程如下:
罗丹明基荧光探针的结构如结构式(I)所示:
上述罗丹明基荧光探针的合成路线如下:
首先,在1,2-二氯乙烷为溶剂的条件下,通过罗丹明B和POCl3反应得到罗丹明B酰氯。然后,以乙腈为溶剂、三乙胺为缚酸剂,通过罗丹明B酰氯与2-胍基苯并咪唑反应即可得到目标产物。
上述罗丹明基荧光探针检测Sn(IV)的原理如下:
在EtOH-H2O (5:5, v/v)溶剂中,探针溶液本身是无色无荧光状态,当向溶液中加入Sn(IV)后,Sn(IV)将会和探针胍基和苯并咪唑基团中的N原子发生配位作用进而使探针内酰胺基团发生开环反应使溶液变为紫红色并产生橙红色荧光,其最大吸收和发射波长分别为559 nm和581 nm。通过测定探针荧光紫外吸收和荧光发射强度变化,达到测定Sn4+浓度和分布状况的目的。
在众多的功能团中,苯并咪唑化合物集高活性、芳香性、易修饰性、富电子性及生物亲和性等特性于一身,是理想的荧光探针功能团。本发明应用胍基苯并咪唑作为识别团,结合性能优良的罗丹明B发光团,设计合成可应用于环境和生物样品中Sn(IV)检测的功能型荧光探针,该探针对SnCl4和其他有机锡(IV)化合物包括:一丁基三氯化锡、二丁基二氯化锡、三丁基氯化锡和四丁基锡均表现出良好的选择性响应性能,并且具有水溶性优良、检测灵敏度高、响应时间短、持续时间长、抗干扰性强、适用pH范围宽和检测浓度范围广等优点,可用于和生物样品中Sn(IV)的浓度和分布情况检测,显示出较强的应用前景。
附图说明
图1为该探针的单晶结构图;
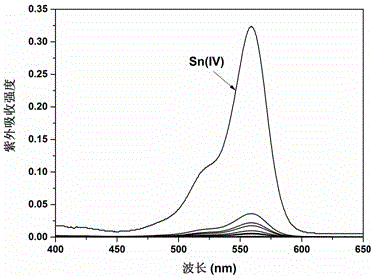
图2为该探针在EtOH-H2O (5:5, v/v)溶剂中的离子选择性紫外可见吸收图;
图3为该探针在EtOH-H2O (5:5, v/v)溶剂中的离子选择性荧光发射光谱图;
图4为该探针在EtOH-H2O (5:5, v/v)溶剂中的对有机锡(IV)化合物选择性的紫外可见吸收图;
图5为该探针在EtOH-H2O (5:5, v/v)溶剂中的对有机锡(IV)化合物选择性的荧光发射光谱图;
图6为该探针在EtOH-H2O (5:5, v/v)溶剂中的抗干扰能力紫外可见吸收图;
图7为该探针在EtOH-H2O (5:5, v/v)溶剂中的抗干扰能力荧光发射光谱图;
图8为该探针在EtOH-H2O (5:5, v/v)溶剂中的紫外可见吸收滴定图;
图9为该探针在EtOH-H2O (5:5, v/v)溶剂中的荧光发射光谱滴定图;
图10为该探针在EtOH-H2O (5:5, v/v)溶剂中的紫外可见吸收强度随Sn(IV)浓度的变化图;
图11为该探针在EtOH-H2O (5:5, v/v)溶剂中的荧光发射强度随Sn(IV)浓度的变化图;
图12为该探针在EtOH-H2O (5:5, v/v)溶剂中的紫外可见吸收强度与Sn(IV)浓度的线性关系图;
图13为该探针在EtOH-H2O (5:5, v/v)溶剂中的荧光发射强度随Sn(IV)浓度的线性关系图;
图14为该探针在EtOH-H2O (5:5, v/v)溶剂中的紫外可见吸收发射强度随pH的变化图;
图15为该探针在EtOH-H2O (5:5, v/v)溶剂中的荧光发射强度随pH的变化图;
图16为该探针在不同溶剂中紫外可见吸收强度的变化图;
图17为该探针在不同溶剂中荧光发射强度的变化图;
图18为该探针在不同比例的EtOH-H2O溶剂中的紫外可见吸收强度的变化图;
图19为该探针在不同比例的EtOH-H2O溶剂中的荧光发射强度的变化图;
图20为该探针在EtOH-H2O (5:5, v/v)溶剂中与Sn(IV)的配位比测定的紫外可见吸收图;
图21为该探针在EtOH-H2O (5:5, v/v)溶剂中与Sn(IV)的配位比测定的荧光发射光谱图;
图22为该探针在EtOH-H2O (5:5, v/v)溶剂中加入Sn(IV)后的时间响应紫外可见吸收图;
图23为该探针在EtOH-H2O (5:5, v/v)溶剂中加入Sn(IV)后的时间响应荧光发射光谱图;
图24为该探针在EtOH-H2O (5:5, v/v)溶剂中加入Sn(IV)后的可逆性检测紫外可见吸收图;
图25为该探针在EtOH-H2O (5:5, v/v)溶剂中加入Sn(IV)后的可逆性检测荧光发射光谱图;
图26为该探针在活的L929细胞和MG-63细胞中对Sn(IV)检测的细胞成像图。
具体实施方式
为了更加清楚的理解本发明,下面通过具体实施例对本发明做进一步的详细描述。
实施例1:探针的合成
在干燥的1000 ml圆底烧瓶中加入0.4780 g (0.001 mol)罗丹明B,加入5 mL干燥的1,2-二氯乙烷作为溶剂,然后向其中加入0.5 mL 三氯氧磷,连接回流冷凝、干燥管和尾气吸收装置,加热回流反应6 h。反应结束后,将反应液冷却至室温,然后用旋转蒸发仪蒸除溶剂,得到深红色干燥或粘稠状物质。
向反应瓶中加入5 mL干燥的乙腈作为溶剂,然后称量0.1750 g (0.001 mol) 2-胍基苯并咪唑,将其溶解5 mL干燥的乙腈中,并向其中加入3 mL三乙胺,在搅拌下30 min内将其缓慢滴加到反应瓶中,滴加过程中会产生大量白色烟雾并剧烈放热。连接回流冷凝、干燥管和尾气吸收装置,加热回流反应6-8 h。反应结束后,将反应液冷却至室温,然后用旋转蒸发仪蒸除溶剂,向其中加入10 mL二氯甲烷和10 mL蒸馏水,搅拌15 min。然后将其倒入分液漏斗中,并用二氯甲烷萃取。合并有机相,用无水硫酸镁干燥30 min。然后将有机相浓缩并用二氯甲烷-甲醇(60:1, v:v)作为洗脱剂柱色谱进行分离,得到淡黄色固体0.7361 g,产率80.7%。
m.p.:272—273 ºC;E.A. (%): H, 6.18; C, 72.30; N, 16.29. 理论值:H, 6.22; C, 72.10; N, 16.35。IR (KBr, υ/cm-1):3433.2, 3377.3, 3064.8, 3016.6, 2966.4, 2927.9, 1689.6, 1633.7, 1614.4, 1517.9, 1452.4, 1319.3, 1269.1, 1220.9, 1151.5, 1118.7, 815.8, 785.0, 758.0。
1H NMR (400 MHz, CDCl3, TMS): 9.46 (s, 1H), 8.94 (s, 1H), 8.14 (s, 1H), 7.99 (d, J = 7.4 Hz, 1H), 7.56 (dt, J = 23.2, 7.0 Hz, 2H), 7.41 (d, J = 6.2 Hz, 1H), 7.20 (dd, J = 18.8, 7.0 Hz, 2H), 7.11 – 6.98 (m, 2H), 6.40 (dd, J = 23.4, 5.5 Hz, 4H), 6.17 (dd, J = 8.8, 2.3 Hz, 2H), 3.30 (dd, J = 13.9, 6.9 Hz, 8H), 1.12 (t, J = 7.0 Hz, 12H)。
13C NMR (100 MHz, CDCl3, TMS): δ: 164.69, 150.24, 148.57, 147.46, 145.11, 143.06, 137.05, 129.00, 125.75, 124.16, 122.97, 122.31, 119.25, 117.74, 115.39, 115.16, 111.57, 103.23, 102.66, 101.36, 91.33, 61.30, 38.69, 7.01。
MS: 600.3187 [M+H]+. 理论值:600.3089。
单晶结构(图1):单斜晶系,Pbca空间点群,晶胞参数:a = 11.8726(17) Å, b = 23.890(3) Å, c = 25.006(3) Å ; α = 90.00 º, β = 90.00 º, γ = 90.00 º。
实施例2:探针的离子选择性测定
以EtOH-H2O (5:5, v/v)为溶剂准确配置探针浓度为10 μM,分别与5倍当量的各种金属离子混合后的溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图2和图3所示。可以看出,该探针只对Sn(IV)表现出明显的选择性响应,对其他离子均无明显响应。
以EtOH-H2O (5:5, v/v)为溶剂准确配置探针浓度为10 μM,分别与5倍当量的各种有机锡(IV)化合物混合后的溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图4和图5所示。可以看出,该探针对所有的有机锡(IV)化合物同样表现出明显的选择性响应。
实施例3:探针的抗干扰能力测定
以EtOH-H2O (5:5, v/v)为溶剂准确配置探针浓度为10 μM,先与5倍当量的Sn(IV)混合,再分别与5倍当量的各种干扰离子混合后的溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图6和图7所示。可以看出,除Cu(II)因其天然顺磁性引起的荧光淬灭外,该探针对Sn(IV)的测定基本不受其他共存离子的干扰。
实施例4:探针的滴定和检测范围测定
以EtOH-H2O (5:5, v/v)为溶剂准确配置探针浓度为10 μM,分别与0-5.0倍当量的Sn(IV)混合后的溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱测定结果如图8和图9所示。可以看出,该探针荧光发射强度与Sn(IV)浓度的增加而逐渐增强,在0.06 μmol·L-1 - 50 μmol·L-1的范围内表现出明显的线性关系,检测限为0.03 μmol·L-1 (图10-图13)。
实施例5:探针的适用pH范围测定
以EtOH-H2O (5:5, v/v)为溶剂分别准确配置在不同pH值下,探针浓度为10 μM的纯探针和探针与5倍当量的Sn(IV)混合的两组溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图14和图15所示。可以看出,该探针适用于pH值为5.0-8.0的体系中Sn(IV)的检测。
实施例6:探针溶剂选择性测定
分别以不同混合溶剂准确配置浓度为10 μM的探针和5倍当量的Sn(IV)的混合溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图16和图17所示。可以看出,使用不同有机溶剂和水混合溶剂体系时,探针在EtOH-H2O和MeOH-H2O混合溶剂体系中的检测响应情况较好,而其他溶剂体系的响应都比较小。由于EtOH相比于MeOH不仅响应强度较强,而且毒性和对环境及生物体的伤害也较小,因此,EtOH-H2O混合溶剂被选作测试的溶剂体系。
分别以不同比例的EtOH-H2O混合溶剂准确配置浓度为10 μM的探针和5倍当量的Sn(IV)的混合溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图18和图19所示。可以看出,随着溶剂体系中EtOH含量的增加,探针的紫外吸收和荧光发射强度均有所增强。本实例中选择EtOH-H2O (5:5, v/v)体系作为光学测试溶剂。
实施例7:探针与离子的配位比测定
以EtOH-H2O (5:5, v/v)为溶剂准确配置探针与Sn(IV)浓度之和为20 μM,[Sn(IV)]/([Sn(IV)]+[探针])分别为0.1-0.9的溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱测定结果如图20和图21所示。可以看出,该探针与Sn(IV)的配位比为1:1。
实施例8:探针响应时间测定
以EtOH-H2O (5:5, v/v)为溶剂分别准确配置浓度为10 μM的探针和5倍当量的Sn(IV)的混合溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱随时间的变化情况,测定结果如图22和图23所示。可以看出,探针对Sn(IV)的响应时间在10 s内,且随着时间推移探针荧光强度并未减弱。
实施例9:探针的可逆性测定
以EtOH-H2O (5:5, v/v)为溶剂分别准确配置浓度为10 μM的探针和5倍当量的Sn(IV)的混合溶液,然后向其中加入0-4.0倍当量的EDTA溶液,测定其紫外吸收光谱及在540 nm激发波长下的荧光发射光谱,测定结果如图24和图25所示。可以看出,随着EDTA的加入,探针荧光强度逐渐减弱,当EDTA加入量为Sn(IV)2倍当量时,溶液荧光完全消失,说明探针对Sn(IV)的测定具有可逆性。
实施例10:探针在小鼠成纤维细胞(L929)和人成骨肉瘤细胞(MG-63)中的荧光共聚焦成像
图26表示探针在L929和MG-63细胞中对Sn(IV)的荧光共聚焦成像。将L929和MG-63细胞37 ºC的恒温培养箱中培养30 min,向培养皿中加入10 μmol/L的探针溶液培养30 min。共聚焦未呈现出明显的荧光发射(图26-a)。然后向体系中5倍浓度Sn(IV)和10%乙醇并在37 ºC的恒温培养箱内培养30 min。细胞中出现明显的荧光发射(图26-b),明视场图片(图26-c)表明在成像过程中细胞始终保持活性,证明该探针对细胞的毒性较小。上述实验结果表明,该系列探针可用于L929和MG-63细胞中Sn(IV)的检测和成像。
- 还没有人留言评论。精彩留言会获得点赞!