一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法与流程
本发明属于植物活性组分的提取纯化技术领域,具体涉及一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法。
背景技术:
近年来,大量流行病学研究表明,十字花科蔬菜具有显著的化学预防癌症的作用,经常大量食用十字花科蔬菜的人群患多种癌症的概率显著低于不食用或少量食用十字花科蔬菜的人群,即十字花科蔬菜的摄入量与多种癌症的发病率呈现显著的负相关性,说明十字花科蔬菜中含有的天然活性成分具有预防癌症的功效。进一步研究表明,十字花科蔬菜中含有大量的硫代葡萄糖苷和黑芥子酶,硫代葡萄糖苷分布于细胞液中,而黑芥子酶分布于特定的蛋白体中。在十字花科蔬菜组织细胞完好的情况下,硫代葡萄糖苷与黑芥子酶不能相互接触,硫代葡萄糖苷可稳定存在。当组织细胞发生损伤时,黑芥子酶可与硫代葡萄糖苷接触,硫代葡萄糖苷被快速水解,形成不稳定的糖苷配基,该糖苷配基通过非酶催化的分子内重排反应,转化生成具有高效抗癌活性的异硫氰酸酯类化合物,因此,在人们食用十字花科蔬菜的过程中,十字花科蔬菜能够生成并释放具有高效抗癌活性的异硫氰酸酯类化合物,从而具有了抗癌防癌的功效。
萝卜是一种人们日常大量食用的十字花科蔬菜,萝卜芽苗、萝卜根茎和萝卜叶子中都含有丰富的还原型萝卜硫苷(4-甲硫基-3-丁烯基硫代葡萄糖苷,化学结构见图2)和黑芥子酶,黑芥子酶可将还原型萝卜硫苷水解,并通过非酶催化的分子内重排反应转化生成还原型萝卜硫素(4-甲硫基-3-丁烯基异硫氰酸酯)。还原型萝卜硫素是具有诱导Ⅱ相解毒酶活性的一种异硫氰酸酯类化合物,其不仅可提高人体对致癌物的清除能力,还可抑制并杀死癌细胞。研究表明,还原型萝卜硫素可通过阻断癌细胞周期循环以及促进癌细胞凋亡而阻碍肿瘤组织的生长;还原型萝卜硫素可作为细胞致癌代谢途径阻遏因子,通过多重机制特异性地调节组织细胞致癌代谢过程;还原型萝卜硫素能够高效诱导醌氧化还原酶的表达,加速细胞中致癌物质的代谢排出过程,从而具有化学预防癌症的功效;还原型萝卜硫素具有抑制幽门螺杆菌生长增殖和小鼠胃炎的活性,并能够通过抑制和消除幽门螺杆菌感染,来预防幽门螺杆菌感染引起的胃癌。还原型萝卜硫素是萝卜中发现的抗癌活性最强的植物化学组分,对乳腺癌、肺癌、前列腺癌以及肠癌等多种癌症都具有很强的抑制功效。但还原型萝卜硫素稳定性极差,易降解,且易与含巯基的化合物反应而失去抗癌活性,而其前体物质还原型萝卜硫苷化学性质稳定,不易降解,并在人体摄入后,可在肠道微生物的作用下转化生成具有高效抗癌活性的还原型萝卜硫素,因此,还原型萝卜硫苷可作为抗癌和防癌天然活性成分,添加至食品、功能性食品、保健品和药品中。目前,国际上可供出售的硫代葡萄糖苷高纯品(纯度≥98%)主要有4-甲基亚磺酰基-3-丁基硫代葡萄糖苷、4-甲硫基-3-丁基硫代葡萄糖苷、4-甲基亚磺酰基-3-丁烯基硫代葡萄糖苷和烯丙基硫代葡萄糖苷,均由美国和德国公司提供,且价格昂贵,而具有高效抗癌和防癌效果的还原型萝卜硫苷高纯品尚无公司销售。
技术实现要素:
本发明针对目前还原型萝卜硫苷依赖国外进口,价格昂贵、工艺技术复杂的缺点,提供了一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,该方法可高效率的制备高纯度的还原型萝卜硫苷,大大降低了生产成本,实现了还原型萝卜硫苷高纯品的工业化生产。
本发明的目的是通过如下技术方案实现的:
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
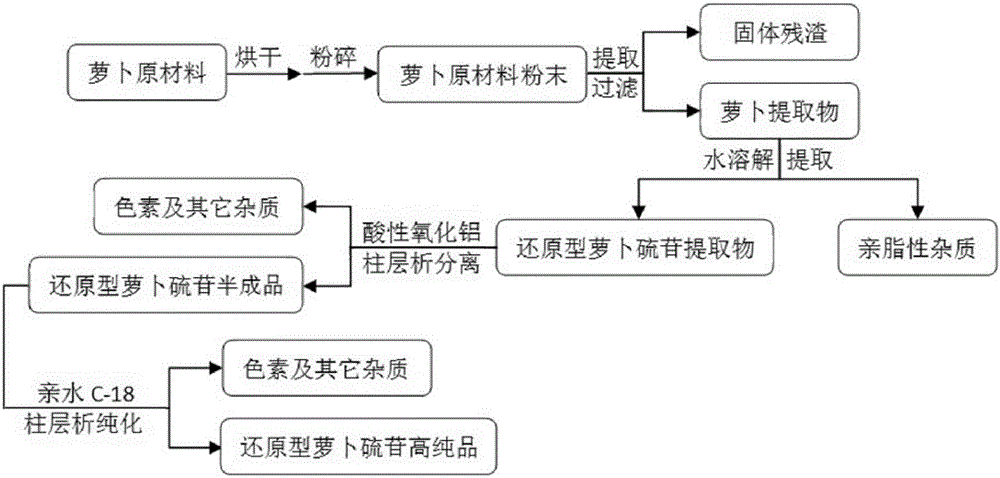
(1)将萝卜原材料干燥,粉碎,得萝卜原材料粉末;
(2)以提取剂回流提取萝卜原材料粉末,过滤,收集滤液,重复回流提取,过滤除去固体杂质,收集并合并滤液,减压蒸馏回收提取剂,得干燥的萝卜提取物;
(3)用水溶解提取萝卜提取物,过滤,收集滤液,重复溶解提取,过滤除去固体杂质,收集并合并滤液,减压蒸馏,得干燥的还原型萝卜硫苷提取物;
(4)酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为25-250μm的酸性氧化铝浸泡于去离子水中,浸泡10-120min,重复洗涤1-5次,去离子水洗涤后,装填于高径比为2-30的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为25-750mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附0.25-20毫克还原型萝卜硫苷提取物,去离子水洗脱,除去不能被酸性氧化铝吸附的杂质;
d.用5-20g/L的硫酸钾-水溶液洗脱,在流速为1-15BV/h和检测波长为210-245nm下,收集还原型萝卜硫苷色谱峰,减压蒸馏得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取还原型萝卜硫苷和硫酸钾混合物,过滤除去硫酸钾固体杂质,收集并合并滤液,减压蒸馏回收甲醇,得干燥的还原型萝卜硫苷半成品;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为10-140μm的亲水C-18浸泡于无水甲醇中,浸泡10-120min,重复洗涤1-5次,无水甲醇洗涤后,装填于高径比为2-30的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配置成10-750mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附0.1-15毫克还原型萝卜硫苷半成品;
d.超纯水洗脱,在流速为1-15BV/h和检测波长为210-245nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥到干燥的高纯度还原型萝卜硫苷。
所述的,步骤(1)中,萝卜原材料为萝卜芽苗、萝卜根茎和萝卜叶子中的一种;所述干燥为40-65℃条件下烘箱干燥至含水量为1.5-7.5%;粉碎的粉末粒度为30-300目。
所述的,步骤(2)中,提取剂为70-100%甲醇-水溶液,提取剂的加入量为萝卜原材料粉末重量的5-30倍,回流提取0.5-3h,重复回流提取1-5次。
优选的,步骤(2)中,提取剂的加入量为萝卜原材料粉末重量的10-20倍,回流提取1-2h,重复回流提取2-3次。
所述的,步骤(3)中,水的加入量为萝卜提取物重量的5-30倍,溶解提取10-180min,重复溶解提取1-5次。
优选的,步骤(3)中,水的加入量为萝卜提取物重量的10-20倍,溶解提取30-60min,重复溶解提取2-3次。
优选的,步骤(4)中,酸性氧化铝的粒径为50-200μm,浸泡时间为30-60min,重复洗涤2-3次,低压不锈钢柱的高径比为5-20,还原型萝卜硫苷提取物溶液浓度为50-500mg/mL,进样量为每毫升酸性氧化铝上样吸附0.5-15毫克还原型萝卜硫苷提取物,硫酸钾-水溶液浓度为5-15g/L,流速为3-10BV/h,检测波长为220-240nm。
所述的,步骤(4)中,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的10-30倍,搅拌浸取10-60min,重复浸取1-3次。
优选的,步骤(5)中,亲水C-18的粒径为25-100μm;浸泡时间为30-60min;重复洗涤2-3次;低压不锈钢柱高径比为5-20;还原型萝卜硫苷半成品溶液浓度为25-500mg/mL;进样量为每毫升亲水C-18上样吸附0.25-10毫克还原型萝卜硫苷半成品;流速为3-10BV/h;检测波长为220-240nm。
本发明的有益效果:本发明的原材料价廉易得,适用范围广,采用提取剂和水溶解提取还原型萝卜硫苷提取物,同时沉淀除去大量亲脂性杂质成分,显著提高了总体工艺产率和提取物中还原型萝卜硫苷的含量;采用酸性氧化铝低压柱吸附和亲水C-18低压柱吸附相结合,显著提高还原型萝卜硫苷产品的纯度及收率,降低了生产成本,简化了提取纯化工艺过程,易于工业化放大生产。
附图说明
图1为本发明的工艺流程图;
图2为本发明制备的还原型萝卜硫苷的化学结构;
图3为本发明制备的还原型萝卜硫苷提取物的高效液相色谱图;
图4为本发明酸性氧化铝低压柱初步纯化还原型萝卜硫苷提取物的色谱图;
图5为本发明亲水C-18低压柱纯化还原型萝卜硫苷半成品的色谱图;
图6为本发明制备的高纯度还原型萝卜硫苷的高效液相色谱图。
具体实施方式
以下结合具体实施例,对本发明的工艺技术方案作进一步的描述,但,这些实施例并不构成对本发明要求保护范围的限制。
实施例1
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜芽苗,50℃烘箱干燥,获得干燥的萝卜芽苗,含水量为3.5%;高速粉碎机粉碎并过筛,获得粒度在50-300目范围内的萝卜芽苗粉末;
(2)采用100%甲醇-水溶液回流提取萝卜芽苗粉末,100%甲醇-水溶液的加入量为萝卜芽苗粉末重量的5倍,回流提取1h,重复提取5次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为25.3%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的20倍,溶解提取60min,重复提取3次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为16.4%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为75-150μm的酸性氧化铝浸泡于去离子水中,浸泡10min,重复洗涤5次,装填于高径比为30的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为25mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附0.25毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用20g/L的硫酸钾-水溶液洗脱,在流速为1BV/h和检测波长为235nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的10倍,搅拌浸取60min,重复浸取2次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为44.2%,收率为96.5%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为10μm的亲水C-18浸泡于无水甲醇中,浸泡120min,无水甲醇重复洗涤3次,装填于高径比为2的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成500mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附10毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为3BV/h和检测波长为235nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为99.6%,收率为91.3%。
实施例2
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜芽苗,40℃烘箱干燥,获得干燥的萝卜芽苗,含水量为7.5%;高速粉碎机粉碎并过筛,获得粒度在30-300目范围内的萝卜芽苗粉末;
(2)采用80%甲醇-水溶液回流提取萝卜芽苗粉末,80%甲醇-水溶液的加入量为萝卜芽苗粉末重量的30倍,回流提取0.5h,重复提取3次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为27.5%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的5倍,溶解提取10min,重复提取5次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为19.2%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为25-50μm的酸性氧化铝浸泡于去离子水中,浸泡60min,重复洗涤3次,装填于高径比为20的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为50mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附0.5毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用10g/L的硫酸钾-水溶液洗脱,在流速为6BV/h和检测波长为210nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的30倍,搅拌浸取30min,重复浸取1次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为50.3%,收率为93.6%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为50μm的亲水C-18浸泡于无水甲醇中,浸泡60min,无水甲醇重复洗涤5次,装填于高径比为5的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成10mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附0.1毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为1BV/h和检测波长为210nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为99.2%,收率为92.5%。
实施例3
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜芽苗,65℃烘箱干燥,获得干燥的萝卜芽苗,含水量为1.5%;高速粉碎机粉碎并过筛,获得粒度在60-300目范围内的萝卜芽苗粉末;
(2)采用70%甲醇-水溶液回流提取萝卜芽苗粉末,70%甲醇-水溶液的加入量为萝卜芽苗粉末重量的20倍,回流提取3h,重复提取1次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为27.6%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的30倍,溶解提取180min,重复提取1次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为17.1%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为150-250μm的酸性氧化铝浸泡于去离子水中,浸泡120min,重复洗涤5次,装填于高径比为15的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为350mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附7毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用15g/L的硫酸钾-水溶液洗脱,在流速为10BV/h和检测波长为245nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的20倍,搅拌浸取10min,重复浸取3次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为46.7%,收率为94.8%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为100μm的亲水C-18浸泡于无水甲醇中,浸泡30min,无水甲醇重复洗涤2次,装填于高径比为30的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成25mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附0.25毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为10BV/h和检测波长为245nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为99.5%,收率为90.8%。
实施例4
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜根茎,切成10×10×20mm的方形柱体小块,50℃烘箱干燥,获得干燥的萝卜根茎,含水量为4.0%;高速粉碎机粉碎并过筛,获得粒度在40-300目范围内的萝卜根茎粉末;
(2)采用90%甲醇-水溶液回流提取萝卜根茎粉末,90%甲醇-水溶液的加入量为萝卜根茎粉末重量的10倍,回流提取2h,重复提取3次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为22.1%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的20倍,溶解提取120min,重复提取2次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为15.2%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为50-200μm的酸性氧化铝浸泡于去离子水中,浸泡120min,重复洗涤1次,装填于高径比为2的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为750mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附15毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用5g/L的硫酸钾-水溶液洗脱,在流速为15BV/h和检测波长为220nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的10倍,搅拌浸取20min,重复浸取2次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为43.5%,收率为93.2%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为25μm的亲水C-18浸泡于无水甲醇中,浸泡10min,无水甲醇重复洗涤3次,装填于高径比为10的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成750mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附15毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为15BV/h和检测波长为220nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为98.5%,收率为86.7%。
实施例5
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜根茎,切成10×10×20mm的方形柱体小块,55℃烘箱干燥,获得干燥的萝卜根茎,含水量为2.5%;高速粉碎机粉碎并过筛,获得粒度在60-300目范围内的萝卜根茎粉末;
(2)采用100%甲醇-水溶液回流提取萝卜根茎粉末,100%甲醇-水溶液的加入量为萝卜根茎粉末重量的20倍,回流提取0.5h,重复提取5次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为21.5%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的10倍,溶解提取60min,重复提取3次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为13.8%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为75-150μm的酸性氧化铝浸泡于去离子水中,浸泡90min,重复洗涤4次,装填于高径比为5的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为250mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附10毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用15g/L的硫酸钾-水溶液洗脱,在流速为3BV/h和检测波长为230nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的30倍,搅拌浸取40min,重复浸取1次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为40.9%,收率为95.6%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为140μm的亲水C-18浸泡于无水甲醇中,浸泡90min,无水甲醇重复洗涤1次,装填于高径比为20的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成250mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附10毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为10BV/h和检测波长为230nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为98.8%,收率为90.5%。
实施例6
一种以萝卜为原材料制备高纯度还原型萝卜硫苷的方法,是由以下步骤制备得到的:
(1)收获新鲜的萝卜叶子,切成10×10mm的方形萝卜叶片,45℃烘箱干燥,获得干燥的萝卜叶子,含水量为5.5%;高速粉碎机粉碎并过筛,获得粒度在30-300目范围内的萝卜叶子粉末;
(2)采用80%甲醇-水溶液回流提取萝卜叶子粉末,80%甲醇-水溶液的加入量为萝卜叶子粉末重量的30倍,回流提取2h,重复提取2次,过滤除去固体杂质,收集并合并滤液,在50℃条件下,减压蒸馏回收甲醇,得干燥的萝卜提取物,提取率为18.5%;
(3)将萝卜提取物溶解于水中,水的加入量为萝卜提取物重量的30倍,溶解提取30min,重复提取2次,过滤除去固体杂质,收集并合并滤液,在55℃条件下减压蒸馏,得干燥的还原型萝卜硫苷提取物,总提取率为9.51%;
(4)采用酸性氧化铝低压柱色谱初步纯化还原型萝卜硫苷提取物:
a.将粒径为50-75μm的酸性氧化铝浸泡于去离子水中,浸泡30min,重复洗涤2次,装填于高径比为20的低压不锈钢柱中;
b.将还原型萝卜硫苷提取物用去离子水溶解配制成浓度为500mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷提取物溶液;
c.将还原型萝卜硫苷提取物溶液上样,进样量为每毫升酸性氧化铝上样吸附20毫克还原型萝卜硫苷提取物,去离子水洗脱,充分除去不能被酸性氧化铝吸附的杂质;
d.用10g/L的硫酸钾-水溶液洗脱,在流速为10BV/h和检测波长为240nm下,收集还原型萝卜硫苷色谱峰,在55℃条件下减压蒸馏,得到干燥的还原型萝卜硫苷和硫酸钾混合物;
e.用无水甲醇搅拌浸取,无水甲醇的加入量为还原型萝卜硫苷和硫酸钾混合物总质量的20倍,搅拌浸取50min,重复浸取2次,过滤除去硫酸钾固体杂质,收集并合并滤液,在50℃条件下减压蒸馏回收甲醇,并得到干燥的还原型萝卜硫苷半成品,还原型萝卜硫苷含量为38.5%,收率为96.8%;
(5)亲水C-18低压柱色谱进一步纯化:
a.将粒径为50μm的亲水C-18浸泡于无水甲醇中,浸泡60min,无水甲醇重复洗涤3次,装填于高径比为15的低压不锈钢柱中;
b.将还原型萝卜硫苷半成品用超纯水溶解配制成100mg/mL的溶液,5000rpm离心20min,除去固体杂质,得还原型萝卜硫苷半成品溶液;
c.将还原型萝卜硫苷半成品溶液上样,进样量为每毫升亲水C-18上样吸附5毫克还原型萝卜硫苷半成品;
d.用超纯水洗脱,在流速为6BV/h和检测波长为240nm下,收集还原型萝卜硫苷色谱峰,经冷冻干燥得到高纯度还原型萝卜硫苷,还原型萝卜硫苷含量为98.2%,收率为85.6%。
- 还没有人留言评论。精彩留言会获得点赞!