二氟亚甲基鏻内盐作为新的氨解试剂用于合成β‑酮酰胺的方法与流程
本发明属于有机合成领域,具体为二氟亚甲基鏻内盐作为新的氨解试剂用于合成β-酮酰胺的方法。
背景技术:
β-酮酰胺及其衍生物在现代有机化学及药物化学中代表着一类重要的结构单元。它们在有机合成中也是非常有用合成模块,能够用于各种杂环化合物的合成。例如:内酰胺、呋喃、吡喃、异喹啉、环己酮、螺环吲哚、四氢吡啶等。此外,通过简单的化学反应,β-酮酰胺能够转化为β-羟基酰胺或γ-酮酰胺,这两类化合物也是众多生理活性化合物的重要单元或合成子。鉴于β-酮酰胺具有以上重要的用途,发展一种有效合成β-酮酰胺的方法具有重要意义。
以下是几类合成β-酮酰胺的具体合成方法:
(一)、强碱性条件下,采用酰胺与酯进行亲核取代反应是合成β-酮酰胺的一类最经典方法(Org·Lett.,2005,7,5717;Chem.Commun.,2014,50,2535)。
(二)、酰胺与醛羟醛缩合反应得到的β-羟基酰胺在二氧化锰作用下能够被氧化为β-酮酰胺(Org·Lett.,2012,14,724)。
(三)、氯磷配位下,采用铑作催化剂氢化还原β-羰基腈,能够制备一系列β-酮酰胺(Catal.Sci.Technol.,2016,6,4398.)。
(四)、钯催化卤代芳烃、一氧化碳及乙酰基酰胺的羰基化-脱羧连续反应合成β-酮酰胺(Adv.Synth.Catal.,2014,356,3519.)。
(五)、采用仲胺和β-酮酸酯直接氨解反应是合成大量β-酮酰胺的重要方法(Org.Biomol.Chem.,2014,12,8473.)。
上述方法中,第一类方法反应条件苛刻,第二至第四类方法需要当量氧化剂或者需要昂贵且有毒的金属催化剂。这些缺陷使得这四类方法很难用于β-酮酰胺的大量合成。第五种方法,反应条件简单,易于β-酮酰胺的规模化生产。但目前采用仲胺作为氨解试剂,反应产率普遍较低(<60%)。
技术实现要素:
本发明正是针对以上技术问题,提供一种二氟亚甲基鏻内盐作为新的氨解试剂用于合成β-酮酰胺的方法。该方法成本低、工艺简便、生产安全可靠、且绿色环保。
本发明的具体技术方案如下:
二氟亚甲基鏻内盐作为新的氨解试剂用于合成β-酮酰胺的方法,该方法包括以下步骤:首先在惰性气体环境下,以极性试剂为溶剂,采用β-酮酸酯和二氟亚甲基鏻内盐为原料,在一定温度下进行充分搅拌反应,反应达到终点后,分离、提纯得到β-酮酰胺。所述的极性试剂是水、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMA)、二氧六环、二甲亚砜、N-甲基吡咯烷酮(NMP)、甲醇或叔丁醇中的一种,或其组合。
所述的β-酮酸酯是指3位被烷基或芳基取代,2位被烷基或芳基取代,酯基为烷基或芳基酯的3-氧代-丙酯。β位芳环上取代基为甲基或甲氧基或乙基或烯丙基或炔丙基或苯基或苄基或硝基或卤素或酯基,取代位置为对位或间位或邻位,例如:3-氧代-3-对甲苯基丙酸乙酯、3-氧代-3-对甲氧苯基丙酸甲酯、3-氧代-3-对氯苯基丙酸丙酯、3-氧代-3-对硝基苯基丙酸丁酯、3-氧代-3-(4’-吡啶基)丙酸甲酯、1-氧代-1,2,3,4-四氢萘-2-甲酸乙酯。
所述的二氟亚甲基鏻内盐是指与磷原子相连的一个基团为氨基,另两个为氨基或烷氧基或烷基或芳基取代基,或其组合,例如:2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐、2-(二(二甲氨基)(甲氧基)磷鎓基)-2,2-二氟乙酸盐、2-((二甲氨基)(甲氧基)(苯基)磷鎓基)-2,2-二氟乙酸盐。
所述β-酮酸酯与二氟亚甲基鏻内盐物质的量之比为1∶1.0~5,β-酮酸酯物质的量与反应溶剂体积之比为1∶1~20molL-1,该投料比和溶剂用量经济合算、节约成本。
所述反应终点是指:由薄层色谱法检测反应液中原料β-酮酸酯转化完全进行判定,薄层色谱硅胶为:硅胶GF254,薄层色谱展开剂为∶石油醚∶乙酸乙酯=1~10∶1(体积比),显色方式:碘显色或者紫外显色(254nm),反应终点判断方法简便易行。
作为可选方式,反应温度为40~130℃,反应温度可控,易于操作。
作为可选方式,分离、提纯步骤为:反应达终点后,反应瓶被冷却至室温,加入适量水猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相依次用NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物经重结晶或用硅胶柱层析分离得到β-酮酰胺及其烯醇式互变异构体。
本发明的积极效果体现在:
(一)、以容易得到的β-酮酸酯和容易制备的二氟亚甲基鏻内盐为原料,在常用有机极性溶剂中,40~130℃条件下充分搅拌反应就能一步合成β-酮酰胺类化合物。
(二)、反应条件温和,可操作性强,成本低,安全性高,绿色环保、
(三)、反应转化率和收率高,工艺流程短,反应规模易于扩大,产物分离简单,具有适于工业化生产的优势。
附图说明
图1为实施例1中制备得到的N,N-二甲基-3-氧代-3-苯基丙酰胺的1H NMR谱图;
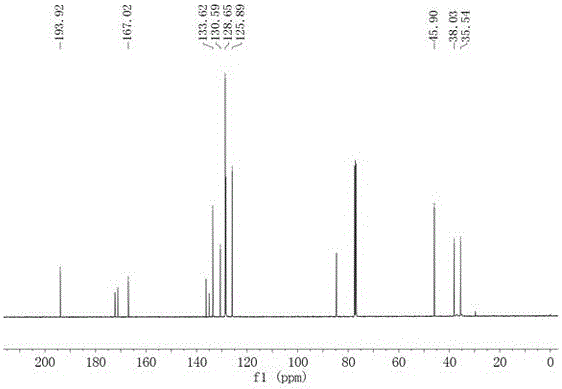
图2为实施例1中制备得到的N,N-二甲基-3-氧代-3-苯基丙酰胺的13CNMR谱图;
图3为实施例1中制备得到的N,N-二甲基-3-氧代-3-苯基丙酰胺的烯醇式异构体单晶衍射图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,下面结合具体实施方式对本发明作进一步的详细描述,但不应将此理解为本发明上述主题的范围仅限于下述实施例。本领域技术人员可以对本专利作各种改动或修改,但这些等价形式同样落于本申请所附权利要求书所限定的范围。
极性溶剂便宜易得,作为反应溶剂,有助于二氟亚甲基鏻内盐的溶解,并有序地释放出二氟烯基磷叶丽德,有效避免副反应及提高反应产率;N,N-二甲基甲酰胺(DMF)和N-甲基吡咯烷酮(NMP)为常用非质子极性溶剂,因此本实施例中均使用无水DMF为反应溶剂。
实施例1:
化合物N,N-二甲基-3-氧代-3-苯基丙酰胺的制备:
向一个干燥无氧氮气保护的三口瓶中依次加入3-氧代-3-苯基丙酸甲酯(0.895g,5mmol),2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐(2.57g,10mmol),无水DMF5ml,随后反应瓶被置于60℃的油浴中进行充分搅拌。通过薄层色谱法确认反应终点后,将反应瓶冷却至室温,加入适量水溶液猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相用饱和NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物柱层析后,得到酮式与烯醇式共存的黄色固液混合物0.793g,产率为83%。
两种互变异构体的氢谱和碳谱数据由混合谱图推导而出。酮式:1H NMR(400MHz,CDCl3)δ7.98(d,J=7.7Hz,2H),7.55(t,J=7.4Hz,1H),7.44(t,J=7.6Hz,2H),4.08(s,2H),3.00(s,3H),2.96(s,3H).13C NMR(101MHz,CDCl3)δ193.9,167.0,133.6,130.6,128.7,125.9,45.9,38.0,35.5.烯醇式:1H NMR(400MHz,CDCl3)δ15.41(s,1H),7.78(d,J=6.7Hz,2H),7.40(q,J=5.6Hz,3H),5.79(s,1H),3.06(s,6H).13C NMR(101MHz,CDCl3)δ172.3,171.2,136.2,135.0,128.7,128.4,84.6,38.0,35.5.IR(KBr)max3061,2926,1686,1641,1497,1363,1264,1163,1080,989,761,692cm-1;MS(EI)m/z 191.1[M]+;HRMS(EI)m/z[M]+calcd for C11H13NO2,191.0946;Found,191.0950.
实施例2:
化合物N,N-二甲氨基-3-(3-甲氧基)苯基-3-氧代-丙酰胺的制备:
向一个干燥无氧氮气保护的三口瓶中依次加入3-(3-甲氧基)苯基-3-氧代-丙酸甲酯(1.050g,5mmol),2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐(2.57g,10mmol),无水DMF5ml,随后反应瓶被置于60℃的油浴中进行充分搅拌。通过薄层色谱法确认反应终点后,将反应瓶冷却至室温,加入适量水溶液猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相用饱和NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物柱层析后,得到酮式与烯醇式共存的黄色固液混合物0.918g,产率为83%。
两种互变异构体的氢谱和碳谱数据由混合谱图推导而出。酮式:1H NMR(400MHz,CDCl3)δ7.53(d,J=7.6Hz,1H),7.49(s,1H),7.37-7.21(m,2H),7.08(d,J=8.1Hz,1H),4.05(s,2H),3.80(s,3H),2.98(s,3H),2.94(s,3H).13C NMR(101MHz,CDCl3)δ193.8,167.0,159.8,137.6,129.7,121.3,120.1,112.7,55.4,45.9,38.0,35.5.烯醇式:1H NMR(400MHz,CDCl3)δ15.43(s,1H),7.37-7.23(m,3H),6.93(d,J=7.9Hz,1H),5.75(s,1H),3.01(s,6H).13C NMR(101MHz,CDCl3)δ172.2,170.9,159.7,136.4,129.4,118.2,116.3,111.3,84.8,55.3,38.0,35.5.IR(KBr)max3068,2937,2833,1687,1640,1588,1493,1359,1263,1213,1167,1040,873,776,686cm-1;MS(EI)m/z 221.9[M]+;HRMS(EI)m/z[M+H]+calcd for C12H16NO3,222.1125;Found,222.1123.
实施例3:
化合物N,N-二甲氨基-3-(2-氯)苯基-3-氧代-丙酰胺的制备:
向一个干燥无氧氮气保护的三口瓶中依次加入3-(3-甲氧基)苯基-3-氧代-丙酸甲酯(1.060g,5mmol),2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐(2.57g,10mmol),无水DMF5ml,随后反应瓶被置于60℃的油浴中进行充分搅拌。通过薄层色谱法确认反应终点后,将反应瓶冷却至室温,加入适量水溶液猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相用饱和NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物柱层析后,得到酮式与烯醇式共存的黄色固液混合物1.044g,产率为87%。
两种互变异构体的氢谱和碳谱数据由混合谱图推导而出。酮式:1H NMR(400MHz,CDCl3)δ7.63(d,J=7.3Hz,1H),7.38(s,2H),7.32-7.25(m,1H),4.10(s,2H),3.01(s,3H),2.95(s,3H).13C NMR(101MHz,CDCl3)δ196.2,166.6,138.1,131.8,131.0,130.6,129.9,127.1,49.0,38.0,35.4.烯醇式:1H NMR(400MHz,CDCl3)δ15.31(s,1H),7.55(d,J=2.8Hz,1H),7.38(s,2H),7.32-7.25(m,1H),5.67(s,1H),3.01(s,6H).13C NMR(101MHz,CDCl3)δ171.9,170.1,134.9,132.3,130.5,130.4,130.1,126.8,90.5,38.0,35.4.IR(KBr)max3054,2932,1606,1497,1461,1362,1256,1160,1076,965,760,691cm-1;MS(EI)m/z 225.7[M]+;HRMS(EI)m/z[M+H]+calcd for C11H13ClNO2,226.0629;Found,226.0628.
实施例4:
化合物N,N-二甲氨基-3-(2’-噻吩基)-3-氧代-丙酰胺的制备:
向一个干燥无氧氮气保护的三口瓶中依次加入3-(2,-噻吩基)-3-氧代-丙酸甲酯(1.060g,5mmol),2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐(2.57g,10mmol),无水DMF5ml,随后反应瓶被置于60℃的油浴中进行充分搅拌。通过薄层色谱法确认反应终点后,将反应瓶冷却至室温,加入适量水溶液猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相用饱和NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物柱层析后,得到酮式与烯醇式共存的黄色固液混合物0.578g,产率为74%。
两种互变异构体的氢谱和碳谱数据由混合谱图推导而出。酮式:1H NMR(400MHz,CDCl3)δ7.82(s,1H),7.62(d,J=4.4Hz,1H),7.08(s,1H),3.97(s,2H),3.02(s,3H),2.91(s,3H).13C NMR(101MHz,CDCl3)δ186.5,166.4,143.4,134.8,133.9,128.4,46.6,38.1,35.6.烯醇式:1H NMR(400MHz,CDCl3)δ15.48(s,1H),7.48(s,1H),7.35(d,J=4.5Hz,1H),7.00(s,1H),5.64(s,1H),2.99(s,6H).13C NMR(101MHz,CDCl3)δ172.2,139.2,128.2,127.7,126.9,83.7,38.1,35.6.IR(KBr)max3089,2932,1642,1504,1409,1314,1263,1135,1061,848,735,593cm-1;MS(EI)m/z197.7[M]+;HRMS(EI)m/z[M]+calcd for C9H12NO2S,198.0583;Found,198.0583.
实施例5:
化合物N,N-二甲氨基-1-氧代-1,2,3,4-四氢萘-2-丙酰胺的制备:
向一个干燥无氧氮气保护的三口瓶中依次加入1-氧代-1,2,3,4-四氢萘-2-丙酸甲酯(1.020g,5mmol),2,2-二氟-2-(三(二甲胺基)磷鎓基)乙酸盐(2.57g,10mmol),无水DMF5ml,随后反应瓶被置于60℃的油浴中进行充分搅拌。通过薄层色谱法确认反应终点后,将反应瓶冷却至室温,加入适量水溶液猝灭反应,再加入乙酸乙酯萃取水相,合并有机相,有机相用饱和NaCl水溶液洗涤,无水硫酸钠干燥,过滤,旋转蒸发回收溶剂,残留物柱层析后,得到酮式与烯醇式共存的黄色固液混合物0.586g,产率为54%。
1H NMR(400MHz,CDCl3)δ8.01(d,J=7.8Hz,1H),7.48(t,J=7.4Hz,1H),7.30(t,J=7.3Hz,1H),7.26(d,J=7.6Hz,1H),3.84(dd,J=11.6,4.5Hz,1H),3.09(s,3H),3.15-2.96(m,2H),3.04(s,3H),2.55(ddd,J=16.2,12.1,4.7Hz,2H),2.27(ddd,J=13.2,8.6,4.2Hz,2H).13C NMR(101MHz,CDCl3)δ194.4,170.0,144.1,133.7,132.2,128.8,127.6,126.7,51.7,37.7,35.7,28.3,26.4.IR(KBr)max 3062,2937,1681,1641,1460,1401,1302,1225,1143,890,761,572cm-1;MS(EI)m/z 217.9[M]+;HRMS(EI)m/z[M]+calcd for C13H16NO2,218.1176;Found,218.1175。
本申请并不局限于前述的具体实施方式。本申请扩展到任何在本说明书中披露的新特征或任何新的组合,以及披露的任一新的方法或过程的步骤或任何新的组合。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种三氟甲基修饰的(+)-Patulolide C及其制造方法
- 用于三氟甲基亚磺酸钠干燥的方形真空干燥机的制作方法
- N-(取代的)-5-氟-4-亚氨基-3-甲基-2-氧代-3,4-二氢嘧啶-1(2h)-甲酰胺衍生物的制作方法
- 一种含亚磺酸基的还原性球形纤维素吸附剂及其制备方法
- 一种去除饮用水中全氟辛烷磺酸基化合物的方法
- 含有茚满和二氟亚甲氧基桥的液晶化合物及其制备方法与应用的制作方法
- 由具有全氟磺酸侧基的聚全氟环丁烷以及与聚偏二氟乙烯的掺混物制成的聚电解质膜的制作方法
- 6-(取代的)亚甲基青霉烷酸类;6-(取代的)羟甲基青霉素烷酸类及其衍生物的制法的制作方法
- 三氟甲基磺酸2-三甲基铵-4
- 一种n-芳基-5-三氟甲基-2-吡咯烷酮和n-芳基-6-三氟甲基-2-吡啶烷酮的合成方法
- 一种三氟甲基修饰的(+)-Patulolide C及其制造方法
- 用于三氟甲基亚磺酸钠干燥的方形真空干燥机的制作方法
- N-(取代的)-5-氟-4-亚氨基-3-甲基-2-氧代-3,4-二氢嘧啶-1(2h)-甲酰胺衍生物的制作方法
- 一种含亚磺酸基的还原性球形纤维素吸附剂及其制备方法
- 一种去除饮用水中全氟辛烷磺酸基化合物的方法
- 含有茚满和二氟亚甲氧基桥的液晶化合物及其制备方法与应用的制作方法
- 由具有全氟磺酸侧基的聚全氟环丁烷以及与聚偏二氟乙烯的掺混物制成的聚电解质膜的制作方法
- 6-(取代的)亚甲基青霉烷酸类;6-(取代的)羟甲基青霉素烷酸类及其衍生物的制法的制作方法
- 三氟甲基磺酸2-三甲基铵-4
- 一种n-芳基-5-三氟甲基-2-吡咯烷酮和n-芳基-6-三氟甲基-2-吡啶烷酮的合成方法