鉴定猪多杀性巴氏杆菌和/或副猪嗜血杆菌组合物和方法与流程
本发明涉及一种生物技术领域的组合物和多重PCR方法,具体涉及一种能同时鉴定猪多杀性巴氏杆菌和/或副猪嗜血杆菌的组合物和多重PCR方法。
背景技术:
研究表明,猪呼吸道疾病是由一种或多种细菌、病毒混合感染引起的疾病。通常由病毒或支原体首先侵袭呼吸道,破坏防御屏障,各种气源性病菌如多杀性巴氏杆菌以及副猪嗜血杆菌等进入呼吸道和肺部而造成继发或混合感染。猪多杀性巴氏杆菌属革兰氏阴性菌,主要导致猪的出急性血性败血症、猪肺疫和萎缩性鼻炎,常与其他病毒和细菌呈混合感染或者继发感染。
而副猪嗜血杆菌则是一种革兰氏阴性菌,能够引起猪纤维性浆膜炎、脑膜炎和关节炎等,且常与猪呼吸道疾病有关。副猪嗜血杆菌目前对其的分离鉴定要比养殖场实际感染率少20%以上,其通常多杀性巴氏杆菌、猪繁殖与呼吸病毒等病原混合感染,由于其培养条件苛刻,限制了对其的研究。
猪多杀性巴氏杆菌和副猪嗜血杆菌是猪呼吸道常见的重要致病菌,引起的临床症状很难区分。对猪多杀性巴氏杆菌和副猪嗜血杆菌的鉴定多采用形态观察、生理生化鉴定及其免疫学鉴定等传统的方法,这些方法耗时耗力且准确度差,因此仅仅依靠常规检验方法和临床经验很难对病原进行判断,进而会贻误动物疫病的防控的最佳时机;因此,建立一种准确快速的鉴定猪上述呼吸道两种常见病原体方法十分必要。
多重PCR(multiplex PCR)是在一个PCR反应体系中加入多对特异性引物,针对多个DNA模板或同一模板的不同区域扩增多个目的片段的PCR技术。其可在同一PCR反应体系中同时加入多种病原微生物的特异性引物,在同一条件下进行PCR扩增,可用于同时鉴定多种病原体或鉴定出是哪一型病原体感染。
因此,开发一种通过多重PCR鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌方法,已经成为本领域技术人员亟待解决的技术问题。
技术实现要素:
鉴于猪多杀性巴氏杆菌和副猪嗜血杆菌均是猪场PRDC的常见重要病原体,且往往是混合感染,而传统的诊断技术如细菌分离、免疫学试验等费时费力,不适于临床快速诊断,也不适于大规模的流行病学调查的现状。
本发明解决的技术问题是克服现有技术的上述不足,提供一种直接从样品中一次鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌的组合物以及多重PCR检测方法。本发明方法简单易行,鉴定快速,准确程度高。
本发明解决所述技术问题的主要发明构思如下:
本发明为了解决通过一次检测就可以检出样品中两种病原体的技术问题,首先从已发表的文献中分别筛选出具有猪多杀性巴氏杆菌和副猪嗜血杆菌两种病原体基因型特点的保守性基因片段,针对这些基因靶点,分别设计合成扩增这些靶点基因的引物,将多对引物放在一个PCR反应体系,通过各项参数调整优化,建立直接从样品中一次检测两种病原体的两套互为补充鉴定的多重PCR检测方法;本发明还进一步优化了病原培养方法,通过缩短培养时间,进一步达到利用该多重PCR方法快速检测实际样品的目的。
具体来说,本发明是通过如下技术方案实现的。
一种鉴定猪多杀性巴氏杆菌和/或副猪嗜血杆菌的组合物,所述组合物至少包含如下两组引物对;其中一组引物对选自由序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,和序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;另一组引物对选自由序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对。
其中,所述组合物包含如下五组引物对:序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对。
其中,所述组合物用于同时鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌。
本发明还提供一种含有所述组合物的试剂盒。
进一步,该试剂盒还包括说明书。
一种同时鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌的多重PCR方法,所述方法包括如下步骤:
(1)筛选具有猪多杀性巴氏杆菌和副猪嗜血杆菌的至少两个高保守性基因片段,作为PCR检测的靶点基因,分别设计合成扩增上述靶点基因的引物,所述引物至少包含如下两组引物对;其中一组引物对选自由序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,和序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;另一组引物对选自由序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;
(2)将步骤(1)的引物对放在一个PCR反应体系中,扩增靶点基因;以及
(3)鉴定PCR扩增产物。
其中,在步骤(1)中,猪多杀性巴氏杆菌的保守性基因片段为KMT1基因、16s rRNA,副猪嗜血杆菌pila基因、16s rRNA和lipo基因。
其中,在步骤(2)中采用两个PCR反应体系;优选所述两个PCR反应体系的退火温度分别为55℃和58℃。
其中,步骤(2)所述两个PCR反应体系分别如下:PCR反应体系1:DNA模板10μl,副猪嗜血杆菌16s rRNA和猪多杀性巴氏杆菌16s rRNA上、下游引物分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;PCR反应体系2:DNA模板12μl,副猪嗜血杆菌pila,LIPO,猪多杀性巴氏杆菌KMT1多套上、下游引物分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃1min和72℃1min的循环,循环30次,最后72℃延伸10min。
一种通过所述组合物,所述试剂盒,所述PCR方法对样品进行鉴定的方法,所述方法包括如下步骤:将待测样品直接接种在TSB液体培养基中培养8h后,取菌液98℃加热10min提取病原体DNA样品,作为模板,按照权利要求6-9任一项所述方法进行多重PCR,得到扩增结果后确认是否含有猪多杀性巴氏杆菌和/或副猪嗜血杆菌;优选在反应体系1中,通过815bp的条带鉴定副猪嗜血杆菌,通过305bp的条带鉴定猪多杀性巴氏杆菌,在反应体系2中,通过288bp或231bp的条带鉴定副猪嗜血杆菌,通过588bp的条带鉴定猪多杀性巴氏杆菌。如果采用PCR反应体系1对病原体DNA进行扩增后,PCR产物的琼脂糖电泳图谱中发现815bp的条带,说明感染了副猪嗜血杆菌,发现305bp的条带则说明感染了猪多杀性巴氏杆菌,如果815bp和305bp的条带都存在则表明存在两种病原的混合感染现象;如果采用PCR反应体系2对病原体DNA进行扩增后,PCR产物的琼脂糖电泳图谱中发现288bp或231bp的条带,说明感染了副猪嗜血杆菌,发现588bp的条带则说明感染了猪多杀性巴氏杆菌,如果288bp和588bp或231bp和588bp的条带都存在则表明存在两种病原的混合感染现象;反之,如果上述电泳条带都没发现则表明该样本中无感染现象。PCR体系1和PCR体系2的结果互相补充,2个反应体系鉴定结果均为阳性的样本,准确程度高。更具体来说,本发明通过如下技术方案实现的:
一种同时鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌的多重PCR方法,具体步骤如下:
(1)筛选具有猪多杀性巴氏杆菌和副猪嗜血杆菌两个病原体基因型特点的保守性基因片段,作为PCR鉴定的基因靶点,分别设计合成扩增上述靶点基因的引物;
(2)将多对引物放在一个PCR反应体系中,扩增靶点基因;
(3)通过琼脂糖凝胶电泳鉴定鉴定PCR扩增产物;其中:
扩增猪多杀性巴氏杆菌的上游引物1的序列如序列1所示;下游引物1的序列如序列2所示,上游引物2的序列如序列3所示;下游引物2的序列如序列4所示;扩增副猪嗜血杆菌的上游引物1的序列如序列5所示;下游引物1的序列如序列6所示,上游引物2的序列如序列7所示;下游引物2的序列如序列8所示,上游引物3的序列如序列9所示;下游引物3的序列如序列10所示,相关的具体信息见下表1。
表1病原引物相关信息
其中,在本发明的步骤(1)中,由于对引物的退火温度,片段长度等要求,最终选定的结果是猪多杀性巴氏杆菌(PM)的KMT1基因、16s rRNA,副猪嗜血杆菌pila基因、16s rRNA和LIPO基因。
其中,在步骤(2)中,PCR反应体系1如下:DNA模板10μl,副猪嗜血杆菌和猪多杀性巴氏杆菌16s rRNA上、下游引物分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;PCR反应体系2如下:DNA模板12μl,pila,LIPO,KMT1多套上、下游引物分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;
其中,对实际待检测样品前处理时,选择猪多杀性巴氏杆菌、副猪嗜血杆菌都适宜的TSB改良培养基(胰蛋白大豆肉汤30g,加水940ml,121度高压灭菌15分钟,冷却后加50ml小牛血清和10ml过滤除菌的0.01%NAD(烟酰胺腺嘌呤二核苷酸),将现场采到组织样品直接接种在TSB液体培养基中培养8h后,取菌液98℃加热10min提取病原体DNA样品,作为模板,进行多重PCR方法。而常规的样品前处理则是先将组织样品在TSA固体平板上划线,一般要等24小时后才能长出菌落,然后将长出菌落再接种TSB液体培养基培养12小时后取菌液作为提取被检病原体DNA样品进行PCR检测。因此本发明较常规方法缩短了28小时的检测时间,能进一步达到快速检测实际样品的目的。
与现有技术相比,本发明具有如下的有益效果:
(1)较常规的PCR检测方法,本发明的多重PCR检测方法具有重复性好、特异性强、准确程度高、快速的特点,提高了检测效率。
(2)该方法体系既可以准确检测病原体,还可以对混合感染状况进行分析。
附图说明:
图1:副猪嗜血杆菌、猪多杀性巴氏杆菌多重PCR体系1退火温度优化结果;
其中:M:DNA 100bp ladder;泳道1:58℃;泳道2:57.5℃;泳道3:57℃;泳道4:56.5℃;泳道5:56℃;泳道6:51℃;
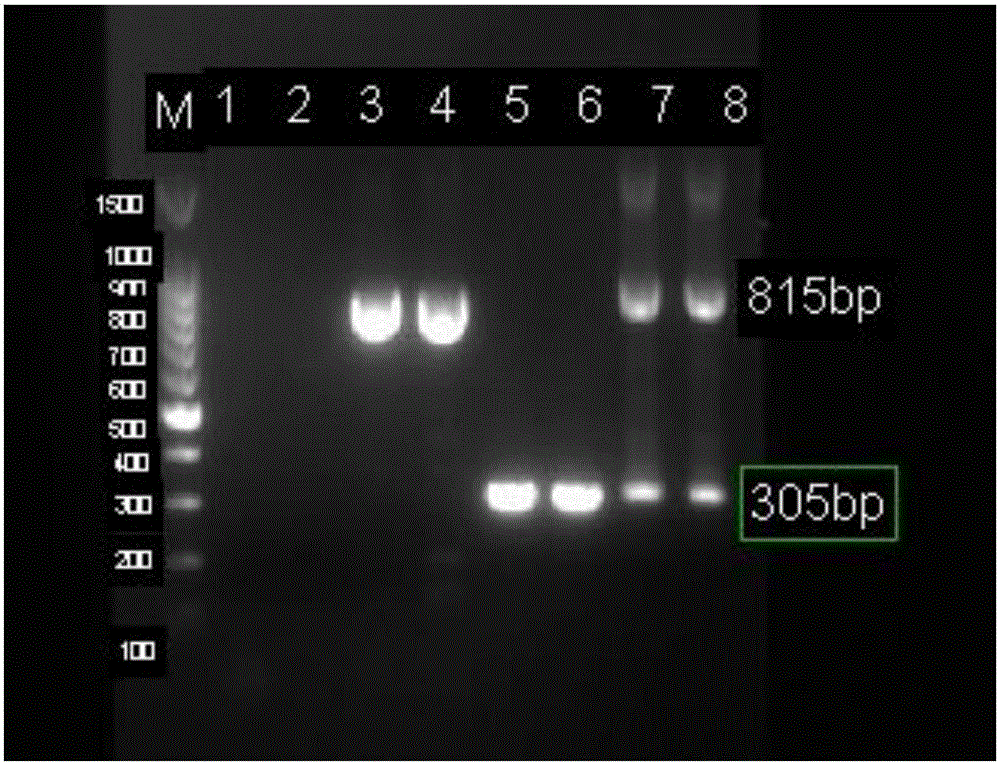
图2:副猪嗜血杆菌、巴氏杆菌多重PCR体系1特异性检测结果;
其中:M:DNA 100bp ladder;泳道1:嗜热脂肪土芽孢杆菌;泳道2:大肠杆菌;泳道3:沙门氏菌;泳道4:副猪嗜血杆菌;泳道5:副猪嗜血杆菌;泳道6:多杀巴氏杆菌;泳道7:副猪嗜血杆菌和多杀性巴氏杆菌;泳道8:副猪嗜血杆菌和多杀性巴氏杆菌。
图3:副猪嗜血杆菌、巴氏杆菌多重PCR体系1样品检测结果;
其中:M:DNA 100bp ladder;泳道1:阴性样品1;泳道2:副猪嗜血杆菌感染样品2;泳道3:副猪嗜血杆菌感染样品3;泳道4:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品4;泳道5:猪多杀性巴氏杆菌感染样品5;泳道6:猪多杀性巴氏杆菌感染样品6;泳道7:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品7;泳道8:副猪嗜血杆菌感染样品8;泳道9:猪多杀性巴氏杆菌9;泳道10:猪多杀性巴氏杆菌感染样品10;泳道11:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品11;泳道12:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品12;泳道13:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品13;。
图4:副猪嗜血杆菌、猪多杀性巴氏杆菌多重PCR体系2退火温度优化结果;
其中:M:DNA 100bp ladder;泳道1:55℃;泳道2:54.5℃;泳道3:54℃;泳道4:53.5℃;泳道5:53℃;泳道6:52.5℃;泳道7:52℃;泳道8:51.5℃。
图5:副猪嗜血杆菌、巴氏杆菌多重PCR体系2特异性检测结果;
其中:M:DNA 100bp ladder;泳道1、2:嗜热脂肪土芽孢杆菌;泳道3、4:副猪嗜血杆菌;泳道5、6:多杀巴氏杆菌;泳道7、8:双重PCR。
图6:副猪嗜血杆菌、巴氏杆菌多重PCR体系2样品检测结果;
其中:M:DNA 100bp ladder;泳道1-13:副猪嗜血杆菌感染样品1;泳道2:副猪嗜血杆菌感染样品2;泳道3:副猪嗜血杆菌感染样品3;泳道4:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品4;泳道5:副猪嗜血杆菌感染样品4;泳道6:猪多杀性巴氏杆菌感染样品6;泳道7:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品7;泳道8:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品8;泳道9:副猪嗜血杆菌感染样品9;泳道10:猪多杀性巴氏杆菌感染样品10;泳道11:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品11;泳道12:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品12;泳道13:副猪嗜血杆菌、猪多杀性巴氏杆菌感染样品13;。
具体实施方式
为了充分说明本发明解决技术问题所实施使用的技术方案。下面结合实施例和附图对发明做详细说明,但本发明的技术方案、技术方案的实施方式以及保护范围并不仅仅限于此。
在一种具体的实施方式中,本发明提供了一种鉴定猪多杀性巴氏杆菌和/或副猪嗜血杆菌的组合物,所述组合物至少包含如下两组引物对;其中一组引物对选自由序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,和序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;另一组引物对选自由序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对。
通过上述表述可以看出,本发明可以通过只选择每个病原体中的一组引物对进行鉴定,也可以选择多组引物对进行鉴定,这样有利于针对不同的样品来源选择合适的样品,同时还可以基于上述组合,制备适合不同场合应用的试剂盒,当然地,当同时使用五组序列进行测定时,增加测定的准确度和假阳性率。
优选地,本发明的鉴定猪多杀性巴氏杆菌和/或副猪嗜血杆菌的组合物含如下五组引物对:序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对。
上述组合物可以做成任何用于实时监测的工具,包括但不限于试剂盒等,优选所述的试剂盒进一步包含说明书以及必要试剂和工具等。进一步地,可以含有用于定量的相关工具如荧光参比试剂等。
本发明还提供一种通过所述引物对同时鉴定猪多杀性巴氏杆菌和副猪嗜血杆菌的多重PCR方法,具体包括如下步骤:(1)筛选具有猪多杀性巴氏杆菌和副猪嗜血杆菌的至少两个高保守性基因片段,作为PCR鉴定的靶点基因,分别设计合成扩增上述靶点基因的引物,其中所述引物至少包含如下两组引物对;其中一组引物对选自由序列表中序列1和序列2所示的两条单链DNA组成的PCR引物对,和序列表中序列5和序列6所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;另一组引物对选自由序列表中序列3和序列4所示的两条单链DNA组成的PCR引物对,序列表中序列7和序列8所示的两条单链DNA组成的PCR引物对,和序列表中序列9和序列10所示的两条单链DNA组成的PCR引物对组成的引物对组中的至少一组引物对;之后将步骤(1)的引物对放在一个PCR反应体系中,扩增靶点基因;以及鉴定PCR扩增产物。
在该PCR过程中,选择合适的引物是十分关键的,本发明通过选择所述的引物对达到了准确特异性地测定所述病原菌的目的。
在一种优选的具体实施方式中,所述步骤(2)中采用两个PCR反应体系;优选所述两个PCR反应体系的退火温度分别为55℃和58℃。这是通过多次试验证明的结果,在最终确定的最适退火温度下,琼脂糖电泳图谱上的条带清晰,无非特异性扩增现象,有利于操作者很容易速的判断鉴定结果,真正达到了实时快速监测。
在一种优选的具体实施方式中,两个PCR反应体系分别如下:PCR反应体系1:DNA模板10μl,副猪嗜血杆菌和猪多杀性巴氏杆菌16s rRNA上、下游引物分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃退火1min和72℃1min的循环,循环30次,最后72℃延伸10min;优选PCR反应体系2:DNA模板12μl,pila,LIPO,KMT1多套上、下游引物分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃退火1min和72℃1min的循环,循环30次,最后72℃延伸10min。
上述两个体系单独均能进行鉴定,本发明将两体系结合,达到结果互相补充,两个反应体系鉴定结果均为阳性的样本,准确程度高。PCR反应体系中适用PCR Mix简化了PCR过程,增强鉴定过程的重复性和规范性。
在本发明优选的一种具体实施方式中,本发明提供对样品鉴定前的产品的处理方法,其将待测样品直接接种在TSB液体培养基中培养8h后,取菌液98℃加热10min提取病原体DNA样品,作为模板,进行多重PCR,得到扩增结果后确认是否含有猪多杀性巴氏杆菌和/或副猪嗜血杆菌,如果采用PCR反应体系1对病原体DNA进行扩增后,PCR产物的琼脂糖电泳图谱中发现815bp的条带,说明感染了副猪嗜血杆菌,发现305bp的条带则说明感染了猪多杀性巴氏杆菌,如果815bp和305bp的条带都存在则表明存在两种病原的混合感染现象;如果采用PCR反应体系2对病原体DNA进行扩增后,PCR产物的琼脂糖电泳图谱中发现288bp或231bp的条带,说明感染了副猪嗜血杆菌,发现588bp的条带则说明感染了猪多杀性巴氏杆菌,如果288bp和588bp或231bp和588bp的条带都存在则表明存在两种病原的混合感染现象;反之,如果上述电泳条带都没发现则表明该样本中无感染现象。PCR体系1和PCR体系2的结果互相补充,2个反应体系鉴定结果均为阳性的样本,准确程度高。
实施例
下面对本发明实施例中的测定方法以及材料来源进行说明。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照试剂制造厂商所建议的条件。
实施例1多重PCR方法退火温度优化
1.样品前处理
将养猪场送检猪肺组织样品置于TSB改良液体培养基中,培养8小时后取菌液作为提取病原体DNA样品。
2.细菌DNA提取
本发明采用常规DNA提取方法,步骤如下:
2.1取菌液1mL98℃加热10min提取病原体DNA样品,作为模板。
3.多重PCR扩增反应体系建立
在PCR反应体系,特别是多重PCR反应体系中,退火温度是一个关键因素。本发明为两套多重PCR体系选择了适合多对引物的退火温度,多重PCR反应体系如下:
PCR反应体系1如下:DNA模板10μl,副猪嗜血杆菌和猪多杀性巴氏杆菌16s rRNA上、下游引物(即序列1和2、5和6)分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;
PCR反应体系2如下:DNA模板12μl,pila,LIPO,KMT1多套上、下游引物(即序列3和4、7和8、9和10)分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;
4结果
图1和图4为副猪嗜血杆菌、猪多杀性巴氏杆菌多重PCR退火温度优化结果,设置退火温度进行梯度实验,结果显示多重PCR反应体系1和反应体系2分别在退火温度55℃和58℃时能更好的扩增出预期的条带。
实施例2:多重PCR方法体系特异性验证
特异性是PCR反应体系又一个关键的因素。本发明为了确保所建立的多重PCR体系的特异性,利用大肠杆菌等作为对照,验证该体系的特异性,以体系只能扩增出猪多杀性巴氏杆菌或副猪嗜血杆菌目的基因片段,而对照组不能扩增出片段为特异性合格。
1.样品前处理
取大肠杆菌等菌株作为对照PCR模板;将实验室保存的副猪嗜血杆菌、猪多杀性巴氏杆菌在TSB改良培养基上划线,37℃培养24h后挑取单菌落接种于TSB培养基中。
2.细菌DNA提取
方法同实施例1。
3.多重PCR扩增反应体系建立
多重PCR反应体系如下:PCR反应体系1如下:DNA模板10μl,副猪嗜血杆菌和猪多杀性巴氏杆菌16S rRNA上、下游引物分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;
PCR反应体系2如下:DNA模板12μl,pila,LIPO,KMT1多套上、下游引物分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;PCR结束后,取8μl产物作琼脂糖凝胶电泳分析。
4.结果
副猪嗜血杆菌、巴氏杆菌多重PCR特异性鉴定结果见图2和图5。可见该多重PCR体系只能检出副猪嗜血杆菌、猪多杀性巴氏杆菌单独或混合感染,特异性强。
实施例3多重PCR方法检测实际样品中猪多杀性巴氏杆菌和副猪嗜血杆菌
1.样品前处理
选择猪多杀性巴氏杆菌和副猪嗜血杆菌都比较适宜的TSB改良培养基,将面拭子采集感染猪多杀性巴氏杆菌或副猪嗜血杆菌或未感染的上述两种病原菌的猪肺部渗出液,无菌操作直接接种在TSB改良液体培养基中培养8h后,取菌液提取猪被检病原体DNA样品,作为模板,进行多重PCR检测。
2.细菌DNA提取
方法同实施例1。
3.多重PCR扩增反应
多重PCR反应体系如下:PCR反应体系1如下:DNA模板10μl,副猪嗜血杆菌和猪多杀性巴氏杆菌16S rRNA上、下游引物分别为各1.2μl和0.8μl,PCR Mix30μl,超纯水补充至55μl;PCR反应条件:94℃预变性4min,进入94℃60s,55℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;PCR反应体系2如下:DNA模板12μl,pila,LIPO,KMT1多套上、下游引物分别为各0.96μl,0.64μ和0.8μl,PCR Mix30μl,超纯水补充至60μl;PCR反应条件:94℃预变性4min,进入94℃60s,58℃1min和72℃1min的循环,循环30次,最后72℃延伸10min;PCR结束后,取8μl产物作琼脂糖凝胶电泳分析。
4结果
副猪嗜血杆菌、巴氏杆菌多重PCR样品鉴定结果如图3和图6所示。由结果看出,该多重PCR鉴定体系可以直接检出组织样品中单独感染的巴氏杆菌、副猪嗜血杆菌的单独及混合感染。
- 还没有人留言评论。精彩留言会获得点赞!