一种用于诊断膀胱癌的定量PCR引物和试剂盒的制作方法
本发明涉及膀胱癌诊断技术领域,尤其涉及一种用于诊断膀胱癌的定量PCR引物和试剂盒。
背景技术:
长链非编码RNA(Long non-coding RNA,lncRNA)是一类本身不编码蛋白、转录本长度超过200nt的RNA分子,它可在多层面上(如表观遗传调控、转录调控以及转录后调控等)调控基因的表达。lncRNA最初被认为是RNA聚合酶II转录的副产物,是一种“噪音”,不具有生物学功能。然而,近年来的研究表面,lncRNA参与了X染色体沉默、染色体修饰和基因组修饰、转录激活、转录干扰、核内运输等过程,其调控作用正在被越来越多的人研究。近年来研究表明lncRNA有助于肿瘤的早期诊断、预后的判断并且可以作为分子靶向治疗的目标基因,因此具有较好的临床应用价值。
诱导性基因表达系统可以从时间上调控基因的表达,是基因功能研究的重要工具之一,其中,四环素诱导的基因表达系统是应用最广泛的一种,并且在合成生物学的发展历程中作为一种工具被广泛应用。由于四环素诱导的基因表达系统可以从时间上控制基因的表达,为膀胱癌的诊断与治疗带来了新的思路。
TUC338(Gene ID:102157401,https://www.ncbi.nlm.nih.gov/gene/?term=TUC338)在肝癌、舌癌等癌中起着重要的作用,但是该基因与膀胱癌的关系未见报道。
技术实现要素:
本发明发现TUC338基因与膀胱癌相关,因此本发明提供一种用于诊断膀胱癌的定量PCR引物和试剂盒,能够实现膀胱癌的诊断。
根据本发明的第一方面,本发明提供一种用于诊断膀胱癌的定量PCR引物,包括上游引物和下游引物,其序列均是人TUC338基因上的核苷酸序列,用于扩增人TUC338基因。
本发明发现了TUC338基因与膀胱癌相关,因此根据PCR的原理,可以设计针对该基因的引物,用于扩增该基因,以定量分析该基因的表达水平,从而用于诊断膀胱癌的发生。
进一步地,上述上游引物和下游引物的序列分别如SEQ ID NO:3和SEQ IDNO:4所示。使用SEQ ID NO:3和SEQ ID NO:4所示的引物进行定量PCR扩增,能够显著地区分膀胱癌患者和健康人中TUC338基因的表达量。根据本发明的发现,用于扩增TUC338基因的引物不限于SEQ ID NO:3和SEQ ID NO:4,然而发明人发现SEQ ID NO:3和SEQ ID NO:4所示的引物对于区分膀胱癌患者和健康人具有显著优异的效果,因此是优选的引物对。
根据本发明的第二方面,本发明提供一种用于诊断膀胱癌的定量PCR试剂盒,该试剂盒包括定量PCR引物,上述引物包括上游引物和下游引物,其序列均是人TUC338基因上的核苷酸序列,用于扩增人TUC338基因。
进一步地,上述上游引物和下游引物的序列分别如SEQ ID NO:3和SEQ IDNO:4所示。
进一步地,上述试剂盒还包括作为内参的引物。
进一步地,上述作为内参的引物,包括上游引物和下游引物,其序列分别如SEQ ID NO:5和SEQ ID NO:6所示。
进一步地,上述试剂盒还包括DNA聚合酶。
进一步地,上述DNA聚合酶是Taq DNA聚合酶。
根据本发明的第三方面,本发明提供分离的人TUC338基因在制备用于诊断膀胱癌的定量PCR引物中的用途。
根据本发明的第四方面,本发明提供如SEQ ID NO:3和SEQ ID NO:4所示的引物对在作为诊断膀胱癌的定量PCR引物中的用途。
经研究,本发明人发现TUC338基因与膀胱癌相关,因此针对TUC338基因,可以设计引物,用于定量扩增TUC338基因,根据TUC338基因的扩增量来确定膀胱癌的发生情况。
附图说明
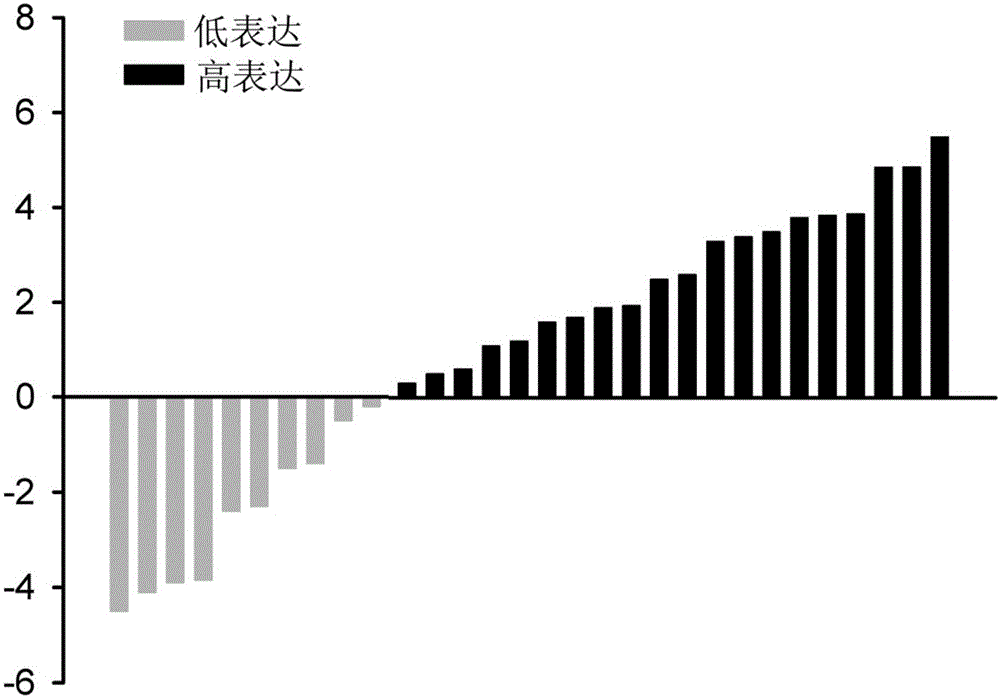
图1:TUC338在膀胱癌组织中的表达水平。使用定量PCR方法检测膀胱癌组织中TUC338的相对集中度。
图2:TUC338在细胞系中的表达水平。与SV-HUC-1细胞系对比,TUC338在T24(A)及5637(B)均显著性高表达(*P<0.01)。
图3:si-TUC338敲减TUC338的表达量。与si-NC组对比,TUC338表达水平在si-TUC338组中表达水平显著性下降(P<0.01)。
图4:四环素诱导TUC338shRNA敲减TUC338的表达量。加入不同浓度强力霉素(DOX)后四环素诱导组的TUC338表达水平下降;1μg/ml强力霉素能够最大程度的抑制TUC338的表达水平(P<0.01)。
图5:CCK8法检测转染siRNA质粒抑制细胞增殖的结果。与si-NC组对比,在si-TUC338组中,T24细胞(图A)及5637细胞(图B)的增殖被显著性抑制(P<0.01)。
图6:CCK8法检测转染四环素诱导shRNA质粒抑制细胞增殖的结果。与对照组相比,在加入1μg/ml强力霉素诱导的TUC338shRNA组中,T24细胞(图A)及5637细胞(图B)的增殖被显著地抑制(P<0.01)。
图7:ELISA法检测转染siRNA质粒后细胞凋亡情况的结果图。转染si-TUC338后,半胱天冬酶3(Caspase-3)在T24(图A)及5637(图B)均显著性提高(P<0.05)。
图8:ELISA法检测转染四环素诱导shRNA质粒细胞凋亡情况的结果图。转染四环素诱导TUC338 shRNA后,半胱天冬酶3在T24(图A)及5637(图B)均显著性提高(P<0.01)。
图9:四环素诱导系统质粒psi-LVRInU6TGP的图谱。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。
实验方法:
1.标本的收集
膀胱癌及其配对的癌旁正常组织标本收集于安徽医科大学第一附属医院行全膀胱手术切除的膀胱癌患者标本。每例患者均签署知情同意书。
2.细胞培养
两种膀胱癌细胞系T24和5637以及正常膀胱上皮细胞SV-HUC-1均购自中科院上海生科院。膀胱癌(人)细胞5637、T24和正常膀胱上皮细胞SV-HUC-1分别培养于1640、DMEM和F-12K培养基(含10%胎牛血清、1%谷氨酰胺、1%青霉素-链霉素混合液),放置于37℃、5%CO2的培养箱培养,贴壁细胞在长满瓶底时,用0.25%胰蛋白酶消化后按比例进行传代培养。
3.四环素诱导的针对TUC338的短发夹RNA(shRNA)质粒构建
四环素诱导系统质粒psi-LVRInU6TGP购于广州富能基因公司(FulenGen,广州,中国),其图谱如图9所示。将针对TUC338的shRNA序列插入到四环素诱导系统的下端。
针对TUC338的shRNA序列是GCCCAATTGTGCAGTGTGAAA(SEQ ID NO:1);针对阴性对照NC shRNA的序列为TTCTCCGAACGTGTACGTTT(SEQ ID NO:2)。
4.细胞瞬时转染
si-TUC338序列为GCCCAATTGTGCAGTGTGAAA(SEQ ID NO:1);阴性对照si-NC序列为TTCTCCGAACGTGTACGTTT(SEQ ID NO:2)。将细胞接种于24孔板,待细胞贴壁后进行转染,方法参考转染试剂LipofectamineTM2000说明书。转染6h后,用移液枪吸弃每孔培养液,每孔再加入新的培养基500μl,减少Lipofectamine 2000对细胞的毒性。
5.实时荧光定量PCR
采用试剂盒 Premix Ex TaqTM II(Tli RNaseH Plus)(TaKaRa,货号DRR820A)进行实时荧光定量PCR。
PCR扩增条件为:95℃预变性30s,然后以95℃5s、60℃30s进行40个循环。
定量PCR用的TUC338引物:
上游引物:5’-CCGGATTGACAGCCCTGGAGA-3’(SEQ ID NO:3),
下游引物:5’-CTGAGGCGGAAGGATTGAGTGAGC-3’(SEQ ID NO:4);
GAPDH上游引物:5’-AGAAGGCTGGGGCTCATTTG-3’(SEQ ID NO:5),
GAPDH下游引物:5’–AGGGGCCATCCACAGTCTTC-3’(SEQ ID NO:6)。
6.细胞增殖检测
用含10%胎牛血清的无抗生素培养液配成单个细胞悬液,以每孔2500个细胞接种到96孔板,每孔体积100μl。使用细胞增殖及细胞毒性检测试剂盒(CCK8试剂盒)(博士德生物,货号:AR1160)检测细胞生长。分别于转染后24、48和72h,取相应的孔做检测。每孔加CCK8溶液10μl。孵育1h,选择450nm波长用酶标仪(Bio-Rad,美国)测定各孔吸光值,记录结果,以时间为横坐标,吸 光值为纵坐标绘制细胞生长曲线。取3次独立重复试验做统计。
7.细胞凋亡检测
用半胱天冬酶3酶联免疫吸附测定法(caspase3ELISA)测凋亡指标半胱天冬酶3的活性来检测细胞凋亡,Caspase 3Assay Kit(Colorimetric)试剂盒购于Abcam(货号ab39401)。转染前,每孔1×105细胞种植到12孔板中。当细胞长到60%的融合度,按照说明书转染质粒48小时后,吸弃旧培养基,用PBS洗细胞两次。
8.统计学分析
数据分析使用SPSS 20.0统计软件,正态分布的数据采用x±s表示。TUC338在标本癌组织及癌旁组织表达差异情况用配对样本t检验,CCK8细胞增殖数据用ANOVA,其它数据采用独立样本t检验。P<0.01具有统计学意义。
实验结果
1.TUC338在膀胱癌组织及细胞中高表达,同时与临床病理特征相关。
在30对膀胱癌标本中,使用定量PCR方法,检测膀胱癌组织及细胞中TUC338的表达水平。图1显示,膀胱癌组织中TUC338表达明显高于癌旁组织,其中高表达20例(66.7%)。表1显示,高表达的TUC338与膀胱癌的病例分期及TNM分期高度相关(P<0.01);但是与性别、年龄、肿瘤大小和淋巴结转移无显著性联系;相对于正常膀胱上皮细胞(SV-HUC-1),TUC338在T24(图2A)及5637(图2B)细胞中显著高表达(P<0.01)。
表1 TUC338表达水平与膀胱癌临床病理特征之间的关系[n(%)]
2.si-TUC338敲低膀胱癌细胞TUC338表达
转染si-TUC338 48小时后使用定量PCR方法检测膀胱癌细胞中TUC338的表 达水平。T24(图3A)和在5637(图3B)细胞系中,与si-NC组比较,在si-TUC338组细胞TUC338表达均显著降低。表明si-TUC338可显著下调5637及T24细胞内TUC338的表达。
3.四环素诱导的TUC338shRNA敲低TUC338的表达
当加入不同浓度的强力霉素后,四环素诱导的TUC338shRNA可以显著地降低TUC338在T24(图4A)和5637(图4B)的表达(p<0.01)。当1μg/ml的强力霉素加入已转入四环素诱导的TUC338shRNA质粒后,相对于对照组,在T24细胞中,TUC338表达水平下降了40%(P<0.01);在5637细胞中下降了39%(P<0.01)。这些结果表明四环素诱导的TUC338shRNA可以降低TUC338的表达,并与强力霉素呈剂量依赖性。由于1μg/ml的强力霉素能够最大程度地抑制TUC338的表达,后续研究采用1μg/ml的浓度。
4.si-TUC338抑制膀胱癌细胞增殖
CCK8结果显示si-TUC338可以显著地降低T24(图5A)和5637(图5B)细胞的增殖(P<0.01)。这些结果表明si-TUC338抑制膀胱癌细胞增殖。
5.四环素诱导的TUC338shRNA抑制细胞增殖
CCK8法检测结果显示当加入了1μg/ml的强力霉素后,相对于对照组,四环素诱导的TUC338shRNA能够显著地抑制T24(图6A)和5637(图6B)的细胞增殖(P<0.01)。
6.TUC338抑制膀胱癌细胞凋亡
ELISA法结果显示,相对对照组,半胱天冬酶3活性和凋亡率在转染si-TUC338的T24细胞(图7A)和5637细胞(图7B)中显著提高(P<0.01)。以上结果显示,TUC338可以抑制膀胱癌细胞凋亡。
7.四环素诱导的TUC338shRNA促进细胞凋亡
当加入了1μg/ml的强力霉素后,ELISA法结果显示,相对于对照组,四环素 诱导的TUC338shRNA能够显著地提高T24细胞(图8A)和5637细胞(图8B)中半胱天冬酶3活性(P<0.01)。上述结果表明与对照组相比,四环素诱导的TUC338shRNA能够显著地增加凋亡细胞总数量及早期凋亡细胞。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用