基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系的制作方法
本发明涉及将微流控芯片技术应用到体内组织工程的模拟与应用领域,具体涉及一种基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系。
背景技术:
动物实验在现代医学与生物学中占据了极为重要的位置,但是经费以及动物伦理也成了难以回避的问题。结合微流控技术与生物科学技术,创造出了一种“器官芯片”,能够用微芯片复制人体器官的功能,使医学实验变得更为简便。
药物进入体内之后往往会经过吸收、分布、代谢、排泄等过程。药物自体外或给药部位经过细胞组成的屏蔽膜进入血液循环,通过门静脉进入肝脏,受到肝脏内药物代谢酶的影响,药物原型或代谢物经过血液循环迅速分布在各组织。肝脏作为人体的重要代谢器官,在药物的处置中发挥重要作用。
1885年德国人paulehrlich第一次证明了脑血管的通透性与非神经性血管不同,其后的研究者们相继认识到血和脑之间有屏障存在,并称之为血-脑屏障。血脑屏障是一个以脑微血管内皮细胞、星形胶质细胞和周细胞共同构成的结构的和功能的屏障,它调节分子进出大脑以维持神经的微环境。很多脑内的疾病都与血脑屏障的防御功能被破坏有关,药物又无法顺利通过血脑屏障。因此,建立体外血脑屏障模型,研究血脑屏障的结构和功能特性、对各种化学成分的转运能力及其损伤和防御功能被破坏的机制,对于进一步研究血脑屏障的功能原理,认识脑部感染和药物的转运机制,以及由于屏障功能失效造成的脑损伤和疾病和如何进行药物治疗有着重大意义。
细胞生物学发展至今,现有的体外血脑屏障的模拟方法主要集中于商品化的孔板或transwell小室,研究二维层面血脑屏障模型的结构和功能,主要存在的问题是孔板或者transwell小室很难在体外构建存在二维平面到三维空间的界面转换的血脑屏障模型,难以实现间充质干细胞穿越血脑屏障进行脑内肿瘤治疗的原位观察。
微流控芯片技术作为一门迅速发展起来的科学技术,已经在生物医学领域展现了其独特的优势,更因其同细胞尺寸匹配、环境同生理环境相近、在时间和空间维度上能够提供更为精确的操控,易于通过灵活设计实现多种细胞功能研究等特点而成为新一代细胞研究的重要平台。它对于实验结果能够实时追踪和原位观察,不仅能够获得最终结果,也可以得到细胞迁移过程中出现的暂时性信息,为间充质干细胞穿越血脑屏障过程的研究提供常规分析中有可能缺失的重要生物学信息。而目前,利用微流控芯片进行间充质干细胞穿越血脑屏障,尤其是从二维平面迁移运动到三维基质过程的研究分析还处于空白阶段。
微流控芯片技术作为一门迅速发展起来的科学技术,已经在生物医学领域展现了其独特的优势,更因其同细胞尺寸匹配、环境同生理环境相近、在时间和空间维度上能够提供更为精确的操控,易于通过灵活设计实现多种细胞功能研究等特点而成为新一代细胞研究的重要平台。应用微流控技术构建具有肝-脑功能的器官芯片模拟药物体内代谢过程,研究药物及其代谢产物在血脑屏障的通透性具有十分重要的优势和意义。
目前,利用微流控技术构建具功能的复杂多器官芯片进行相关研究分析还处于空白阶段,如能实现在生物学研究及医药研发中具有极大的应用前景。
技术实现要素:
针对上述问题,本发明提供一种基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系及其应用,该体系可以模拟体内代谢过程进行药物毒性评价,应用于药物经代谢后通透血脑屏障的药物评价。
一种流控芯片,该微流控芯片主要由顶层芯片、多孔滤膜、底层芯片组成,多孔滤膜通过不可逆封接顶层芯片的下表面,封有顶层芯片的多孔滤膜下表面通过pdms与底层芯片的上表面粘合封接;
顶层芯片由u形的顶层芯片主通道和顶层芯片主通道入口连接而成,
底层芯片由左侧主通道、右侧主通道、和胶原通道、胶原通道入口、底层芯片左侧主通道入口以及底层芯片右侧主通道入口组成,胶原通道左连左侧主通道,右连右侧主通道;
顶层芯片主通道通过多孔滤膜下连底层芯片左侧主通道;底层芯片左侧主通道通过多孔滤膜上连顶层芯片主通道,右连胶原通道。
所述底层芯片的左侧主通道为i形,所述底层芯片的右侧主通道为u型,所述底层芯片细胞胶原通道为“丰”字形,在胶原通道中间的位置上为横向结构,胶原通道通过横向结构与左侧通道和右侧通道相连接,横向结构的数量为1~10个。
所述底层芯片是由高度不同的两部分组成,左侧主通道、右侧主通道高度为200-500μm,胶原通道高度为80-200μm,主通道高度:胶原通道高度为1~3:1。
所述芯片材料为可透光透气的pdms聚合物,pdms单体与引发剂比例为5~10:1,多孔滤膜材料为聚碳酸酯膜,聚碳酸酯膜的孔径为0.01~10um。
顶层芯片主通道和底层芯片右侧主通道设计为弯型,底层芯片左侧主通道和胶原通道设计为直型,这样,各通道入口能够相互避开,且具一定距离,不会影响操作,避免距离过近导致的接触污染。每层芯片的下表面和多孔滤膜为不可逆封接,每层芯片的上表面和多孔滤膜为pdms粘合。
本发明提供的微流控芯片的制备方法,不可逆封接方法为紫外活化1小时,硅烷化处理30分,氧等离子封接。
pdms粘合方法为使用单体与引发剂比例为20:1的pdms聚合物,在玻片上甩10~50um厚,芯片上表面蘸取pdms后,与已不可逆封接有顶层芯片的多孔滤膜对齐封接,放入80度烘箱,30分。
一种基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系,采用上述微流控芯片,按照以下方法构建而成:
(1)芯片预处理
设计制作芯片,用移液器将配制好的胶原工作液加入胶原通道,加1mlpbs缓冲液于培养皿中,将固定芯片的培养皿放入培养箱中孵育30min,促使胶原由粘稠状液体变为果冻状凝胶,凝胶过程结束后,细胞主通道加入新鲜的细胞培养液;
(2)细胞的接种与培养
肝细胞调整至1~5×106cells/ml的细胞悬液,加入顶层芯片主通道,细胞贴附于多孔滤膜界面生长,将芯片平移放入37℃培养箱中继续培养、每隔24h换液一次;
鼠脑胶质细胞经消化后,调整至1~5×105cells/ml的细胞悬液,取10μl细胞悬液加入底层芯片左侧主通道;当在光学显微镜下观察到细胞均匀分布时,立即将芯片竖立,并移入恒温培养箱中放置,竖立方向为左侧主通道在上,胶原通道在下;竖立放置8min后,取出观察,如果细胞紧贴于左侧主通道与胶原通道的胶原交界面,说明细胞接种成功;将芯片放平,移入恒温培养箱中继续培养12小时;鼠脑微血管内皮细胞经消化后如前法接种于胶质细胞层上,形成两层细胞屏障层。移入恒温培养箱中继续培养12小时;
脑胶质瘤细胞(u87)或神经细胞经消化后,调整至1~5×106cells/ml的细胞悬液,取10μl细胞悬液加入底层芯片右侧主通道,将芯片平移放入37℃培养箱中继续培养、每隔24h换液一次;
(3)待细胞生长状态良好,可进行后续试验;观察药物经代谢后对血脑屏障的通透效果以及对靶细胞的作用。
一种基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系的应用,其特征在于:可采用上述体系,对药物经代谢后在血脑屏障通透性及对靶细胞的作用性进行评价,具体过程如下:
(1)免疫荧光,常规免疫染色操作,zo-1免疫染色,表征血脑屏障紧密连接情况;
(2)小分子滤过,使用小分子荧光物质,加入左侧主通道,荧光显微镜下于不同时间点拍照,分析小分子物质的渗透性,表征血脑屏障模型的渗透性;
(3)于顶层芯片施加药物,观察药物经肝代谢后,穿透血脑屏障对u87细胞活性的影响;
(4)使用cck-8试剂盒进行细胞活性的检测,cck-8试剂:细胞培养基的体积比为1:9,混合均匀成检测工作液,加入底层芯片右侧主通道,置培养箱中3小时后,转入96孔板中,酶标仪测定450nm处吸光度,用于对细胞活力进行定量,作为药物毒性的指标之一;
(5)免疫荧光,常规免疫染色操作,荧光显微镜观察拍照,进行live/dead染色,观察药物对细胞的毒性作用。
本发明基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系,顶层芯片接种有肝细胞,可以模拟体内药物的代谢过程;底层芯片主要由左侧主通道和右侧主通道通过胶原通道连接。在左侧主通道接种脑胶质细胞与脑微血管内皮细胞,通过侧立培养使两种细胞在左侧主通道与胶原通道的界面生长并形成两层细胞屏障,模拟血脑屏障的生理功能,可以观察药物在血脑屏障的通透性,以及药物经肝代谢后的化学成分在血脑屏障的通透性及其对靶细胞的影响。实现模拟体内代谢过程的药物血脑屏障通透性评价体系的构建,及其在药物经代谢后的药效学评价应用。
本发明基于微流控芯片的模拟体内代谢过程的肝-血脑屏障体系,构建了一个能够模拟体内代谢过程的血脑屏障评价平台,不但能够模拟药物在体内的代谢,同时能够实现药物在血脑屏障通透性的观察。以此平台进行药物评价,获得的数据更符合人的实际情况,降低因为研发前期药物毒性数据不可靠导致的药物研发后期的失败率。
本发明将体外肝-血脑屏障模型的构建与表征、屏障功能的评价集成到一块几平方厘米的芯片上,可以用于血脑屏障模型的体外模拟及后续应用。本发明与transwell小室细胞共培养模型相比,解决了细胞共培养模型二次接种和耗时长的问题,考虑到药物的体内代谢过程,更接近体内真实微环境,而且显著降低了细胞和试剂消耗量,并可以单次同时获得多个实验相关参数。
附图说明
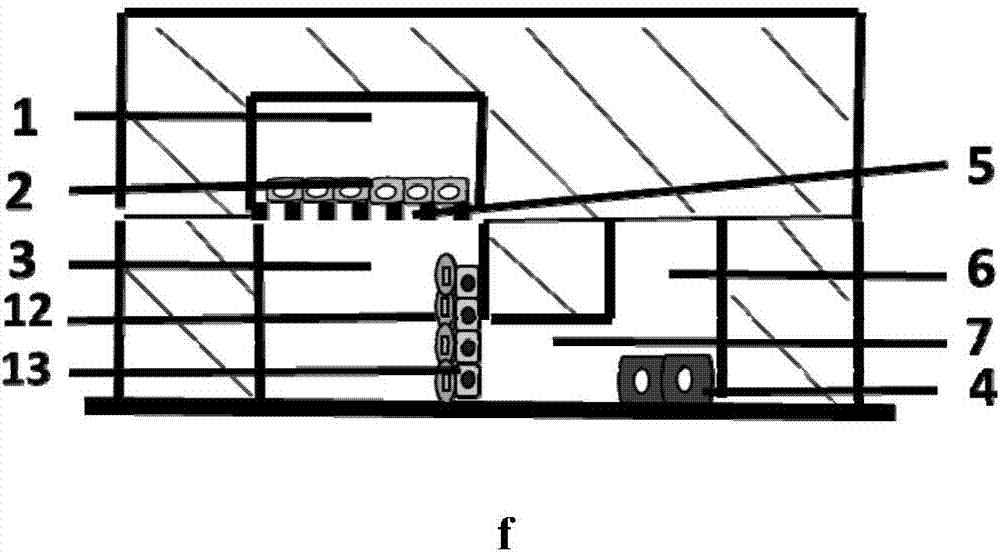
图1本发明微流控芯片示意图;a底层芯片胶原通道结构示意图;b底层芯片主通道结构示意图;c底层芯片俯视示意图;d顶层肝芯片结构示意图;e本发明微流控芯片俯视示意图;f本发明微流控芯片横截面示意图。
其中:1顶层芯片主通道,2肝细胞,3左侧主通道,4靶细胞,5多孔滤膜,6右侧主通道,7胶原通道,8胶原通道入口,9底层芯片左侧主通道入口,10底层芯片右侧主通道入口,11顶层芯片主通道入口,12脑微血管内皮细胞,13脑胶质细胞;
图2bbb模型功能表征a内皮细胞zo-1免疫荧光图,bbbb模型渗透表征图,cbbb模型跨膜电阻。
图3药物经肝-血脑屏障对脑胶质瘤细胞的作用au87细胞live/dead染色图;bu87细胞cck-8细胞活力定量图。
具体实施方式
下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
实施例1
设计并制作微流控芯片,如图1所示。
该微流控芯片主要由顶层芯片、多孔滤膜、底层芯片组成,多孔滤膜通过不可逆封接顶层芯片的下表面,封有顶层芯片的多孔滤膜下表面通过pdms与底层芯片的上表面粘合封接;顶层芯片由u形的顶层芯片主通道1和顶层芯片主通道入口11连接而成;
底层芯片由左侧主通道3、右侧主通道6、胶原通道7、胶原通道入口8、底层芯片左侧主通道入口9以及底层芯片右侧主通道入口10组成,胶原通道7左连左侧主通道3,右连右侧主通道6;
顶层芯片主通道1通过多孔滤膜5下连底层芯片左侧主通道3;底层芯片左侧主通道3通过多孔滤膜5上连顶层芯片主通道1,右连胶原通道7。
所述底层芯片的左侧主通道3为i形,所述底层芯片的右侧主通道6为u型,所述底层芯片细胞胶原通道7为“丰”字形,在胶原通道中间的位置上为横向结构,胶原通道通过横向结构与左侧通道3和右侧通道6相连接,横向结构的数量为3个。
所述底层芯片是由高度不同的两部分组成,左侧主通道3、右侧主通道5高度为300μm,胶原通道6高度为100μm,主通道高度:胶原通道高度为3:1。
所述芯片材料为可透光透气的pdms聚合物,pdms单体与引发剂比例为5:1,多孔滤膜材料为聚碳酸酯膜,聚碳酸酯膜的孔径为0.4um。
su8胶甩100μm厚,曝光胶原通道结构。在其上再甩200μm厚su8胶,对齐后曝光主通道结构,显影制成模板,浇pdms制成芯片,打孔备用。多孔滤膜6置于玻片上紫外活化1小时,硅烷化处理30分钟,与顶层芯片1一同进行氧等离子封接,置80度烘箱,30分钟。使用单体与引发剂比例为20:1的pdms聚合物,在玻片上甩10um-50um厚,底层芯片上表面蘸取薄pdms后,与封接有顶层芯片的多孔滤膜对齐粘合,80度,30分钟固化完全。
肝细胞调整至合适的细胞密度,加入顶层芯片主通道,细胞贴附于多孔滤膜界面生长,将芯片平移放入37℃培养箱中继续培养、每隔24h换液一次。
鼠脑胶质细胞经消化后,调整合适的细胞密度,取10μl细胞悬液加入底层芯片左侧主通道;当在光学显微镜下观察到细胞均匀分布时,立即将芯片竖立,并移入恒温培养箱中放置,竖立方向为左侧主通道在上,胶原通道在下;竖立放置8min后,取出观察,如果细胞紧贴于左侧主通道与胶原通道的胶原交界面,说明细胞接种成功;将芯片放平,移入恒温培养箱中继续培养12小时;鼠脑微血管内皮细胞经消化后如前法接种于胶质细胞层上,形成两层细胞屏障层。移入恒温培养箱中继续培养12小时。
脑胶质瘤细胞(u87)经消化后,调整合适的细胞密度,取10μl细胞悬液加入底层芯片右侧主通道,将芯片平移放入37℃培养箱中继续培养、每隔24h换液一次。
常规免疫荧光染色法表征血脑屏障模型细胞表面zo-1蛋白的表达,如图2a所示,可见已形成紧密连接,具有屏障结构。测量血脑屏障形成期间不同时间点的跨膜电阻,如图2b所示,可见阻值在24小时即已稳定于200ω*cm2以上,可见血脑屏障模型紧密连接已形成良好。以小分子荧光物质为探针,表征血脑屏障模型的渗透性,如图2c所示,可见未建立屏障模型组在60min时即已大量透过荧光物质,而血脑屏障模型组,在24小时仍未有荧光物质透过,具有屏障功能。
实施例2
药物的通透血脑屏障评价应用。
24小时后,分别加入含紫杉醇(ptx)2.34nm、卡培他滨(cap)80μm、替莫唑胺(tmz)40μm的细胞培养液培养,处理48小时后对右侧主通道u87细胞进行cck-8细胞活力测定,结果如图3b所示,进行live/dead染色,结果如图3a所示。可见,紫杉醇经肝代谢后,细胞毒性有所降低,且不易通过血脑屏障,细胞毒性进一步降低。卡培他滨经肝代谢后,细胞毒性显著增强,能够通过血脑屏障体系。替莫唑胺经肝代谢前后细胞毒性改变不显著,且容易通过血脑屏障。药物经肝细胞代谢过程转化成代谢产物,药物活性发生了改变,药物的血脑屏障通透性也影响药物的活性。
- 还没有人留言评论。精彩留言会获得点赞!