一种恒化器及其肠道菌群的生长调节方法与流程
本发明属于微生物菌液培养技术领域,具体涉及一种恒化器及其肠道菌群的生长调节方法。
背景技术:
恒化器是一种微生物连续培养器,它通过调节培养基的流速控制微生物生长繁殖与代谢速度,并保持培养基的化学环境恒定。微生物的连续培养是相对于分批培养而言的。连续培养是指在深入研究分批培养中生长曲线形成的内在机制的基础上,开放培养系统,不断补充营养液、解除抑制因子、优化生长代谢环境的培养方式。由于培养系统的相对开放性,因此,连续培养也称为开放培养。恒化连续培养往往控制微生物在低于最高生长速率的条件下生长繁殖,它是研究微生物生长、繁殖、产物代谢规律和基因表达与调控机理的重要技术手段。目前的恒化器的酸碱pH调控系统、补料系统、反应系统、出料及取样系统和进气系统的设置比较复杂,使用不方便,只针对筛选琥珀酸突变菌。由于肠道菌群菌种的复杂性和对条件的敏感性,目前,尚没有一种适合肠道菌群培养的恒化器装置及方法。同时微生物恒化培养是一个复杂的生化反应过程,它受到微生物生长代谢生理、基质浓度、环境等诸多因素的影响。生物量守恒定律是微生物恒化培养模型建模的基本原理,现有的肠道菌群恒化器模型主要考虑了培养基的消耗与菌群的生长过程,忽略了菌群营养存储过程和肠道壁对菌群的吸附作用。
技术实现要素:
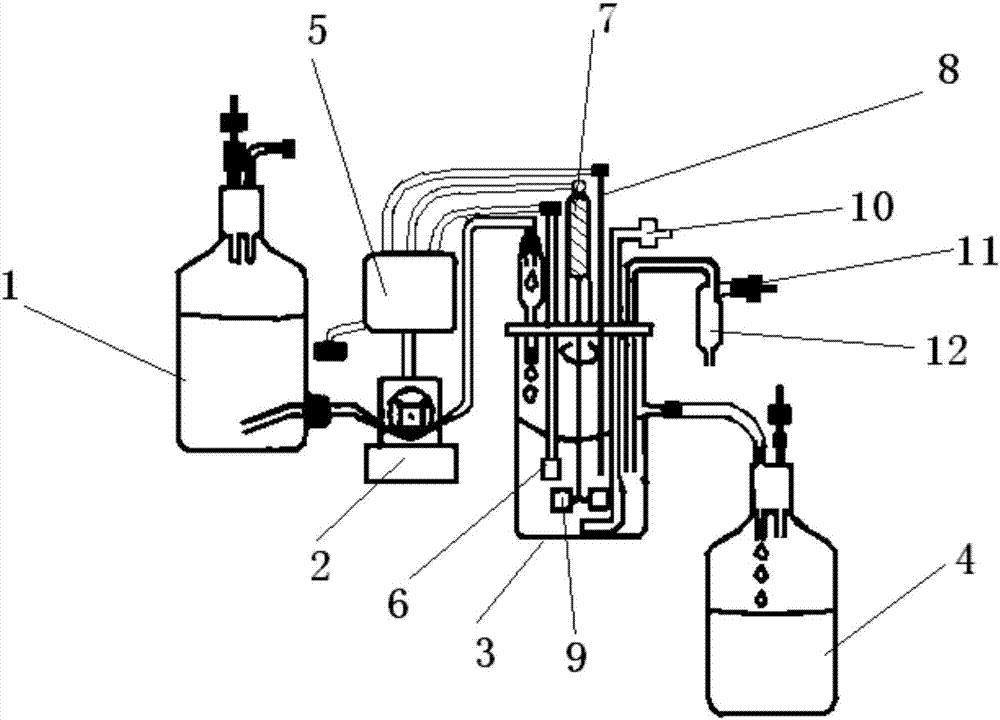
针对现有技术中存在的缺陷,本发明的目的在于提供一种恒化器及其肠道菌群的生长调节方法,模拟菌群营养存储过程以及肠道壁对菌群的吸附作用,从而更加准确的揭示肠道菌群连续恒化培养过程的内在机理和规律。为了解决上述技术问题,本发明采用如下技术方案予以实现:一种恒化器,包括营养液储备器,所述的营养液储备器依次连接有蠕动泵、培养器和溢出器;所述的蠕动泵连接有控制系统,所述的控制系统连接在电源上,所述的控制系统连接有电机的一端,所述的电机的另一端连接有搅拌叶,所述的搅拌叶置于培养器中;所述的培养器中设有无菌空气管和空气过滤器,空气过滤器置于培养器外的一端设有取样口,培养器和溢出器之间的管道上设有排液阀;所述的控制系统还连接有温度传感器和pH值传感器,所述的温度传感器和pH值传感器均伸入培养器中液体液面以下。恒化器的两种群肠道菌群的生长调节方法,所述的两种群为浮游细菌菌群和附着细菌菌群,包括以下步骤:步骤一:计算培养液的输入率、输出率和肠道菌群的输出率;培养液的输入率为D0*S0,培养液的输出率为D*S(t),菌群的输出率为D*u(t);其中,S0为培养液的初始输入浓度,mol·L-1,S(t)为t时刻培养液的浓度,mol·L-1,D为培养液输出到溢出器的速率,D=D0,day-1,u(t)为t时刻肠道菌群的浓度,mol·L-1;步骤二:计算肠道菌群对培养液的吸收率;单位菌群对培养液的吸收率表示为:其中,i=1,2,i=1表示浮游细菌,i=2表示附着细菌,ki为i的半饱和常数,Qi(t)为t时刻i的细胞配额,mol·cell-1Qmax,i为i的最大细胞配额,mol·cell-1,Qmin,i为i的最小细胞配额,mol·cell-1,ρmax,i为i肠道菌群的最大消耗率,mol·cell-1·day-1;步骤三:计算菌群细胞对培养液的消耗率;浮游细菌对培养液总的消耗为:附着细菌对培养液总的消耗为:其中,u(t)为t时刻浮游细菌浓度,mol·L-1,ν(t)为t时刻附着细菌浓度,mol·L-1;γ1为浮游细菌的消耗率,γ2为附着细菌的消耗率;步骤四:计算单位菌群的增长率;其中,μmax,i为i菌群的最大生长率,day-1,(Qi-Qmin,i)+是函数(Qi-Qmin,i)的正部;步骤五:建立两种群肠道菌群的生长模型;培养液浓度的变化率:浮游细菌浓度的变化率:浮游细菌细胞配额的变化率:附着细菌浓度的变化率:附着细菌细胞配额的变化率:其中,α为浮游细菌吸附到肠道壁上的概率,0<α<1,β为附着细菌游离于肠道壁的概率,0<β<1,α和β的大小取决于培养器壁的光滑程度,培养器壁越光滑,α越小,β越大;;步骤六:根据步骤五所得的两种群肠道菌群生长模型,通过改变营养液输入到培养器的输入速率、培养液输出到溢出器中的速率和培养器壁的光滑程度来控制两种群肠道菌群的增长率;培养液输出到溢出器中的速率越大,培养器壁越粗糙,肠道菌群即浮游细菌的增长率越小。与现有技术相比,本发明的有益效果是:(1)本发明的恒化器,设置储备器,蠕动泵,培养器和溢出器等结构,专门用于培养肠道菌群。(2)本发明引入了菌群营养存储过程,刻画了具有营养存储过程的菌群生长繁殖过程;描述了具有营养存储过程的营养基消耗过程;考虑了肠道壁的吸附作用,刻画了附着细菌与浮游细菌间的转化过程。附图说明图1为本发明建模流程图。图2为恒化器结构示意图。图3为菌群浓度随时间变化的数值模拟图。附图中各标号的含义:1-储备器,2-蠕动泵,3-培养器,4-溢出器,5-控制系统,6-温度传感器,7-电动机,8-pH值传感器,9-搅拌叶,10-无菌空气管,11-空气过滤器,12-取样口。以下结合实施例对本发明的具体内容作进一步详细解释说明。具体实施方式(一)一种恒化器,如图2所示,包括营养液储备器1,蠕动泵2,培养器3和溢出器4,营养液储备器1依次连接有蠕动泵2、培养器3和溢出器4;蠕动泵2还与控制系统5相连,控制系统5通过导线分别与温度传感器6、电动机7和pH值传感器8相连,电动机7连接有搅拌叶9,搅拌叶9置于培养器3中,用于搅拌培养液;培养器3中还设有无菌空气管10和空气过滤器11,控制系统5连接在电源上,温度传感器6、搅拌叶9和pH值传感器8均伸入培养器3中液体液面以下,空气过滤器11置于培养器3外的一端设有取样口12,培养器3和溢出器4之间的管道上设有排液阀。恒化器进行肠道菌群连续培养的方法:1)配制培养液A和培养液B,将培养液A灌入营养液储备器中,培养器中接入肠道菌群菌种;2)开启蠕动泵,将培养液A连续泵入培养器中,同时,不断泵入无菌CO2气体,开动电动机搅拌,关闭排液阀培养8~10小时,开启排液阀,连续培养;3)排出菌液至溢出器中,溢出器中菌液装满后,收集菌液,离心收集菌体,向菌体中加入培养液B,搅拌分散混匀,置于0~4℃条件下保存。培养液A由如下组分组成:葡萄糖30~40g/L,蛋白胨1~5g/L,酵母提取物3~10g/L,碳酸氢钠2~3g/L,苹果酸钠2~4g/L,余量为无菌水。培养液B由如下组分组成:葡萄糖3~4g/L,氯化钠1~2g/L,酒石酸钾1~2g/L,壳聚糖1~2g/L,余量为无菌水。蠕动泵的泵入速率为30~50mL/h;所述无菌CO2的泵入速率为0.1~0.2L/min;排液阀的排出速率为30~50mL/h;述离心的速率为300~800rpm;培养液B加入量为离心菌体重量的3~10倍。(二)两种群肠道菌群恒化器模型的建模机理:由于肠道壁的吸附作用,培养过程中部分菌群会吸附到肠道壁上,因此,将菌群分为浮游细菌(planktonicbacteria)和附着细菌(attachedbacteria)两类,肠道壁的吸附作用导致部分菌群吸附到细胞壁上,成为附着细菌,同时在反应过程中,附着细菌也以一定概率游离于细胞壁,变回为浮游细菌,因此分别考虑两类菌群的生长繁殖情况。浮游细菌浓度记为u(t),附着细菌浓度记为ν(t),浮游细菌的细胞配额为Q1(t),附着细菌的细胞配额为Q2(t)。假设浮游细菌吸附到肠道壁上的概率为α,附着细菌游离于肠道壁的概率为β,则肠道中有αu的浮游细菌转化为附着细菌,有βν的附着细菌转化为浮游细菌。培养液浓度的变化率=培养液的输入率-培养液的输出率-浮游细菌对营养基的消耗率-附着细菌对营养基的消耗率;浮游细菌浓度的变化率=浮游细菌浓度的增长率-浮游细菌浓度的输出率-浮转附+附转浮;其中,浮转附是指肠道中有αu的浮游细菌转化为附着细菌,附转浮是指肠道中有βν的附着细菌转化为浮游细菌。浮游细菌细胞配额的变化率=浮游细菌对培养液的吸收率-浮游细菌生长所消耗的营养;附着细菌浓度的变化率=附着细菌浓度的增长率-附着细菌浓度的输出率+浮转附-附转浮;附着细菌细胞配额的变化率=附着细菌对培养液的吸收率-附着细菌生长所消耗的营养;一种两种群肠道菌群的生长调节方法,包括以下步骤:步骤一:计算t时刻培养液的输入量、输出量和肠道菌群的输出量;设S(t)为t时刻培养液的浓度,u(t)为t时刻肠道菌群的浓度,D0为培养液的输入速率,D为恒化器的稀释率,则:培养液的输入率为D0*S0,培养液的输出率为D*S(t),菌群的输出率为D*u(t);计算中,培养液的输入速率D0也是指营养液输入到培养器的输入速率,恒化器的稀释率D也为培养液输出到溢出器的速率。为保持培养器中物质体积不变,实际操作中输入速率Do与D输出速率相同。步骤二:计算肠道菌群对培养液的吸收率;显然,单位菌群对培养液的吸收率既依赖于培养液的浓度S(t),又依赖于细胞配额Q(t),细胞配额(cellquota)Q(t)为t时刻肠道菌群的细胞平均营养存储。假设菌群对培养液的吸收满足Monod动力学,且Monod函数的饱和值随细胞配额Q(t)的增加而减少,即单位菌群对培养液的吸收率表示为:或者其中,i=1,2,i=1表示浮游细菌,i=2表示附着细菌,ki为i的半饱和常数,Qmax,i为i的细胞最大配额,单位mol·cell-1,Qmin,i为i的细胞最小配额,单位mol·cell-1,ρmax,i为i肠道菌群的最大消耗率,mol·cell-1·day-1,和分别表示ρmax,i的最大值和最小值;在肠道菌群的实际培养过程中,根据实验情况来选择公式(2)或者(9)。步骤三:计算菌群细胞对培养液的消耗率;假设菌群的消耗率(yieldrate)为γi(i=1,2),则单位浓度的菌群对培养液的消耗率为:浮游细菌菌群对培养液总消耗为:附着细菌菌群对培养液总消耗为:步骤四:计算单位浓度的菌群的增长率;单位浓度菌群的增长率依赖于细胞配额Q(t),假设菌群的增长也满足Monod动力学,即单位菌群的增长率为:其中,μmax,i为菌群的最大生长率,day-1,(Qi-Qmin,i)+是函数(Qi-Qmin,i)的正部。步骤五:建立两种群肠道菌群恒化器模型;根据上述建模机理,建立两种群肠道菌群生长模型,即得到:培养液浓度变化率:浮游细菌浓度的变化率:浮游细菌细胞配额的变化率:附着细菌浓度的变化率:附着细菌细胞配额的变化率:其中,α为浮游细菌吸附到肠道壁上的概率,0<α<1,β为附着细菌游离于肠道壁的概率,0<β<1,α和β的大小取决于培养器壁的光滑程度,培养器壁越光滑,α越小,β越大;步骤六:根据步骤五所得的两种群肠道菌群生长模型,通过改变营养液输入到培养器的输入速率、培养液输出到溢出器中的速率和培养器壁的光滑程度来控制两种群肠道菌群的增长率;两种群肠道菌群的增长率主要受培养器壁光滑程度和培养液的输入输出速率的影响,尤其对培养液输入快慢的敏感性较高,营养液输入到培养器的输入速率越快,培养液输出到溢出器中的速率越快,肠道菌群的增长率越小;培养器壁越粗糙,附着细菌增加,使附着细菌游离于肠道壁的概率β增加,浮游细菌吸附到肠道壁上的概率α减小,进而使肠道菌群的增长率减小。因此,可以改善培养器壁的光滑程度,控制营养液输入到培养器中的速率,以及培养液输出到溢出器中的速率,来控制附着细菌的增长率,增加浮游细菌的增长率,为实际生产应用提供指导作用。以下给出本发明的具体实施例,需要说明的是本发明并不局限于以下具体实施例,凡在本申请技术方案基础上做的等同变换均落入本发明的保护范围。实施例1本实施例采用(一)中所述的恒化器,培养液A由如下组分组成:葡萄糖35g/L,蛋白胨3g/L,酵母提取物7g/L,碳酸氢钠2g/L,苹果酸钠3g/L,余量为无菌水;培养液B由如下组分组成:葡萄糖3g/L,氯化钠1g/L,酒石酸钾1g/L,壳聚糖1g/L,余量为无菌水;开启蠕动泵,将培养液A连续泵入培养器中,同时,不断泵入无菌CO2气体,开动电动机搅拌,关闭排液阀培养9小时,开启排液阀,连续培养;蠕动泵的泵入速率为40mL/h,无菌CO2的泵入速率为0.15L/min;排出菌液至溢出器中,溢出器中菌液装满后,收集菌液,离心收集菌体,向菌体中加入培养液B,搅拌分散混匀,置于4℃条件下保存;排液阀的排出速率为40mL/h;离心的速率为400rpm;培养液B加入量为离心菌体重量的7倍。本实施例连续培养的微生物增长率为30%。实施例2本实施例与实施例1的相同,区别仅在于:培养液A的组成:葡萄糖40g/L,蛋白胨5g/L,酵母提取物10g/L,碳酸氢钠3g/L,苹果酸钠4g/L,余量为无菌水;培养液B的组成:葡萄糖4g/L,氯化钠2g/L,酒石酸钾2g/L,壳聚糖2g/L,余量为无菌水;关闭排液阀培养时间为8小时,蠕动泵的泵入速率为50mL/h,无菌CO2的泵入速率为0.2L/min;培养液B置于0℃条件下保存,排液阀的排出速率为50mL/h,离心的速率为300rpm;培养液B加入量为离心菌体重量的3倍。本实施例连续培养的微生物增长率为32%。实施例3本实施例与实施例2的相同,区别仅在于:培养液A的组成:葡萄糖40g/L,蛋白胨5g/L,酵母提取物10g/L,碳酸氢钠3g/L,苹果酸钠4g/L,莨菪粉4g/L,余量为无菌水;莨菪粉的制备方法为:取莨菪的新鲜花朵浸泡在0.5wt%的柠檬酸钠水溶液中36小时,捞出晒干,磨成粉末,制成;排液阀的排出速率为30mL/h,离心的速率为800rpm;培养液B加入量为离心菌体重量的10倍。本实施例连续培养的微生物增长率为55%。实施例4本实施例与实施例2相同,区别仅在于:培养液A的组成:葡萄糖40g/L,蛋白胨5g/L,酵母提取物10g/L,碳酸氢钠3g/L,苹果酸钠4g/L,矢车菊粉4g/L,余量为无菌水;矢车菊粉的制备方法为:取矢车菊浸泡在0.5wt%的酒石酸钠水溶液中36小时,捞出晒干,磨成粉末,制成;本实施例连续培养的微生物增长率为51%。实施例5本实施例与实施例2相同,区别仅在于:培养液的组成:葡萄糖40g/L,蛋白胨5g/L,酵母提取物10g/L,碳酸氢钠3g/L,苹果酸钠4g/L,商陆提取物4g/L,余量为无菌水;商陆提取物的制备方法为:取商陆的茎叶,加入4倍重量份数的70%乙醇水溶液回流提取3次,合并滤液,蒸干制成;本实施例连续培养的微生物增长率为49%。实施例1至5为恒化器单种群肠道菌群的增长率。实施例6本实施例采用(三)中所述的建模方法对两种群的肠道菌群的增长率进行拟合,拟合过程中各参数取值为:γ1=1,γ2=1;D=0.12day-1;S0=2*10-5mol·L-1;ρmax,1=12*10-14mol·cell-1·day-1;ρmax,2=12*10-14mol·cell-1·day-1;k1=9*10-7mol·L-1;k2=6.5*10-7mol·L-1;μmax,1=1.2day-1;μmax,2=1.2day-1;Qmax,1=9.5*10-14mol·cell-1;Qmax,2=32*10-13mol·cell-1;Qmin,1=2.6*10-14mol·cell-1;Qmin,2=1*10-13mol·cell-1;α=0.05;β=0.2。培养液浓度的变化率:浮游细菌浓度的变化率:浮游细菌细胞配额的变化率:附着细菌浓度的变化率:附着细菌细胞配额的变化率:对浮游细菌浓度曲线和附着细菌浓度进行曲线拟合,如图3所示,图中u表示浮游细菌的浓度变化曲线,v表示浮游细菌的浓度变化曲线,计算得到肠道菌群的增长率为17.9%,由于两种群肠道菌群中部分的浮游细菌转化为附着细菌,因此使肠道菌群的增长率相对于实施例1~5有所降低。对比例1本对比例采用实施例1的恒化器,进行肠道菌群连续培养的方法,按照如下步骤进行:1)配制培养液A和培养液B,将培养液A灌入营养液储备器中,培养器中接入肠道菌群菌种;培养液A的组成:葡萄糖35g/L,蛋白胨3g/L,酵母提取物7g/L,碳酸氢钠2g/L,余量为无菌水;培养液B的组成:葡萄糖3g/L,氯化钠1g/L,酒石酸钾1g/L,壳聚糖1g/L,余量为无菌水;2)开启蠕动泵,将培养液A以40mL/h的速率连续泵入培养器中,同时以0.15L/min的速率不断泵入无菌CO2气体,开动电动机搅拌,关闭排液阀培养9小时,开启排液阀,连续培养;3)以40mL/h的速率排出菌液至溢出器中,溢出器中菌液装满后,收集菌液,然后离心收集菌体,向菌体中加入培养液B,培养液B加入量为离心菌体重量的7倍,搅拌分散混匀,置于2℃条件下保存;本对比例连续培养的微生物增长率为11%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1