沙地柏调节植物钙营养和干旱信号感应基因CML11及其应用的制作方法
本发明属于植物生物技术领域,具体地说,涉及一种我国北方荒漠化地区防风固沙树种沙地柏(Sabina vulgaris.)有关氮营养及碱胁迫感应基因CML9(Q6-1)。本发明选用内蒙古蒙草抗旱股份有限公司苗木基地的树种沙地柏为实验材料,运用Illumina Solexa转录组高通量测序的方法,获得该树种的氮营养及碱胁迫感应基因,对候选氮营养及碱胁迫感应的基因CML9(Q6-1)进行生物信息学分析,同时对其进行不同元素的表型分析,更直观的了解基因的生理学功能。
背景技术:
沙地柏(Sabina vulgaris.),又名叉子圆柏、新疆圆柏,主要分布于内蒙古、陕西、新疆、宁夏、甘肃、青海等地。主要培育基地有江苏、浙江、安徽、湖南等地。沙地柏能忍受风蚀沙埋,长期适应干旱的沙漠环境,是干旱、半干旱地区防风固沙和水土保持的优良树种。喜光,喜凉爽干燥的气候,耐寒、耐旱、耐瘠薄,对土壤要求不严,不耐涝,在肥沃通透土壤成长较快。适应性强,扦插宜活,栽培管理简单,这种生命力坚强的常绿植物在北方绿化和造林中具有举足重轻的作用,所以研究沙地柏,对于野生植物抗旱相关基因的开发和利用具有重要意义。目前对于沙地柏的研究主要集中在生理和生态特性方面,在关于其抗旱基因的克隆及利用方面均无报道。
我国植物分子育种能力同发达国家差距巨大,拥有自主知识产权的抗逆基因是世界植物分子育种领域竞争的焦点。对于植物抗逆基因的开发及利用,目前的研究主要集中于模式植物拟南芥或水稻、小麦等作物中,缺乏对野生植物体内丰富的抗逆基因的挖掘。本发明正是利用Illumina公司的高通量测序技术,对我国北方荒漠化地区防风固沙首选树种沙地柏进行转录组测序,获得了一种经自然环境长期筛选出的抗旱相关基因CML11。
技术实现要素:
本发明的目的是的利用分子克隆技术,对有关钙营养及干旱信号感应基因CML11进行克隆,最终得到用于基因表达的表达载体,从而使该基因导入到拟南芥野生植物中并在野生植物体内表达,再通过表型分析进一步验证该基因的功能。
本发明的实施方案是选用内蒙古蒙草抗旱有限公司苗木基地的沙地柏为实验材料,采用Illumina Solexa转录组高通量测序的方法,对其转录组序列鉴定分析,确定Ca2+结合蛋白种类和数量,从而获得沙地柏有关钙营养及干旱信号感应基因CML11的核苷酸序列,通过分子克隆技术获得该基因,并将其导入到拟南芥中,最终获得转基因植株,通过对转基因植株进行表型分析了解基因的生物学功能。
本发明的一个目的在于提供新的沙地柏抗旱相关基因,定名为CML11,其序列为SEQ No.1的序列。
本发明涉及一种在沙地柏根内表达量较高的基因,名称为CML11,其核苷酸序列如序列表中SEQ NO.1或SEQ NO.2所示,其编码的194个氨基酸序列,如序列表中SEQ NO.3所示。
具体地说,本发明提供了含有下述序列之一的分离的多核苷酸:
(1)序列表中的SEQ NO.1或SEQ NO.2
(2)与序列表中的SEQ NO.1或SEQ NO.2限定的DNA序列具有90%以上同源性,且编码相同功能蛋白质的DNA序列;
上述涉及的多核苷酸还包括取代、缺失和插入突变体以及等位变体、剪接变体、片段、衍生物等。
本领域技术人员可以理解的是,上述的分离的多核苷酸也包括那些与SEQ NO.1或SEQ NO.2所示序列具有较高同源性的序列,例如同源性大于95%,或90%,甚至85%的序列;还包括那些在严谨条件下可与SEQ NO.1或SEQ NO.2所示序列杂交的序列;或者可与SEQ NO.1或SEQ NO.2的序列互补的序列。
本发明同时提供了将本发明的新基因CML11应用于植物抗旱基因工程的技术方案。
本发明从沙地柏中成功地分离获得了一种经自然环境长期筛选出的抗相关基因CML11,这给利用基因工程技术培育抗旱植物提供了新的方向,对干旱胁迫下的分子育种工作具有重要意义。具体来说,本发明的具体实施方案之一是将CML11基因应用于植物基因工程以提高植物在干旱胁迫下的生存能力。
以上概括的描述了本发明,可通过参照本文提供的某些具体实施例进一步理解本发明,这些实施例仅是为了说明而不是限制本发明。
附图说明
图1:实验总流程图。
图2:抗旱基因CML11四种T3代植株分别在CK、0μM Ca2+、1μM ABA这三个浓度培养基上的叶子的表型图(A)和鲜重图(B),从图中可以更清晰的看到转基因植物的叶片在0μM Ca2+、1μM ABA上的敏感表型。
图3:抗旱基因CML11四种T3代植株分别在0μM NO3-、0μM PO43-、pH 7.0、100mM NaCl这四个浓度梯度培养基上的叶子的表型图(A)和鲜重图(B),从图3中可以看到转基因植株的叶片与野生型Col-0植株没有差异。
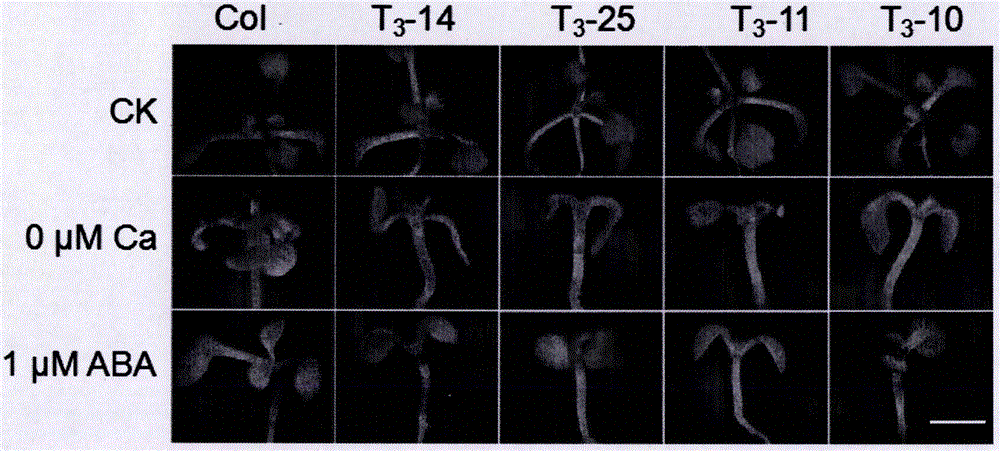
图4:抗旱基因CML11四种T3代植株分别在0μM Ca2+、1μM ABA、这二个浓度培养基上整株苗的表型图,从图4表型图中可以看出转基因植物在低钙条件下与野生型Col-0相比有着明显的叶黄而小、根短的敏感表型,同时在1μM ABA培养环境下也表现出叶小、根短的敏感表型。
图5:抗旱基因CML11四种T3代植株分别在:0μM Ca2+、1μM ABA、这二个浓度培养基上植株的根长图,从图5根长图中可以看出转基因植物在低钙条件下与野生型Col-0相比有着明显根短的敏感表型,同时在1μM ABA培养环境下也表现出根短的敏感表型。
图6:抗旱基因CML11四种T3代植株分别在100mM NaCl、0μM NO3-、0μM pO43-、pH 7.0这四个浓度培养基上整株苗的表型图,从图6中可以看到在低氮、低磷、100mMNaCl及碱性生长环境下转基因植物与野生型植物都没有明显的区别。
图7:抗旱基因CML11四种T3代植株分别在100mM NaCl、0μM NO3-、0μM PO43-、pH 7.0这四个浓度培养基上植株的根长,从图6中可以看到在低氮、低磷、100mM NaCl及碱性生长环境下转基因植物与野生型植物都没有明显的区别。
图8:表型分析中培养皿的种植方式。
具体实施方式
实施例1、沙地柏样品采集
为了最大限度的增加其体内和抗逆性相关的RNA的丰富度,选择在天气相对寒冷的12月(2013年)进行沙地柏根的取样,样品在收集后迅速保存于液氮中备用。
实施例2、表达载体的构建
1、由于沙地柏植物的RNA较难提取,所以我们前期的目的基因是由南京金斯瑞公司合成的,后续表达载体的构建是用公司合成好的基因来完成的。合成基因所用的克隆载体是pUC57-Simple,抗性是Amp。
2、目的载体的连接和构建的完成
本发明中用到的表达载体是pOREE3,其抗性为Kan。
目的载体的连接是将合成好的的基因片段和目的载体同时经过5’:BamH I 3′:Kpn I的酶切,经过DNA胶回收,DNA连接酶连接,然后转化大肠杆菌,经过菌落PCR和提取质粒,酶切验证的方法,最终获得连接到的载体基因的质粒。
双酶切反应体系:
a、目的片段与表达载体的连接:
原则:按照目的片段和表达载体摩尔比是3∶1或1∶3的比例进行连接
T4DNA连接酶(1μl)+buffer(2μl)+17μl(目的片段+表达载体)
16℃过夜连接
b、转化:取大肠杆菌感受态于冰上解冻,将连有目的片段和表达载体的产物再次转化到大肠杆菌感受态里,混匀,冰浴30分钟,42℃热激90秒,立即置于冰上2分钟;加入500μl无抗性LB液体培养基,37℃摇床上200rpm或37℃恒温培养箱静置培养60分钟后,将菌液涂布与含有相应抗生素(Kan 50mg/ml)的固体LB平板上;37℃倒置培养过夜后观察其结果。
c、挑取菌板上的单菌落加入到含有Kan(50mg/ml)抗生素的5ml LB培养液里,37℃摇床过夜培养。
d、质粒提取:选用TRAN的质粒提取试剂盒提取质粒
1)、取2ml过夜培养的菌液,10000x g离心1分钟,去上清。如菌液量大,可分多次离心收集。
2)、加入250μl无色溶液RB(含RnaseA),震荡悬浮细菌沉淀,不应留有小的菌块。
3)、加入250μl蓝色溶液LB,温和地上下翻转混合4-6次,使菌体充分裂解,形成蓝色透亮的溶液,颜色由半透亮变为透亮蓝色,指示完全裂解(不宜超过5分钟)。
4)、加入350μl黄色溶液NB,轻轻混合5-6次(颜色由蓝色完全变成黄色,指示混合均匀,中和完全),直至形成紧实的黄色凝集块,室温静置2分钟。
5)、12000x g离心5分钟,小心吸取上清加入离心柱中。12000x g离心1分钟,弃流出液。如上清体积大于800μl,可以分成多次加入柱中,并同上离心,弃流出液。
6)、加入650μl溶液WB,12000x g离心1分钟,弃流出液。
7)、12000x g离心2分钟,彻底去除残留的WB。
8)、将离心柱置于一干净的离心管中,在柱的中央加入30-50μl EB或去离子水(PH>7.0)室温静置1分钟。
9)、10000xg离心1分钟,洗脱出的DNA于-20℃保存
e、酶切验证:继续选用前面所用的限制性内切酶5’:BamH I 3′:Kpn I对阳性克隆质粒进行验证。
双酶切反应体系
37℃恒温培养箱,温浴30分钟。1%琼脂糖凝胶电泳检测,选取带型正确的进行保菌(40%黄盖甘油)
3、农杆菌转化:电转化法转化农杆菌
1)、取农杆菌感受态,置于冰上融化,加入质粒约5μl,混匀后冰上放置30分钟。
2)、同时准备干净干燥的电转杯,冰上预冷;
3)、将电转杯表面擦干,把加有质粒的农杆菌全部加入电转杯中后放入电转仪,电激转化;
4)、电转杯加入1ml无抗生素的LB培养液,反复吹吸,吸入2ml离心管中,28℃摇床200rpm或28℃恒温培养箱恢复培养1.5小时后;
5)、取500μl菌液涂布于含有抗生素(Rif 50mg/ml和Kan 50mg/ml)的固体LB培养基上,28℃恒温培养箱倒置培养1-2天直至单克隆出现;
6)、选取阳性农杆菌单菌落进行摇菌,28℃摇床,250rpm,培养1-2天
4、农杆菌质粒提取:选用TRAN的质粒提取试剂盒提取质粒
1)、取2ml过夜培养的菌液,10000x g离心1分钟,去上清。如菌液量大,可分多次离心收集。
2)、加入250μl无色溶液RB(含RnaseA),震荡悬浮细菌沉淀,不应留有小的菌块。
3)、加入250μl蓝色溶液LB,温和地上下翻转混合4-6次,使菌体充分裂解,形成蓝色透亮的溶液,颜色由半透亮变为透亮蓝色,指示完全裂解(不宜超过5分钟)。
4)、加入350μl黄色溶液NB,轻轻混合5-6次(颜色由蓝色完全变成黄色,指示混合均匀,中和完全),直至形成紧实的黄色凝集块,室温静置2分钟。
5)、12000x g离心5分钟,小心吸取上清加入离心柱中。12000x g离心1分钟,弃流出液。如上清体积大于800μl,可以分成多次加入柱中,并同上离心,弃流出液。
6)、加入650μl溶液WB,12000x g离心1分钟,弃流出液。
7)、12000x g离心2分钟,彻底去除残留的WB。
8)、将离心柱置于一干净的离心管中,在柱的中央加入30-50μl EB或去离子水(PH>7.0)室温静置1分钟。
9)、10000x g离心1分钟,洗脱出的DNA于-20℃保存
5、酶切验证:选用限制性内切酶5’:BamH I 3′:Kpn I对所提取的质粒进行验证,双酶切反应体系
28℃恒温培养箱,温浴30分钟。1%琼脂糖凝胶电泳检测,分析结果,选择条带正确的农杆菌保存甘油菌(40%蓝盖)用于转化植物。
实施例3、转基因植物的获取
本实施例采用花絮侵染法来获取转基因植株代号CML11
1、挑取已正确保菌的农杆菌进行活化(活化目的是确保菌的活力),将活化好的菌加入到含有抗生素(Rif50mg/ml和Kan 50mg/ml)的5ml LB培养液中,28℃摇床过夜培养,将摇好的菌液放入到离心机内,5000x g,10min,弃去上清液,加入1ml的侵染液(5%蔗糖,0.02%silwet77悬浮液溶于水),用胶头滴管轻轻吹吸使菌悬浮。
2、选用三盒长势良好且已开花的野生型Col-0植株,剪去植株上的已结豆荚和已完成授粉的花苞,用胶头滴管吸取菌液滴在未开花的花苞上,并贴标签标注,每隔2-3天侵染一次,直至所有植株都开花(注:每次侵染前一天给植物浇水)。
3、当植株成熟后及时收取T1代种子,待种子干燥一周左右将其撒播在含有抗生素(草铵膦120mM)的抗性固体MQA CK培养皿上,先放置到4℃冰箱春化三天,再光照培养一周左右,进行阳性苗T1代的筛选。
4、选取抗性培养皿上长势良好的T1代植株,移土培养并单株标号,待其成熟后及时单株收取T2代种子,干燥一周后,继续将其单管撒在抗性培养基上,光照培养数天后,选取符合活死比为3∶1的T2代植株移土培养,种子成熟后及时单株收取T3代种子,干燥一周后,将T3代种子撒在含有草铵膦抗性的MQA CK培养基上,选取全活的纯合植株进行表型分析。
实施例4、CML11在不同元素中的表型分析
本实例中用到的MQA培养基成分主要有
大量元素:1MKNO3、1MMgSO4、1MH3PO4、1MCaCl2
微量元素:MS微量(0.5x)、
Fe2+盐:MS Fe2+盐(0.5x)
Mn2+盐:MS Mn2+盐(0.5x)以及0.5M MES缓冲液
碳源:1%蔗糖
a.具体的培养基方案如表1(100ml)
注:0μM PO43-、0μM Ca2+、0μM NO3-、这几个梯度加入1.0%的琼脂糖1g;1mM Ca2+、1μM ABA、100mM NaCl、pH 7.0这几个梯度加入1.2%的琼脂1.2g;另ABA是在培养基灭完菌之后温度降至手温时再加0.5μl;KOH或BTP调pH为5.7(注:1mM Ca2+pH7.0的用KOH调到pH 7.0,1μM ABA是在高压灭菌后,培养基温度降到手可以碰触的温度时加入0.5μl)。
表1各种元素的培养基方案
b.种植方式如图8所示
点播种子的过程是在无菌条件下进行的,点播种子之前先要用75%酒精对种子进行消毒(洗种子时间不宜超过30分钟),然后,再将种子在无菌条件下换用100%酒精冲洗一下,并将其连酒精一起晾干在无菌的滤纸上,待种子完全晾干后,用消过毒的镊子将种子点播在培养基上。
每种梯度一个重复,待种完后用封口膜封口,先在4℃冰箱春化三天,再放置温度为22℃,湿度为40%RH的培养室竖直光照培养十四天之后观察CML11与野生型Col-0的表型,并对其进行根长和鲜重的数据采集和照片拍摄,可以看出CML11相对于野生型Col-0在0μM Ca2+有叶黄而小、根短的表型;在干旱激素1μM ABA表现为叶小、根短。同时,CML11相对于野生型Col在100mM NaCl、0μM NO3-、0μM PO43-、pH 7.0这几个浓度梯度上是没有明显区别的。具体情形如图所示(附图2、附图3、附图4、附图5、附图6、附图7)。
c.培养皿的摆放
7个梯度为一组,分为四组。
以上实施例进一步说明了本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所做的修改或替换,均属于本发明的范畴。
- 还没有人留言评论。精彩留言会获得点赞!