免疫应答的引发的制作方法
本申请是国际申请日为2009年11月20日、国际申请号为pct/dk2009/050310、进入国家阶段的申请号为200980154924.4、发明名称为“免疫应答的引发”的pct申请的分案申请。
本申请中引用的所有专利和非专利参考文献在此通过引用整体并入。
本发明涉及使用恒定链连接的抗原的引发免疫应答的技术和方法(当这些用于引发使用任何合适疫苗的后续加强免疫接种时)。
背景技术:
疫苗接种是给受试者施用抗原材料(疫苗),以便产生对疾病或状况的免疫。当用于刺激免疫应答时,抗原被称为免疫原,并且该过程被称为免疫接种。疫苗接种涉及一种或多种免疫原的施用,这可以以几种形式施用。
疫苗接种要求实体免疫应答的建立。由感染或疫苗接种激活的免疫应答依赖于几种细胞类型例如t、b和抗原呈递细胞,以及几种不同分子主要是抗原、mhc分子、t和b细胞受体及许多其他的相互作用。
常规疫苗或第一代疫苗基于被杀死或减毒的致病菌株。这些通常具有减少的传染力,并且它们通常是无足够的免疫原性的,导致来自疫苗接种的不充分保护。
基于来自致病生物的个别抗原蛋白质的第二代疫苗或亚单位疫苗的开发已揭示纯肽或碳水化合物趋于是弱免疫原。
dna疫苗或第三代疫苗具有诱导较广泛范围的免疫应答类型的能力,但维持在人中具有低免疫原性的潜在缺点。
对于所有类型的疫苗,疫苗接种程序面对关于增加疫苗效力的未满足需要,以克服上述局限性且提供在疫苗接种过程中刺激免疫系统的更经济方法。
本发明目标在于通过提供用于增加疫苗效力的解决方案来解决与疫苗的低免疫原性相关的问题。
本发明目标在于通过提供用于引发免疫应答的解决方案来解决与疫苗的低免疫原性相关的问题。
本发明因此涉及用核酸构建体引发免疫系统,所述核酸构建体包括mhcii类结合的恒定链/cd74(本文被称为恒定链或ii)或其变体,且编码至少一种抗原蛋白质或所述抗原蛋白质的片段,随后为后续加强疫苗接种,以增加所述疫苗的效力。
根据本发明的疫苗可以涉及致病性抗原或癌抗原。
本文呈现的数据显示使用包括恒定链或其变体的核酸构建体开发引发-加强方案并不简单。
令人惊讶的是,本发明公开了可以改变来自恒定链的ii-key(包括lrmk氨基酸残基)和/或ii-clip结构域的部分,而不减少所述免疫引发的效应。
不充分地解决这个问题的现有技术参考文献在下文讨论:
wo2007/062656(holst等人)涉及开发改良dna疫苗,以这样的方式刺激免疫应答,所述方式增加应答的动力学,同时伴随扩大且改善应答。holst等人发现抗原与恒定链的融合通过cd4+t细胞独立机制显著增强随后的抗病毒cd4+和cd8+t细胞应答。
holmes等人(jclinoncol.2008,jul10;26(20):3426-33)描述了ii-key杂合肽疫苗的首次人i期试验,其中ii-key包括lrmk4氨基酸序列,恒定链蛋白质的中心部分。
kallinteris等人的发现(expertopin.biol.ther.2006,6(12):1311,1321)也涉及利用包括lrmk氨基酸的ii-key部分用于增强疫苗效力。
us2008/0095798(humphreys等人)公开了用于增加疫苗针对病原体的效力的方法,通过首先用包括所述ii-key肽的lrmk残基的ii-key杂合肽构建体引发受试者的免疫系统,并且随后施用针对病原体的疫苗以加强在引发步骤中产生的免疫应答。
技术实现要素:
本发明显示用核酸构建体引发免疫系统,所述核酸构建体包括至少一种mhcii类结合的恒定链/cd74(本文被称为恒定链或ii)或其变体,且编码至少一种抗原蛋白质或所述抗原蛋白质的片段,随后为后续加强疫苗接种增加所述疫苗的效力。
根据本发明的疫苗可以涉及致病性抗原或癌抗原。
令人惊讶的是,本发明公开了ii-key结构域(包括lrmk氨基酸残基)和/或ii-clip结构域的部分可以从恒定链中部分置换或省略,而不降低所述引发的作用。
因此,本发明已解决了通过采用二步引发-加强方案的疫苗接种而产生的充分刺激免疫应答的问题,由此首先用包括恒定链或其变体的核酸构建体引发免疫系统,随后为以这样的方式使用任何类型的合适疫苗的后续加强免疫接种,所述方式增加应答的动力学,同时伴随扩大且改善应答。特别地,在此可提供用于直接、特异和快速刺激免疫系统的新型系统,以便改善所有动物例如人的疫苗接种方案。
这个问题通过在权利要求中表征的本发明的实施方案得到解决。通过本发明,发现用基于ii链的核酸构建体的引发显著增加在用疫苗后续加强后的抗原特异性cd8+t细胞、cd4+t细胞和/或b细胞生成。
因此,本发明的一个方面是提供包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中所述核酸构建体能够引发免疫系统,以增强在受试者中施用后续疫苗后的免疫接种。
在一个实施方案中,本发明提供了包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中通过在受试者中施用后续疫苗,所述核酸构建体能够引发免疫接种。
在一个实施方案中,在本发明的核酸构建体中包括的恒定链可以由其野生型序列加以改变,而不减少ii的效应。
因此,在一个实施方案中,包括lrmk氨基酸残基的ii-key结构域已通过缺失或置换例如突变加以改变。
在另一个实施方案中,ii-clip结构域的部分已通过缺失或置换例如突变加以改变。ii-clip结构域可以具体地通过将在位置91和99上的甲硫氨酸置换为丙氨酸而改变;这令人惊讶地增加mhcii呈递。
在另一个实施方案中,ii可以具体地通过缺失ii的前17个氨基酸而改变;这令人惊讶地增加记忆应答。
由此可见这些改变各自可以分开或组合发生。
在一个实施方案中,当用于引发针对病毒、微生物例如细菌或寄生虫的疫苗的免疫应答时,在本发明的核酸构建体中包括的恒定链由其野生型序列加以改变。
在另一个实施方案中,当用于引发癌症疫苗或针对异常生理学应答的疫苗的免疫应答时,在本发明的核酸构建体中包括的恒定链可以由或不由其野生型序列加以改变。
在另一个实施方案中,用于引发免疫应答的核酸构建体和用于加强免疫应答的后续疫苗的至少一个部分是等同的。引发物和加强物(booster)的所述至少一个等同部分可以是ii或其变体、抗原肽或抗原肽的部分、或遍在的辅助t细胞表位。
同样本发明的一个目的是提供包括如本文详述的核酸构建体的递送媒介物(vehicle),其中所述递送媒介物是基于rna的媒介物、基于dna的媒介物/载体、基于脂质的媒介物、基于聚合物的媒介物或病毒衍生的或dna或rna媒介物。
在一个优选实施方案中,所述递送媒介物包括脂质体的形成、生物可降解聚合物微球体的形成、核酸构建体包被到胶体金颗粒上或掺入病毒衍生的dna或rna载体内。
在另外一个优选实施方案中,所述核酸构建体或所述递送媒介物借助于针注射、基因枪、射流注射(jetinjection)、电穿孔、超声或水动力递送进行施用。
因此,本发明的一个方面是提供通过包括这样的序列的核酸构建体刺激免疫应答的方法,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体。
一个进一步目的提供刺激在这些中的任何或这些中的任何的任何部分内编码的核酸构建体或蛋白质的细胞内散布的装置(means)。
本发明的另外一个目的是提供如由本文描述的核酸构建体编码的嵌合蛋白质。
本发明的一个进一步方面是提供识别由本文描述的核酸构建体编码的嵌合蛋白质的抗体。
本发明的一个方面是提供用于改善疫苗效力的方法,其包括施用如本文详述的核酸构建体。
与本发明特别相关的是包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其适合于引发免疫应答。
本发明的另外一个方面是提供部分试剂盒(kitinparts),所述试剂盒包括如本文描述的核酸构建体连同施用所述核酸构建体的医疗器械或其他装置,和/或合适疫苗,和另外关于如何使用部分试剂盒的说明书。
因此可见本发明提供了通过给动物施用如本文下文详述的核酸构建体用于加强动物中的免疫应答的方法。
本发明涉及下列内容:
“权利要求1.一种核酸构建体,其包括编码下述的序列:
a.与b可操作地连接的至少一种恒定链或其变体,
b.至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段,
其中所述核酸构建体用于癌症疫苗的引发,和/或所述恒定链或其变体不包括前17个氨基酸,和/或所述恒定链或其变体不包括key区域的lrmk氨基酸残基,和/或所述恒定链包括clip区域的变体;
2.根据权利要求1的核酸构建体,其用作用于刺激免疫应答的引发物,从而增加后续施用的疫苗的效力;
3.根据权利要求1的核酸构建体,其中至少一种恒定链或其变体是生物特异性的;
4.根据前述权利要求中任一项的核酸构建体,其中至少一种恒定链或其变体是人源的;
5.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的至少一个区域、肽或结构域加入、去除或置换所述至少一种恒定链的区域、肽或结构域;
6.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的key区域的lrmk氨基酸残基中的1、2、3或4个由其他氨基酸残基置换;
7.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的key区域的lrmk氨基酸残基中的1、2、3或4个由丙氨酸置换;
8.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的key区域的lrmk氨基酸残基中的1、2、3或4个是缺失的;
9.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的clip区域在位置91和99上的甲硫氨酸氨基酸残基由其他氨基酸残基置换;
10.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的clip区域在位置91和99上的甲硫氨酸氨基酸残基由丙氨酸置换;
11.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链的前17个氨基酸是缺失的(δ17ii);
12.根据前述权利要求中任一项的核酸构建体,其中所述恒定链包括与来自另一种蛋白质的三聚结构域偶联的氨基酸残基编号50–118;
13.根据前述权利要求中任一项的核酸构建体,其中所述至少一种恒定链或其片段引起以cd4+t细胞依赖性和/或不依赖性方式的mhc-i和/或mhc-ii依赖性免疫应答;
14.根据前述权利要求中任一项的核酸构建体,其中至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段选自:致病性生物、癌症特异性多肽和与异常生理学应答相关的蛋白质或肽;
15.根据前述权利要求中任一项的核酸构建体,其中来自致病性生物的所述至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段选自包括下述的病原体:病毒、微生物和寄生虫;
16.根据前述权利要求中任一项的核酸构建体,其中至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段来自哺乳动物生物,优选人病原体;
17.根据前述权利要求中任一项的核酸构建体,其中至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段来自癌症特异性多肽;
18.根据前述权利要求中任一项的核酸构建体,其中至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段来自选自下述的癌症特异性多肽:hpv衍生的病毒癌基因e5、e6、e7和l1;存活素、bcl-xl、mcl-1和rho-c;
19.根据前述权利要求中任一项的核酸构建体,其中至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段是与权利要求14–18所述抗原中的任何至少85%等同的抗原肽或蛋白质;
20.根据前述权利要求中任一项的核酸构建体,其中在所述恒定链或其变体和所述抗原蛋白质或肽或所述蛋白质或肽的抗原片段之间的操作接头选自:直接连接或由间隔区介导的连接;
21.根据权利要求20的核酸构建体,其中所述操作接头是间隔区;
22.根据权利要求21的核酸构建体,其中所述间隔区编码关于mhcii类分子的至少一个辅助表位;
23.根据权利要求21的核酸构建体,其中所述间隔区编码至少一个蛋白酶切割位点;
24.根据前述权利要求中任一项的核酸构建体,其中至少一种恒定链与至少2种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接;
25.根据前述权利要求中任一项的核酸构建体,其中使得所述构建体能够表达的启动子在所述至少一种可操作地连接的恒定链或其变体和至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段编码序列前;
26.根据前述权利要求中任一项的核酸构建体,其中所述启动子选自组成型启动子、诱导型启动子、生物特异性启动子、组织特异性启动子和细胞类型特异性启动子、cmv启动子、sv40启动子和rsv启动子;
27.根据前述权利要求中任一项的核酸构建体,其包括与抗原呈递和/或细胞内散布有关的基因;
28.根据前述权利要求中任一项的核酸构建体,其包括编码佐剂的基因;
29.一种递送媒介物,其包括根据前述权利要求中任一项的核酸构建体;
30.根据权利要求29的递送媒介物,其中所述媒介物选自:基于rna的媒介物、基于dna的媒介物/载体、基于脂质的媒介物、基于聚合物的媒介物和病毒衍生的dna或rna媒介物;
31.根据权利要求30的递送媒介物,其中所述递送媒介物是聚乙二醇化的载体或媒介物;
32.根据权利要求30的递送媒介物,其中所述基于脂质的媒介物是脂质体;
33.根据权利要求30的递送媒介物,其中所述基于聚合物的媒介物由选自下述的阳离子聚合物dna载体形成:聚乙烯亚胺(pei)、聚乙二胺和聚丙胺树状聚体、聚烯丙胺、阳离子右旋糖酐、壳聚糖、阳离子蛋白质(聚赖氨酸、鱼精蛋白和组蛋白)、阳离子肽、多肽、脂多糖和多糖;
34.根据权利要求33的递送媒介物,其中所述递送媒介物是生物可降解聚合物微球体;
35.根据权利要求30的递送媒介物,其中所述递送媒介物包括将所述核酸构建体包被到胶体金颗粒上;
36.一种用于施用根据权利要求29–35中任一项的递送媒介物的方法,其中所述施用选自针注射、基因枪、射流注射、电穿孔、超声和水动力递送;
37.一种用于施用根据权利要求29–35中任一项的核酸构建体的方法,其中所述施用选自针注射、基因枪、射流注射、电穿孔、超声和水动力递送;
38.一种细胞,其包括如权利要求1–28中任一项中定义的核酸构建体;
39.一种嵌合蛋白质,其包括至少一种可操作地连接的恒定链或其变体和至少一种抗原蛋白质或肽,编码其的序列如通过权利要求1–28中任一项中的核酸构建体中的任何定义的;
40.一种抗体,其可以识别如权利要求39中定义的嵌合蛋白质;
41.根据权利要求40的抗体在用于检测所述抗体与之结合的蛋白质的测定中的用途;
42.一种组合物,其包括编码下述的核酸序列:
a.与b可操作地连接的至少一种恒定链或其变体,
b.至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段;
43.一种用作药物的组合物,其包括编码下述的核酸序列:
a.与b可操作地连接的至少一种恒定链或其变体,
b.至少一种多肽;
44.根据权利要求42和43中任一项的组合物,其包括如权利要求1–28中任一项中定义的核酸构建体;
45.根据权利要求42-44中任一项的组合物,其中所述组合物包括至少2种载体;
46.一种组合物,其包括根据权利要求39的至少一种嵌合蛋白质,如通过权利要求1–28中任一项中的核酸构建体中的任何定义的;
47.根据权利要求42-46中任一项的组合物,其中所述组合物包括佐剂;
48.一种部分试剂盒,其包括:
a.包括根据权利要求1–28中任一项的核酸构建体的组合物,
b.用于施用所述组合物的医疗器械或其他装置,
c.关于如何使用所述部分试剂盒的说明书;
49.根据权利要求48的部分试剂盒,其中所述试剂盒包括第二种活性成分;
50.根据权利要求49的部分试剂盒,其中所述第二种活性成分是合适疫苗;
51.一种用于增加疫苗效力的方法,其包括步骤:
a.提供根据权利要求1–28中任一项的核酸构建体、或根据权利要求42–47中任一项的组合物,
b.通过施用步骤a)的核酸构建体或组合物引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答;
52.根据权利要求51的方法,其中用于引发免疫应答的所述核酸构建体的至少一部分和用于加强所述免疫应答的所述疫苗是等同的;
53.根据权利要求52的方法,其中所述等同部分是所述抗原肽或蛋白质的部分;
54.根据权利要求52的方法,其中所述等同部分是遍在辅助t细胞表位;
55.根据权利要求51的方法,其中所述免疫应答是mhc-i依赖性的;
56.根据权利要求51的方法,其中所述免疫应答是mhc-ii依赖性的;
57.根据权利要求51的方法,其中所述免疫应答是mhc-i和mhc-ii依赖性的;
58.根据权利要求51的方法,其中所述免疫应答是t细胞依赖性的;
59.根据权利要求51的方法,其中所述免疫应答是cd4+t细胞依赖性的;
60.根据权利要求51的方法,其中所述免疫应答是cd4+t细胞不依赖性的;
61.根据权利要求51的方法,其中所述免疫应答是cd8+t细胞依赖性的;
62.根据权利要求51–61中任一项的方法,其包括步骤:
a.提供根据权利要求42–47中任一项的至少一种组合物,
b.给受试者施用所述至少一种组合物至少一次用于动物的治疗或预防;
63.根据权利要求51–62中任一项的方法,其中所述组合物施用于最可能是给定感染的接受器的区域;
64.根据权利要求51–63中任一项的方法,其中所述受试者是人;
65.根据权利要求51–63中任一项的方法,其中所述受试者是哺乳动物;
66.根据权利要求51–63中任一项的方法,其中所述受试者是雪貂;
67.根据权利要求51–63中任一项的方法,其中所述受试者是鱼;
68.根据权利要求51–63中任一项的方法,其中所述受试者是鸟。”。
附图说明
图1:用基于ii链的裸露dna疫苗的dna引发。
图2:在ii序列中结构域和测试的突变的定位。
图3:ii显著增加siinfekl/h-2kbova衍生表位的细胞表面呈递。
图4:ii仅以顺式工作。
图5:n末端缺失和置换不影响ii刺激能力。
图6:c末端缺失和置换不影响ii刺激能力。
图7:仅n和c末端缺失降低ii刺激能力。
图8:ad-iigp和ad-gp疫苗的剂量应答。
图9:ad-gp、ad-iigp和ad-iiclipgp作用于mhcii类呈递的比较。
图10:ad-gp、ad-iigp、ad-gplamp-1和ad-iiδ17gp在体内时间过程研究中的比较。
图11:ad-gp、ad-iigp、ad-iiδ17gp、ad-iikeygp、ad-iiclipgp、ad-ii1-117gp和ad-ii1-199gp在体内应答中的比较。
图12:ad-gp能够引发后续ad-iigp加强。
图13:ad-iigp不能引发后续ad-gp或ad-iigp加强。
图14:ad-gp和adii-gp疫苗的剂量应答。
图15:与包括残基50-215的恒定链变体(ii50-215)偶联的甘露糖受体,与腺病毒纤维蛋白质进一步偶联。
定义
腺病毒:一组包含双链dna的病毒。腺病毒可以进行遗传修饰,使得其不能复制或条件性不能复制。以这种形式,作为腺病毒构建体或腺病毒载体,它们可以用作基因递送媒介物用于疫苗接种或基因疗法。
腺病毒纤维蛋白质:来自腺病毒的任何血清型的纤维蛋白质。它还称为腺病毒纤维结或具有异源结插入片段的腺病毒纤维结。
佐剂:其与施用的免疫原决定簇/抗原/核酸构建体的混合物增加或以其他方式修饰对于所述决定簇的免疫应答的任何物质。
氨基酸:任何合成或天然存在的氨基羧酸,包括在肽和多肽包括在体内合成的蛋白质和酶中存在的任何氨基酸,从而包括氨基酸的修饰。术语氨基酸在本文中与术语“氨基酸残基”同义使用,其意欲包含如所述已与至少一个其他种类例如2、例如3、例如超过3个其他种类反应的氨基酸。通用词氨基酸包括天然和非天然氨基酸,其中任何可以以“d”或“l”异构形式存在。氨基酸可以缩写为‘aa’。
抗体:免疫球蛋白分子和免疫球蛋白分子的活性部分。抗体是例如完整免疫球蛋白分子或其保留免疫学活性的片段。
抗原:可以与克隆分布的免疫受体(t细胞或b细胞受体)结合的任何物质。通常是肽、多肽或多聚体多肽。抗原优选能够引发免疫应答。
加强:通过加强物注射(shot)或剂量来加强是给予免疫试剂例如疫苗的一次或多次另外剂量,在用于引发免疫系统的物质的初始剂量后一段时间给予,以维持或增强通过相同(同源)或另一种(异源)免疫试剂的先前剂量引发的免疫应答。
载体:抗原与之偶联以帮助诱导免疫应答的实体或化合物。
嵌合蛋白质:由核苷酸序列编码的遗传改造蛋白质,所述核苷酸序列通过将2种或更多种完整或部分基因或一系列(非)随机核酸剪接在一起制备。
补体:其作用于“补充”抗体工作的复杂系列的血液蛋白质。补体破坏细菌,产生炎症,且调节免疫反应。
细胞因子:生长或分化调节剂,在本文中非限定使用,并且不应限制本发明和权利要求的解释。除细胞因子外,粘附或辅助分子或其任何组合可以单独或与细胞因子组合采用。
ctl:细胞毒性t淋巴细胞。表达cd8连同t细胞受体,且因此能够响应由i类分子呈递的抗原的t细胞亚组。
递送媒介物:由此核苷酸序列或多肽或两者可以从至少一种介质转运到另一种介质的实体。
片段:用于指出核酸或多肽的非全长部分。因此,片段自身也分别是核酸或多肽。
异源加强或引发-加强:其中用于加强免疫系统的物质不同于先前用于引发免疫应答的物质。
同源加强或引发-加强:其中用于加强免疫系统的物质与先前用于引发免疫应答的物质相同。
个体:鸟、哺乳动物、鱼、两栖类或爬行类包括人类的任何物种或亚种。
恒定链:与内质网和后续细胞区室中的mhcii分子结合且稳定其的整合膜蛋白质糖蛋白。此处术语恒定链涵盖所有天然存在或人工生成的与人恒定链具有特定相似性的全长或片段化的同源基因和蛋白质。恒定链在本文中缩写为ii。
分离的:与本文公开的核酸、多肽或抗体结合使用的‘分离的’指已鉴定且从其天然的、一般的细胞环境的组分中分离和/或回收的那些。本发明的核酸、多肽和抗体优选是分离的,并且本发明的疫苗和其他组合物优选包括分离核酸、多肽或分离抗体。
mhc:主要组织相容性复合物,存在mhc的2个主要亚类,i类和ii类。
裸露dna:不与组蛋白结合的dna;通常是低甲基化和富含cpg的dna。裸露dna可以是环状或线性的,例如环状质粒。
核酸:传送遗传信息的核苷酸链或序列。就本发明而言,核酸可以是脱氧核糖核酸(dna)或下述中的任何:核糖核酸(rna)、锁核酸(lna)、肽核酸(pna)、嵌入核酸(ina)、扭曲嵌入核酸(tina)、己糖醇核酸(hna)、阿糖核酸(ana)、环己烷核酸(cna)、环己烯基核酸(cena)、甘油核酸(gna)、苏糖基核酸(tna)、缺口-聚体(gap-mers)、混合-聚体(mix-mers)和吗啉代类物质(morpholinos)。
核酸构建体:遗传改造的核酸。一般包括几种元件例如基因或其片段、启动子、增强子、终止子、多聚腺苷酸尾、接头、多聚接头、操作接头、多克隆位点(mcs)、标记、终止密码子、其他调节元件、内部核糖体进入位点(ires)或其他。
操作接头:以保证核酸或多肽的生物加工的方式使核酸构建体或(嵌合)多肽的2个部分结合在一起的核苷酸或氨基酸残基序列。
病原体:疾病的特异性成因剂,特别是生物剂例如病毒、细菌、朊病毒或寄生虫,其可以引起对其宿主的疾病,也被称为传染剂。
肽:限定序列且由酰胺键连接的多个共价连接的氨基酸残基。该术语与寡肽和多肽类似地使用。天然和/或非天然氨基酸可以通过肽键或通过非肽键连接。术语肽还包含通过化学或酶催化反应引入的翻译后修饰,如本领域已知的。该术语可以指多肽变体或片段。
药物载体:也称为赋形剂或稳定剂,在采用的剂量和浓度下对暴露于其的细胞或个体是无毒的。通常生理学上可接受的载体是ph缓冲的水性溶液。生理学上可接受的载体的例子包括缓冲液例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质例如血清白蛋白、明胶或免疫球蛋白;亲水聚合物例如聚乙烯吡咯烷酮;氨基酸例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物包括葡萄糖、甘露糖或糊精;螯合剂例如edta;糖醇例如甘露糖醇或山梨糖醇;成盐抗衡离子例如钠;和/或非离子表面活性剂例如tweentm、聚乙二醇(peg)和pluronicstm。
多个:至少2个。
引发:用例如dna初始引发免疫系统,以使免疫应答集中于所需免疫原。
引发-加强:用例如dna初始引发免疫系统,以使免疫应答集中于所需免疫原,并且用疫苗随后加强免疫应答,导致由所述疫苗诱导的免疫应答中的增加。
启动子:rna聚合酶在其上结合以起始通过一种或多种附近结构基因的信使rna转录的dna链中的结合位点。
信号肽:决定蛋白质在细胞中的最终定位的短氨基酸序列,也被称为分选肽。
合适疫苗:用于根据本发明使用的任何疫苗,能够加强通过初始引发刺激的免疫应答,特征在于用于引发免疫应答的核酸构建体和用于加强免疫应答的后续疫苗的至少一个部分是等同的。引发物和加强物的所述至少一个等同部分可以是ii或其变体、抗原肽或抗原肽的部分、或遍在的辅助t细胞表位。
表面活性剂:能够减少它溶解于其中的液体的表面张力的表面活性试剂。表面活性剂是包含其为亲水的极性基团和其为疏水的非极性基团,并且通常由脂肪链组成的化合物。
疫苗:能够在动物中诱导免疫应答的物质或组合物:在该正文中也被称为免疫原性组合物。免疫应答是在生物中诱导记忆的免疫应答(体液/抗体和/或细胞免疫应答),导致传染剂由二次而不是初次应答对抗,从而减少其对宿主生物的影响。本发明的疫苗可以作为预防和/或治疗药物给予。组合物可以包括下述中的一种或多种:一种或多种抗原、包括与ii可操作地连接的一种或多种抗原的核酸构建体、载体、佐剂和药物载体。
变体:给定参考核酸或多肽的‘变体’指这样的核酸或多肽,其展示出与所述参考核酸或多肽的一定序列同源性/同一性程度,但不等同于所述参考核酸或多肽。
结构域、区域和基序在本文中可以互换使用。
具体实施方式
本发明涉及包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽编码序列可操作地连接的恒定链或其变体。核酸构建体用于引发免疫应答,以加强后续加强疫苗接种的效应。
免疫应答
疫苗可以在预防上使用:它们在实际感染发生前给予;或在治疗上使用:其中它们引发或加速对已在体内的病原体的免疫应答。2种疫苗接种方法要求实体免疫应答的建立。通过感染或疫苗接种激活的免疫应答依赖于几种细胞类型例如t、b和抗原呈递细胞,以及几种不同分子主要是抗原、mhc分子、t和b细胞受体及许多其他的相互作用。
抗原是在抗原呈递细胞的表面上由mhc分子呈递的肽片段。抗原可以是外源的,即致病性来源,或源于生物自身,所谓的自体或自身抗原。mhc分子是由特异性染色体区域编码的多态基因家族的代表,所述特异性染色体区域称为“主要组织相容性复合物”(“majorhistocompatibilitycomplex”),因此为mhc。存在2类mhc分子,mhci类(mhc-i)和mhcii类(mhc-ii)。
t辅助细胞通过由mhcii类(mhc-ii)分子呈递的抗原刺激,所述mhc-ii分子位于抗原呈递细胞的表面上。mhc-ii分子在内质网中合成。在合成过程中,它们以阻止mhc-ii分子负载有自体或自身抗原的方式与恒定链(ii)组合。mhc-ii分子通过恒定链中的信号序列转运至在特异性细胞区室中的细胞表面。随着区室通过加工其内含物而成熟,它从溶酶体发展到晚期内体(在与内吞囊泡融合后)到mhcii类区室(miic)。内吞囊泡包含外源抗原,即蛋白酶解切割的细菌肽片段。这些片段通过其降解制备,以负载到mhc-ii分子上。mhc-ii分子通过恒定链在2部分过程中释放,这时恒定链首先通过蛋白酶解被降解,仅留下在mhc-ii结合结构域中称为clip的肽,其次通过hla-dm分子去除clip。mhc-ii分子随后游离,以结合外源抗原,且在miic囊泡与质膜融合后,将其呈递在细胞表面上。这起始体液免疫应答,因为呈递的抗原刺激t辅助细胞的激活,这依次通过几种方式激活b细胞,这最终分化成抗体分泌细胞。
当t细胞毒性细胞的t细胞受体识别与在抗原呈递细胞上的mhci类分子结合的抗原时,细胞免疫应答起始。mhc-i分子不与功能性类似与mhc-ii结合的恒定链的分子结合。mhc-i加工成的抗原呈递分子另外不同于mhc-ii分子的那种,因为mhc-i分子已在内质网中负载有抗原。由mhc-i分子呈递的抗原一般是通过蛋白质的蛋白酶体切割的肽片段,所述蛋白质已通过抗原呈递细胞自身合成。这些蛋白质可以是在细胞自身dna中编码的异常蛋白质或衍生自病毒或其他病原体的蛋白质,所述病毒或其他病原体已感染细胞且寄生其蛋白质合成机制。mhci类相关蛋白酶解系统存在于基本上所有细胞中。
2类t细胞的功能是显著不同的,如由其名称所示的。细胞毒性t细胞通过细胞的直接裂解和通过分泌细胞因子例如γ-干扰素来消灭细胞内病原体和肿瘤。占优势的细胞毒性t细胞是cd8+t细胞,这也是抗原特异性的。辅助t细胞也是裂解细胞,但其主要功能是分泌促进b细胞(抗体生产细胞)和其他t细胞的活性的细胞因子,并且因此它们广泛增强对于外源抗原的免疫应答,包括抗体介导的和细胞毒性t细胞介导的应答机制。cd4+t细胞是免疫应答中的主要辅助t细胞表型。
核酸构建体
本发明的一个方面涉及包括这样的序列的核酸构建体例如裸露dna构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段简言之抗原可操作地连接的至少一种恒定链或其变体。
在一个实施方案中,本发明涉及包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中所述恒定链或其变体不包括key区域的lrmk氨基酸残基。
在另一个实施方案中,本发明涉及包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中所述恒定链或其变体包括clip区域的变体。
在另一个实施方案中,本发明涉及包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中所述恒定链或其变体不包括前17个氨基酸。
在另外一个实施方案中,本发明涉及包括这样的序列的核酸构建体,所述序列编码与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接的至少一种恒定链或其变体,其中所述核酸构建体用于癌症疫苗的引发。
核酸构建体应理解为遗传改造的核酸。核酸构建体可以是非复制的且线性的核酸、环状表达载体或自主复制质粒。核酸构建体可以包括几种元件,例如但不限于基因或其片段、启动子、增强子、终止子、多聚腺苷酸尾、接头、多聚接头、操作接头、多克隆位点(mcs)、标记、终止密码子、内部核糖体进入位点(ires)和用于整合的宿主同源序列或其他限定元件。应当理解根据本发明的核酸构建体可以包括上述元件的任何组合的所有或亚组。
用于改造核酸构建体的方法是本领域众所周知的(参见例如,molecularcloning:alaboratorymanual,sambrook等人,编辑,coldspringharborlaboratory,第2版,coldspringharbor,n.y.,1989)。进一步地,根据本发明的核酸构建体可以无需模板而合成,并且可以得自各种商业供应者(例如genscriptcorporation)。
在一个实施方案中,核酸构建体包括的核酸残基可以被修饰。所述修饰可以选自:乙酰化、甲基化、磷酸化、遍在蛋白化、核糖基化、硫化及其他。
在一个实施方案中,根据本发明的核酸构建体可以由dna组成。在另一个实施方案中,核酸构建体可以由选自下述的核酸组成:脱氧核糖核酸(dna)、核糖核酸(rna)、锁核酸(lna)、肽核酸(pna)、嵌入核酸(ina)、扭曲嵌入核酸(tina)、己糖醇核酸(hna)、阿糖核酸(ana)、环己烷核酸(cna)、环己烯基核酸(cena)、甘油核酸(gna)、苏糖基核酸(tna)、缺口-聚体、混合-聚体、吗啉代类物质或其组合。
如上所述,mhcii分子在加工过程中与恒定链结合,直至结合的恒定链降解,以允许外源抗原肽负载到mhcii分子上。当应用包括恒定链–接头–表位的‘外部’蛋白质构建体时,其中恒定链包括key区域(包括lrmk氨基酸残基),所述蛋白质构建体在所述mhcii分子定位于细胞的细胞外表面上时将与mhcii分子(包含抗原)相互作用。因此,效应是外部的,并且依赖于蛋白质构建体(包括lrmk氨基酸残基)的恒定链key-残基竞争负载到mhcii分子上的能力。换言之,在细胞内加工过程中已负载到mhcii分子上的抗原必须被“倒出”(“tippedoff”)或从细胞表面上的mhcii分子中去除,并且由包括恒定链–接头–表位的蛋白质构建体代替。这给出无法扩增的“1:1”-效应,并且它不变地依赖于来自恒定链的lrmk氨基酸残基的存在。
根据本发明的核酸构建体涉及应用编码恒定链或其变体且还编码抗原肽或表位的‘内部’核酸构建体,即核酸构建体转染到受试者中细胞的细胞内间隙内。所述核酸构建体将使用细胞翻译机制,以产生恒定链–接头–表位或恒定链–表位产物,在所述mhc分子定位在细胞内例如在胞内体或miic中时,这将与mhcii分子或mhci分子(不包含抗原)相互作用。因此,效应是内部的,并且不依赖于蛋白质构建体(包括lrmk氨基酸残基)的恒定链key-结构域竞争负载到mhc分子上的能力。事实上,该效应不依赖于ii-key区域及其lrmk残基的存在。此外,这给出可以扩增的效应,因为一个核酸构建体可以产生超过一种产物。
核酸构建体的‘内部’使用具有优于蛋白质构建体的‘外部’使用的几个优点,如上详述:1)扩增;小量核酸构建体的引入产生可以都与mhc分子结合的许多产物,这还可以是二次扩增的,因为与mhc结合的所述产物可以通过内在化进一步再循环,以最终增加其展示,2)细胞自身抗原加工系统的使用确保表位与mhc分子的正确和紧密结合,3)不需要ii-key区域的lrmk残基和天然ii-clip结构域。
密码子最佳化和简并核酸序列
功能蛋白质在异源宿主中的表达是现代生物技术的基石。不幸的是,许多蛋白质难以在其原始背景外表达。它们可以包含表达限制性调节元件,来自使用非经典核苷酸编码的生物,或来自具有在所需宿主中很少使用的密码子的普遍基因(generife)。基因合成速度和效率中的改善已致使可行的完整基因重新设计用于最大限度的蛋白质表达。例如,当在研究下的基因的密码子频率与宿主表达系统的密码子频率匹配时,蛋白质表达可以显著改善。例如,重新设计策略可以不仅包括最佳密码子偏好的使用,还包括mrna结构元件的改变以及翻译和起始区的修饰。用于密码子最佳化的技术是本领域技术人员已知的,并且可以通过商业供应者例如genscriptcorporation执行。
应当理解根据本发明包括恒定链或其变体的核酸构建体可以以任何方式进行密码子最优化,以便通过翻译成蛋白质即氨基酸产生包括根据本发明的恒定链或其变体的氨基酸序列,所述恒定链对应于seqidno:2(人ii)中公开的氨基酸序列。
同样地,根据本发明包括恒定链的核酸构建体可以以任何方式进行密码子最优化,以便通过翻译成蛋白质即氨基酸产生包括根据本发明的恒定链或其变体的氨基酸序列,所述恒定链对应于其中核酸构建体可以用于引发免疫应答的任何动物的氨基酸序列;包括任何脊椎动物、哺乳动物、鱼或鸟。
密码子偏好:密码子偏好已鉴定为在原核生物基因表达中的单个最重要因子。给定密码子在遗传密码中出现的程度在生物之间、在以高和低水平表达的蛋白质之间和甚至在相同操纵子的不同部分之间显著不同。关于这点的原因几乎是必然的,因为优选密码子与细胞内可用的同族trna丰度相关。这个关系用于最优化翻译系统且平衡密码子浓度与同工trna(isoacceptortrna)浓度。
替换很少使用的密码子:一般而言,基因包含的罕见密码子越多,异源蛋白质将在那种特定宿主系统内以合理水平表达的可能性越小。如果罕见密码子成簇或在蛋白质的n末端部分中出现,那么这些水平变得甚至更低。用更紧密地反映宿主系统的密码子偏好而不改变氨基酸序列的其他密码子替换罕见密码子可以增加功能蛋白质表达水平。
消除问题密码子:生物使用小于5%-10%时机的任何密码子都可能引起问题,不管它来自何处。再次,紧密或相邻密码子对蛋白质表达比它们分开可以具有更大的影响。消除罕见密码子和可以作为终止信号阅读的密码子可以阻止低表达或不存在表达的情况。
在哺乳动物宿主中表达病毒蛋白质:如果基因正确制备,甚至病毒基因也可以在哺乳动物细胞系中成功表达。病毒基因的密集信息负荷频繁导致重叠的读码框。许多病毒基因还在编码序列内编码顺式作用的负调节序列。病毒基因可以重新合成,不仅只表达所需蛋白质,还破坏调节元件,从而增强蛋白质产生。病毒密码子最优化在dna疫苗研究中是特别有用的,因为它增加靶的免疫原性。
其他限制:尽管密码子偏好在基因表达中发挥很大作用,但表达载体和转录启动子的选择也是重要的。在蛋白质n末端区域周围的核苷酸序列对于罕见密码子的存在和紧邻起始aug的密码子的特性是特别敏感的。在翻译和mrna稳定性之间还存在一定相互影响。
遗传密码的简并性
根据上文可见遗传密码具有冗余性但不具有多义性(ambiguity)。例如,尽管密码子gaa和gag都指定谷氨酸(冗余性),但其中无一指定任何其他氨基酸(无多义性)(关于完全关联参见下文密码子表)。编码一种氨基酸的密码子可以在其3个位置中的任何中不同。遗传密码的简并性是解释沉默突变的存在的原因。因为4种碱基的三联体密码指定20种氨基酸和终止密码子,所以产生简并性。
该表显示20种氨基酸、起始(start)和终止(stop)密码子和64种可能密码子。mrna的方向是5'到3'。
同义置换
沉默突变或置换是不导致对蛋白质的氨基酸序列的改变的dna突变。它们可以在非编码区中出现(在基因外或在内含子内),或它们可以以不改变最终氨基酸序列的方式在外显子内出现。短语沉默突变或置换通常可与短语同义突变或置换互换使用;然而,同义突变或置换是前者的子范畴,仅在外显子内出现。
应当理解根据本发明包括恒定链或其变体的核酸构建体可以包括同义置换,以便通过翻译成蛋白质即氨基酸产生包括根据本发明的恒定链或其变体的氨基酸序列,所述恒定链对应于seqidno:2(人ii)中公开的氨基酸序列。
同样地,根据本发明包括恒定链的核酸构建体可以包括同义置换,以便通过翻译成蛋白质即氨基酸产生包括根据本发明的恒定链或其变体的氨基酸序列,所述恒定链对应于其中核酸构建体可以用于引发免疫应答的任何动物的氨基酸序列;包括任何脊椎动物、哺乳动物、鱼或鸟。
非同义置换成同义氨基酸
非同义置换引起氨基酸中的改变。然而,氨基酸根据所述氨基酸的性质分组,并且一个氨基酸由另一个氨基酸的置换可以对包括所述氨基酸的蛋白质的功能或性质没有影响(如果置换导致同义氨基酸)。此类置换可以指示保守置换或突变:dna或rna序列中的改变导致一个氨基酸由生物化学相似的氨基酸替换。
因此,应当理解根据本发明包括恒定链或其变体的核酸构建体可以包括非同义置换,以便通过翻译成蛋白质即氨基酸产生包括恒定链变体的氨基酸序列,其中所述非同义置换导致其为同义的一个或多个氨基酸的置换。
同义置换可以包括疏水性氨基酸由另一个疏水性氨基酸的置换;亲水性氨基酸由另一个亲水性氨基酸的置换;极性氨基酸由另一个极性氨基酸的置换;非极性氨基酸由另一个非极性氨基酸的置换;带正电的氨基酸由另一个带正电的氨基酸的置换;带负电的氨基酸由另一个带负电的氨基酸的置换;中性氨基酸由另一个中性氨基酸的置换;多重性(ambiguous)氨基酸由其配对多重性荷电氨基酸的置换,例如异亮氨酸和亮氨酸、天冬酰胺和天冬氨酸以及谷氨酰胺和谷氨酸;芳香族氨基酸由另一个芳香族氨基酸的置换;脂肪族氨基酸由另一个脂肪族氨基酸的置换;或任何氨基酸由丙氨酸的置换。这些置换可以指示等值置换。
剪接变体
可变剪接是rna剪接变异机制,其中初级基因转录物(前mrna)的外显子分离且重新连接,以便产生可变核糖核苷酸排列。这些线性组合随后经历翻译过程,其中指定氨基酸的特定和独特序列,导致同种型蛋白质或剪接变体。以这种方式,可变剪接使用遗传表达以促进更多样的蛋白质的合成。在真核生物中,可变剪接是朝向更高效率的重要步骤,因为信息可以经济得多地被贮存。几种蛋白质可以在其长度在原核生物编码方式中只够2种蛋白质的dna序列中编码。
在一个实施方案中,本发明的核酸构建体可以这样设计,以便产生多重抗原肽或抗原肽的片段和/或多重恒定链或其变体。
在一个实施方案中,根据本发明的核酸构建体包括抗原肽或所述抗原肽的片段的至少1、例如2、例如3、例如4、例如5、例如6、例如7、例如8、例如9、例如10、例如11、例如12、例如13、例如14、例如15、例如16、例如17、例如18、例如19、例如20种剪接变体。
超过一种抗原肽剪接变体可以包含等同或不等同的抗原肽。
在另一个实施方案中,根据本发明的核酸构建体包括恒定链或其变体的至少1、例如2、例如3、例如4、例如5、例如6、例如7、例如8、例如9、例如10、例如11、例如12、例如13、例如14、例如15、例如16、例如17、例如18、例如19、例如20种剪接变体。
超过一种恒定链剪接变体可以包含等同或不等同恒定链或其变体。
在一个实施方案中,恒定链的至少一种剪接变体包括天然全长恒定链。在另一个实施方案中,恒定链的至少一种剪接变体包括恒定链的变体。在另外一个实施方案中,恒定链的至少一种剪接变体包括恒定链的变体,其中所述ii不包括ii-key区域的lrmk氨基酸残基。在另一个实施方案中,恒定链的至少一种剪接变体包括恒定链的变体,其中所述ii不包括clip结构域的m91和m99残基。
由此可见剪接变体可以包括等同或不等同抗原肽和/或等同或不等同恒定链或其变体的任何组合。
以这种方式,可能的是“改组”(“shuffle”)包括恒定链的不同结构域或区域的序列(外显子),以便通过可变剪接获得恒定链的变体。以这种方式,还可能的是“改组”包括一种或多种抗原肽的不同结构域或区域的序列(外显子),以便通过可变剪接获得一种或多种所述抗原肽的变体。
恒定链
恒定链(ii)或mhcii类结合的恒定链或cd74或p31是非多态ii型嵌膜蛋白质,关于人和小鼠ii的氨基酸序列分别参见seqidnos:2和4,并且同样地关于人和小鼠ii的核酸序列分别参见seqidnos:1和3。恒定链在淋巴细胞成熟和适应性免疫应答中具有多重功能,特别地靶向溶酶体区室是iiclip序列可以占据mhcii类分子,直至这些与胞内体区室融合(pietersj.1997,curr.opin.immunol.,9:8996)。此外,ii已显示发挥mhci类伴侣蛋白的功能(morris等人,2004,immunol.res.30:171-179),并且通过其胞内体靶向序列,促进针对共价连接抗原的cd4+而不是cd8+t细胞的增殖(diebold等人,2001,genether.8:487-493)。
恒定链蛋白质包括几个结构域:包括信号或分选肽(也称为溶酶体靶向序列)的细胞溶质结构域、跨膜结构域、和其自身包括clip区域、key区域(包括lrmk残基)的腔结构域、核心结构域和三聚结构域。这些结构域的两侧为高度弹性区域(strumptner-cuvelette&benaroch,2002,biochem.biophys.acta.,1542:1-13)。恒定链已在几种生物中得到表征,包括脊椎动物(例如鸡)、哺乳动物(例如牛、犬、小鼠和大鼠)和人。
本发明涉及包括这样的序列的核酸构建体,其中至少一种恒定链或其变体是生物特异性的,或可以与特定生物有关。优选地,至少一种恒定链具有脊椎动物起源,更优选哺乳动物起源且最优选人起源。与之相关,由seqidno:1限定的序列是来自人的恒定链的核酸序列。在另一个优选实施方案中,至少一种恒定链具有禽起源,最优选来自家鸡(gallusgallusdomesticus)(鸡)。在另外一个优选实施方案中,至少一种恒定链衍生自鱼,最优选可以在养鱼场中培育的鱼(例如大麻哈鱼或鲑鱼)。在另外一个优选实施方案中,至少一种恒定链衍生自雪貂。
采用的恒定链优选是待接受核酸构建体的生物的恒定链。本发明的一个目的是恒定链和宿主生物或处理接受者具有相同物种。
在本发明的一个实施方案中,包括至少一种恒定链或其变体的核酸构建体具有下述前提:当核酸构建体包括至少一种恒定链的变体时,所述恒定链不包括ii-key序列的lrmk氨基酸残基。
在本发明的另一个实施方案中,包括至少一种恒定链或其变体的核酸构建体具有下述前提:当核酸构建体包括至少一种恒定链的变体时,所述恒定链包括ii-clip结构域的变体。在一个实施方案中,所述变体是在位置91和99上的甲硫氨酸由另一个氨基酸的置换。在另一个实施方案中,所述变体是m91am99a双点突变(在位置91和99上的氨基酸甲硫氨酸至丙氨酸的置换)。
在另一个实施方案中,ii变体是ii的前17个氨基酸的缺失(δ17ii)。
在第三个实施方案中,ii变体包括在位置91和99上的甲硫氨酸的置换,和ii的前17个氨基酸的缺失。
本发明人已惊讶地发现ii-key结构域的lrmk残基不是根据本发明用于引发免疫应答所需的。
此外,本发明人已惊讶地发现在ii的位置91和99上的甲硫氨酸置换增加mhcii呈递。
此外,本发明人已发现缺失ii的前17个氨基酸令人惊讶地增加记忆应答。
本发明人已进一步发现包括残基编号50–118的恒定链的中心部分是获得ii的完全效应所需的。这种ii变体缺乏三聚结构域。因此,在一个实施方案中,核酸构建体包括至少一种恒定链或其变体,其中所述恒定链包括与来自另一种蛋白质的三聚结构域偶联的氨基酸残基编号50–118。所述其他蛋白质可以是例如细菌蛋白质或腺病毒纤维蛋白质。
本发明还涉及核酸构建体,其中编码的至少一种恒定链是具有至少40个氨基酸的seqidno:2中鉴定的序列片段且与seqidno:2的相同片段具有至少85%同一性。
片段是来自如seqidno:2中所示恒定链的任何部分的至少40个氨基酸的片段。这包括包含下述残基的片段:残基1-40、10-50、20-60、25-65、30-70、35-75、40-80、45-85、50-90、55-95、60-100、65-105、70-110、75-115、80-120、85-125、90-130、95-135、100-140、105-145、110-150、115-155、120-160、125-165、130-170、135-175、140-180、145-185、150-190、155-195、160-200,165-205、170-210和175-216。它还包括如上文列出中的任何扩大至其任一侧的高达5个残基的片段。它进一步包括至少50个残基、至少60个残基、至少70个残基、至少80个残基、至少90个残基、至少100个残基、至少110个残基、至少120个残基、至少130个残基、至少140个残基、至少150个残基、至少160个残基、至少170个残基、至少180个残基至少190个残基、至少200个残基和至少210个残基的片段。
在本发明的范围内包括与seqidno:2具有至少85%序列同一性、例如至少90%序列同一性、例如至少91%序列同一性、例如至少92%序列同一性、例如至少93%序列同一性、例如至少94%序列同一性、例如至少95%序列同一性、例如至少96%序列同一性、例如至少97%序列同一性、例如至少98%序列同一性、例如99%序列同一性的上述片段中的任何。
氨基酸序列之间的同一性/同源性可以使用众所周知的评分矩阵进行计算,例如blosum30、blosum40、blosum45、blosum50、blosum55、blosum60、blosum62、blosum65、blosum70、blosum75、blosum80、blosum85和blosum90中的任何一个。
在一个实施方案中,本发明是核酸构建体,其中编码的至少一种恒定链是具有至少186个氨基酸的seqidno:2的片段。这包括如上定义并且因此与seqidno:2的恒定链序列共享同一性的片段中的任何。
本发明另外涉及核酸构建体,其中编码的至少一种恒定链与seqidno:2至少85%等同。
这包含与seqidno:2具有至少85%序列同一性、例如至少90%序列同一性、例如至少91%序列同一性、例如至少92%序列同一性、例如至少93%序列同一性、例如至少94%序列同一性、例如至少95%序列同一性、例如至少96%序列同一性、例如至少97%序列同一性、例如至少98%序列同一性、例如99%序列同源性的衍生自如seqidno:2中提及的恒定链的任何序列,其包括在本发明的范围内。这包括比seqidno:2中所述的序列更长或更短的序列。
与起源、序列同一性或长度无关,上述序列中的任何来自在此命名的恒定链变体。
由此可见在本发明的范围内,来自任何生物的恒定链变体可以是根据上文的变体,即变体可以在ii-key区域中是改变的和/或在ii-clip区域中是改变的和/或是生物恒定链的片段和/或在恒定链的所有序列上或在其片段内与所述恒定链至少85%等同。恒定链还可以来自生物的相关物种或来自遥远相关的物种。
本发明的另一个方面涉及如由核酸构建体编码的至少一种恒定链的区域、肽或结构域的添加、去除或置换。这些区域、肽或结构域中的一个或多个的去除将截短所得到的恒定链。区域、肽或结构域的添加或替换包括从已知来源例如天然存在的蛋白质或多肽或从人工合成的多肽或编码其的核酸残基中选择这些序列的选项。区域、结构域或肽的添加包括添加每种类型或不同类型区域、结构域、肽中的1个、2个或更多个,和编码这些区域、结构域和肽的核酸中的1个、2个、3个或更多个的选项。这些基于序列可以是彼此等同或不同的。区域、肽和结构域无需与支架恒定链源于相同的生物。
区域、结构域或肽的去除包括去除每种类型或不同类型区域、结构域、肽中的1个、2个、3个或更多个和去除编码这些区域、结构域和肽的氨基酸残基中的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个的选项。执行编码所得到的多肽的个别核苷酸以及核苷酸段的添加、缺失和置换是本领域众所周知的。
当确定哪些置换、缺失、重排或其他改变对于构建体将是有利的时,比对来自不同生物的同源基因或蛋白质的核酸且特别是蛋白质序列可以具有极大帮助。如下举例说明的比对人和鼠类恒定链序列给出哪些氨基酸残基对于在这些生物中恒定链的结构和功能可以具有重要性的指示–这些是在2个序列之间是保守的残基。同样地,推测的较不重要的残基是在其中序列不同的那些。就本发明而言有利的是执行变体残基/区域的置换和/或缺失。当尝试突变或缺失或以其他方式改变例如人恒定链的序列以便改善其免疫应答刺激能力时,检查保守残基且制备例如同源置换(即其中氨基酸被视为具有例如相同结构质量、极性、疏水性或其他的置换)也可以是相关的。
在衍生自人和小鼠的恒定链蛋白质如下比对中,key区域的lrmk氨基酸残基是具有下划线的。
key区域
本发明的一个优选实施方案涉及至少一种恒定链的key区域的去除、置换或替换。如上所述,key区域的添加或替换包括用来自相同或其他生物的恒定链的key区域或来自相同或其他生物的key区域的变体来添加或替换在选择的一种或多种恒定链的变体中的现有key区域的选项。如由上文可见的,变体key区域可以是特异性生成的key区域的突变体形式,通过单个或多个核酸置换、缺失或添加生成。一个优选实施方案包括单独的key区域的n末端或c末端相邻序列,但不含key区域自身。相邻意指在key区域的10个残基内、在key区域的20个残基内、在30个残基内、在40个残基内、在50个残基内、在75个残基内或在100个残基内的任何氨基酸。
一个最优选的实施方案包括key区域的一个或多个置换或缺失,导致在key区域中包括的lrmk氨基酸中的1个、2个、3个或4个氨基酸残基的置换或缺失。在一个实施方案中,缺失在key区域中包括的lrmk氨基酸中的至少1个、例如2个、例如3个、例如4个。在另一个实施方案中,在key区域中包括的lrmk氨基酸中的至少1个、例如2个、例如3个、例如4个由其他氨基酸置换。所述氨基酸可以是选自下述的任何氨基酸:g(甘氨酸)、p(脯氨酸)、a(丙氨酸)、v(缬氨酸)、l(亮氨酸)、i(异亮氨酸)、m(甲硫氨酸)、c(半胱氨酸)、f(苯丙氨酸)、y(酪氨酸)、w(色氨酸)、h(组氨酸)、k(赖氨酸)、r(精氨酸)、q(谷氨酰胺)、n(天冬酰胺)、e(谷氨酸)、d(天冬氨酸)、s(丝氨酸)和t(苏氨酸)。
在一个特定实施方案中,lrmk氨基酸残基各自由丙氨酸(a)氨基酸残基置换,从而序列阅读为:aaaa。在另一个实施方案中,lrmk氨基酸残基由包括同义或等值置换的氨基酸置换。例如,氨基酸残基l可以由i、v、m或f置换;r可以由k、h、e或d置换;m可以由l、i、f或v置换;并且k可以由h或r置换。
在本发明的一个实施方案中,key区域可以包括大于lrmk残基,或lrmk残基可以由大于4个氨基酸残基的序列替换。
本发明的一个实施方案涉及如上所述不含key区域的恒定链的片段。这些片段可以是至少5个氨基酸残基长,长度至少10个残基、至少15个残基、至少20个残基、至少25个残基、至少30个残基或至少35个残基。另一个实施方案涉及恒定链的片段,其中信号肽被去除,并且恒定链片段是至少10个氨基酸残基长,长度至少15个残基、至少20个残基、至少25个残基、至少30个残基、至少35个残基、至少50个残基、至少60个残基、至少70个残基、至少80个残基、至少90个残基、至少100个残基、至少110个残基、至少120个残基、至少130个残基、至少140个残基、至少150个残基、至少160个残基、至少170个残基或至少180个残基。
在本发明的一个实施方案中,由如本文描述的核酸构建体编码的至少一种恒定链不包括ii-key区域的lrmk氨基酸残基。
在一个实施方案中,本发明因此涉及包括与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段连接的至少一种恒定链或其变体的核酸构建体,其中所述恒定链或其变体不包括ii-key区域的lrmk氨基酸残基。
clip区域
本发明的另一个实施方案涉及至少一种恒定链的clip区域的去除、添加或替换。如上所述,clip区域的添加或替换包括用来自相同或其他生物的恒定链的clip区域或来自相同或其他生物的clip区域的变体来添加或替换在选择的一种或多种恒定链的变体中的现有clip区域的选项。如由上文可见的,变体clip区域可以是特异性生成的clip区域的突变体形式,通过单个或多个核酸置换、缺失或添加生成。一个优选实施方案包括单独的clip区域,或连同n末端相邻序列或c末端相邻序列的clip区域,不含恒定链的任何其他区域或结构域。其他优选实施方案包括单独的clip区域的n末端或c末端相邻序列,但不含clip区域自身。相邻意指在clip区域的10个残基内、在clip区域的20个残基内、在30个残基内、在40个残基内、在50个残基内、在75个残基内或在100个残基内的任何氨基酸,。
一个优选实施方案包括clip区域的一个或多个置换或缺失,导致在clip区域的1个、2个、3个、4个或更多个氨基酸残基的置换或缺失。在一个实施方案中,缺失在clip区域中包括的氨基酸中的至少1个、例如2个、例如3个、例如4个或更多个。在另一个实施方案中,在clip区域中包括的氨基酸中的至少1个、例如2个、例如3个、例如4个或更多个由其他氨基酸置换。所述氨基酸可以是选自下述的任何氨基酸:g(甘氨酸)、p(脯氨酸)、a(丙氨酸)、v(缬氨酸)、l(亮氨酸)、i(异亮氨酸)、m(甲硫氨酸)、c(半胱氨酸)、f(苯丙氨酸)、y(酪氨酸)、w(色氨酸)、h(组氨酸)、k(赖氨酸)、r(精氨酸)、q(谷氨酰胺)、n(天冬酰胺)、e(谷氨酸)、d(天冬氨酸)、s(丝氨酸)和t(苏氨酸)。
本发明的一个实施方案涉及如上所述不含clip区域的恒定链的片段。这些片段可以是至少5个氨基酸残基长,长度至少10个残基、至少15个残基、至少20个残基、至少25个残基、至少30个残基或至少35个残基。另一个实施方案涉及恒定链的片段,其中信号肽被去除,并且恒定链片段是至少10个氨基酸残基长,长度至少15个残基、至少20个残基、至少25个残基、至少30个残基、至少35个残基、至少50个残基、至少60个残基、至少70个残基、至少80个残基、至少90个残基、至少100个残基、至少110个残基、至少120个残基、至少130个残基、至少140个残基、至少150个残基、至少160个残基、至少170个残基或至少180个残基。
在一个特定实施方案中,在位置91和99上的m氨基酸残基各自由丙氨酸(a)氨基酸残基置换,从而序列阅读为:m91am99a。在另一个实施方案中,在位置91和99上的m氨基酸残基由包括同义或等值置换的氨基酸置换。
在本发明的一个实施方案中,由如本文描述的核酸构建体编码的至少一种恒定链不包括在ii-clip序列的位置91和99上的m氨基酸残基。
在一个实施方案中,本发明因此涉及包括与至少一种抗原蛋白质或肽或所述蛋白质或肽的抗原片段连接的至少一种恒定链或其变体的核酸构建体,其中所述恒定链或其变体不包括在ii-clip区域的位置91和99上的m氨基酸残基。
n或c末端改变:
本发明的一个实施方案涉及至少一种恒定链的n或c末端区域的去除(缺失)、置换或替换。如上所述,n或c末端区域的添加或替换包括用来自相同或其他生物的恒定链或其他蛋白质的n或c末端区域或来自相同或其他生物的n或c末端区域的变体来添加或替换在选择的一种或多种恒定链的变体中的现有n或c末端区域的选项。如由上文可见的,变体n或c末端区域可以是特异性生成的n或c末端区域的突变体形式,其通过单个或多个核酸置换、缺失或添加生成。
一个实施方案包括ii的前(n末端)或末(c末端)氨基酸的缺失,例如ii的前或末1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、125、130、135、140、145或150个氨基酸。
在本发明的一个特定实施方案中,ii变体包括ii的前17个氨基酸的缺失(δ17ii)。
本发明的一个实施方案涉及不含完整n或c末端区域的如上所述恒定链的片段。这些片段可以是至少5个氨基酸残基长,长度至少10个残基、至少15个残基、至少20个残基、至少25个残基、至少30个残基或至少35个残基。另一个实施方案涉及恒定链的片段,其中信号肽被去除,并且恒定链片段是至少10个氨基酸残基长,长度至少15个残基、至少20个残基、至少25个残基、至少30个残基、至少35个残基、至少50个残基、至少60个残基、至少70个残基、至少80个残基、至少90个残基、至少100个残基、至少110个残基、至少120个残基、至少130个残基、至少140个残基、至少150个残基、至少160个残基、至少170个残基或至少180个残基。
在本发明的一个实施方案中,ii的跨膜区段的所有或部分可以由来自任何其他蛋白质例如趋化因子受体ccr6tm6的相应区段替换。
在本发明的另一个实施方案中,ii的跨膜区段的所有或部分可以由来自趋化因子受体ccr6tm6的相应区段替换。
信号肽
本发明的另一个实施方案涉及至少一种恒定链,其中信号肽被去除、替换或添加到编码恒定链的序列上。信号肽是决定蛋白质在细胞中的最终定位的短氨基酸序列,也被称为分选肽。决定蛋白质至亚细胞区室例如内质网、高尔基体和各种区室包括高尔基体、核、质膜、线粒体及其中的各种空间和膜、过氧化物酶体、溶酶体、胞内体和分泌囊泡的信号肽都包括在本发明的范围内。一个优选实施方案包括单独的恒定链的溶酶体靶向序列。
抗原
恒定链的上述变体中的任何以这样的形式包含在本发明中,其中所述变体中的至少一种与至少一种抗原例如抗原蛋白质或肽或所述蛋白质或肽的抗原片段可操作地连接。
本发明的一个目的是包括但不限于源于致病性生物的抗原蛋白质或肽或所述蛋白质或肽的片段、癌症特异性多肽和抗原、和与异常生理学应答相关的蛋白质或肽。
更优选地,本发明的一个目的是包括源于下述类型病原体中的任何的抗原:病毒、微生物和寄生虫。这包括任何动物已知的病原体。优选具有来自哺乳动物病原体的抗原,例如特异性靶向哺乳动物例如雪貂的病原体。优选具有来自人病原体的抗原。一般而言,可以使用发现与人病原体或疾病相关的任何抗原。
在另一个实施方案中,优选具有来自禽病原体的抗原,例如特异性靶向鸟或家禽的病原体。更优选具有来自鸡(家鸡)的抗原。一般而言,可以使用发现与禽病原体相关的任何抗原。
在另外一个实施方案中,优选具有来自鱼类病原体即特异性靶向鱼的病原体的抗原。更优选具有来自可以在养鱼场中培育的鱼的抗原。一般而言,可以使用发现与鱼类病原体相关的任何抗原。
病毒抗原
在一个优选实施方案中,至少一种抗原可以源于但不限于下述病毒科中的任何:腺病毒、沙粒病毒科、星状病毒科、布尼亚病毒科、嵌杯病毒科、冠状病毒科、黄病毒科、疱疹病毒科、正粘病毒科、副粘病毒科、细小rna病毒科、痘病毒科、呼肠病毒科、逆转录病毒科、弹状病毒科和披膜病毒科。
更具体而言,至少一种抗原或抗原序列可以衍生自下述病毒中的任何:甲型流感例如h1n1、h1n2、h3n2和h5n1(禽流感),乙型流感,丙型流感病毒,甲型肝炎病毒,乙型肝炎病毒,丙型肝炎病毒,丁型肝炎病毒、戊型肝炎病毒,轮状病毒属,诺瓦克病毒属中的任何病毒,肠腺病毒,细小病毒属,登革热病毒,猴痘,单股负链病毒目,狂犬病病毒属例如狂犬病病毒,拉戈斯蝙蝠病毒,莫科拉病毒,杜温哈格病毒,欧洲蝙蝠病毒1和2以及澳大利亚蝙蝠病毒,短暂热病毒属,水泡病毒属,水疱性口炎病毒(vsv),疱疹病毒例如单纯疱疹病毒1和2型,水泡带状疱疹,巨细胞病毒,eb病毒(ebv),人疱疹病毒(hhv),人疱疹病毒6和8型,人免疫缺陷病毒(hiv),乳头状瘤病毒,鼠类γ疱疹病毒,沙粒病毒例如阿根廷出血热病毒、玻利维亚出血热病毒、sabia伴随出血热病毒、委内瑞拉出血热病毒、拉沙热病毒,machupo病毒,淋巴细胞性脉络丛脑膜炎病毒(lcmv),布尼亚病毒科例如克里米亚-刚果出血热病毒,汉他病毒,引起伴肾病综合征的出血热病毒,裂谷热病毒,丝状病毒科(丝状病毒)包括埃博拉出血热和马尔堡出血热,黄病毒科包括科萨努尔森林病病毒,鄂木斯克出血热病毒,引起蜱传脑炎的病毒和副粘病毒例如亨德拉病毒和尼帕病毒,重型天花和轻型天花(天花),甲病毒例如委内瑞拉马脑炎病毒,东方马脑炎病毒,西方马脑炎病毒,sars-相关冠状病毒(sars-cov),西尼罗河病毒,引起任何脑炎的病毒。
在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽来自选自下述的病毒:hiv、丙型肝炎病毒、流感病毒、疱疹病毒、拉沙、埃博拉、天花、禽流感、丝状病毒、马尔堡和乳头状瘤病毒。
在本发明的一个更优选实施方案中,至少一种抗原蛋白质或肽选自下述和/或可以是下述中的任何的至少一个抗原片段:水疱性口炎病毒糖蛋白(vsv-gp);甲型流感ns-1(非结构蛋白质1)、m1(基质蛋白质1)、np(核蛋白)、nep、m2、m2e、ha、na、pa、pb1、pb2、pb1-f2;lcmvnp、lcmvgp;埃博拉gp、埃博拉np;hiv抗原tat、vif、rev、vpr、gag、pol、nef、env、vpu;siv抗原tat、vif、rev、vpr、gag、pol、nef、env;鼠类γ疱疹病毒m2、m3和orf73(例如mhv-68m2、m3和orf73);鸡卵白蛋白(ova);或辅助t细胞表位。将本文提及抗原中的任何的2种或更多种组合是在本发明的范围内的。
微生物抗原
本发明的一个实施方案包括来自微生物的至少一种抗原蛋白质或肽或抗原蛋白质或肽的片段。更具体而言,至少一种抗原可以衍生自来自非详尽列表的下述中的一种:炭疽(炭疽芽孢杆菌(bacillusanthracis)),结核分枝杆菌(mycobacteriumtuberculosis),沙门氏菌属(salmonella)(鸡沙门氏菌(salmonellagallinarum)、鸡白痢沙门氏菌(s.pullorum)、伤寒沙门氏菌(s.typhi)、肠炎沙门氏菌(s.enteridtidis)、副伤寒沙门氏菌(s.paratyphi)、都柏林沙门氏菌(s.dublin)、鼠伤寒沙门氏菌(s.typhimurium)),肉毒梭菌(clostridiumbotulinum),产气荚膜梭菌(clostridiumperfringens),白喉杆菌(corynebacteriumdiphtheriae),百日咳博德特氏菌(bordetellapertussis),弯曲杆菌属(campylobacter)例如空肠弯曲杆菌(campylobacterjejuni),新型隐球菌(crytococcusneoformans),鼠疫耶尔森氏菌(yersiniapestis),小肠结肠炎耶尔森氏菌(yersiniaenterocolitica),假结核耶尔森氏菌(yersiniapseudotuberculosis),单核细胞增多性李斯特菌(listeriamonocytogenes),钩端螺旋体属(leptospira)物种,嗜肺军团菌(legionellapneumophila),伯氏疏螺旋体(borreliaburgdorferi),链球菌属(streptococcus)物种例如肺炎链球菌(streptococcuspneumoniae),脑膜炎奈瑟球菌(neisseriameningitides),流感嗜血杆菌(haemophilusinfluenzae),弧菌属(vibrio)物种例如霍乱弧菌(vibriocholerae)o1、霍乱弧菌非o1、副溶血弧菌(v.parahaemolyticus)、副溶血弧菌、溶藻弧菌(v.alginolyticus)、弗尼斯弧菌(v.furnissii)、鲨鱼弧菌(v.carchariae)、霍氏弧菌(v.hollisae)、辛辛那提弧菌(v.cincinnatiensis)、梅氏弧菌(v.metschnikovii)、海鱼弧菌(v.damsela)、拟态弧菌(v.mimicus)、河流弧菌(v.fluvialis)、创伤弧菌(v.vulnificus),蜡状芽孢杆菌(bacilluscereus),嗜水气单胞菌(aeromonashydrophila)、豚鼠气单胞菌(aeromonascaviae)、温和气单胞菌(aeromonassobria)和维氏气单胞菌(aeromonasveronii),类志贺邻单胞菌(plesiomonasshigelloides),志贺氏菌属(shigella)物种例如宋氏志贺氏菌(shigellasonnei)、鲍氏志贺氏菌(s.boydii)、弗氏志贺氏菌(s.flexneri)和痢疾志贺氏菌(s.dysenteriae),致泻大肠埃希氏菌(enterovirulentescherichiacoli)eec(产肠毒素大肠埃希氏菌(escherichiacoli-enterotoxigenic)(etec)、肠致病性大肠埃希氏菌(escherichiacoli-enteropathogenic)(epec)、肠出血性大肠埃希氏菌o157∶h7(escherichiacolio157:h7enterohemorrhagic)(ehec)、肠侵袭性大肠埃希氏菌(escherichiacoli-enteroinvasive)(eiec)),葡萄球菌属(staphylococcus)物种例如金黄色葡萄球菌(s.aureus)且特别是万古霉素中间产物/抗性物种(visa/vrsa)或多药抗性物种(mrsa),志贺氏菌属物种例如弗氏志贺氏菌、宋氏志贺氏菌、痢疾志贺氏菌,微小隐孢子虫(cryptosporidiumparvum),布鲁氏菌属(brucella)物种例如流产布鲁氏菌(b.abortus)、马尔他布鲁氏菌(b.melitensis)、绵羊布鲁氏菌(b.ovis)、猪布鲁氏菌(b.suis)和犬布鲁氏菌(b.canis),鼻疽伯克霍尔德菌(burkholderiamallei)和类鼻疽伯克霍尔德菌(burkholderiapseudomallei),鹦鹉衣原体(chlamydiapsittaci),贝氏柯克斯体(coxiellaburnetii),土拉热弗朗西丝菌(francisellatularensis),普氏立克次体(rickettsiaprowazekii),夹膜组织胞浆菌(histoplasmacapsulatum),粗球孢子菌(coccidioidesimmitis)。
在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽来自选自下述的微生物:结核分枝杆菌、炭疽芽孢杆菌、葡萄球菌属物种和弧菌属物种。
寄生虫抗原
本发明的一个实施方案涉及核酸构建体,其中编码的至少一种抗原蛋白质或肽来自寄生虫。
本发明的另一个实施方案涉及核酸构建体,其包括来自上述病原体中的任何的至少2种抗原蛋白质或肽的组合。
优选地,抗原衍生自但不限于选自下述的寄生虫:疟原虫属(plasmodium)物种例如三日疟原虫(plasmodiummalariae)、卵形疟原虫(plasmodiumovale)、间日疟原虫(plasmodiumvivax)、恶性疟原虫(plasmodiumfalciparum),微小内蜒阿米巴(endolimaxnana),蓝氏贾第虫(giardialamblia),溶组织内阿米巴(entamoebahistolytica),微小隐孢子虫(cryptosporidiumparvum),人芽囊原虫(blastocystishominis),阴道毛滴虫(trichomonasvaginalis),刚地弓形虫(toxoplasmagondii),圆孢子球虫(cyclosporacayetanensis),鼠隐孢子虫(cryptosporidiummuris),卡氏肺囊虫(pneumocystiscarinii),杜氏利什曼原虫(leishmaniadonovani)、热带利什曼原虫(leishmaniatropica)、巴西利什曼原虫(leishmaniabraziliensis)、墨西哥利什曼原虫(leishmaniamexicana),棘阿米巴属(acanthamoeba)物种例如卡氏棘阿米巴(acanthamoebacastellanii)和卡伯特森氏棘阿米巴(a.culbertsoni),福氏耐格里原虫(naegleriafowleri),克鲁斯氏锥虫(trypanosomacruzi)、布氏罗得西亚锥虫(trypanosomabruceirhodesiense)、布氏冈比亚锥虫(trypanosomabruceigambiense),贝氏等孢子球虫(isosporabelli),结肠小袋纤毛虫(balantidiumcoli),蛔虫(roundworm)(似蚓蛔线虫(ascarislumbricoides)),钩虫(hookworm)(美洲钩虫(necatoramericanus)、十二指肠钩虫(ancylostomaduodenal)),蛲虫(pinworm)(蠕形住肠线虫(enterobiusvermicularis)),蛔虫(犬弓蛔虫(toxocaracanis)、猫弓蛔虫(toxocaracati)),犬心丝虫(heartworm)(犬恶丝虫(dirofilariaimmitis)),类圆线虫属(strongyloides)(粪类圆线虫(stronglyoidesstercoralis)),毛线虫属(trichinella)(旋毛线虫(trichinellaspiralis)),丝虫属(filaria)(班氏吴策线虫(wuchereriabancrofti)、马来丝虫(brugiamalayi)、旋盘尾丝虫(onchocercavolvulus)、罗阿丝虫(loaloa)、链尾曼森线虫(mansonellastreptocerca)、常现曼森线虫(mansonellaperstans)、奥氏曼森线虫(mansonellaozzardi))和异尖线虫(anisakine)幼虫(简单异尖线虫(anisakissimplex)(鲱鱼蠕虫)),拟地新线虫属(pseudoterranova)(海豹线虫(phocanema)、钻线虫(terranova))形态种(鳕鱼或海豹蠕虫),对盲囊线虫属(contracaecum)物种和宫脂线虫(hysterothylacium)(鲔蛔线虫属(thynnascaris)物种),鞭形鞭虫(trichuristrichiura),牛肉绦虫(beeftapeworm)(牛肉绦虫(taeniasaginata)),猪肉绦虫(porktapeworm)(猪带绦虫(taeniasolium)),鱼绦虫(fishtapeworm)(阔节裂头绦虫(diphyllobothriumlatum))和犬绦虫(dogtapeworm)(犬复孔绦虫(dipylidiumcaninum)),肠吸虫(intestinalfluke)(布氏姜片吸虫(fasciolopsisbuski)),血吸虫(bloodfluke)(日本血吸虫(schistosomajaponicum)、曼氏血吸虫(schistosomamansoni)、埃及血吸虫(schistosomahaematobium)),肝吸虫(liverfluke)(华支睾吸虫(clonorchissinensis)),东方肺吸虫(orientallungfluke)(卫氏并殖吸虫(paragonimuswestermani))和绵羊肝吸虫(sheepliverfluke)(肝片形吸虫(fasciolahepatica)),鲑隐孔吸虫(nanophyetussalmincola)和希氏侏形吸虫(n.schikhobalowi)。
在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽来自选自下述的寄生虫:疟原虫属物种、利什曼原虫属物种和锥虫属物种。
本发明的至少一种抗原可以是来自恶性疟原虫的var2csa。在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽或抗原蛋白质或肽的片段是var2csa。
家畜抗原
本发明的一个方面涉及衍生自感染家畜的疾病或因子的抗原和/或抗原序列,特别是商业上相关的动物例如猪、牛、马、绵羊、山羊、美洲驼、兔、貂、小鼠、大鼠、犬、猫、雪貂,家禽例如鸡、火鸡、雉鸡及其他,鱼例如鲑鱼、大麻哈鱼、鳕鱼及其他养殖物种。至少一种抗原或抗原序列可以衍生自其的疾病或其因子(agent)的例子包括但不限于:多物种疾病例如:炭疽、aujeszky氏病、蓝舌病,布鲁氏菌病例如:流产布鲁氏菌、马尔他布鲁氏菌或猪布鲁氏菌;克里米亚刚果出血热,棘球蚴病/包虫病,细小rna病毒科的病毒,引起口蹄疫的口蹄疫病毒属特别是7个免疫上不同的血清型中的任何:a、o、c、sat1、sat2、sat3、asia1,或心水病,日本脑炎,钩端螺旋体病,新大陆螺旋蝇蛆病(嗜人锥蝇(cochliomyiahominivorax)),旧大陆螺旋蝇蛆病(蛆症金蝇(chrysomyabezziana)),副结核,q型热,狂犬病,裂谷热,牛疫,旋毛虫病,土拉菌病,水疱性口腔炎或西尼罗河热;牛疾病例如:牛边虫病、牛巴贝虫病、牛生殖道弯曲杆菌病、牛海绵状脑病、牛结核病、牛病毒性腹泻、牛传染性胸膜肺炎、地方流行性牛白血病、出血性败血症、牛传染性鼻气管炎/传染性脓疱性外阴阴道炎、疙瘩皮肤病(lumpkyskindisease)、恶性卡他热、泰勒虫病、毛滴虫病或锥虫病(舌蝇传播的);绵羊和山羊疾病例如:山羊关节炎/脑炎、接触传染性无乳症、接触传染性山羊胸膜肺炎、地方流行性母羊流产(绵羊衣原体病)、梅迪-维斯纳病(maedi-visna)、内罗毕绵羊病、绵羊附睾炎(羊布鲁氏菌)、小反刍动物瘟疫、沙门氏菌病(羊流产沙门氏菌(s.abortusovis))、羊瘙痒症、绵羊痘和山羊痘;马疾病例如:非洲马瘟病、马接触传染性子宫炎、马交媾病、马脑脊髓炎(东方)、马脑脊髓炎(西方)、马传染性贫血、马流感、马焦虫病、马鼻肺炎、马病毒性动脉炎、马鼻疽、苏拉病(伊氏锥虫(trypanosomaevansi))或委内瑞拉马脑脊髓炎;猪疾病例如:非洲猪瘟、古典猪瘟、尼帕病毒性脑炎、猪囊虫病、猪繁殖与呼吸综合征、猪水疱病或传染性肠胃炎;禽疾病例如:禽衣原体病、禽传染性支气管炎、禽传染性喉气管炎、禽支原体病(鸡毒支原体(m.gallisepticum))、禽支原体病(滑液支原体(m.synoviae))、鸭病毒性肝炎、家禽霍乱、家禽伤寒、高致病性禽流感这是任何甲型或乙型流感病毒且特别是h5n1、传染性法氏囊病(gumboro病)、马立克氏病、新城疫、鸡白痢或火鸡鼻气管炎;兔类动物和啮齿类动物疾病例如:病毒性肠炎、粘液瘤病或兔出血性疾病;鱼疾病例如:地方流行性造血器官坏死症、传染性造血器官坏死症、鲤鱼春季病毒血症、病毒性出血性败血症、传染性胰脏坏死病、传染性鲑鱼贫血、流行性溃疡综合征、细菌性肾病(鲑鱼肾杆菌(renibacteriumsalmoninarum))、三代虫病(gyrodactylosis)(三代虫病(gyrodactylussalaris))、红海鲷虹彩病毒病;或其他疾病例如骆驼痘或利什曼病。
在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽来自aujeszky氏病、口蹄疫、水疱性口炎病毒、禽流感或新城疫。
本发明的另外一个优选实施方案涉及至少一种抗原蛋白质或肽或所述抗原蛋白质或肽的片段,其是与上述抗原中的任何具有至少85%同一性的抗原肽或蛋白质。氨基酸之间的同源性或同一性可以通过先前提及的blosum评分矩阵中的任何进行计算。
癌抗原
许多蛋白质/糖蛋白已得到鉴定且与特定类型的癌症联系;这些被称为癌症特异性多肽、肿瘤相关抗原或癌抗原。一般而言,可以使用发现与癌症肿瘤相关的任何抗原。其中可以发现癌症特异性抗原的一种方法是通过扣除分析(subtractionanalysis)例如各种微阵列分析,例如dna微阵列分析。此处,比较在健康和癌性患者之间、在癌性患者组之间、或在相同患者中的健康和癌性组织之间的基因表达模式(如由所述基因编码的rna或蛋白质水平中可见的)。从彼此中“扣除”具有大约相等的表达水平的基因,留下在健康和癌性组织之间不同的基因/基因产物。这种方法是本领域已知的,并且可以用作鉴定新型癌抗原的方法或产生对于给定患者或患者组特异的基因表达概况。因此鉴定的抗原,单一抗原和它们可以在其中发现的组合落入本发明的范围内。
优选地,本发明的至少一种抗原衍生自但不限于选自下述的癌症特异性多肽:mage-3,mage-1,gp100,gp75,trp-2,酪氨酸酶,mart-1,cea,ras,p53,b-连环蛋白,gp43,gage-1,bage-1,psa,muc-1、2、3,和hsp-70,trp-1,gp100/pmel17,β-hcg,ras突变型,p53突变型,hmw黑素瘤抗原,muc-18,hoj-1,细胞周期蛋白依赖性激酶4(cdk4),半胱天冬酶8,her-2/neu,bcr-abl酪氨酸激酶,癌胚抗原(cea),端粒酶,sv40大t,人乳头状瘤病毒hpv6、11、16、18、31和33型;hpv衍生的病毒癌基因e5、e6、e7和l1;存活素、bcl-xl、mcl-1和rho-c。
在本发明的一个优选实施方案中,至少一种抗原蛋白质或肽或抗原蛋白质或肽的片段来自选自下述的癌症特异性多肽:hpv衍生的病毒癌基因e5、e6、e7和l1;存活素、bcl-xl、mcl-1和rho-c。
与异常生理学应答相关的抗原
本发明的一个实施方案涉及核酸构建体,其中至少一种抗原蛋白质或肽或抗原蛋白质或肽的片段来自与异常生理学应答相关的多肽。此类异常生理学应答包括但不限于自身免疫疾病、过敏反应、癌症和先天性疾病。其例子的非详尽列表包括疾病例如类风湿性关节炎、全身性红斑狼疮、多发性硬化、银屑病和crohn氏病。
操作接头(operativelinker)
本发明的一个方面涉及核酸构建体,其中在恒定链和抗原蛋白质或肽或抗原蛋白质或肽的片段之间的操作连接是直接连接或由间隔区介导的连接。术语操作接头应理解为核苷酸或氨基酸残基序列,其以保证核酸或多肽的生物加工的方式使核酸构建体或嵌合多肽的2个部分结合在一起。如果操作接头是直接连接,那么各自编码开放读码框或开放读码框的片段的2个核酸彼此紧邻放置,并且从而也在框内。如果操作接头由间隔区介导,那么一系列核苷酸分别插入编码至少一种恒定链和至少一种抗原肽的核苷酸之间。具有间隔区是在本发明的范围内的,其中间隔区仅是以保留开放读码框的方式使本发明的至少2种元件连接的一系列核苷酸,或间隔区可以编码如本文下文定义的一种或多种信号或分离元件。
在一个特定实施方案中,本发明包括操作接头,其中操作接头是间隔区。
在一个实施方案中,本发明包括编码关于mhcii类分子的至少一个辅助表位的间隔区。辅助表位的例子是免疫原决定簇例如白喉毒素。特别地白喉毒素b片段cooh-末端区域已显示在小鼠中是免疫原性的。此外,hsp70部分或整体、以及其他免疫原性肽例如流感病毒、或具有锚定至hlai类和ii类分子的锚定基序的免疫原性序列或肽也可以在核酸构建体的间隔区中编码。
在另一个实施方案中,核酸构建体的间隔区编码至少一个蛋白酶切割位点。溶酶体蛋白酶例如组织蛋白酶、天冬氨酸蛋白酶和锌蛋白酶以及其他细胞内蛋白酶的切割位点落入本发明的范围内。
在另外一个实施方案中,核酸构建体的操作接头可以包括至少一个sirna或mirna编码序列。sirna(小干扰rna)和mirna(微小rna)以序列特异性方式靶向内源rna用于降解。因此可以选择在本发明的核酸构建体内编码的sirna或mirna,以靶向不希望有的基因产物。
在另一个实施方案中,操作接头包括至少一个多聚接头或多克隆位点(mcs)。多聚接头和mcs是包括限制酶识别序列的核苷酸系列,即其中限制酶以平端或交错方式切割dna的位点,促进dna的其他片段/序列亚克隆到核酸构建体内。多聚接头/mcs的识别序列一般是独特的,意味着它们在核酸构建体的其他地方未发现。操作接头可以另外包括一个或多个终止或末端密码子,其发出新生多肽从核糖体释放的信号。操作接头还可以包括至少一个ires(内部核糖体进入位点)和/或至少一个启动子。ires是允许在信使rna(mrna)序列中间起始翻译的核苷酸序列,作为蛋白质合成的更大过程的部分。启动子是使得基因能够被转录的dna序列。启动子由rna聚合酶识别,这随后起始转录,参见下文。启动子可以是单向或双向的。
在一个实施方案中,跨越在恒定链和至少一种抗原之间的区域的操作接头是这样的操作接头,其包括至少一个多聚接头和至少一个启动子以及还任选地至少一个ires。这些元件可以以任何次序放置。在一个进一步优选的实施方案中,恒定链的终止密码子已被缺失,并且多聚接头已以保存开放读码框的方式克隆到载体内,允许插入多聚接头内的至少一种抗原的框内阅读。这具有促进多种抗原在一个步骤或多个克隆步骤中亚克隆到相同构建体内,并且允许多种抗原在与恒定链相同的框内同时表达的优点。终止密码子可以在多聚接头后插入用于翻译终止。这个实施方案可以与上述辅助表位中的任何、mi/sirna或本文描述的其他元件中的任何进行组合。
本发明的一个实施方案涉及操作接头相关于至少一种恒定链和至少一种抗原蛋白质或肽或所述蛋白质或肽的片段的放置,其中至少一种抗原肽编码序列放置在:恒定链序列内、恒定链序列的前端、恒定链序列的末端部分。这以确保构建体的开放读码框的可读性的方式完成,从而使得至少一个操作接头在抗原肽之前、周围或之后。
本发明的另一个实施方案进一步涉及操作接头相关于至少一种恒定链和至少一种抗原蛋白质或肽或所述蛋白质或肽的片段的放置,其中至少一种抗原肽编码序列优选放置在恒定链的末端部分,并且操作接头插入两者之间;末端部分是恒定链或其片段的第一个或最后一个残基。
在另一个实施方案中,核酸构建体不包括操作接头;相反,至少一种抗原肽编码序列与恒定链直接栓系(tethered)。至少一种抗原肽编码序列可以放置在:恒定链序列内、恒定链序列的前端、恒定链序列的末端部分。这以确保构建体的开放读码框的可读性的方式完成。
存在关于包括或排除操作接头的2种可能性的优点;在一个实施方案中,排除接头可以减少引发针对所述接头的免疫应答而不是引发针对抗原肽的免疫的可能性。
组合
核酸构建体编码多个元件是在本发明的范围内的。元件是至少一种恒定链或其变体和至少一种抗原蛋白质或肽或所述蛋白质或肽的片段。因此具有多个恒定链或其变体落入本发明的范围内,这些各自彼此可操作地连接且与多个抗原蛋白质或肽或抗原蛋白质或肽的片段可操作地连接。核酸构建体的元件因此必须彼此是可操作地连接的。各自与一种抗原蛋白质或肽或所述蛋白质或肽的片段可操作地连接的几个系列的恒定链或其变体(这些系列各自彼此可操作地连接)包含在本发明内。
本发明的优点和非常重要的方面涉及下述事实:可以起始任何类型的免疫应答例如t细胞介导和抗体介导的应答,二者可以用已知是弱抗原的表位、未知抗原性质的多肽和同时多个表位/抗原来起始。
因此,也在本发明的范围内的是一个优选实施方案是核酸构建体,所述核酸构建体编码与多个抗原蛋白质或肽或蛋白质或肽的片段可操作地连接的至少一种恒定链或其变体,例如2、3、4、5、6、8、10、12种或更多种抗原蛋白质或肽或蛋白质或肽的片段。
核酸构建体可以包括另外元件。这些包括但不限于:内部核糖体进入位点(ires);编码涉及抗原呈递的蛋白质的基因,所述蛋白质例如lamp、钙网织蛋白、hsp33、hsp60、hsp70、hsp90、hsp100、shsp(小热休克蛋白)和热休克结合蛋白例如77-残基dnaj-同源hsp73-结合结构域;编码涉及细胞内散布(spreading)的蛋白质的基因,所述蛋白质例如vp22、hivtat、cx43或其他连接蛋白和细胞内缝隙连接组成成分;编码天然杀伤细胞(nk细胞)活化分子例如h60和细胞因子、鸡卵白蛋白或任何t辅助细胞表位的基因。
在本发明的一个优选实施方案中,核酸构建体包括编码涉及抗原呈递的蛋白质的至少一种基因,所述蛋白质例如lamp、limp、钙网织蛋白hsp33、hsp60、hsp70、hsp90、hsp100、shsp(小热休克蛋白)或77-残基dnaj-同源hsp73-结合结构域。
在本发明的另外一个优选实施方案中,核酸构建体包括编码涉及细胞内散布的蛋白质的至少一种基因,所述蛋白质例如vp22、cx43、hivtat、其他连接蛋白和细胞内缝隙连接组成成分。
启动子
术语启动子将在此处用于指一组转录控制模块,其在rna聚合酶ii的起始位点周围成簇。关于启动子被如何组织的许多想法衍生自几种病毒启动子的分析,包括关于hsv胸苷激酶(tk)和sv40早期转录单位的启动子。由更近期工作加强的这些研究已显示启动子由不连续功能模块组成,各自由约7-20bpdna组成,并且包含转录激活蛋白质的一个或多个识别位点。每个启动子中的至少一个模块作用于rna合成的起始位点的定位。这点的最佳已知例子是tata盒,但在缺乏tata盒的某些启动子中,例如哺乳动物末端脱氧核苷酰转移酶基因的启动子和sv40晚期基因的启动子,重叠自身起始位点的不连续元件帮助固定起始位置。
另外的启动子元件调节转录起始频率。一般地,这些位于起始位点上游30-110bp的区域中,尽管许多启动子近期已显示也包含起始位点下游的功能元件。元件之间的间距是弹性的,从而使得当元件倒转或相对于彼此移动时,启动子功能被保存。在tk启动子中,在活性开始下降前元件之间的间距可以增至相隔50bp。依赖于启动子,看起来个别元件可以共同或独立地作用,以激活转录。可以引导由核酸构建体编码的序列的转录起始的任何启动子可以在本发明中使用。
本发明的一个方面包括核酸构建体,其中使得构建体能够表达的启动子在至少一种可操作地连接的恒定链和抗原蛋白质或肽编码序列前。
进一步方面的是启动子选自组成型启动子、诱导型启动子、生物特异性启动子、组织特异性启动子、细胞类型特异性启动子和炎症特异性启动子。
启动子的例子包括但不限于:组成型启动子例如:猴病毒40(sv40)早期启动子、小鼠乳腺肿瘤病毒启动子、人免疫缺陷病毒长末端重复启动子、莫洛尼病毒启动子、禽白血病病毒启动子、eb病毒即早期启动子、劳斯肉瘤病毒(rsv)启动子、人肌动蛋白启动子、人肌球蛋白启动子、人血红蛋白启动子、巨细胞病毒(cmv)启动子和人肌肉肌酸启动子,诱导型启动子例如:金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子(tet开或tet关),组织特异性启动子例如:her-2启动子和psa相关启动子和双向启动子,其能够起始从启动子任一方向的转录。
使用诱导型启动子的优点包括提供可以随意激活的“休眠”核酸构建体的选项。如果免疫应答的引发优选仅在体内局部与全身性(例如在涉及癌症的情况下)比较诱导,或免疫应答的引发在施用时对于接受者的健康是有害的,这可以是有用的。
在一个优选实施方案中,核酸构建体包括选自下述的启动子:cmv启动子、sv40启动子和rsv启动子。
递送媒介物
本发明的一个方面包括如包括在递送媒介物中的在上文任何中描述的核酸构建体。递送媒介物是由此核苷酸序列或多肽或两者可以从至少一种介质转运到另一种介质的实体。递送媒介物一般用于表达在核酸构建体内编码的序列和/或用于构建体或其中编码的多肽的细胞内递送。
核酸构建体可以在体内或先体外后体内转移到细胞内;后者通过从患者中取出靶组织(即肝细胞或白血细胞),在体外转移构建体,并且随后将转导细胞重新植入患者内来进行。
非病毒递送的方法包括物理(无载体递送)和化学方法(基于合成载体的递送)。
物理方法包括针注射、基因枪、射流注射、电穿孔、超声和水动力递送,采用渗透细胞膜且促进细胞内基因转移的物理力。所述物理力可以是电或机械的。
化学方法使用合成或天然存在的化合物作为载体,以将转基因递送到细胞内。用于非病毒基因递送的最频繁研究的策略是通过使用阳离子脂质或阳离子聚合物将dna配制成浓缩颗粒。含dna的颗粒随后经由以细胞内囊泡形式的胞吞作用、巨胞饮作用或吞噬作用被细胞吸收,dna的小部分从细胞内囊泡中释放到细胞质内并移动到核内,在其中发生转基因表达。
在本发明的范围内的是递送媒介物是选自下述的媒介物:基于rna的媒介物、基于dna的媒介物/载体、基于脂质的媒介物、基于聚合物的媒介物和病毒衍生的dna或rna媒介物。
本发明的一个优选实施方案涉及通过机械或电技术递送核酸构建体。
•物理
○注射:一个优选实施方案涉及在溶液中的核酸构建体的简单注射。注射通常用递送至细胞外空间的核酸构建体在骨骼肌中肌内(im)、皮内(id)或对于肝进行。通过注射的递送可以通过下述得到辅助:电穿孔;使用盐水或蔗糖的高渗溶液;用肌毒素例如布比卡因暂时损害肌纤维;或加入能够增强dna被靶细胞内在化效率的物质,例如转铁蛋白、与水不混溶的溶剂、非离子聚合物、表面活性剂或核酸酶抑制剂。
○基因枪:基因枪或biolistic粒子递送系统是用于将遗传信息注射细胞的装置。有效负荷(payload)是用例如质粒dna包被的重金属例如金、银或钨的元素粒子。这种技术通常简称为biolistics。压缩氦可以用作推进剂。特别地在金颗粒例如胶体金颗粒上的核酸构建体涂层是一个有利的实施方案。
○气动(射流)注射:不需要颗粒,水性溶液。
○电穿孔或电渗透作用是由外部应用的电场引起的细胞质膜的导电性和渗透性的显著增加。
○超声促进的基因转移:超声产生膜孔,并且促进通过dna被动扩散跨越膜孔的细胞内基因转移。效率可以通过使用造影剂或使得膜更具有流动性的条件得到增强。
○水动力基因递送:水动力基因递送是将裸露质粒dna引入在高度充满(perfused)的内脏(例如肝)的细胞内的简单方法。在啮齿类动物中,大量dna溶液的快速尾静脉注射引起注射溶液在下腔静脉的暂时溢流,这超过心输出量。因此,注射诱导dna溶液逆流到肝内的流动、肝内压力的快速升高、肝扩大和肝窗的可逆破裂。
•化学
○阳离子脂质介导的基因递送:尽管某些阳离子脂质单独显示出良好的转染活性,但它们通常用不荷电磷脂或胆固醇作为辅助脂质进行配制,以形成脂质体。在与阳离子脂质体混合后,使质粒dna浓缩成称为lipoplex的准稳定颗粒。lipoplex中的dna被充分保护免于核酸酶降解。lipoplex能够触发细胞摄取,并且促进在到达破坏性溶酶体区室前使dna从细胞内囊泡中释放。
○阳离子聚合物介导的基因递送:大多数阳离子聚合物都具有使dna浓缩成为小颗粒并且通过与细胞表面上阴离子位点的电荷-电荷相互作用促进经由胞吞作用的细胞摄取的功能。阳离子聚合物dna载体包括聚乙烯亚胺(pei)、聚乙二胺和聚丙胺树状聚体(dendrimers)、聚烯丙胺、阳离子右旋糖酐、壳聚糖、阳离子蛋白质(聚赖氨酸、鱼精蛋白和组蛋白)和阳离子肽。
○脂质-聚合物杂交系统:用聚阳离子预浓缩dna,随后用阳离子脂质体、阴离子脂质体或两亲性聚合物连同或不连同辅助脂质包被。
化学递送媒介物的例子包括但不限于:生物可降解聚合物微球体、基于脂质的制剂例如脂质体载体、阳离子荷电分子例如脂质体、钙盐或树状聚体、脂多糖、多肽和多糖。
可选的物理递送方法可以包括裸露核酸构建体在粘膜表面例如鼻和肺粘膜上的气溶胶滴注;核酸构建体向眼和粘膜组织的局部施用;和水合作用例如通过其盐水溶液受力进入眼的角膜基质内的基质水合。
本发明的另一个实施方案包括载体,其在本文中指示病毒载体(即非病毒),作为递送媒介物。根据本发明的病毒载体由修饰的病毒基因组制成,即形成病毒基因组的实际dna或rna,并且以裸露形式引入。因此,在由病毒或非病毒蛋白质制成的病毒基因组周围的任何包被结构不是根据本发明的病毒载体的部分。
病毒载体由其衍生的病毒选自下述非详尽组:腺病毒、逆转录病毒、慢病毒、腺伴随病毒、疱疹病毒、痘苗病毒、泡沫病毒、巨细胞病毒、塞姆利基森林病毒、痘病毒、rna病毒载体和dna病毒载体。此类病毒载体是本领域众所周知的。
重组细胞
本发明的一个方面涉及包括如在上文中的任何中定义的核酸构建体的细胞。此类重组细胞可以用作体外研究的工具,用作核酸构建体的递送媒介物或用作基因疗法方案的一部分。根据本发明的核酸构建体可以通过本领域众所周知的技术引入细胞内,并且所述技术包括dna显微注射到细胞的核内、转染、电穿孔、脂转染/脂质体融合和粒子轰击。合适的细胞包括自体和非自体细胞,并且可以包括异种细胞。
在一个优选实施方案中,本发明的核酸构建体包括在抗原呈递细胞(apc)内。在其表面上呈递与mhc分子结合的抗原的任何细胞被视为抗原呈递细胞。此类细胞包括但不限于巨噬细胞、树突细胞、b细胞、杂合apc和养育(foster)apc。制备杂合apc的方法是本领域众所周知的。
在一个更优选的实施方案中,apc是专职抗原呈递细胞,并且最优选apc是mhc-i和/或mhc-ii表达细胞。
根据上文中的任何的apc可以是得自患者的干细胞。在引入本发明的核酸构建体后,干细胞可以以治疗具有医学状况的患者的意图重新引入患者内。优选地,从患者中分离的细胞是能够分化成抗原呈递细胞的干细胞。
在本发明的范围内另外包括的是包括本发明的核酸构建体的抗原呈递细胞不表达任何共刺激信号,并且抗原蛋白质或肽或所述蛋白质或肽的抗原片段是自身抗原。
嵌合蛋白质和抗体
本发明的一个目的是由如本文上文描述的核酸构建体编码的嵌合蛋白质,包括至少一种可操作地连接的恒定链或其变体和至少一种抗原蛋白质或肽或所述抗原蛋白质或肽的片段。嵌合蛋白质应理解为由核苷酸序列编码的遗传改造蛋白质,所述核苷酸序列通过将2种或更多种完全或部分基因或一系列(非)随机核酸剪接在一起制备。
本发明的一个方面涉及可以识别如本文上文定义的嵌合蛋白质的抗体。术语抗体应理解为免疫球蛋白分子和免疫球蛋白分子的活性部分。抗体是例如完整免疫球蛋白分子或其保留免疫学活性的片段。此类抗体可以用于动物的被动免疫接种,或用于在用于检测抗体与之结合的蛋白质的测定中。
核酸构建体组合物
本发明的一个方面涉及包括核酸序列的组合物,所述核酸序列编码与至少一种抗原蛋白质或肽或所述抗原蛋白质或肽的片段可操作地连接的至少一种恒定链或其变体。组合物因此可以包括如上文中的任何中定义的核酸构建体。组合物可以另外用作药物。
根据本发明的核酸构建体组合物可以根据已知方法进行配制,例如通过一种或多种药学上可接受的载体也称为赋形剂或稳定剂与活性剂的混合。这些赋形剂对于施用于任何个体/动物,优选脊椎动物且更优选人可以是可接受的,因为它们在采用的剂量和浓度下对暴露于其的细胞或个体是无毒的。通常生理学上可接受的载体是ph缓冲水溶液。此类赋形剂、载体和配制方法的例子可以例如在remington'spharmaceuticalsciences(maackpublishingco,easton,pa)中找到。生理学上可接受的载体的例子包括但不限于:缓冲液例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质例如血清白蛋白、明胶或免疫球蛋白;亲水聚合物例如聚乙烯吡咯烷酮;氨基酸例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物包括葡萄糖、甘露糖或糊精;螯合剂例如edta;糖醇例如甘露糖醇或山梨糖醇;成盐抗衡离子例如钠;和/或非离子表面活性剂例如tweentm、聚乙二醇(peg)和pluronicstm。
为了配制适合于有效施用的药学上可接受的组合物,此类组合物根据本发明将包含有效量的核酸构建体,所述核酸构建体被包括在递送媒介物内或嵌合蛋白质在如本文描述的核酸构建体内编码。通常,如果用如由本发明的核酸构建体编码的蛋白质或多肽引发免疫应答,那么通过使蛋白质或肽与之偶联且因此帮助诱导免疫应答,载体将用作支架。载体蛋白质可以是任何常规载体,包括适合于呈递免疫原决定簇的任何蛋白质。合适载体一般是大的、缓慢代谢的大分子,例如蛋白质、多糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物、脂质聚集体(例如油小滴或脂质体)和非活性病毒颗粒。此类载体是本领域普通技术人员众所周知的。此外,这些载体可以充当免疫刺激剂(“佐剂”)。动物的免疫接种可以用佐剂和/或药物载体执行。常规载体蛋白质包括但不限于钥孔血蓝蛋白,血清蛋白质例如转铁蛋白、牛血清白蛋白或人血清白蛋白,卵白蛋白,免疫球蛋白或激素例如胰岛素。载体可以连同佐剂或独立于其存在。
在下文中,核酸构建体组合物或组合物意指包含对于预防和治疗用途包括刺激患者中的免疫应答有用的组合物。进一步考虑本发明的组合物不包括任何全身或局部毒性反应或任何其他副作用。
在一个优选实施方案中,如本文使用的,短语‘组合物’指用于引发免疫应答的组合物。
在一个优选实施方案中,核酸构建体是包装的。用于核酸构建体的包装装置(means)包括选自但不限于下述的装置:基于rna的或基于dna载体、基于脂质的载体、病毒表达载体、病毒递送载体、胶体金颗粒和生物可降解聚合物微球体的包被。先前提及的递送装置中的任何因此可以用于在组合物中使用的包装目的。
在一个实施方案中,核酸构建体的包装方法是选自但不限于下述的病毒表达载体:腺病毒、逆转录病毒、慢病毒、腺伴随病毒、疱疹病毒、痘苗病毒和dna病毒载体。病毒载体可以是复制缺陷型或条件复制缺陷型病毒载体。
本发明的一个方面涉及包括至少2种载体的组合物。这包含如所述的任何1种或2种不同核酸构建体可以包装到至少2种载体内,这些载体是如上文中的任何中所述的类型。本发明另外涉及包括3、4、5或6种载体的组合物。再次,这些载体可以彼此不同或相同,并且可以携带如本文上文描述的等同或不同核酸构建体。本发明的一个进一步方面涉及组合物,其包括如由本文描述的核酸构建体中的任何编码的至少一种嵌合蛋白质。当嵌合蛋白质或多肽待用作免疫原时,它可以通过在重组细胞中表达任何一种或多种上述核酸构建体产生,或它可以通过本领域已知的方法通过化学合成制备。如上文中所述,此类嵌合蛋白质和/或肽可以与载体偶联,以增加对于蛋白质/肽的免疫应答,并且可以连同或不连同佐剂和/或赋形剂一起施用。
在一个实施方案中,本发明涉及如本文描述的核酸构建体用于产生组合物的用途。
增强免疫应答:常规佐剂
佐剂可以包括在组合物中以增强特异性免疫应答。因此,特别重要的是鉴定这样的佐剂,当与一种或多种抗原/核酸构建体和/或递送媒介物(其中任何也可以被称为免疫原决定簇)组合时,其导致能够诱导强特异性免疫应答的组合物。免疫原决定簇还可以在免疫接种前与2种或更多种不同佐剂混合。组合物在呈现的正文中还被称为免疫原性组合物。
大量佐剂已得到描述并且用于在实验室动物例如小鼠、大鼠和兔中生成抗体。在此类设置中,副作用的耐受相当高,因为主要目标是获得强抗体应答。对于用途和对于批准用于在药物中使用,且特别对于在人中使用,要求组合物的组分包括佐剂是充分表征的。进一步要求组合物具有任何不良反应的最低限度危险,例如肉芽肿、脓肿或发热。
本发明的一个实施方案涉及包括佐剂的组合物。在一个优选实施方案中,组合物适合于施用于哺乳动物例如人类。因此,优选佐剂适合于施用于哺乳动物,并且最优选地适合于施用于人类。
在另一个优选实施方案中,组合物适合于施用于鸟或鱼,并且最优选鸡(家鸡)。因此,优选佐剂适合于施用于鸟或鱼。
佐剂的选择可以进一步通过其刺激希望的免疫应答类型b细胞和/或t细胞激活的能力进行选择,并且组合物可以配制为最优化对相关淋巴组织的分布和呈递。
关于本发明的佐剂可以根据其起源进行分组,其为矿物质、细菌、植物、合成的或宿主产物。在这个分类法下的第一个组是矿物质佐剂,例如铝化合物。与铝盐沉淀的抗原或与预形成的铝盐或化合物混合或吸附的抗原已广泛用于增强动物和人中的免疫应答。铝颗粒已在免疫接种后7天在兔的局部淋巴结中得到证实,并且可能另一种显著功能是将抗原导向在结自身中的含t细胞区域。佐剂效力已显示与引流淋巴结的暗示相关。虽然许多研究已证实与铝盐一起施用的抗原导致增加的体液免疫,细胞介导的免疫看起来仅是轻微增加的,如通过迟发型超敏反应测量的。氢氧化铝已描述为激活补体途径。这种机制可以在局部炎症应答以及免疫球蛋白生产和b细胞记忆中起作用。此外,氢氧化铝可以保护抗原不受快速分解代谢。主要由于其极佳的安全记录,铝化合物是目前在人中使用的唯一佐剂。
另一大组佐剂是细菌起源的那些。具有细菌起源的佐剂可以进行纯化且合成(例如胞壁酰二肽、脂质a),并且宿主介质已得到克隆(白介素1和2)。最近十年已在细菌起源活性组分的几种佐剂的化学纯化中获得显著进展:百日咳博德特氏菌、结核分枝杆菌、脂多糖、弗氏完全佐剂(fca)和弗氏不完全佐剂(difcolaboratories,detroit,mich.)和merckadjuvant65(merck和company,inc.,rahway,n.j.)。另外,依照本发明的合适佐剂是例如titermaxclassical佐剂(sigma-aldrich)、iscoms、quila、alun,参见us58767和5,554,372,脂质a衍生物、霍乱毒素衍生物、hsp衍生物、lps衍生物、合成肽基质、gmdp及其他以及与免疫刺激剂组合(us5,876,735)。百日咳博德特氏菌在本发明的背景中作为佐剂是有利的,由于其通过对t淋巴细胞群体的作用调节细胞介导的免疫的能力。对于脂多糖和弗氏完全佐剂,佐剂活性部分已得到鉴定且合成,这允许研究结构-功能关系。这些还考虑用于包括在根据本发明的免疫原性组合物中。
已发现脂多糖(lps)及其各种衍生物包括脂质a与脂质体或其他脂质乳剂组合是有力佐剂。仍未确定是否可以产生用于在人中的一般使用的具有足够低毒性的衍生物。弗氏完全佐剂是大多数实验研究中的标准。
矿物油可以加入免疫原性组合物中,以便保护抗原不受快速分解代谢。
许多其他类型的材料可以用作根据本发明的免疫原性组合物中的佐剂。这些包括植物产物例如皂苷、动物产物例如壳多糖和众多合成化学制品。
根据本发明的佐剂还可以通过其提议的作用机制进行分类。这类分类法必定是略微任意的,因为大多数佐剂看起来通过超过一种机制起作用。佐剂可以通过抗原定位和递送,或通过对构成免疫系统的细胞例如巨噬细胞和淋巴细胞的直接作用起作用。根据本发明的佐剂通过其增强免疫应答的另一种机制是通过抗原沉积物的产生。这看起来促成铝化合物、油乳剂、脂质体和合成聚合物的佐剂活性。脂多糖和胞壁酰二肽的佐剂活性看起来主要通过巨噬细胞的激活介导,而百日咳博德特氏菌影响巨噬细胞和淋巴细胞。当掺入根据本发明的免疫原性组合物内可以是有用的佐剂的进一步例子在us5,554,372中描述。
在根据本发明的组合物中有用的佐剂因此可以是矿物盐,例如氢氧化铝和磷酸铝或钙凝胶、油乳剂和基于表面活性剂的制剂例如mf59(微流体化去污剂稳定的水包油乳剂)、qs21(纯化皂苷)、as02(sbas2、水包油乳剂+单磷酰脂质a(mpl)+qs21)、montanideisa51和isa-720(稳定的油包水乳剂)、佐剂65(包含花生油、二缩甘露醇一油酸和单硬脂酸铝)、ribiimmunochemresearchinc.,hamilton,utah)、微粒佐剂例如病毒体(掺入流感血凝素的单层脂质体小泡(原文为cehicles,疑为vehicles))、as04(含mpl的al盐)、iscoms(皂苷和脂质(例如胆固醇)的结构复合物、聚丙交酯共乙交酯(plg)、微生物衍生物(天然和合成)例如单磷酰脂质a(mpl)、detox(mpl+草分支杆菌(m.phlei)细胞壁支架)、agp(rc-529(合成乙酰化单糖))、dc_chol(能够自组构成脂质体的类脂免疫刺激剂)、om-174(脂质a衍生物)、cpg基序(包含免疫刺激cpg基序的合成寡核苷酸)、修饰细菌毒素、具有无毒佐剂效应的lt和ct、内源人免疫调节剂例如hgm-csf或hil-12或immudaptin(c3d串联排列)、惰性媒介物例如金颗粒。
佐剂的另外例子包括:免疫刺激油乳剂(例如,油包水、水包油、水包油包水例如弗氏不完全佐剂例如montainde®,specol,矿物盐例如al(oh)3、alpo4,微生物产物,皂苷例如quala,合成产物以及佐剂佐剂,和免疫刺激复合物(iscom)和细胞因子,热灭活细菌/组分,纳米珠,lps,lta。其他常用佐剂的列表公开于wo2003/089471中的第6-8页上,所述列表在此引入作为参考。
根据本发明的免疫原性组合物还可以包含稀释剂例如缓冲剂,抗氧化剂例如抗坏血酸,低分子量(小于约10个残基)多肽,蛋白质,氨基酸,碳水化合物包括葡萄糖、甘露糖或糊精,螯合剂例如edta,谷胱甘肽及其他稳定剂和赋形剂。中性缓冲盐水或与非特异性血清白蛋白混合的盐水是示例性合适稀释剂。
佐剂一般以根据制造商的说明书的量包括在免疫原性组合物中。
增强免疫应答:非常规佐剂
细胞因子调节
对于有效的疫苗,它必须诱导对于给定病原体的合适免疫应答。这可以通过修饰表达的抗原形式(即细胞内与分泌的比较)、递送方法和途径和递送的dna剂量来完成。然而,它还可以通过共施用编码免疫调节分子例如细胞因子、淋巴因子或共刺激分子的质粒dna(pdna)来完成。这些“遗传佐剂”可以连同如本文概述的‘常规佐剂’或‘其他免疫刺激佐剂’中的任何以许多方式施用:
•作为2种分开质粒的混合物,一种编码免疫原和另一种编码细胞因子;
•作为通过间隔区分开的单一的双或多顺反子载体;或
•作为质粒编码的嵌合体或融合蛋白;或
•以其天然形式,即蛋白质或核苷酸。
一般而言,促炎因子(例如各种白介素、肿瘤坏死因子和gm-csf)加上th2诱导细胞因子的共施用增加抗体应答,而促炎因子和th1诱导细胞因子降低体液应答且增加细胞毒性应答(这例如在病毒保护中更重要)。有时还使用共刺激分子如b7-1、b7-2和cd40l。
这个概念已成功地应用于编码il-10的pdna的局部施用。编码b7-1(在apc上的配体)的质粒在抗肿瘤模型中已成功地增强免疫应答,并且使编码gm-csf和约氏疟原虫(p.yoelii)的环子孢子蛋白(pycsp)的质粒混合已增强针对后续攻击的保护(而单独的编码pycsp的质粒则不是)。gm-csf可以促使树突细胞更有效地呈递抗原,且增强il-2产生和th细胞激活,从而驱动增加的免疫应答。这可以通过首先用ppycsp和pgm-csf混合物引发,且以后用表达pycsp的重组痘病毒加强得到进一步增强。然而,与通过单独的ppcmsp1-hbs递送获得的保护比较,编码gm-csf(或ifn-γ、或il-2)和夏氏疟原虫(p.chabaudi)裂殖子表面蛋白质1(c末端)-乙型肝炎病毒表面蛋白质(pcmsp1-hbs)的融合蛋白的质粒的共注射实际上消除了针对攻击的保护。
其他免疫刺激佐剂
在一个实施方案中,下述中的任何可以用作关于根据本发明的核酸构建体或组合物的免疫刺激佐剂:
lps(脂多糖),poly-ic(多聚肌醇胞嘧啶)或任何其他佐剂,其类似于双链rna、ll37、rig-1解螺旋酶、il-12、il-18、ccl-1、ccl-5、ccl-19、ccl-21、gm-csf、cx3cl、cd86、pd-1、分泌pd-1、il10-r、分泌il10-r、il21、icosl、41bbl、cd40l,以及刺激免疫应答的其他任何蛋白质或核酸序列。
在一个实施方案中,使免疫刺激佐剂与腺病毒纤维蛋白质融合。例如,cx3cl可以与腺病毒纤维蛋白质融合。
免疫刺激cpg基序
质粒dna自身看起来对免疫系统具有佐剂作用。质粒dna已衍生自这样的细菌,发现所述细菌触发先天性免疫防御机制,激活树突细胞和产生th1细胞因子。这是由于识别具有免疫刺激的的特定cpg二核苷酸序列。cpg刺激(cpg-s)序列在细菌衍生的dna中的出现频率为真核生物中的20倍。这是因为真核生物显示“cpg抑制”-即cpg二核苷酸对以比预期的低得多的频率出现。另外,cpg-s序列是低甲基化的。这在细菌dna中频繁出现,而在真核生物中出现的cpg基序在胞嘧啶核苷酸上都是甲基化的。相比之下,抑制免疫应答激活的核苷酸序列(命名为cpg中和,或cpg-n)在真核生物基因组中是过度出现的。最佳免疫刺激序列已发现是未甲基化的cpg二核苷酸,其侧面为2个5'嘌呤和2个3'嘧啶。此外,在这个免疫刺激六聚体外的侧面区域任选是富含鸟嘌呤的,以确保结合且摄取到靶细胞内。
先天性免疫系统与适应性免疫系统协同作用,以设定针对dna编码蛋白质的应答。cpg-s序列诱导多克隆b细胞激活以及细胞因子表达和分泌的上调。受刺激的巨噬细胞分泌il-12、il-18、tnf-α、ifn-α、ifn-β和ifn-γ,受刺激的b细胞分泌il-6和一些il-12。在dna疫苗的质粒骨架中cpg-s和cpg-n序列的操纵可以确保对于编码抗原的免疫应答的成功,并且驱动针对th1表型的免疫应答。如果病原体要求th应答用于保护,那么这是有用的。cpg-s序列也已用作外部佐剂,用于具有可变成功率的dna和重组蛋白质疫苗接种。具有低甲基化的cpg基序的其他生物也已证实多克隆b细胞扩增的刺激。然而,在这背后的机制可以比简单甲基化更复杂–未发现低甲基化的鼠类dna设定免疫应答。
dna的配制
dna免疫接种的效率可以通过针对降解稳定dna且增加dna递送到抗原呈递细胞内的效率得到改善。这可以通过用dna包被生物可降解的阳离子微粒(例如用十六烷基三甲基溴化铵配制的聚(丙交酯共乙交酯))来达到。此类dna包被微粒在产生ctl方面可以与重组痘苗病毒一样有效,特别是当与铝混合时。直径300nm的颗粒看起来对于通过抗原呈递细胞摄取是最有效的。
施用
根据本发明的核酸构建体和组合物可以以治疗有效量施用于个体。有效量可以根据各种因素例如个体的状况、重量、性别和年龄而改变。其他因素包括施用方式。
在一个实施方案中,根据本发明的核酸构建体可以以dna、rna、lna、pna、ina、tina、hna、ana、cna、cena、gna、tna、缺口-聚体、混合-聚体(mix-mers)、吗啉代类物质或其任何组合的形式递送给受试者。
在一个实施方案中,根据本发明的核酸构建体可以以dna的形式递送给受试者。
在另一个实施方案中,根据本发明的核酸构建体可以以rna的形式递送给受试者。因此,核酸构建体可以在施用前转录成rna。
在另外一个实施方案中,根据本发明的核酸构建体可以以蛋白质的形式递送给受试者。因此,核酸构建体可以在施用前翻译成蛋白质。
在其中根据本发明的核酸构建体以蛋白质的形式递送给受试者的实施方案中,蛋白质可以已进行修饰,以增加稳定作用和/或最优化进入细胞内的递送。蛋白质可以具有增加的稳定性,原因在于二硫键的存在(例如us5,102,985用过氧化氢处理以还原形式的蛋白质溶液,以90-96%得率生成具有分子内二硫桥的蛋白质)、极性残基中的增加、表面电荷最优化、表面盐桥、封装(例如用中孔硅酸盐),或蛋白质可以与热休克蛋白(例如hsp-60、hsp-70、hsp-90、hsp-20、hsp-27、hsp-84及其他)、hivtat易位结构域、腺病毒纤维蛋白质或任何其他蛋白质或结构域连接。
药物或兽医学组合物可以通过各种途径提供给个体,例如皮下(sc或s.c.)、局部、经口和肌内(im或i.m.)。药物组合物的施用经口或肠胃外实现。肠胃外递送的方法包括局部、动脉内(直接对于组织)、肌内、大脑内(ic或i.c.)、皮下、髓内、鞘内、心室内、静脉内(iv或i.v.)、腹膜内或鼻内施用。本发明还具有提供用于在用组合物引发免疫应答的方法中使用的合适局部、经口、全身和肠胃外药物制剂的目的。
例如,组合物可以在此类经口剂型中施用,例如片剂、胶囊(各自包括限时释放和持续释放制剂)、丸剂、粉剂、颗粒剂、酏剂、酊剂、溶液、悬浮液、糖浆剂和乳状剂,或通过注射。同样地,它们还可以以静脉内(弹丸和输注)、腹膜内、皮下、局部连同或不连同阻塞、或肌内形式施用,全部使用药学领域普通技术人员众所周知的形式。可以采用包括本文所述化合物中的任何的有效但无毒量的组合物。还包含其是本领域已知适合于配制可注射免疫原性肽组合物的任何和所有常规剂型,例如冻干形式和溶液、悬浮液或乳剂形式,需要时,其包含常规药学上可接受的载体、稀释剂、防腐剂、佐剂、缓冲组分等。
在一个实施方案中,用于引发和/或后续加强疫苗的组合物作为缓慢或持续释放制剂给予。
根据本发明的核酸构建体或组合物的优选施用方式包括但不限于全身施用,例如静脉内或皮下施用、真皮内施用、肌内施用、鼻内施用、经口施用、直肠施用、阴道施用、肺施用和一般地任何形式的粘膜施用。此外,在本发明中包括用于在本文中提及的任何施用形式的方法在本发明的范围内。
根据本发明的核酸构建体或组合物可以施用一次,或任何次数例如2、3、4或5次。
在一个优选实施方案中,核酸构建体或组合物施用一次,随后为合适疫苗的施用。
在另一个优选实施方案中,核酸构建体或组合物在施用疫苗前作为一系列施用进行施用。此类系列可以包括每天、每第二天、每第三天、每第四天、每第五天、每第六天、每周、每两周或每第三周施用核酸构建体或组合物,总共1、2、3、4或5次。
在一个实施方案中,在首先施用核酸构建体或组合物用于引发免疫应答和其次施用疫苗用于加强之间的时间段是相隔至少1天、例如相隔至少2天、例如相隔3天、例如相隔至少4天、例如相隔5天、例如相隔至少6天、例如相隔7天、例如相隔至少8天、例如相隔9天、例如相隔至少10天、例如相隔15天、例如相隔至少20天、例如相隔25天。
用核酸构建体或组合物引发因此预期通过施用疫苗得到进一步加强。施用可以以不同于先前施用或类似于先前施用的形式或在不同于先前施用或类似于先前施用的身体部分中。
加强注射(shot)是同源或异源加强注射。同源加强注射是其中第一次和后续施用包括相同构建体且更具体而言相同递送媒介物。异源加强注射是其中等同构建体包括在不同载体内。
根据本发明的组合物的优选施用形式是将组合物施用于身体区域,内或外,最可能是给定感染的接受器(receptacle)。感染接受器是感染通过其接受的身体区域,例如关于流感,感染接受器是肺。
本发明的核酸构建体或组合物可以施用于它对于其可以是有利的任何生物,特别是任何动物例如脊椎动物。组合物的施用装置和方式适合于接受者落入本发明的范围内。
组合物的优选接受者是哺乳动物,并且在本发明的一个更优选实施方案中,哺乳动物选自:牛、猪、马、绵羊、山羊、美洲驼、小鼠、大鼠、猴、犬、猫、雪貂和人。在最优选的实施方案中,哺乳动物是人。
组合物的另一个优选接受者是来自鸟纲(鸟)的任何脊椎动物,例如家鸡(鸡)。
本发明的一个实施方案包括进一步包括第二种活性成分的组合物。第二种活性成分选自但不限于佐剂、抗生素、化学治疗、抗变应原、细胞因子、免疫系统的补体因子和共刺激分子。
本发明的另一个实施方案包括部分试剂盒,其中试剂盒包括根据上文中的任何的至少一种核酸构建体或组合物,用于施用所述核酸构建体或组合物的装置,和关于如何做到这点的说明书。包括多个剂量的相同组合物或几种不同组合物在本发明的范围内。在一个优选实施方案中,部分试剂盒进一步包括第二种活性成分。在一个更优选的实施方案中,所述第二种活性成分是合适疫苗,即能够加强通过所述免疫应答的先前引发产生的免疫应答的疫苗。
本发明进一步包括用于加强动物中的免疫应答的方法,其包括给动物施用根据上文中的任何的核酸构建体或组合物,随后施用合适疫苗,从而引发且加强受试者的免疫系统。
免疫应答可以是但不限于下述应答类型中的任何:mhc-i依赖性应答、mhc-i和/或mhc-ii依赖性应答、t细胞依赖性应答、cd4+t细胞依赖性应答、cd4+t细胞不依赖性应答、cd8+t细胞依赖性应答和b细胞依赖性免疫应答。合适疫苗是在用根据本发明的核酸构建体或组合物引发免疫系统后能够加强免疫系统的那些。
在一个进一步的实施方案中,本发明涉及治疗有此需要的个体的方法,其包括施用如本文上文所述的组合物,以治疗所述个体中的临床状况。
增加疫苗的效力
本发明的一个实施方案涉及编码至少一种恒定链或其变体和至少一种抗原蛋白质或肽或蛋白质或肽的片段的核酸构建体,其中至少一种抗原蛋白质或肽或蛋白质或肽的片段来自病毒、细菌或寄生虫。
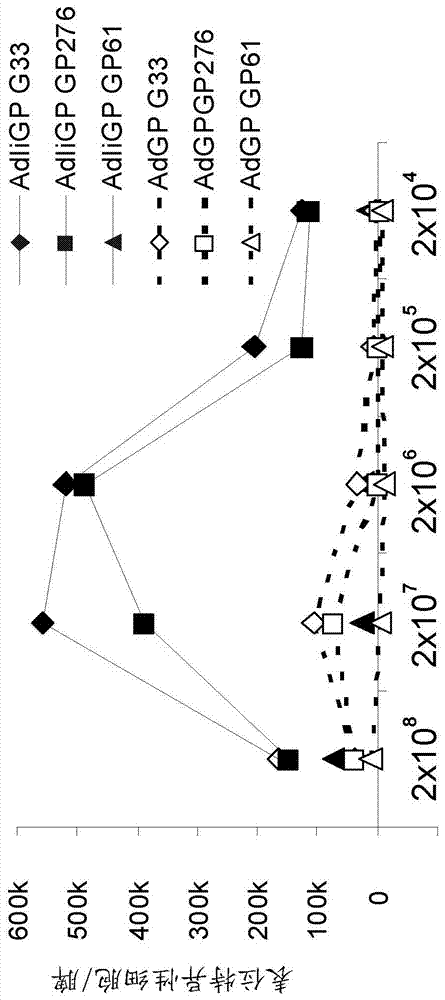
本文呈现的数据显示使用包括恒定链或其变体的核酸构建体开发引发-加强方案并不简单。因此,如图1中呈现的,包括恒定链和抗原的裸露dna构建体(dna-iigp)能够引发免疫应答,而包括抗原但不含恒定链的裸露dna构建体(dna-gp)不能引发免疫应答。此外,图12中呈现的数据显示包括抗原的腺病毒载体(adgp)能够引发特定(ad-iigp)但并非全部(ad-gp)免疫应答,而图13中呈现的数据显示包括恒定链连同抗原的腺病毒载体(ad-iigp)在正常剂量和处理方案下不能引发任何(ad-iigp和ad-gp)免疫应答。然而,可能的是通过使用较低剂量的ad-iigp用于引发来最优化ad-iigp加强的ad-iigp引发(如图14中所示)。
本发明的一个目的是提供编码至少一种恒定链和病毒、细菌或寄生虫抗原或其片段的核酸构建体,其中所述恒定链是恒定链的变体,用于引发免疫应答,其中所述引发随后为用癌症疫苗的后续加强疫苗接种。所述恒定链的变体可以是如本文其他地方指定的任何变体,包括其中ii-keylrmk氨基酸残基已通过例如缺失或置换加以改变,或其中clip区域的部分已通过例如缺失或置换加以改变的恒定链。
在一个实施方案中,本发明涉及核酸构建体用于增加疫苗效力的用途。
在一个实施方案中,本发明公开了用于增加疫苗效力的方法,其包括步骤:
a.提供包括恒定链或其变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答。
在一个实施方案中,本发明公开了用于增加疫苗效力的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的ii-keylrmk氨基酸残基的改变。
在一个实施方案中,本发明公开了用于增加疫苗效力的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的clip区域改变。
在一个实施方案中,本发明公开了用于增加疫苗效力的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体不包括前17个氨基酸。
在另一个实施方案中,本发明涉及核酸构建体用于引发免疫应答的用途。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链或其变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的ii-keylrmk氨基酸残基改变。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的clip区域改变。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链的变体和抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体不包括前17个氨基酸。
增加癌症疫苗的效力
本发明的一个实施方案涉及编码至少一种恒定链或其变体和至少一种抗原蛋白质或肽或蛋白质或肽的片段的核酸构建体,其中至少一种抗原蛋白质或肽或蛋白质或肽的片段来自癌症特异性多肽或癌抗原。
本发明的一个目的是提供编码至少一种恒定链和癌抗原或其片段的核酸构建体,其中所述恒定链以其天然、野生型形式,用于引发免疫应答,其中所述引发随后为用癌症疫苗的后续加强疫苗接种。
本发明的另外一个目的是提供编码至少一种恒定链和癌抗原或其片段的核酸构建体,其中所述恒定链是恒定链的变体,用于引发免疫应答,其中所述引发随后为用癌症疫苗的后续加强疫苗接种。所述恒定链的变体可以是如本文其他地方指定的任何变体,包括其中ii-keylrmk氨基酸残基已通过例如缺失或置换加以改变,或其中clip区域的部分已通过例如缺失或置换加以改变,或其中前17个氨基酸已缺失的恒定链。
由此可见当用于加强免疫应答的随后施用的疫苗是癌症疫苗时,由根据本发明的核酸构建体编码的恒定链可以以其天然、野生型形式,或它可以是恒定链的变体。
在一个实施方案中,本发明涉及核酸构建体用于增加癌症疫苗效力的用途。
在一个实施方案中,本发明公开了用于增加癌症疫苗效力的方法,其包括步骤:
a.提供包括恒定链或其变体和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答。
在一个实施方案中,本发明公开了用于增加癌症疫苗效力的方法,其包括步骤:
a.提供包括恒定链和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答,
其中所述恒定链以其天然、野生型形式。
在一个实施方案中,本发明公开了用于增加癌症疫苗效力的方法,其包括步骤:
a.提供包括恒定链的变体和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的ii-keylrmk氨基酸残基的改变,和/或通过例如缺失或置换的clip区域部分的改变,和/或ii的前17个氨基酸的缺失。
在另一个实施方案中,本发明涉及核酸构建体用于引发免疫应答的用途。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链或其变体和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答,
其中所述恒定链以其天然、野生型形式。
在一个实施方案中,本发明公开了用于引发免疫应答的方法,其包括步骤:
a.提供包括恒定链的变体和癌症特异性抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用合适的癌症疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的ii-keylrmk氨基酸残基的改变,和/或通过例如缺失或置换的clip区域部分的改变,和/或ii的前17个氨基酸的缺失。
增加针对异常生理学应答的疫苗的效力
本发明的一个目的是提供编码至少一种恒定链和与异常生理学应答相关的多肽或其片段的核酸构建体,其中所述恒定链以其天然、野生型形式,用于引发免疫应答,其中所述引发随后为用针对所述异常生理学应答的疫苗的后续加强疫苗接种。
本发明的另外一个目的是提供编码至少一种恒定链和与异常生理学应答相关的多肽或其片段的核酸构建体,其中所述恒定链是恒定链的变体,用于引发免疫应答,其中所述引发随后为用针对所述异常生理学应答的疫苗的后续加强疫苗接种。所述恒定链的变体可以是如本文其他地方指定的任何变体,包括其中ii-keylrmk氨基酸残基已通过例如缺失或置换加以改变,或其中clip区域的部分已通过例如缺失或置换加以改变,或其中前17个氨基酸已缺失的恒定链。
由此可见当用于加强免疫应答的随后施用的疫苗是针对所述异常生理学应答的疫苗时,由根据本发明的核酸构建体编码的恒定链可以以其天然、野生型形式,或它可以是恒定链的变体。
在一个实施方案中,本发明涉及核酸构建体用于增加针对异常生理学应答的疫苗效力的用途。
在另一个实施方案中,本发明涉及核酸构建体用于引发免疫应答的用途。
在一个实施方案中,本发明公开了用于增加针对异常生理学应答的疫苗效力的方法,其包括步骤:
a.提供包括恒定链或其变体和与异常生理学应答相关的抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用针对异常生理学应答的合适疫苗加强步骤b)的免疫应答。
在一个实施方案中,本发明公开了用于增加针对异常生理学应答的疫苗效力的方法,其包括步骤:
a.提供包括恒定链和与异常生理学应答相关的抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用针对异常生理学应答的合适疫苗加强步骤b)的免疫应答,
其中所述恒定链以其天然、野生型形式。
在一个实施方案中,本发明公开了用于增加针对异常生理学应答的疫苗效力的方法,其包括步骤:
a.提供包括恒定链的变体和与异常生理学应答相关的抗原肽或其片段的核酸构建体,
b.通过施用步骤a)的核酸构建体引发受试者的免疫系统,从而刺激所述受试者中的免疫应答,和
c.通过施用针对异常生理学应答的合适疫苗加强步骤b)的免疫应答,
其中所述恒定链的变体包括通过例如缺失或置换的ii-keylrmk氨基酸残基的改变,和/或通过例如缺失或置换的clip区域部分的改变,和/或ii的前17个氨基酸的缺失。
疫苗类型
本发明的一个方面涉及受试者中的免疫应答引发,通过施用包括ii连接的抗原的核酸构建体来进行,随后为通过给相同受试者施用合适疫苗达到的后续加强。
根据本发明的合适疫苗具有与用于引发免疫应答的核酸构建体共同的至少一个等同特征。所述等同特征可以包括在恒定链的部分或全部、抗原肽的部分或全部、主链结构的部分或全部例如启动子区的部分或全部、增强子的部分或全部、终止子的部分或全部、多聚腺苷酸尾的部分或全部、接头的部分或全部、多聚接头的部分或全部、操作接头的部分或全部、多克隆位点(mcs)的部分或全部、标记的部分或全部、终止密码子的部分或全部、内部核糖体进入位点(ires)的部分或全部和用于整合的宿主同源序列或其他限定元件的部分或全部中。
在一个优选实施方案中,等同特征是抗原肽或独特辅助t细胞表位的部分或全部。在一个最优选的实施方案中,等同特征是抗原肽的部分或全部。
在另一个优选实施方案中,等同特征是恒定链的部分或全部。
疫苗可以被视为常规或创新的。本文引用的疫苗类型中的任何可以在根据本发明的后续加强步骤中使用。
常规疫苗或第一代疫苗依赖于完整生物;已被杀死的致病菌株,或具有减毒致病性的菌株。
分子生物学技术已用于开发新疫苗,基于来自致病生物的个别抗原蛋白质的第二代疫苗。概念上,抗原肽而不是完整生物的使用将避免致病性,同时提供包含最具免疫原性的抗原的疫苗。这些包括基于众所周知的灭活毒性化合物的基于类毒素的疫苗,和基于灭活或减毒致病菌株的片段的亚单位疫苗。
缀合物疫苗:特定细菌具有弱免疫原性的多糖外衣壳。通过使这些外衣壳与蛋白质(例如毒素)连接,免疫系统可以导致识别多糖,如同它是蛋白质抗原。
重组载体疫苗:通过使一种微生物的生理学和另一种的dna组合,免疫可以针对具有复杂感染过程的疾病产生。
合成疫苗主要或整个由合成肽、碳水化合物或抗原组成。
dna(或遗传)疫苗或第三代疫苗是用于开发预防和治疗疫苗的新的和有希望的候选物。dna疫苗由dna的小环状段(质粒)构成,其已进行遗传改造,以产生来自微生物的一种或多种抗原。将疫苗dna注射到机体的细胞内,其中宿主细胞的“内部机制”“阅读”dna,并且将其转变成致病蛋白质。因为这些蛋白质被识别为外来的,所以它们通过宿主细胞加工且在其表面上展示,以改变免疫系统,这随后触发一系列免疫应答。确保免疫应答的强度通过载体(即裸露dna、病毒载体、活减毒病毒等)效力、抗原表达水平和重组抗原自身(即高或低亲和力mhc结合物、对于或多或少有限的t或b细胞储库选择的结构决定簇等)的组合决定。免疫记忆的有效诱导要求或获益于cd4+(辅助细胞)t细胞与介导免疫记忆的许多效应的cd8+(细胞毒性)t细胞和b细胞的相互作用,这一般是真实的。
在本发明的一个实施方案中,用根据本发明的核酸构建体引发免疫应答随后为用于加强所述免疫应答的第一代或常规疫苗的后续施用。
在本发明的一个实施方案中,用根据本发明的核酸构建体引发免疫应答随后为用于加强所述免疫应答的第二代疫苗的后续施用。
在本发明的一个实施方案中,用根据本发明的核酸构建体引发免疫应答随后为用于加强所述免疫应答的第三代或dna疫苗的后续施用。
在dna疫苗构建体中使用恒定链以增加免疫原性是本领域众所周知的。在本发明的一个实施方案中,用根据本发明的核酸构建体引发免疫应答随后为用于加强所述免疫应答的dna疫苗的后续施用,所述dna疫苗包括恒定链或其变体。
在本发明的一个实施方案中,用根据本发明的核酸构建体引发免疫应答随后为用于加强所述免疫应答的腺病毒疫苗的后续施用。
疫苗可以进一步是单价的(monovalent)(也称为一价的(univalent))或多价的(multivalent)(也称为多价的(polyvalent))。单价疫苗设计为针对单一抗原或单一微生物免疫接种。多价或多价体疫苗设计为针对相同微生物的2种或更多种菌株,或针对2种或更多种微生物免疫接种。
附图详述
图1:用基于ii链的裸露dna疫苗的dna-引发显著增强在用高度有效的病毒载体的后续加强后的病毒特异性cd8+t细胞生成。小鼠用dna-iigp、dna-gp进行基因枪免疫接种2次,相隔3周,或不予以处理。在最后一次免疫接种后3周,所有小鼠在右后足垫中用2x107ifuad5-iigp注射,并且4周后,处死动物,并且如图1中所述分析脾细胞。表位特异性ifn-γ+cd8+t细胞数目作为平均值±se(n=5只小鼠/组)呈现。*指示相对于仅用ad5-iigp疫苗接种的小鼠的统计显著性(曼-怀二氏秩和检验)。描述了来自2次相似实验之一的结果。
图2:ii序列中的结构域和测试突变定位。wtii中的结构域在条上描述。ess;胞内体分选信号,tm;跨膜结构域,key;肽呈递增强区域,clip;ii类结合的恒定链肽,trim:三聚结构域。ii中的缺失突变和置换程度在条下标记。a;ad-δ17iigp,b;ad-iiltmgp,c;ad-iiutmgp,d;ad-δ50iigp,e;ad-ii1-201gp,f;ad-ii1-118gp,g;ad-ii1-105gp,h;ad-iiclipgp,i;ad-iikeygp,j;ad-ii51-118gp。
图3:ii显著增加siinfekl/h-2kbova衍生表位的细胞表面呈递。骨髓衍生的树突细胞用ad-ova、ad-iiova或ad-iigp(阴性对照)转染,并且表面对于mhcii类(染色成熟树突细胞)和用siinfekl/h-2kb特异性抗体(ova表位)染色。
图4:ii仅以顺式工作。a)来自ad-iigp和ad-ii+gp载体的ii的表达;在用50moiad-iigp和ad-ii+gp感染的cos7细胞中将ii表达对gapdh进行标准化。b)tcr318gp33限制响应ad-gp、ad-iigp或ad-ii+gp转导的bmdc(骨髓衍生的树突细胞)的t细胞增殖。
图5:n末端缺失和置换不影响ii刺激能力。tcr318gp33限制响应ad-gp、ad-iigp、ad-δ17iigp、ad-iiltmgp、ad-iiutmgp、ad-δ50iigp转导的bmdc(骨髓衍生的树突细胞)的t细胞增殖。
图6:c末端缺失和置换不影响ii刺激能力。tcr318gp33限制响应ad-gp、ad-iigp、ad-ii1-205gp、adii1-118gp和ad-ii1-105gp转导的bmdc(骨髓衍生的树突细胞培养系统)的t细胞增殖。
图7:仅n和c末端缺失减少ii刺激能力。tcr318gp33限制响应ad-gp、ad-iigp、ad-iiclipgp、ad-iikeygp和ad-ii51-118gp转导的bmdc(骨髓衍生的树突细胞培养系统)的t细胞增殖。
图8:ad-iigp和ad-gp疫苗的剂量应答。小鼠组用在指示菌株中的指示疫苗进行疫苗接种。在疫苗接种后14天,处死小鼠,并且用指示表位刺激脾细胞。通过细胞内染色和facs分析测定特异性cd8+脾细胞的总数目。数据显示ad-iigp在极低剂量下诱导应答,并且因此用低剂量ad-iigp(或任何抗原)引发和用更高剂量ad-iigp(或任何抗原)后续加强可以应用于同源引发-加强方案。
图9:ad-gp、ad-iigp和ad-iiclipgp用于mhcii类呈递(cd4+t细胞的刺激)的比较。smartagp61-80限制响应ad-gp、ad-iigp和ad-iiclipgp转导的bmdc的t细胞呈递显示增加的ad-iiclipgp的mhcii抗原呈递。
图10:在体内时间-过程研究中的ad-gp、ad-iigp、ad-gplamp-1和ad-iiδ17gp比较。
图11:ad-gp、ad-iigp、ad-iiδ17gp、ad-iikeygp、ad-iiclipgp、ad-ii1-117gp和ad-ii1-199gp体内应答的比较。
图12:ad-gp能够引发后续ad-iigp加强。3组c57bl/6小鼠用ad-gp进行疫苗接种。60天后,这些小鼠不受干扰,用ad-gp进行疫苗接种,或用ad-iigp进行疫苗接种。包括用ad-gp进行疫苗接种的第4组小鼠。第一次疫苗接种后120天,处死小鼠,并且通过用所述肽的先体外后体内再刺激和用于干扰素-γ产生的细胞内染色来定量识别指示表位的抗原特异性细胞。
图13:ad-iigp不能引发后续ad-gp或ad-iigp加强。3组c57bl/6小鼠用ad-iigp进行疫苗接种。60天后,这些小鼠不受干扰,用ad-gp进行疫苗接种,或用ad-iigp进行疫苗接种。包括用ad-iigp进行疫苗接种的第4组小鼠。第一次疫苗接种后120天,处死小鼠,并且通过用所述肽的先体外后体内再刺激和用于干扰素-γ产生的细胞内染色来定量识别指示表位的抗原特异性细胞。这显示ad-iigp引发不能用ad-iigp加强,而dna-iigp引发可以用ad-iigp加强(参见图1)。
图14:ad-gp和adii-gp疫苗的剂量应答。小鼠组用在指示菌株中的指示疫苗进行疫苗接种。在疫苗接种后14天,处死小鼠,并且用指示表位刺激脾细胞。通过细胞内染色和facs分析测定cd8+脾细胞的总数目。
图15:与包括残基50–215(ii50-215)的恒定链的变体偶联的甘露糖受体进一步与腺病毒纤维蛋白质偶联。腺病毒纤维蛋白质(ad纤维)可以源自腺病毒的任何血清型。甘露糖受体可以是来自甘露糖受体的一个或多个结构域。ii可以是ii的变体或全长。ag=抗原。
本发明的实施例
本发明现在将参考下述实施例进一步举例说明。应当理解下述仅作为例子并且可以做出细节中的修饰,同时仍落入本发明的范围内。
实施例1:用基于ii链的裸露dna疫苗引发显著加强在用最优化病毒载体的后续加强后的病毒特异性cd8+t细胞生成。
用裸露dna疫苗(即核酸构建体)引发显示加强通过用ad5(腺病毒血清型5)载体的后续免疫接种产生的免疫应答。用dna-iigp(表达与恒定链(ii)融合的lcmv(淋巴细胞性脉络丛脑膜炎病毒)糖蛋白(gp)的dna构建体)引发在本文中证实显著增强通过在腺病毒血清型5载体(ad5-iigp)中递送的相同基因构建体诱导的cd8+t细胞应答,提供关于在未来异源免疫接种(“引发-加强”)方案中包括基于ii链的dna构建体的强论据。
我们的研究显示ii链连接的免疫增强效应并不限于ad5载体,还与dna平台相关。此外,考虑ii链增强超过一种表位的呈递的事实,这提出基于ii链的dna疫苗作为用于各种异源引发-加强方案的非常有希望的候选物。
结果和讨论
改善诱导的t细胞记忆的一种方法是通过异源引发-加强方案,例如裸露dna引发随后为载体加强。因此具有在我们实验室中的合适载体——表达与p31ii链融合的lcmvgp的复制缺陷型腺病毒(ad5-iigp),在实验上测试了这种可能性。首先,我们执行了标准dna疫苗接种,用dna-iigp或dna-gp的基因枪疫苗接种2次,相隔3周。第二次dna疫苗接种后3周,通过在右后足垫中接种2x107ifuad5-iigp免疫接种小鼠组和匹配对照,并且4周后,通过关于ifn-γ的iccs和流式细胞术计数脾中的病毒特异性cd8+t细胞数目。用融合的dna构建体引发的小鼠包含比未引发小鼠明显更多的gp33-41和gp276-286特异性ifn-γ+cd8+t细胞,并且对于gp92-101特异性细胞注意到相似趋势,尽管在这种情况下差异不是统计上显著的。相比之下,在不存在ii的情况下用编码gp的裸露dna引发对通过用ad5-iigp的后续免疫接种诱导的gp特异性记忆cd8+t细胞水平具有很少作用(图1)。应当指出观察到的诱导ii作用不反映疫苗接种小鼠的免疫反应性的非特异性加强,因为用仅包括ii但不含gp的载体的dna引发对随后用腺病毒载体接种的小鼠中的gp特异性cd8+t细胞水平没有作用(数据未显示)。
我们已显示使用改良dna载体作为异源引发-加强方案的一部分将显著加强通过已最优化的病毒载体诱导的应答(holst等人,2008)。这强烈指出甚至基于非常免疫原性载体的免疫接种也可以通过用基于ii链的裸露dna疫苗最初引发宿主得到进一步改善。总之,因为与抗原的ii链融合物将导致用于广泛cd8+t细胞应答的引发,所以基于ii链的dna疫苗应代表关于针对快速突变病毒的预防策略作为异源引发-加强方案的一部分的明确优点。
材料与方法
小鼠。c57bl/6(b6)野生型小鼠得自taconicm&b(ry,丹麦)。穿孔蛋白缺陷b6小鼠由最初得自thejacksonlaboratory(barharbor,me)的育种对当地培育。7–10周大的小鼠在所有实验中使用,并且来自外部来源的动物在使用前总是允许适应当地环境至少1周。所有动物在无特殊病原体的条件下饲养,如通过标记(sentinels)筛选验证的。所有动物实验根据国家指导进行。
dna疫苗构建和免疫接种程序。dna疫苗使用真核生物表达载体paccmv.plpa产生,所述paccmv.plpa包含鼠类恒定链随后为lcmv的gp或单独的lcmvgp。构建体如近期描述的生成(holst等人,2008)。大肠杆菌菌株xl1-blue(stratagene,usa)通过电穿孔用构建体进行转化。使用循环测序、bigdyeterminator和abi310遗传分析仪(abiprism,usa)的dna测序鉴定阳性克隆。引物得自tag,copenhagen,丹麦。使用qiagenmaxiprep(qiagen,usa)产生大规模dna制剂。
基因枪免疫接种。将dna以2μgdna/mg金的浓度包被到1.6nm金颗粒上,并且将dna/金复合物包被到塑料管上,从而使得0.5mg金递送至小鼠/注射(1μgdna/注射)。这些程序根据制造商的说明书执行(biorad,ca,usa)(bartholdy等人,2003)。小鼠使用采用压缩氦(400psi)作为粒子原运力的手提式基因枪装置在腹部皮肤上进行免疫接种。除非另有说明,否则小鼠用3-4周的间隔免疫接种2次,并且随后在进一步攻击/研究前允许休息3周。
病毒。lcmv的阿姆斯特朗(armstrong)毒株克隆13在大多数实验中使用。除非另有说明,否则待感染的小鼠接受在0.3ml的i.v.注射中的105pfu,或在右后足垫(f.p.)中在0.03ml中的20pfu克隆13剂量。对于i.c.注射,小鼠接受在0.03ml的体积中的20pfu的向神经阿姆斯特朗克隆53b。如近期描述的(holst等人,2008)产生且滴定编码恒定链连接的gp的复制缺陷型腺病毒(ad5-iigp)。
病毒滴定。通过如先前描述的(battegay等人,1991)免疫焦点测定来测定器官病毒滴度。
cd4+和cd8+t细胞的体内耗尽。使用抗cd4(克隆gk1.5)和抗cd8mabs(克隆53.6.72)。在相对于感染的第-1和0天时,待耗尽细胞的小鼠腹膜内接受在0.3mlpbs的体积中的200□g剂量;而对于假处理,使用纯化的大鼠igg(jacksonimmunoresearch)。通过流式细胞术验证细胞耗尽的效率。
存活研究。死亡率用于评估急性lcmv诱导的脑膜炎的临床严重性。小鼠每天检查2次,共14天时间段,或直至达到100%的死亡率。
lcmv特异性足垫肿胀反应的测定。小鼠如上所述在右后足垫中进行局部感染,并且跟踪局部肿胀反应直至第14天p.i。用指针式测径器(dialcaliper)(mitutoyo7309,mitutoyoco.,tokyo,日本)测量足垫厚度,并且病毒特异性肿胀测定为受感染右足和未感染左足厚度的差异(christensen等人,1994)。
细胞制备。无菌取出来自小鼠的脾细胞,并且转移至hanks`平衡盐溶液(hbss)。通过按压器官经由精细无菌钢丝网获得单细胞悬浮液。细胞用hbss洗涤2次,并且细胞浓度在包含10%胎牛血清(fcs)的rpmi1640中调整,所述rpmi1640补充有2-巯基乙醇、l-谷氨酰胺和青霉素-链霉素溶液。
用于流式细胞术的mab。下述mab都作为大鼠抗小鼠抗体购自pharmingen(sandiego,ca):fitc缀合的抗cd44、cy-铬缀合的抗cd8a、cy-铬缀合的抗cd4和藻红蛋白(pe)缀合的抗ifn-γ。
流式细胞术分析。对于lcmv特异性(产生干扰素-γ)cd8+/cd4+t细胞的显现,使1-2x106个脾细胞重悬浮于0.2ml完全rpmi培养基中,所述完全rpmi培养基补充有10个单位鼠类重组il-2(r&dsystemseuropeltd,abingdon,uk)、3μm莫能星(sigmachemicalsco.,stlouis,mo)和1μg/ml相关肽,并且在37℃下孵育5小时。使用下述肽:对于cd8+t细胞为gp33-41、gp276-86、gp92-101、gp118-125且np396-404用于对照;对于cd4+t细胞为gp61-80。在孵育后,细胞进行表面染色,洗涤,渗透化且用ifn-γ特异性mab染色,如先前描述的(andreasen等人,2000;christensen等人,2003)。同种型匹配的抗体充当对照用于非特异性染色。细胞使用facscalibur(bectondickinson,sanjose,ca)进行分析,并且使用低角度和侧面散射的组合来门控至少104个活细胞,以排除死细胞和碎片。使用cell-quest软件进行数据分析。
实施例2:ii连接的抗原增强的cd8+t细胞激活不依赖于天然ii
ii序列包含在抗原加工具有功能的多个区域,其包括:细胞质分选结构域和三聚结构域、细胞质和近侧膜发信号结构域、细胞质、膜内和周质三聚结构域、涉及解锁mhc分子以促进外源肽结合的“key”基序、在clip区域中对于mhci和ii类的结合基序、周质糖基化位点以及与cd44和巨噬细胞迁移抑制因子(mif)相互作用的在结构上未鉴定的区域(图2)。
ii连接增加在mhci和ii类上的抗原呈递。通过使用骨髓衍生的树突细胞(bmdc)的ad-iiova(ova是卵白蛋白)或ad-ova转导,我们发现ii连接的确诱导mhci类限制性抗原呈递的显著增加,如通过用针对在h-2kb上呈递的siinfeklova表位的抗体的直接染色测量的(图3)。增加的来自ii连接的序列的mhci类限制性抗原的表达直接作用于apc,不依赖于mhcii类、cd4+t细胞和任何其他细胞类型,并且可以在树突细胞培养中直接测量。
以顺式的ii
为了确定ii是仅以顺式还是也以反式工作,通过合成具有β-珠蛋白多聚腺苷酸化信号的磷酸甘油酸酯激酶(pgk)启动子,并且将其克隆到腺病毒骨架的e3区域内,建立在腺病毒载体内的另外读码框。这种载体随后可以用于与穿梭载体重组,所述穿梭载体用于制备ad-gp载体(其表达在人cmv启动子和sv40多聚腺苷酸的控制下来自e1读码框的lcmvgp)。新载体表达来自腺病毒e1区的lcmvgp和来自e3区的ii(ad-ii+gp)。启动子通过转染到cos7细胞内就绿色荧光细胞的诱导进行验证,并且在ad-iigp和ad-ii+gp感染的cos7细胞中iimrna表达的测量证实ii由pgk启动子表达至少与由cmv启动子表达一样有效(图4a)。用ad-gp、ad-iigp和ad-ii+gp感染的bmdc刺激的tcr318细胞的比较显示ii必须与抗原连接,以具有任何作用(图4b)。如果以反式的ii表达已显示功效那将是令人惊讶的,因为用于刺激的bmdc培养物已表达ii。
n末端改变:
从n末端开始,我们进行1)前17个氨基酸的缺失(ad-δ17iigp),这去除基于亮氨酸的胞内体分选信号,2)用来自趋化因子受体ccr6tm6的相应区段替换跨膜区段的前一半(ad-iiltmgp),3)用相应ccr6tm6区段替换跨膜区段的另一半(ad-iiutmgp),和最后4)前50个氨基酸的完全缺失(ad-δ50iigp)。后面一种缺失去除整个细胞溶质、tm和膜近侧区。这些突变无一对其余ii序列增强cd8+t细胞刺激的能力具有任何作用(图5)。
c末端改变:
从c末端我们进行最后14个aa(ad-ii1-201gp,这去除c末端糖基化信号)、最后97个aa(ad-ii1-118gp)和最后110个aa(ad-ii1-105gp)的缺失。通过1-201未观察到对其余ii序列增强cd8+t细胞刺激的能力的作用,而从1-105突变和1-118突变仅可见不一致和较小的减少趋势(图6)。
突变:
我们还尝试在报道的clip区域的mhci类结合位点(ad-iiclipgp:双重的m至a点突变-m91am99a–设计为取消ii与mhci类分子的相互作用)和key基序(ad-iikeygp:lrmk至aaaa的四重的点突变,这将破坏ii-key区段)中进行点突变。这些突变无一对于ii介导的增强的cd8+t细胞刺激是关键的。当我们组合n和c末端截短(truncation)时,唯一有趣的数据出现。因此,当我们测试51-118变体(ad-ii51-118gp)时,观察到cd8+t细胞刺激能力的显著减少,但突变体仍优于ad-gp(图7)。
实施例3
在本发明的一个实施方案中,提供了与ii偶联的与糖基结合蛋白质组合的非人糖基转移酶。ii可以是全长或变体,其中变体可以是包括残基编号50–215的ii的截短形式。这种变体具有完全活性,尽管缺乏跨膜结构域。任选地,可以进一步提供佐剂或一个或多个易位结构域。在图15中提供的是一个实施方案的示意图,其中甘露糖受体(在疫苗中通常靶向的钙依赖性凝集素)与包括残基50–215的恒定链的变体(ii50-215)偶联,与腺病毒纤维蛋白质进一步偶联。腺病毒纤维蛋白质(ad纤维)可以源于腺病毒的任何血清型。甘露糖受体可以是来自甘露糖受体的一个或多个结构域。
在一个特定例子中,提供了这样的腺病毒:在一个读码框中表达egghead(来自果蝇的蛋白质),并且在另一个读码框中表达甘露糖受体(或来自甘露糖受体的结构域),所述受体与不含跨膜区的具有完全活性的ii变体例如ii50-215变体,其与腺病毒纤维蛋白质进一步偶联。
糖基转移酶例如egghead和糖基结合蛋白质例如甘露糖受体可以由在相同腺病毒载体中的不同读码框表达,或糖基转移酶例如egghead和糖基结合蛋白质例如甘露糖受体可以由同时施用的不同腺病毒载体表达。
egghead在所有糖基化er(内质网)蛋白质上偶联甘露糖。分泌蛋白质的甘露糖基化可以因此引起甘露糖化蛋白质与甘露糖受体-ii-ad纤维复合物的结合(如图15中所示)。复合物的腺病毒纤维引起与所述复合物连接的分泌蛋白质由其他细胞吸收,激活这些以变得免疫刺激的,并且提供复合物对ii可以在其中发挥其作用的细胞溶质的接近。
这种技术可以用于构建可以直接施用到例如癌症内的疫苗。
参考文献列表
andreasen,s.o.,christensen,j.e.,marker,o.&thomsen,a.r.(2000).roleofcd40ligandandcd28ininductionandmaintenanceofantiviralcd8+effectortcellresponses.jimmunol164,3689-3697.
bartholdy,c.,stryhn,a.,hansen,n.j.,buus,s.&thomsen,a.r.(2003).incompleteeffector/memorydifferentiationofantigen-primedcd8+tcellsingenegundna-vaccinatedmice.eurjimmunol33,1941-1948.
battegay,m.,cooper,s.,althage,a.,banziger,j.,hengartner,h.和zinkernagel,r.m.(1991).quantificationoflymphocyticchoriomeningitisviruswithanimmunologicalfocusassayin24-or96-wellplates.j.virol.methods33:191-198.
becker,t.c.,noel,r.j.,coats,w.s.,gomez-foix,a.m.,alam,t.,gerard,r.d.和newgard,c.b.(1994).useofrecombinantadenovirusformetabolicengineeringofmammaliancells.methodscellbiol.43pta:161-189.
christensen,j.p.,marker,o.&thomsen,a.r.(1994).theroleofcd4+tcellsincell-mediatedimmunitytolcmv:studiesinmhcclassiandclassiideficientmice.scandjimmunol40,373-382.
christensen,j.p.,kauffmann,s.o.&thomsen,a.r.(2003).deficientcd4+tcellprimingandregressionofcd8+tcellfunctionalityinvirus-infectedmicelackinganormalbcellcompartment.jimmunol171,4733-4741.
diebold,s.s.,m.cotten,n.koch和m.zenke.(2001).mhcclassiipresentationofendogenouslyexpressedantigensbytransfecteddendriticcells.genether.8:487-493.
holmesjp,benavideslc,gatesjd,carmichaelmg,huemanmt,mittendorfea,murrayjl,amina,craigd,vonhofee,ponniahs,peoplesge.(2008).resultsofthefirstphaseiclinicaltrialofthenovelii-keyhybridpreventiveher-2/neupeptide(ae37)vaccine.jclinoncol.jul10;26(20):3426-33.
holst,p.j.,sorensen,m.r.,mandrupjensen,c.m.,orskov,c.,thomsen,a.r.&christensen,j.p.(2008).mhcclassii-associatedinvariantchainlinkageofantigendramaticallyimprovescell-mediatedimmunityinducedbyadenovirusvaccines.jimmunol180,3339-3346.
kallinterisnl,lux,blackwellce,vonhofee,humphreysre,xum.(2006).ii-key/mhcclassiiepitopehybrids:astrategythatenhancesmhcclassiiepitopeloadingtocreatemorepotentpeptidevaccines.expertopin.biol.ther.6(12):1311-1321.
morris,c.r.,a.j.reber,j.l.petersen,s.e.vargas和j.c.solheim.(2004).associationofintracellularproteinswithfoldedmajorhistocompatibilitycomplexclassimolecules.immunol.res.30:171-179.
pieters,j.(1997).mhcclassiirestrictedantigenpresentation.curr.opin.immunol.9:89-96.
sambrook等人,编辑,molecularcloning:alaboratorymanual,coldspringharborlaboratory,2ndedition,coldspringharbor,n.y.,1989.
strumptner-cuvelette,p.和p.benaroch.(2002).multiplerolesoftheinvariantchaininmhcclassiifunction.biochem.biophys.acta.,1542:1-13.
wo2007/062656
us2008/0095798
wo2003/089471
us5,554,372
us5,876,735
5,102,985。
序列表
<110>holst,peterjohannes
thomsen,allanrandrup
christensen,janpravsgaard
grujic,mirjana
<120>免疫应答的引发
<130>p1982dk00
<140>pa200801638
<141>2008-11-21
<160>4
<170>fastseqforwindowsversion4.0
<210>1
<211>1287
<212>dna
<213>智人-恒定链
<400>1
ctgcaggggggggggggggggggggggacattggctcttccttggggagtgatgcacagg60
aggagaagcaggagctgtcgggaagatcagaagccagtcatggatgaccagcgcgacctt120
atctccaacaatgagcaactgcccatgctgggccggcgccctggggccccggagagcaag180
tgcagccgcggagccctgtacacaggcttttccatcctggtgactctgctcctcgctggc240
caggccaccaccgcctacttcctgtaccagcagcagggccggctggacaaactgacagtc300
acctcccagaacctgcagctggagaacctgcgcatgaagcttcccaagcctcccaagcct360
gtgagcaagatgcgcatggccaccccgctgctgatgcaggcgctgcccatgggagccctg420
ccccaggggcccatgcagaatgccaccaagtatggcaacatgacagaggaccatgtgatg480
cacctgctccagaatgctgaccccctgaaggtgtacccgccactgaaggggagcttcccg540
gagaacctgagacaccttaagaacaccatggagaccatagactggaaggtctttgagagc600
tggatgcaccattggctcctgtttgaaatgagcaggcactccttggagcaaaagcccact660
gacgctccaccgaaagagtcactggaactggaggacccgtcttctgggctgggtgtgacc720
aagcaggatctgggcccagtccccatgtgagagcagcagaggcggtcttcaacatcctgc780
cagccccacacagctacagctttcttgctcccttcagcccccagcccctcccccatctcc840
caccctgtacctcatcccatgagaccctggtgcctggctctttcgtcacccttggacaag900
acaaaccaagtcggaacagcagataacaatgcagcaaggccctgctgcccaatctccatc960
tgtcaacaggggcgtgaggtcccaggaagtggccaaaagctagacagatccccgttcctg1020
acatcacagcagcctccaacacaaggctccaagacctaggctcatggacgagatgggaag1080
gcacagggagaagggataaccctacacccagaccccaggctggacatgctgactgtcctc1140
tcccctccagcctttggccttggcttttctagcctatttacctgcaggctgagccactct1200
cttccctttccccagcatcactccccaaggaagagccaatgttttccacccatccctccc1260
cccccccccccccccccccccctgcag1287
<210>2
<211>216
<212>prt
<213>智人-恒定链
<400>2
metaspaspglnargaspleuileserasnasngluglnleupromet
151015
leuglyargargproglyalaprogluserlyscysserargglyala
202530
leutyrthrglypheserileleuvalthrleuleuleualaglygln
354045
alathrthralatyrpheleutyrglnglnglnglyargleuasplys
505560
leuthrvalthrserglnasnleuglnleugluasnleuargmetlys
65707580
leuprolysproprolysprovalserlysmetargmetalathrpro
859095
leuleumetglnalaleuprometglyalaleuproglnglypromet
100105110
glnasnalathrlystyrglyasnmetthrgluasphisvalmethis
115120125
leuleuglnasnalaaspproleulysvaltyrproproleulysgly
130135140
serpheprogluasnleuarghisleulysasnthrmetgluthrile
145150155160
asptrplysvalpheglusertrpmethishistrpleuleupheglu
165170175
metserarghisserleugluglnlysprothraspalaproprolys
180185190
gluserleugluleugluaspproserserglyleuglyvalthrlys
195200205
glnaspleuglyprovalpromet
210215
<210>3
<211>648
<212>dna
<213>小家鼠-恒定链
<400>3
atggatgaccaacgcgacctcatctctaaccatgaacagttgcccatactgggcaaccgc60
cctagagagccagaaaggtgcagccgtggagctctgtacaccggtgtctctgtcctggtg120
gctctgctcttggctgggcaggccaccactgcttacttcctgtaccagcaacagggccgc180
ctagacaagctgaccatcacctcccagaacctgcaactggagagccttcgcatgaagctt240
ccgaaatctgccaaacctgtgagccagatgcggatggctactcccttgctgatgcgtcca300
atgtccatggataacatgctccttgggcctgtgaagaacgttaccaagtacggcaacatg360
acccaggaccatgtgatgcatctgctcacgaggtctggacccctggagtacccgcagctg420
aaggggaccttcccagagaatctgaagcatcttaagaactccatggatggcgtgaactgg480
aagatcttcgagagctggatgaagcagtggctcttgtttgagatgagcaagaactccctg540
gaggagaagaagcccaccgaggctccacctaaagagccactggacatggaagacctatct600
tctggcctgggagtgaccaggcaggaactgggtcaagtcaccctgtga648
<210>4
<211>215
<212>prt
<213>小家鼠-恒定链
<400>4
metaspaspglnargaspleuileserasnhisgluglnleuproile
151015
leuglyasnargproarggluprogluargcysserargglyalaleu
202530
tyrthrglyvalservalleuvalalaleuleuleualaglyglnala
354045
thrthralatyrpheleutyrglnglnglnglyargleuasplysleu
505560
thrilethrserglnasnleuglnleugluserleuargmetlysleu
65707580
prolysseralalysprovalserglnmetargmetalathrproleu
859095
leumetargprometsermetaspasnmetleuleuglyprovallys
100105110
asnvalthrlystyrglyasnmetthrglnasphisvalmethisleu
115120125
leuthrargserglyproleuglutyrproglnleulysglythrphe
130135140
progluasnleulyshisleulysasnsermetaspglyvalasntrp
145150155160
lysilepheglusertrpmetlysglntrpleuleupheglumetser
165170175
lysasnserleugluglulyslysprothrglualaproprolysglu
180185190
proleuaspmetgluaspleuserserglyleuglyvalthrarggln
195200205
gluleuglyglnvalthrleu
210215
- 还没有人留言评论。精彩留言会获得点赞!