组织临界面模型构建方法及三维培养细胞的微流控芯片与流程
本发明属于细胞培养后构建模型的一种芯片,特别针对两种或两种以上细胞构建接触面模型时使用的一种微流控芯片及其模型构建方法,具体涉及为组织临界面模型构建方法及三维培养细胞的微流控芯片。
背景技术:
目前,临床中对于疾病机制的研究多依赖于传统的动物造模和二维细胞培养的方法观察病变现象。但动物模型造模周期长,且不能对病变过程实现实时动态监控,即不能实现病变过程的“全景”再现;而常规的细胞二维培养,微环境过于单一,与体内细胞生长方式及其所处微环境不符,造成得到的部分结果“失真”。因此需要一种可以建立三维细胞生长模型的结构以实现实时观察不同细胞间的相互作用。
微流控芯片技术的发展使模型建立微量化,直观化成为现实,因此可以利用微流控芯片建立一种三维细胞生长模型。如何设计微流控芯片的通道及各接触面的构建,成为解决问题的关键。
本发明利用微流控技术,设计并制作了一种微流控芯片,用于模拟体内特定微结构(如肺泡上皮-间质交界、肺泡-毛细血管交界等),并在此基础上诱发病理模型,对病变过程进行实时监控,为后续机制研究及干预治疗奠定理论及方法基础,具体提供了一种三维培养细胞的微流控芯片。
技术实现要素:
为了实现在微流控芯片内建立三维细胞的目的,本发明的目的是提供一种能解决上述问题的三维培养细胞的微流控芯片。
本发明的目的通过以下技术方案实现:
一种三维培养细胞的微流控芯片,其包括芯片层与覆盖层,其特征在于,所述芯片层与覆盖层结合后内包含2-多条通道,通道中间包括连通部分,且中间通道的深度较其他通道浅,或者中间通道口径较其他通道小;每条通道上设置进出孔。本微流控芯片通过设置2-多条通道及中间连通部分可以实现组织临界面的建立,且简单方便。
进一步,还设置覆盖进出孔的封堵帽,封堵帽下部尺寸与进出孔孔径相同,上端尺寸较大,此种设置方便对封堵帽的操作,且能有效对进出孔进行封堵。
进一步,所述通道数目为3条。3条通道的设置可以实现2-3中组织间临界面的构建。
进一步,两侧通道呈分散状设置,中间通道直线设置,通道中间连通部分均匀设置。此种设置可以使每个通道的进出孔有效分离,操作方便。
进一步,所述两侧通道以中间通道为轴线对称设置。对称的设置可以让整个芯片看起来美观,且能够有效节省芯片空间。
进一步,所述通道形状为方形,且通道两端分别设置进出孔。两端设置的进出孔可以更好的方便操作者的操作。
进一步,所述各通道在芯片层上底面水平,在覆盖层上中间通道处设置突出,使中间通道较浅。此种设置可以保证构建临界面更加接近真实临界面。
进一步,所述通道形状为圆形或者椭圆形通道。圆形与椭圆形的设置更加接近真实的官腔壁或者血管壁。
进一步,所述圆形或椭圆形通道均匀设置于芯片层与覆盖层上,拼合而成,各通道在中间设置连通部分。
进一步,所述中间通道设置为方形通道,其他通道设置为圆形或椭圆形通道。此种设置可以有效模拟两边为官腔或血管中间不为腔道的组织临界面模型。
进一步,采用PDMS材料及软光刻技术进行芯片制作。
进一步,所述芯片尺寸约为1.4cm x1.4cm;各通道尺寸为:中间通道宽度(1mm),两侧通道宽度均为1.5mm。
利用上述芯片建立组织临界面模型的方法,具体步骤如下:
(1)打开中间通道进出孔,关闭两侧微通道进出孔,将细胞-细胞外基质混合物注入中间通道,使其成三维生长;
(2)打开单侧通道进出孔,其他关闭,用基质胶对通道内壁进行包被,将另一种细胞混悬液注入开发通道,使细胞单层贴壁生长于微通道内表面,呈腔状生长,以模拟生物壁及腔;
(3)如果有多个通道,逐次开发单个通道进出孔,关闭其他通道进出孔,用步骤(2)中的方法将后续细胞混悬液注入右侧通道,贴壁生长于通道内表面,呈管腔样生长,每个通道内注入一种细胞混悬液;
(4)在上述生理结构模型基础上,用药物刺激诱发病理模型,观测病变过程。
利用上述芯片建立组织临界面模型的方法,所述微流控芯片设置3个通道,具体步骤如下:
(1)打开中间通道进出孔,关闭两侧微通道进出孔,将细胞-细胞外基质混合物注入中间通道,使其成三维生长;
(2)打开一侧通道进出孔,关闭另一侧通道进出孔,用基质胶对通道内壁进行包被,将另一种细胞混悬液注入打开通道,使细胞单层贴壁生长于微通道内表面,呈腔状生长,以模拟生物壁及腔;
(3)打开另一侧通道进出孔,用(2)中的方法将第三种细胞混悬液注入右侧通道,贴壁生长于通道内表面,呈管腔样生长;
(4)在上述生理结构模型基础上,用药物刺激诱发病理模型,观测病变过程。
进一步,建立组织临界面模型的方法为:
(1)打开中间通道进出孔,关闭左右两侧微通道进出孔,将间质细胞-细胞外基质混合物注入中间通道,使其成三维生长,模拟肺间质区域;
(2)打开左侧通道进出孔,用基质胶对通道内壁进行包被,将上皮细胞混悬液注入左侧通道,使上皮细胞单层贴壁生长于微通道内表面,呈腔状生长,以模拟肺泡壁和肺泡腔;
(3)关闭左侧微通道进出孔,打开右侧通道进出孔,用(2)中的方法将血管内皮细胞混悬液注入右侧通道,贴壁生长于通道内表面,呈管腔样生长,以模拟血管壁和血管腔;
(4)在上述生理结构模型基础上,用药物刺激诱发病理模型,观测病变过程。
进一步,用上述方法,还可模拟人体内各种组织交界面微结构,模拟该微结构的病变以观察,干预。
与现有技术相比,本发明三维培养细胞的微流控芯片可以实现细胞的三维生长,并能有效建立组织临界面模型,模拟生理结构。
附图说明
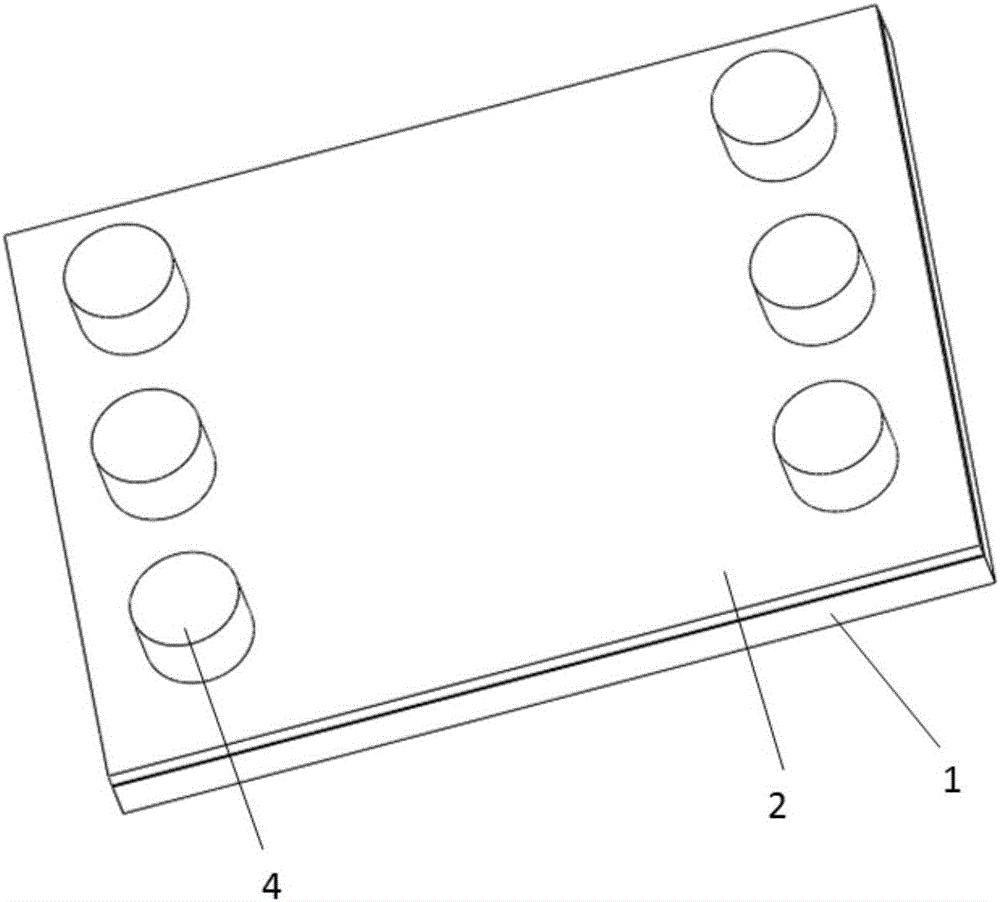
图1为本发明整体结构示意图;
图2为本发明带封堵帽整体结构示意图;
图3为本发明芯片层结构示意图;
图4为本发明覆盖层结构示意图;
图5为本发明中间部分横向剖视图;
图6为本发明封堵帽结构示意图;
图7为本发明实施例5构建肺泡-毛细血管屏障结构图;
图中,1、芯片层;2、覆盖层;21、进出孔;31、中间通道;32、两侧通道;33、连通部分;34、突出;4、封堵帽。
具体实施方式
实施例1一种三维培养细胞的微流控芯片
一种三维培养细胞的微流控芯片,包括芯片层1与覆盖层2,其中芯片层1与覆盖层2结合后内包含3条通道,通道中间包括连通部分33,且中间通道31的深度较其他通道浅,通道形状为方形,且通道两端分别设置进出孔21。两侧通道32呈分散状设置,中间通道31直线设置,两侧通道32以中间通道31为轴线对称设置,通道中间连通部分33均匀设置。此种设置可以使每个通道的进出孔21有效分离,操作方便。3条通道在芯片层1上底面水平,在覆盖层2上中间通道31处设置突出34,使中间通道31较浅。此种设置可以保证构建临界面更加接近真实临界面。采用PDMS材料及软光刻技术进行芯片制作。本微流控芯片通过设置3条通道及中间连通部分33可以实现组织临界面的建立,且简单方便。
实施例2一种三维培养细胞的微流控芯片
一种三维培养细胞的微流控芯片,包括芯片层1与覆盖层2,其中芯片层1与覆盖层2结合后内包含3条通道,通道中间包括连通部分33,且中间通道31的深度较其他通道浅,通道形状为方形,且通道两端分别设置进出孔21。还设置覆盖进出孔21的封堵帽4,封堵帽4下部尺寸与进出孔21孔径相同,上端尺寸较大,此种设置方便对封堵帽4的操作,且能有效对进出孔21进行封堵。两侧通道32呈分散状设置,中间通道31直线设置,两侧通道32以中间通道31为轴线对称设置,通道中间连通部分33均匀设置。此种设置可以使每个通道的进出孔21有效分离,操作方便。3条通道在芯片层1上底面水平,在覆盖层2上中间通道31处设置突出34,使中间通道31较浅。此种设置可以保证构建临界面更加接近真实临界面。采用PDMS材料及软光刻技术进行芯片制作。本微流控芯片通过设置3条通道及中间连通部分33可以实现组织临界面的建立,且简单方便。
实施例3一种三维培养细胞的微流控芯片
一种三维培养细胞的微流控芯片,包括芯片层1与覆盖层2,其中芯片层1与覆盖层2结合后内包含3条通道,通道中间包括连通部分33,中间通道31口径较两侧通道32小;通道形状为圆形或者椭圆形通道。圆形与椭圆形的设置更加接近真实的官腔壁或者血管壁。圆形或椭圆形通道均匀设置于芯片层1与覆盖层2上,拼合而成,各通道在中间设置连通部分33。通道两端分别设置进出孔21。还设置覆盖进出孔21的封堵帽4,封堵帽4下部尺寸与进出孔21孔径相同,上端尺寸较大,此种设置方便对封堵帽4的操作,且能有效对进出孔21进行封堵。采用PDMS材料及软光刻技术进行芯片制作。本微流控芯片通过设置2-多条通道及中间连通部分33可以实现组织临界面的建立,且简单方便。
实施例4一种三维培养细胞的微流控芯片
一种三维培养细胞的微流控芯片,包括芯片层1与覆盖层2,其中芯片层1与覆盖层2结合后内包含3条通道,通道中间包括连通部分33,中间通道31口径较两侧通道32小;中间通道31设置为方形通道,两侧通道32设置为圆形或椭圆形通道。此种设置可以有效模拟两边为官腔或血管中间不为腔道的组织临界面模型。各通道两端分别设置进出孔21。还设置覆盖进出孔21的封堵帽4,封堵帽4下部尺寸与进出孔21孔径相同,上端尺寸较大,此种设置方便对封堵帽4的操作,且能有效对进出孔21进行封堵。采用PDMS材料及软光刻技术进行芯片制作。本微流控芯片通过设置2-多条通道及中间连通部分33可以实现组织临界面的建立,且简单方便。
实施例5一种肺泡-毛细血管屏障结构构建方法(上皮-间质细胞的联合培养)
(1)打开中间通道31进出孔21,关闭左右两侧微通道进出孔21,将细胞外基质胶(matrigel)与培养基的混合液(1:2)从c入孔注入中间通道31,37℃静置5min,使其形成凝胶状态;
(2)仅打开左侧通道进出孔21,将肺上皮细胞(A549)悬液从a孔注入芯片左侧通道内,将芯片与水平面呈90度垂直静置30min后,吸出通道内多余的细胞悬液,最终使得上皮细胞贴左侧通道内侧表面生长,形成腔样结构,模拟肺泡内表面上皮细胞层;
(3)关闭左侧微通道进出孔21,打开右侧通道进出孔21,将间质细胞(THP-1,MRC-5)悬液与matrigel胶1:2混合后,由e入孔注入芯片右侧通道内,37℃静置5min,使得间质细胞在matrigel胶中呈三维生长,模拟肺间质内细胞的生长方式;
(4)打开所有入孔,将新鲜培养基注入左侧通道,培养基通过中间通道31扩散至右侧通道,从而实现上皮-间质细胞的联合培养,以便将该模型用于后续机制研究。
(5)在上述生理结构模型基础上,用药物刺激诱发病理模型,观测病变过程。
构建的肺泡-毛细血管屏障结构如图7所示。
实施例6一种肺泡-毛细血管屏障结构构建方法(上皮-间质-毛细血管内皮细胞联合培养)
(1)打开中间通道31进出孔21,关闭左右两侧微通道进出孔21,将间质细胞悬液-细胞外基质胶(2:1)混合后,从进孔注入中间通道31,使其成三维生长,模拟肺间质区域;
(2)同上述实施例5中步骤2,将上皮细胞混悬液注入左侧通道,使其呈腔样生长,以模拟肺泡上皮层和肺泡腔;
(3)关闭左侧微通道进出孔21,打开右侧通道进出孔21,用上述步骤(2)中的方法将血管内皮细胞混悬液注入右侧通道,使其贴通道内侧表面呈管腔样生长,以模拟血管壁和血管腔;
(4)在上述生理结构模型基础上,用药物刺激诱发病理模型,观测病变过程。
上述实施例的说明只是用于理解本发明。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进,这些改进也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!