一种3,4,5‑三甲氧基苯类化合物及其在制备抗氧化药物中的应用的制作方法
本发明属药物化学领域,具体而言,本发明涉及新型抗氧化剂3,4,5-三甲氧基苯类化合物在制备抗氧化损伤药物及与氧化损伤相关疾病的治疗药物中的应用,这种抗氧化剂通过激活nrf2通路,上调通路下游相关蛋白gclc,进而清除胞内ros从而达到很好的抗氧化作用。
背景技术:
氧化损伤与多种疾病的发生、发展密切相关。例如脑缺血再灌注损伤、帕金森病、阿尔茨海默病等神经系统疾病中都存在氧化应激损伤,抗氧化剂能对这些疾病有治疗作用。抗氧化剂按来源可分为人工合成抗氧化剂(如bha、bht、pg等)和天然抗氧化剂(如茶多酚、植酸等)。按作用机制则可分为两类,一类为直接清除ros的抗氧化剂;第二类为通过激活抗氧化信号通路相关蛋白,间接起到清除ros作用抗氧化剂。目前临床应用的抗氧化剂或处于研究阶段的抗氧剂基本为单一机制,如脑中风缺血再灌注治疗用的依达拉奉通过直接清除自由基起到治疗作用,如天然产物黄酮等可以通过激活keap1-nrf2抗氧化信号通路起到抗氧化作用。到目前为止,基于同时通过直接清除自由基,和激活抗氧化信号通路起到抗氧化作用的研究极少报道。
本发明人经过长期和艰苦的研究实践,发现了3,4,5-三甲氧基苯基在抗氧化活性中起关键作用,并结合了抗氧化/炎症药物中酰基吡唑骨架结构,基于拼合原理设计了一类新型抗氧化剂,获得了具有直接清除ros和激活抗氧化信号通路双重机制的抗氧化活性化合物ws13。
技术实现要素:
本发明目的在于提供一个新型抗氧化剂ws13在制备抗氧化药物及与氧化应激损伤相关疾病的治疗药物中的应用。
本发明的另一目的是提供一种用于治疗氧化应激的药物组合物,其含有治疗有效量的作为活性成分的化合物ws13或其可药用盐及其药用辅料。
具体而言,本发明所述化合物为如下所述:
ws13的分子式为c18h24n2o4,化学名称为:1-(3-(3,4,5-trimethoxyphenyl)-3,4,5,6-tetrahydrocyclopenta[c]pyrazol-1(2h)-yl)propan-1-one.
就已经报道的抗氧化剂而言,其抗氧化活性筛选模型一般以保护细胞免受氧化损伤(如双氧水刺激模型,6-羟基多巴胺pd模型等),激活抗氧化信号通路、清除胞内ros等为主。因此,本发明首先用ws系列化合物对h2o2诱导的pc12细胞氧化损伤保护模型进行了化合物抗氧化活性的初筛(详情见实施例2)。化合物ws13具有较好的抗氧化活性,因此选择这个化合物进一步进行了抗氧化活性量效关系(详情见实施例3)研究,发现它对h2o2诱导的pc12细胞氧化损伤保护具有较好的量效关系。药物对氧化损伤的保护,应该从直接清除活性氧自由基和激活抗氧化信号通路两个方面进行考察,因此进行了以下方面的研究:ws13体外清除dpph实验和pc12细胞nrf2通路激活验证实验(详情见实施例4);ws13激活nrf2通路下游gclc蛋白表达实验(详情见实施例5);nrf2通路gclc蛋白生成抑制剂反向验证实验(详情见实施例5)。研究发现,化合物ws13能直接清除dpph,并明显激活nrf2入核而上调抗氧化相关蛋白gclc的表达,从而清除胞内ros达到抗氧化效果。ws13在抗氧化活性上表现出较好的量效关系,在10μm时,清除ros活性与依达拉奉相当。使用gclc抑制剂时,ws13的抗氧化活性则被抑制。以上实验结果说明ws13通过双重机制发挥抗氧化功能,并且nrf2-gclc通路的激活是发挥抗氧化活性的主要方式。综上所述,化合物ws13具有开发为抗氧化药物的前景。
本发明所述抗氧化化合物可以应用于制备抗氧化药物及与氧化应激相关疾病的治疗药物中,所述疾病的病因至少部分地是由氧化应激引起,所述疾病包括但不限于以下疾病:脑卒中、脑缺血再管注损伤、神经退行性疾病(如阿尔兹海默,帕金森)。
本发明还提供了一种用于治疗氧化应激疾病的药物组合物,其含有治疗有效量的作为活性成分的以上所述ws13或其可药用盐及其药用辅料。“药物组合物”指本发明所述化合物ws13或其可药用盐与现已上市的抗氧化药物联合使用,制备得到的防治氧化应激疾病类药物的组合物,已上市的抗氧化药物包括依达拉奉在内的各种合成或天然抗氧化剂。
本文中所用“药用辅料”指药学领域常规的药物载体,例如:稀释剂、赋形剂如水等,填充剂如淀粉、蔗糖等;粘合剂如纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如琼脂、碳酸钙和碳酸氢钠;吸收促进剂如季铵化合物;表面活性剂如十六烷醇;吸附载体如高岭土和皂粘土;润滑剂如滑石粉、硬脂酸钙/镁、聚乙二醇等。另外还可以在组合物中加入其它辅剂如香味剂、甜味剂等。
本发明药物组合物的各种剂型可以按照药学领域的常规生产方法制备。例如使活性成分与一种或多种载体混合,然后将其制成所需的剂型。所述药物的制剂形式包括注射剂、片剂、胶囊剂、气雾剂、栓剂、膜剂、滴丸剂、软膏剂、控释或缓释剂或纳米制剂。本发明可以组合物的形式通过口服、鼻吸入、直肠或者肠胃外给药的方式施用于需要这种治疗的患者。用于口服时,可将其制成常规的固体制剂如片剂、粉剂、粒剂、胶囊等,制成液体制剂如水或油悬浮剂或其它液体制剂如糖浆、酏剂等;用于肠胃外给药时,可将其制成注射用的溶液、水或油性悬浮剂等。
下面将结合实施例及说明书附图详细说明本发明。
附图说明
图1ws系列化合物合成路线方法。合成条件:(i)溶剂:环己烷;催化剂:对甲苯磺酸;温度:90℃;回流5-6h.(ii)溶剂:乙醇;温度:78℃;回流0.5-1.5h.(iii)试剂:hcl(aq);温度:室温;搅拌至ph~2.(iv)溶剂:乙醇;温度:78℃;回流2h.(v)溶剂:thf;试剂:et3n;温度:0℃;搅拌2h。
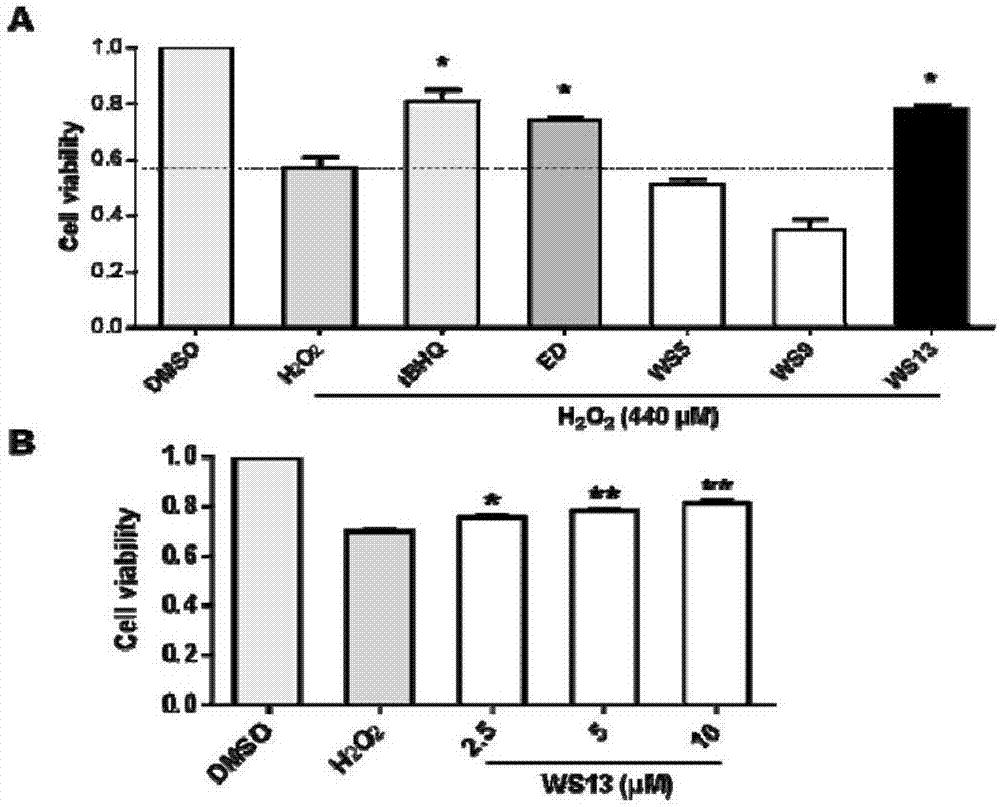
图2ws系列化合物抗氧化活性筛选。(a):pc12细胞用ws系列化合物(10μm)、tbhq(10μm)、或依达拉奉(10μm)预处理24h,随后h2o2(440μm)处理24h,最后通过噻唑蓝染料(mtt)法,用酶标仪测定od值,各组od值与溶剂dmso组od值相比,计算细胞生存率。(b):ws13在双氧水诱导的细胞模型中剂量依赖性提升pc12细胞生存率。不同浓度ws13预处理pc12细胞24h,随后双氧水处理24h。最后用mtt测定od值,计算细胞生存率。每个柱条为三次实验的平均值和误差值(与h2o2组相比,*p<0.05,**p<0.01)。
图3ws13抑制双氧水对pc12细胞的损伤作用。(a):ws13在双氧水诱导的细胞损伤模型中抑制pc12细胞凋亡。pc12细胞经10μm的ws13、依达拉奉、或ws13(2.5,5,10μm)预处理24h,随后双氧水(440μm)处理24h。收集细胞,经annexin-v与pi分别染色,由流式细胞仪检测细胞凋亡。(a-a)dmso;(a-b)h2o2;(a-c)tbhq;(a-d)依达拉奉;(a-e-g)2.5μm、5μm和10μm的ws13。(b):ws13预孵育减少双氧水处理的pc12细胞内ros水平。pc12细胞经10μm的ws13、依达拉奉、或tbhq预保护24h,随后经双氧水处理5h,胞内ros水平由流式细胞仪测定。
图4ws13直接清除ros,并激活nrf2核转位。(a):dpph清除实验。tbhq、依达拉奉或ws13的浓度为10μm。(b):nrf2核转位。pc12细胞经10μm的tbhq、依达拉奉或ws13孵育6h,随后用nrf2抗体和dapi染色,用荧光显微镜观察并拍照。
图5ws13通过诱导gclc的表达起到对细胞的抗氧化保护作用。(a):ws13诱导gclc的mrna转录。pc12细胞用不同浓度ws13(2.5,5,10μm)、tbhq(10μm)、依达拉奉(10μm)孵育24h,随后用rt-pcr评价gclc的mrna水平。每个柱条为三次实验的平均值和误差值(与dmso组相比,*p<0.05)。(b):ws13诱导gclc蛋白的表达。pc12细胞经ws13(2.5,5,10μm)、tbhq(10μm)孵育24h,westblotting实验检测gclc的表达情况。(c):gclc抑制剂bso抑制了ws13对双氧水诱导细胞损伤的保护作用。pc12细胞经gclc抑制剂bso孵育2h,随后经10μm的ws13、tbhq或依达拉奉孵育24h,最后用mtt法检测细胞生存率。每个柱条为三次实验的平均值和误差值(#p<0.05,与双氧水组相比;*p<0.05,与不加bso组相比)。
具体实施方式
本发明在以下的实施例中进一步说明。这些实施例只是为了说明的目的,而不是用来限制本发明的范围。
实施例1化合物的合成。
合成路线见图1。将10mmol环戊酮和吗啡啉溶于20ml的环己烷中,90℃下回流5-6h后,用tlc检测反应的进程。反应完后,减压旋干溶剂后加20ml乙醇复溶,随后加入15mmol的3,4,5-三甲氧基苯甲醛,78℃回流0.5-1.5h,tlc监测反应完全后用1m的盐酸水溶液室温调ph值至2-3。静置析出沉淀,抽滤,真空干燥过夜后得不饱和酮中间体。中间体与当量的水合肼溶于乙醇,78℃回流2h得环化中间体。1mmol的环化中间体与当量的酰氯溶于thf,经et3n催化冰浴2h得目标产物,经硅胶柱色谱纯化后纯度均大于98%。在合成的所有化合物中,药理活性差别很大,有代表性的化合物及其理化性质如下所述:
有效化合物ws13:1-(3-(3,4,5-trimethoxyphenyl)-2,3,5,6-tetrahydrocyclopenta[c]pyrazol-1(4h)-yl)propa-1-one:yellowpower,81.1%yield,mp132.3-135.7℃.1h-nmr(cdcl3),δ:8.132(d,j=15.6hz,1h,h-β),7.926(d,j=8.4hz,2h,h-2’,h-6’),7.733(d,j=9.6hz,1h,h-6),7.490(d,j=15.6hz,1h,h-α),7.431(d,j=9hz,1h,h-3),7.307(m,1h,h-5),7.302(m,1h,h-3),6.700(d,j=8.4hz,2h,h-3’,h=5’),4.190(brs,2h,nh2-4’).esi-msm/z:332.2,333.1(m+h)+,calcdforc18h24n2o4:332.17.
对比用无效化合物ws9:3-chloro-1-(3-(3,4,5-trimethoxyphenyl)-2,3,5,6-tetrahydrocyclopenta[c]pyrazol-1(4h)-yl)propan-1-one:orangeyellowpowder,38.4%yield,mp123.3~125.6℃.1h-nmr(600mhz,d-dmso),δ:6.523(s,2h,ar2-h,ar6-h),4.952(d,j=8.4hz,1h,n-ch),3.822(t,j=10.8hz,2h,ch2-cl),3.739(s,6h,ar3-och3,ar5-och3),3.629(s,3h,ar4-och3),3.182(t,j=13.2hz,2h,c=o-ch2),2.069~2.028(m,2h,ar3’-h),2.001~1.968(m,2h,ar5’-h),1.509(m,2h,ar4’-h).lc-msm/z:366.1,367.1(m+h)+,calcdforc18h23cln2o4:366.13.具体结构式如下:
对比用无效化合物ws5:cyclohexyl(3-(3,4,5-trimethoxyphenyl)-2,3,5,6-tetrahydrocyclopenta[c]pyrazol-1(4h)-yl)methanone:khakipower,63.2%yield,mp105.1~108.5℃.1h-nmr(600mhz,d-dmso),δ:6.236(s,2h,ar2-h,ar6-h),5.462(d,j=10.8hz,1h,n-ch),3.702(s,6h,ar4-och3,ar5-och3),3.622(s,3h,ar3-och3),3.013(t,j=15.6hz,2h,3’-h,5’-h),2.274~2.217(m,1h,c=o-ch),1.988~1.939(m,2h,4’-h),1.726~1.578(dt,4h,ar2’-h,ar6’-h),1.402~1.232(dt,4h,ar3’-h,ar5’-h),0.647~0.576(m,2h,ar4’-h).lc-msm/z:386.2,387.1(m+h)+,calcdforc22h30n2o4:386.22.具体结构式如下:
实施例2ws13对h2o2诱导的pc12细胞氧化损伤具有保护作用。
以5000个/孔的细胞密度在96孔板接种pc12细胞,培养箱过夜。ws系列化合物(10μm)、tbhq(10μm)、或依达拉奉(10μm)孵育24h。随后h2o2(440μm)刺激,培养箱培养24h。最后用mtt法染色,酶标仪测od值,计算细胞生存率。由图2所示的结果显示,与溶剂dmso组相比,加双氧水后能明显抑制细胞的生存。本发明的有效化合物ws13能够明显提高双氧水存在条件下的细胞生存率,而对比化合物ws5和ws9无此活性。具体而言,ws13具有优于依达拉奉,等同tbhq的细胞生存保护活性。此外,ws13表现出较好的量效关系,随给药剂量增加,对双氧水诱导细胞损伤的保护作用明显提升。
实施例3ws13清除pc12细胞内ros并抑制细胞凋亡。
以40万个/孔的细胞密度在6孔板接种pc12细胞,培养箱过夜。细胞经tbhq(10μm)、依达拉奉(10μm)、或ws13(2.5,5,10μm)预处理24h,随后双氧水(440μm)刺激,培养箱培养24h。用不含edta的胰酶消化,收集细胞。经annexin-v与pi分别染色,由流式细胞仪检测细胞凋亡。结果见图3,h2o2能明显诱导pc12细胞凋亡,而ws13可明显地抑制h2o2诱导的细胞凋亡,上调细胞的生存率(图3a)。接种pc12细胞,过夜培养后用ws13(10μm)、tbhq(10μm)、或依达拉奉(10μm)孵育24h,随后h2o2刺激5h。移除培养基,加入含1/1000浓度dcfh探针的无血清无双抗培养基,染色后经流式细胞仪检测荧光信号,检测pc12细胞胞内ros水平。结果显示,h2o2能明显诱导pc12细胞ros水平的上升,而10μm的ws13能明显清除胞内ros,其活性与依达拉奉或tbhq相当(图3b)。因此,ws13可以清除双氧水诱导pc12细胞ros的生成,抑制双氧水诱导的细胞凋亡。
实施例4ws13具有双重抗氧化机制。
为了考察ws13的抗氧化机制,我们检测了ws13对自由基dpph的清除活性和诱导nrf2核转位的活性。结果见图4。以10μm浓度的ws13进行体外dpph清除实验,结果显示ws13具有一定的直接清除自由基dpph的活性,但其活性低于对照依达拉奉或tbhq(图4a)。以30万个/孔细胞密度接种pc12细胞于6孔板(含载玻片),过夜培养后,加入依达拉奉、tbhq或ws13(10μm)孵育6h。随后多聚甲醛固定细胞。经dpai和nrf2抗体依次孵育,荧光显微镜观察,选取合适视野拍照,检测nrf2核转位效果。结果显示,ws13能够明显增加nrf2的核转位水平,效果优于依达拉奉或tbhq(图4b)。以上结果提示,ws13既具有直接清除自由基,也具有激活抗氧化信号通路nrf2的功能,因此ws13可能通过直接清除自由基和激活抗氧化信号通路的双机制起到抗氧化作用,从而起到对双氧水诱导细胞凋亡的保护作用。
实施例5ws13通过诱导gclc的表达起到对细胞的抗氧化保护作用。
nrf2通路下游蛋白的表达变化可以直接反应药物对nrf2通路的激活情况,因此研究了ws13对nrf2通路下游蛋白gclc的表达情况,结果见图5。pc12细胞用药物孵育24h后,与对照依达拉奉或tbhq一样,ws13可明显上调gclc的mrna的转录表达水平,在ws13的浓度(2.5,5,10μm)递增时,其诱导mrna的表达呈现出明显的剂量依赖性(图5a)。进一步用westblotting测定了药物对gclc蛋白表达水平的影响,ws13在2.5μm浓度下就可以诱导蛋白表达,在10μm浓度下表现出与tbhq相当的活性(图5b)。因此,ws13可以明显诱导pc12细胞中nrf2通路gclc蛋白的表达。
为了进一步研究ws13对双氧水诱导细胞凋亡的保护作用是否是由于激活nrf2通路gclc蛋白表达后所导致,进一步用gclc蛋白抑制剂bso进行了研究(图5c)。pc12细胞用bso孵育2h,随后经10μm的ws13、tbhq或依达拉奉孵育24h,再用mtt法检测细胞生存率。由图5c可知,ws13、tbhq或依达拉奉均对双氧水诱导的细胞损伤具有保护作用,能够明显提高细胞生存率;bso加入后可以明显抑制ws13、tbhq或依达拉奉对细胞损伤的保护作用。即加入gclc抑制剂bso后,ws13对pc12细胞的保护作用被逆转了,这也表明ws13确实是通过上调gclc的表达来执行对细胞的抗氧化保护作用。
- 还没有人留言评论。精彩留言会获得点赞!