一种用于肺腺癌诊治的分子标志物的制作方法
本发明属于生物医药领域,涉及一种用于肺腺癌诊治的分子标志物,具体的所述靶标为loc101926969。
背景技术:
肺癌是人类最常见的恶性肿瘤之一,亦是癌症相关死亡的主要原因。尽管肺癌诊断和治疗方法和技术不断的更新提高,但是整体预后仍不理想,其死亡率仍高居癌症之首,5年的生存率还不到15%。而非小细胞肺癌占所有肺癌病人的85%以上,在非小细胞肺癌中,肺腺癌又是其中最主要的部分,其最有效的治疗方法是全肺切除术加合适的辅助放化疗策略,但即使是i期的患者,肿块完全切除之后,仍有约大于25%的患者短期内即复发,严重影响危害人类健康和生命。
近些年随着对肺癌发生发展机制的研究深入,寻找到一些治疗靶点,以及新的靶向治疗方法的尝试为肺癌的诊断治疗带来新的突破,但是由于目前研究发现可药性的靶点数量少及其异常的分布人群范围窄,因此相应的治疗方法的适用人群范围窄以及还存在治疗抵抗等问题,使得治疗效果面临挑战。所以从分子水平,筛选新的与非小细胞肺癌相关的可药性靶点以及发展新的治疗策略成为肺癌研究领域持续的热点。
随着基因组微阵列以及全基因组和转录组测序技术的出现,发现人类转录组有大量的反义基因、重叠基因和非编码rna表达(non-codingrnas,ncrnas)。lncrna是一类长度超过200bp核苷酸的非编码rna,有时长度可以达到100kb。lncrna在人类中广泛表达,并且在基因全局调控的多个生理过程中发挥重要作用。已有研究证实lncrna与多种人类疾病、尤其是肿瘤性疾病密切相关。有些lncrna与疾病的发生呈现明显的正相关,即在疾病的发生发展过程中相应的lncrna呈现过表达状态;有些lncrna与疾病的发生呈现出一定的负相关,即在疾病的发生发展过程中相应的lncrna表达量与正常组织或正常人相比明显降低。但是由于lncrna本身并不编码蛋白质,它在生物学过程中起到具体作用的研究还非常少。寻找与肺腺癌相关的lncrna,并探讨其在肺腺癌发病过程中的机制,对于疾病的早期诊断和靶向治疗,以及lncrna基因的科学研究都具有重大的意义。
技术实现要素:
为了弥补现有技术的不足,本发明的目的在于提供一种用于肺腺癌诊治的分子标志物。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了检测loc101926969基因表达的试剂在制备诊断早期肺腺癌的产品中的应用。
进一步,所述试剂选自:
特异性识别loc101926969的探针;或
特异性扩增loc101926969的引物。
较佳的,所述的特异性扩增loc101926969基因的引物序列如seqidno.2和seqidno.3所示。
本发明提供了一种诊断肺腺癌的产品,所述产品包括通过测序技术、核酸杂交技术、核酸扩增技术检测样本中loc101926969基因的表达水平。其中,所述产品包括(但不限于)芯片、制剂或试剂盒。
进一步,所述核酸扩增技术选自聚合酶链式反应、逆转录聚合酶链式反应、转录介导的扩增、连接酶链式反应、链置换扩增和基于核酸序列的扩增。
本发明提供了loc101926969基因在制备预防或治疗肺腺癌的药物组合物中的应用。
进一步,所述药物组合物包括loc101926969的下调剂。所述下调剂选自:以loc101926969或其转录本为靶序列、且能够抑制loc101926969基因表达或基因转录的干扰分子,包括:shrna(小发夹rna)、小干扰rna(sirna)、dsrna、微小rna、反义核酸,或能表达或形成所述shrna、小干扰rna、dsrna、微小rna、反义核酸的构建物。
进一步,所述的下调剂为sirna。优选的所述sirna序列如seqidno.8、seqidno.9所示。
进一步,所述药物组合物还包括与所述下调剂配伍的其他药类以及药学上可接受的载体和/或辅料。
本发明提供了loc101926969基因在筛选预防或治疗肺腺癌的潜在物质中的应用。
本发明提供了一种筛选预防或治疗肺腺癌的潜在物质的方法,所述方法包括:
用候选物质处理表达或含有loc101926969基因的体系;和
检测所述体系中loc101926969基因的表达;
其中,若所述候选物质可降低loc101926969基因的表达或活性,(优选显著降低,如低20%以上,较佳的低50%以上;更佳的低80%以上),则表明该候选物质是预防或治疗肺腺癌的潜在物质。所述体系选自:细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
所述候选物质包括(但不限于):针对loc101926969基因或其上游或下游基因设计的干扰分子、核酸抑制物、小分子化合物等。
本发明的优点和有益效果:
本发明首次发现了loc101926969的差异表达与肺腺癌的发生发展相关,提示该基因可用于作为诊断肺腺癌的指标。
本发明通过实验证明,sirna沉默loc101926969基因的表达,可以抑制肺腺癌细胞的增殖,降低肺腺癌细胞的迁移和侵袭率,提示loc101926969基因可作为药物靶点用于治疗肺腺癌及其转移。
附图说明
图1是利用qpcr检测loc101926969基因在肺腺癌组织中的表达情况图;
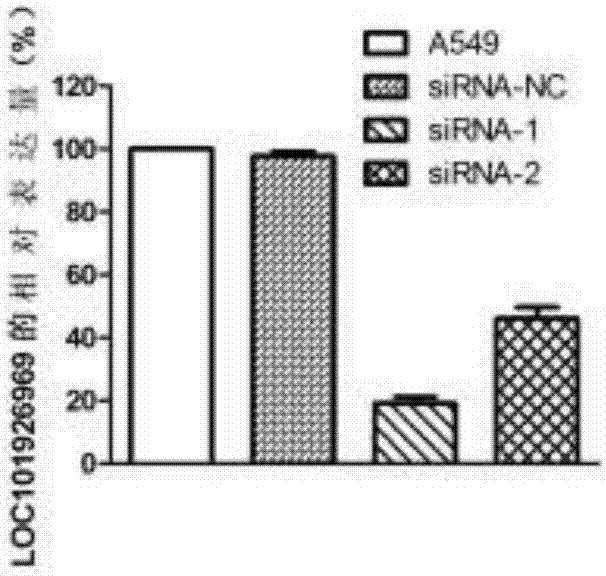
图2是利用qpcr检测loc101926969在肺腺癌细胞中的转染情况图;
图3是用cck-8法检测loc101926969基因对肺腺癌细胞增殖的影响图;
图4是用流式细胞仪检测loc101926969基因对肺腺癌细胞凋亡的影响图;
图5是利用transwell小室检测loc101926969对肺腺癌细胞迁移和侵袭的影响图;其中图a是loc101926969对肺腺癌细胞迁移的影响图;图b是loc101926969对肺腺癌细胞侵袭的影响图。
具体的实施方式
本发明经过广泛而深入的研究,通过高通量方法,采用目前覆盖数据库最广的lncrna芯片,检测肺腺癌标本中lncrna在肿瘤组织和癌旁组织的表达,发现其中具有明显表达差异的lncrna片段,探讨其与肺腺癌的发生之间的关系,从而为肺腺癌的早期检测及靶向治疗寻找更好的途径和方法。通过筛选,本发明首次发现了肺腺癌中loc101926969显著性上调。实验证明,sirna干扰沉默loc101926969,能够有效地抑制肺腺癌细胞的增殖和侵袭,为肺腺癌的精准治疗提供了新途径。
分子标志物
“分子标志物”是其在组织或细胞中的表达水平与正常或健康细胞或组织的表达水平相比发生改变的任何基因。
本领域技术人员将认识到,本发明的实用性并不局限于对本发明的标志物基因的任何特定变体的基因表达进行定量。作为非限制性的实例,标志物基因可具有seqidno.1指定的核苷酸序列。在一些实施方案中,其具有与所列的序列至少85%相同或相似的cdna序列诸如上述所列的序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%相同或相似的cdna序列。
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。可以在转录水平上检测生物标志物的表达水平。
loc101926969基因
loc101926969是位于人2号染色体短臂1区上,一种代表性的人loc101926969基因的核苷酸序列如seqidno.1所示。本发明中的loc101926969包括野生型、突变型或其片段。
本领域技术人员将认识到,本发明的实用性并不局限于对本发明的靶标基因的任何特定变体的基因表达进行定量。如果当核酸或其片段与其它核酸(或其互补链)最佳比对时(具有适当的核苷酸插入或缺失),在至少大约60%的核苷酸碱基、通常至少大约70%、更通常至少大约80%、优选至少大约90%、及更优选至少大约95-98%核苷酸碱基中存在核苷酸序列相同性,则这两个序列是“基本同源的”(或者基本相似的)。
或者,当核酸或其片段与另一核酸(或其互补链)、一条链或其互补序列在选择性杂交条件下杂交时,则其间存在基本同源或(相同性)。当杂交比特异性整体丧失发生更具选择性时,存在杂交选择性。典型地,当在至少大约14个核苷酸的一段序列存在至少大约55%相同性、优选至少大约65%、更优选至少大约75%及最优选至少大约90%相同性时,发生选择性杂交。如本文所述,同源对比的长度可以是较长的序列节段,在某些实施方案中通常为至少大约20个核苷酸,更通常为至少大约24个核苷酸,典型为至少大约28个核苷酸,更典型为至少大约32个核苷酸,及优选至少大约36或更多个核苷酸。
因此,本发明的多核苷酸与seqidno.1优选具有至少75%、更优选至少85%、更优选至少90%同源性。更优选地,存在至少95%、更优选至少98%同源性。
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。可以在转录水平上检测生物标志物的表达水平。
检测技术
本发明的lncrna使用本领域普通技术人员已知的多种核酸技术进行检测,这些技术包括但不限于:核酸测序、核酸杂交和核酸扩增技术。
核酸测序技术的示例性非限制性实例包括但不限于链终止子(sanger)测序和染料终止子测序。本领域的普通技术人员将认识到,由于rna在细胞中不太稳定并且在实验中更易受到核酸酶攻击,因此在测序前通常将rna逆转录成dna。
本发明可在检测前或与检测同时地对核酸(例如,ncrna)进行扩增。核酸扩增技术的示例性非限制性实例包括但不限于:聚合酶链式反应(pcr)、逆转录聚合酶链式反应(rt-pcr)、转录介导的扩增(tma)、连接酶链式反应(lcr)、链置换扩增(sda)和基于核酸序列的扩增(nasba)。本领域的普通技术人员将认识到,某些扩增技术(例如,pcr)需要在扩增前将rna逆转录成dna(例如,rt-pcr),而其他扩增技术则直接扩增rna(例如,tma和nasba)。
通常称为pcr的聚合酶链式反应使用变性、引物对与相反链的退火以及引物延伸的多个循环,以指数方式增加靶核酸序列的拷贝数;tma的转录介导的扩增(在基本上恒定的温度、离子强度和ph的条件下自身催化地合成靶核酸序列的多个拷贝,其中靶序列的多个rna拷贝自身催化地生成另外的拷贝;lcr的连接酶链式反应使用与靶核酸的相邻区域杂交的两组互补dna寡核苷酸;其他扩增方法包括例如:通常称为nasba的基于核酸序列的扩增;使用rna复制酶(通常称为qβ复制酶)扩增探针分子本身的扩增;基于转录的扩增方法;以及自我维持的序列扩增。
本发明中非扩增或扩增的核酸可通过任何常规的手段检测。
芯片、试剂盒
本发明提供了检测中loc101926969基因的表达水平的产品,所述产品包括(但不限于)制剂、芯片或试剂盒。其中芯片包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于loc101926969所示的部分或全部序列。
术语“探针”指能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,术语“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严格性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括,但不限于:溶液相、固相、混合相或原位杂交测定法。
本发明提供了一种试剂盒,所述试剂盒可用于检测loc101926969的表达。优选的,所述的制剂或试剂盒中还含有用于标记rna样品的标记物,以及与所述标记物相对应的底物。此外,所述的试剂盒中还可包括用于提取rna、pcr、杂交、显色等所需的各种试剂,包括但不限于:抽提液、扩增液、杂交液、酶、对照液、显色液、洗液等。此外,所述的试剂盒中还包括使用说明书和/或芯片图像分析软件。
下调剂和药物组合物
基于本发明人的发现,本发明提供了一种loc101926969的下调剂的用途,用于制备抑制肺腺癌的药物组合物。如本文所用,所述的loc101926969的下调剂包括但不限于抑制剂、拮抗剂、阻滞剂、阻断剂、核酸抑制物等。
所述的loc101926969的下调剂是指任何可下调loc101926969基因的表达、或抑制loc101926969基因的转录的物质,这些物质作为对于下调loc101926969有用的物质,可用于预防或治疗肺腺癌。
作为本发明的一种优选方式,所述loc101926969的下调剂是一种loc101926969特异性的小干扰rna分子。如本文所用,所述的“小干扰rna”是指一种短片段双链rna分子,能够以同源互补序列的mrna为靶目标降解特定的mrna,这个过程就是rna干扰(rnainterference)过程。小干扰rna可以制备成双链核酸的形式,它含有一个正义链和一个反义链,这两条链仅在杂交的条件下形成双链。一个双链rna复合物可以由相互分离的正义链和反义链来制备。因此,举例来讲,互补的正义链和反义链是化学合成的,其后可通过退火杂交,产生合成的双链rna复合物。
在筛选有效的sirna序列时,本发明人通过大量的比对分析,从而找出最佳的有效片段。本发明人设计合成了多种sirna序列,并将它们分别通过转染试剂转染肺腺癌细胞系进行验证,选出干扰效果最佳的sirna,进一步地在细胞水平实验,结果证明对于该sirna在能有效的抑制细胞中loc101926969基因的表达水平,以及肺腺癌细胞的增殖。
本发明的核酸抑制物如sirna可以化学合成,也可以通过一个重组核酸结构里的表达盒转录成单链rna之后进行制备。sirna等核酸抑制物,可通过采用适当的转染试剂被输送到细胞内,或还可采用本领域已知的多种技术被输送到细胞内。
药物组合物
本发明还提供了一种组合物,它含有有效量的所述的loc101926969的下调剂,以及药学上可接受的载体。所述的组合物可用于抑制肺腺癌。任何前述的loc101926969的下调剂均可用于组合物的制备。
如本文所用,所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质等。所述的载体中还可以含有细胞(宿主细胞)转染试剂。
本发明可以采用用本领域熟知的多种方法来将所述的下调剂或其编码基因、或其药物组合物给药于哺乳动物。包括但不限于:皮下注射、肌肉注射、经皮给予、局部给予、植入、缓释给予等;优选的,所述给药方式是非肠道给予的。
优选的,可采用基因治疗的手段进行。比如,可直接将loc101926969的下调剂通过诸如注射等方法给药于受试者;或者,可通过一定的途径将携带loc101926969的下调剂的表达单位(比如表达载体或病毒等,或sirna或shrna)递送到靶点上,并使之表达活性的loc101926969下调剂,具体情况需视所述的下调剂的类型而定,这些均是本领域技术人员所熟知的。
本发明的药物组合物可以进一步包含一种或多种抗癌剂。在具体的实施方案中,药物组合物包含至少一种抑制loc101926969基因表达的化合物和至少一种化疗剂。用于本发明的方法的化疗剂,包括但不限于,dna-烷化剂,抗肿瘤抗生素剂,抗代谢剂,微管蛋白稳定剂,微管蛋白去稳定剂,激素拮抗剂,拓扑异构酶抑制剂,蛋白激酶抑制剂,hmg-coa抑制剂,cdk抑制剂,细胞周期蛋白抑制剂,胱天蛋白酶抑制剂,金属蛋白酶抑制剂,反义核酸,三链螺旋dna,核酸适体,和分子修饰的病毒、细菌和外毒素试剂。
可药用载体可包括但不限于:病毒、脂质体、纳米颗粒或聚合物及其任意组合。相关的递送载剂可包括但不限于:脂质体、生物相容性聚合物(包括天然聚合物和合成聚合物)、脂蛋白、多肽、多糖、脂多糖、人工病毒包膜、无机(包括金属)颗粒、以及细菌或病毒(例如杆状病毒、腺病毒和逆转录病毒)、噬菌体、黏粒或质粒载体。
本发明的药物组合物还可与其他治疗肺腺癌的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
本发明的药物组合物还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
药物筛选
本发明提供了一种筛选预防或治疗肺腺癌药物的方法,即:
在实验组中,向细胞培养体系中加入待测化合物,并测定loc101926969的表达水平;在对照组中,向同样的培养体系中不加入待测化合物,并测定loc101926969的表达水平;其中,如果实验组中loc101926969的表达水平大于对照组,则说明该候选化合物为loc101926969的下调剂。
在本发明中,所述的方法还包括:对上面步骤获得的候选化合物进一步测试其抑制肝癌的效果,若测试化合物对肺腺癌有显著的抑制效果,则说明该化合物为预防或治疗肺腺癌的潜在物质。
本发明中,术语“样本”以其最广泛的含义使用。在一种含义中,意在包括从任何来源获得的标本或培养物,以及生物和环境样本。生物样本可获自动物(包括人)并涵盖液体、固体、组织和气体。生物样本包括血液制品,诸如血浆、血清等。然而,此类样本不应解释为限制适用于本发明的样本类型。
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1筛选与肺腺癌相关的基因标志物
1、样品收集
各收集8例肺腺癌癌旁组织和肺腺癌组织样本。肺腺癌肿瘤组织标本取材部位为主要肿瘤区域,位于肿瘤肿块中外1/3与正常组织交接处,排除肿瘤中心明显坏死、钙化部分以及肿瘤外围正常肺组织;癌旁正常肺组织标本取自肿瘤边缘5cm以上的部位,肉眼观察无明显变化。上述所有标本的取得均通过组织伦理委员会的同意。
2、rna样品的制备(利用e.z.n.a.
在研钵中导入液氮,取上述获得的组织放入研钵中,在液氮中剪碎并研磨成粉末,剪碎后投入液氮中并研磨至粉末状,随后转入玻璃匀浆器中;组织匀浆在玻璃匀浆器中加入trizol试剂,在冰上研磨组织。将匀浆后组织匀浆液转入无rna酶的ep管中,室温下静置5min。按照试剂盒中的说明书提取分离rna。具体如下:
1)rna的分离:
在ep管中加入0.2m1氯仿,盖紧ep管盖,手动剧烈振荡15s,使其充分混匀。室温下孵化5min。然后在4℃下以14000g离心15min。离心后样品分为三层,rna存在于上层水相中。
2)rna沉淀
将分离得的水相取450μl移至新的无rna酶的ep管中,按照1:1的比例加入450μl异丙醇,上下颠倒混匀后在室温下孵化10min,4℃14000g离心10min。
3)rna洗脱
离心后小心移去上清,加入1ml75%乙醇(灭酶处理,现用现配并在冰上预冷)冲洗rna,随后4℃7500g离心5min。
4)rna再溶解
小心移去洗涤之后的上清,在超净工作台中打开ep管管盖,在室温下放置rna样本5-10min,晾干。加入无rna酶处理水20-50μl,55-60℃水浴箱中水浴10min。
5)rna样品的质量分析
分光光度计检测:
nanodrop1000分光光度计检测rna样品,rna-seq测序的样品要求:od260/od280为1.8-2.2。
琼脂糖凝胶电泳检测:
将上述提取的rna进行琼脂糖凝胶电泳,agilenttechnologies2100bioanalyzer检测rna样品质量,观察28srrna和18srrna主带明显、无降解、rna完整性指数合格、浓度达到要求,可以用于芯片的lncrna表达谱及筛选实验。
3、逆转录和标记
用lowrnainputlinearamplificationkit将mrna逆转录成cdna,同时用cy3分别标记实验组和对照组。
4、杂交
基因芯片采用康城生物-humanlncrnaarray,按芯片使用说明书的步骤进行杂交。
5、数据分析
利用agilentgenespring软件对芯片结果进行分析,筛选表达量具有显著性差异(标准为该lncrna在癌与癌旁的表达量相差2倍以上,而且p<0.05)的lncrna。
6、结果
结果显示,loc101926969在肺腺癌组织中的表达量显著高于癌旁组织中的表达量。
实施例2qpcr测序验证loc101926969基因的差异表达
1、对loc101926969基因差异表达进行大样本qpcr验证。按照实施例1中的样本收集方式选择肺腺癌癌旁组织和肺腺癌组织各50例。
2、rna提取步骤如实施例1所述。
3、逆转录
1)反应体系:
rna模板1μl,随机引物1μl,双蒸水加至12μl,混匀,低转速离心,65℃5min,然后放在冰上冷却。
继续在12μl反应液中加入下列成分:
5×反应缓冲液4μl,rna酶抑制剂(20u/μl)1μl,10mmdntp混合液2μl,amv反转录酶(200u/μl)1μl;充分混匀并进行离心处理;
2)逆转录反应条件
25℃5min,42℃60min,70℃5min。
3)聚合酶链反应
引物设计:
根据genebank中loc101926969基因和gapdh基因的编码序列设计qpcr扩增引物,由博迈德生物公司合成。具体引物序列如下:
loc101926969基因:
正向引物为5’-ttctgagtgtcggataac-3’(seqidno.2);
反向引物为5’-gcaagttctgatgtaagtg-3’(seqidno.3)。
gapdh基因:
正向引物为5’-aatcccatcaccatcttccag-3’(seqidno.4);
反向引物为5’-gagccccagccttctccat-3’(seqidno.5)。
配制pcr反应体系:
2×qpcr混合液12.5μl,基因引物2.0μl,反转录产物2.5μl,ddh2o8.0μl。
pcr反应条件:95℃10min,(95℃15s,60℃60s)×40个循环,60℃5min延伸反应。75℃至95℃,每20s升温1℃,绘制溶解曲线。以sybrgreen作为荧光标记物,在lightcycler荧光定量pcr仪上进行pcr反应,通过融解曲线分析和电泳确定目的条带,δδct法进行相对定量。
5、统计学方法
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss18.0统计软件来进行统计分析的,癌与癌旁组织的配对比较采用t检验,认为当p<0.05时具有统计学意义。
6、结果
结果如图1所示,与肺腺癌癌旁组织相比,loc101926969在肺腺癌组织中表达上调,差异具有统计学意义(p<0.05),同芯片检测结果一致。
实施例3loc101926969基因的沉默
1、细胞培养
人肺腺癌细胞株a549,以含10%胎牛血清和1%p/s的rpmi1640培养基在37℃、5%co2、相对湿度为90%的培养箱中培养。2-3天换液1次,使用0.25%含edta的胰蛋白酶常规消化传代。
将培养瓶中的细胞用胰酶进行消化并接种在6孔板中,保证细胞数为2-8×105个/孔,加入细胞培养基。过夜,第二天观察细胞密度,细胞密度为70%以上可进行转染。
2、sirna的设计
阴性对照sirna序列(sirna-nc):
正义链为5’-uucuccgaacgugucacgu-3’(seqidno.6)
反义链为5’-acgugacacguucggagaa-3’(seqidno.7)
sirna-1:
正义链为5’-uacagaaaauaagucauagaa-3’(seqidno.8)
反义链为5’-cuaugacuuauuuucuguagu-3’(seqidno.9)
sirna-2:
正义链为5’-uucuucuuuguacaguuacca-3’(seqidno.10)
反义链为5’-guaacuguacaaagaagaaau-3’(seqidno.11)
3、转染
将实验分为三组:对照组(a549)、阴性对照组(sirna-nc)和实验组(sirna1、sirna2),其中阴性对照组sirna与loc101926969基因的序列无同源性,浓度为20nm/孔,同时分别进行转染。
4、qpcr检测loc101926969基因的转录水平
4.1细胞总rna的提取
1)将6孔板中的细胞培养液倒掉,用pbs冲洗两次,各孔加入1mltrizol试剂,室温放置5min。
2)加入0.2m1氯仿,剧烈震荡15s,4℃,12000g离心15min。
3)水相转移到新管中,加入4.5m1异丙醇,室温放置10min;4℃,10000g离心10min。
4)倒掉液体,用lml的75%乙醇洗ep管壁。4℃,7500g,离心5min。
5)倒掉清洗后的75%乙醇,室温晾置5-10min。
6)加入25μ1无rna酶的depc水,-70℃保存。
4.2逆转录步骤同实施例2。
4.3qpcr扩增步骤同实施例2。
5、统计学方法
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss18.0统计软件来进行统计分析的,loc101926969基因实验组与对照组之间的差异采用t检验,认为当p<0.05时具有统计学意义。
6、结果
结果如图2显示,与非转染组与转染sirna-nc组相比,实验组中的loc101926969的表达水平显著降低,差异具有统计学意义(p<0.05)。
实施例4loc101926969基因对肺腺癌细胞增殖的影响
采用cck-8实验检测loc101926969基因对肺腺癌细胞增殖能力影响。
1、细胞培养与转染步骤同实施例3,转染后6h换液,放置细胞培养箱过夜。
2、第二天将细胞取出,显微镜下观察细胞生长情况,1ml/孔加入含edta的胰酶,进行细胞消化,待消化完成后去除胰酶,加入细胞培养基混匀使细胞悬浮,然后进行细胞计数。
3、将细胞悬液浓度稀释为15000个/ml,之后往96孔板中进行接种,每孔加入细胞悬液200μ1,细胞控制在3000个左右,接种8个复孔。设置sirna-1实验组和sirna-nc对照组。共铺4块96孔板分别用于24h、48h、72h、96h4个检测时间点。
4、24h后,将第一块96孔板取出,每孔中加入10μ1的cck-8检测液,将96孔板继续放入细胞培养箱中孵育4h左右,用酶标仪检测各孔在450nm波长处的吸光度值并记录数据。
5、在48h、72h、96h后分别重复步骤4中的操作,最后统计出各时间点的吸光度值,作出生长曲线图。
6、统计学分析
实验都是按照重复3次来完成的,采用spss18.0统计软件来进行统计分析,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。
7、结果
结果如图3所示,与对照相比,实验组在转染sirna-1后,细胞的增殖明显受到了抑制,差异具有统计学意义(p<0.05)说明loc101926969具有促进细胞增殖的作用。
实施例5loc101926969基因对肺腺癌细胞凋亡的影响
使用流式细胞仪检测loc101926969基因对细胞凋亡的影响。
1、细胞培养步骤同实施例3。
2、细胞转染步骤同实施例3。
3、步骤
1)将3m110×上样缓冲液用27m1蒸馏水稀释。
2)收集细胞样本并用预冷的pbs清洗。
3)将细胞加入lml1×上样缓冲液,300g离心10min,吸出缓冲液。
4)再次加入lml1×上样缓冲液,将细胞悬液中细胞浓度调整为1×106个/ml。
5)将细胞悬液取出100μ1,加入ep管中。
6)将5μl的annexinvfitc加入ep管中,混匀ep管中的液体,在室温下避光孵育10min。
7)向ep管中加入5μ1pi染液,在室温下避光5min。
8)在ep管中加入500μl的pbs溶液,轻轻混匀,1h内上流式细胞仪进行检测。
3、统计学方法
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss13.0统计软件来进行统计分析的,两者之间的差异采用的t检验,认为当p<0.05时具有统计学意义。
4、结果:
结果如图4所示,实验组与对照组相比,细胞凋亡率有显著的变化(p<0.05),该结果说明,loc101926969抑制细胞的凋亡。
实施例6细胞迁移及侵袭实验
1、transwell小室制备
无菌条件下matrigel冰浴融化,用pbs进行20倍稀释,以50μl/孔的体积铺在transwell小室的聚碳酸酯膜上。37℃放置4h,待matrigel胶聚合成凝胶后取出,轻轻吸出上层析出液。每孔中加入50μl的含bsa的无血清培养液对基底膜进行水化处理,37℃放置30min。
2、配置细胞悬液
细胞撤血清饥饿处理12-24h,对细胞进行消化处理,终止消化后进行离心,去除上层培养液。用pbs对沉淀细胞进行清洗,加入含有bsa的无血清培养基对其进行重悬。调整细胞的密度至5×l05个/ml。
3、细胞接种
取细胞悬液200μ1(迁移实验为100μ1,侵袭实验为200μ1)加入到transwell小室中。在24孔板下室加入500μ1含fbs的1640培养基。把细胞放入细胞培养箱中培养24h。
4、染色
细胞在培养结束后使用dapi染色。把小室细胞先用pbs漂洗2遍,放入dapi工作液中室温染色5-20min。用pbs漂洗2遍,放入荧光显微镜下观察并计数。
5、结果
结果如图5所示,在肺腺癌细胞转染干扰rna之后,与对照组相比,实验组的迁移及侵袭能力均有明显下降,结果说明loc101926969能够促进肺腺癌的迁移及侵袭。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
sequencelisting
<110>河北医科大学第四医院
<120>一种用于肺腺癌诊治的分子标志物
<160>11
<170>patentinversion3.5
<210>1
<211>2720
<212>dna
<213>人源
<400>1
gtcacccaggccggagtgcagtggcatgatcacagctcactgaagcctcgacttcccagg60
cttaagtgatcctcctacctcactcagcctcccgagtagttgggaccacaggcatgtgcc120
accacatctggctatttttagtattttttgtagagatggggtttcgccatgctgctcagg180
caggtctcaaactcctggcctcaagccatctgcttgtgttggcctcccaaagtgctggat240
tacaggcgtgcaccaccacccccggcctaattgaatttttattttggaagaaccatatac300
ctttatacatattctttctatgacttattttctgtagttgaagttcaagggtgtttgaca360
gtgtgatgtggttattgttaacctgtatgtgggggcatacagatatgttgttttactttt420
tcccataaggctaagatcatctccagaaatattaattttttagacagcgtgattatagtt480
atttaatactcatatttatcaaaatattatatgttaaaaccaataaccatctgaacttat540
ttgaatatagtttttcctattctgttcttagaaatttcagtcattaacaatctttacact600
tagaaagtgttttaattttactttgatgacaggaatagtgtttttctcaatgaaatatat660
aatagcagcttataagtgataaccgttttcattctgtttttaagagaaaatactttggtc720
ttttttaccatgatagtttagtgtgtgatgtcataaaaatgggctgtagccatttaaatt780
cttgttcaagtgcagaaactaagagacttcagtttctattaagccatgtcaactcctatt840
aggagacctttagtggttccagttccagggccttcttgaagaaattgtgatacttgtgta900
agtatatctagagttttctttccagcattggctaagtcacatagctgagaaatatgatac960
atggagaaggttgctgactggatgaacttttctacattgaatactttaaatctggattct1020
agaataaaatatattgatgcatatttgagttgtcaactgtttatgtcttgttcttttcag1080
cttcaacattgctttatggcatgtgtggtcgtttttcactccattgttgttgtttaccca1140
gtttatgggggttgtaatgtttatcacactccttggatgatttccgaagatcaccccatc1200
ctgagatctgctgccttacacagtggaggctgttttctgagtgtcggataactctgttat1260
taaataagtgcatattgagaatactcactccagatgcttagaggcatgttgagaaggaca1320
aagatagtgcctcctgtcaggtcacttacatcagaacttgcaggaaacctgctttataca1380
gcagttgacaggtgtggaaattgaagctcatggaaatgaaagttaatacactaaattttc1440
aaggagttaatgaaaactgacatttctgctaaaaacagcatgttctccctgtgggatttt1500
aaaggaaggtcaatggtaactgtacaaagaagaaatggacatagtctcattgttagcagt1560
ctgaaaatagttgctagcacctccatgcccacgccaatgtctccagcctccttcaagcac1620
cttgctgtgtcttggaaccattgggagccctcacaggaggcccttcgttcctgtatgcat1680
gtggtgccacaagctgctttgggcccggaggaatcctacacatctcagaacacttcctca1740
cctgaccctgtcacccatctctccccttctcatgtgctcagccccttctttgactcttga1800
attttgagtttttacagatgtttgggagctcttactctgacatgaatttataattgtaat1860
ggagactcagacaacgttgtagatcacagagtgaactatgctttttagtgttaaatgcaa1920
tagcttaagatagaatgttttacttgttacataaatgctggttttctttcagatttaagg1980
acatatactttatttttttaagagatagggtcttctatgttgtccaggctggctttgaac2040
tcctgggatcaagtgatcctcctgcctcagccttcgaagtagttgggactacaggcccac2100
gccaccgtgcatggctggacacgtaaatttgaattgaatggttaaacatccagctagctg2160
aaagcatggcagaccctaacagaaaagctacagtgtgtttttgcaactatgaagtgaatg2220
gtttcctggggaaaattgtgactttgtataactatttttgaaaccagaataaattatatt2280
tcacttgcatattcttaaattattaaaattttcagaagtcagtgatacagaaatactatt2340
ttgcaatgttaatctgtttgagtctttggagaaagtggtttcattgtaggtacatgatgc2400
actcttaatattttaaacaaatagttcactcttccatttaagggatatcagttccttgta2460
taaaatgactggatatgtataaagcaattatgttgtcatgtgcctttaaccagctttagt2520
aattactataatctcatatttatgatagttttgttaggtgacaggaccaaatgaaaatat2580
tttatgttttcccatcactttagattttatcattgtgtaaattactgggtttttagcatt2640
tcctaatgtgaagttttaatcatttttaagtatacatattttttttctgtaccatttaaa2700
taaaatatttttataacttt2720
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
ttctgagtgtcggataac18
<210>3
<211>19
<212>dna
<213>人工序列
<400>3
gcaagttctgatgtaagtg19
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
aatcccatcaccatcttccag21
<210>5
<211>19
<212>dna
<213>人工序列
<400>5
gagccccagccttctccat19
<210>6
<211>19
<212>rna
<213>人工序列
<400>6
uucuccgaacgugucacgu19
<210>7
<211>19
<212>rna
<213>人工序列
<400>7
acgugacacguucggagaa19
<210>8
<211>21
<212>rna
<213>人工序列
<400>8
uacagaaaauaagucauagaa21
<210>9
<211>21
<212>rna
<213>人工序列
<400>9
cuaugacuuauuuucuguagu21
<210>10
<211>21
<212>rna
<213>人工序列
<400>10
uucuucuuuguacaguuacca21
<210>11
<211>21
<212>rna
<213>人工序列
<400>11
guaacuguacaaagaagaaau21
- 还没有人留言评论。精彩留言会获得点赞!