基于HRM技术检测结核分枝杆菌耐药性的试剂盒及引物的制作方法
本发明属于生物技术,具体涉及一种基于HRM技术检测结核分枝杆菌耐药性的试剂盒及其引物、应用。
背景技术:
结核病是当今全球范围对人类最具有威胁性的感染性疾病之一,而耐多药结核病(multi-drug resistant tuberculosis,MDR-TB)以及广泛耐药结核病(extensive drug resistant tuberculosis,XDR-TB)的出现使得结核病的流行态势更为严峻。WHO2008报道显示,全球结核病总耐药率为20.0%,耐多药率为5.3%,每年新出现耐多药结核病患者约50万人,广泛耐药结核病患者5万人。随着世界范围内人口流动的增加,耐药性结核病例过去20年来一直呈上升态势,严重地威胁着结核病控制工作的进展。
链霉素、异烟肼和乙胺丁醇属于世界卫生组织推荐的抗结核一线药物,对结核病的治疗具有非常重要的作用,及时进行结核分枝杆菌对链霉素、异烟肼和乙胺丁醇的耐药性检测可指导临床用药,避免延误治疗。结核分枝杆菌对抗结核化疗药物异烟肼(INH)的耐药机制较为复杂,约92%的INH耐药菌与katG,inhA和ahpC三个基因突变有关,其中katG和inhA基因是主要的耐药基因,katG的丢失或突变导致其编码的过氧化氢-过氧化物酶活性丧失或下降,而inhA基因突变减弱了异烟肼对分枝杆菌酸生物合成的抑制作用;结核分枝杆菌耐乙胺丁醇与阿拉伯糖基转移酶的编码基因,embABC操纵子突变或emb蛋白表达增高有关,该操纵子由embC、embA和embB三个基因组成,其中embB基因(尤其是306位密码子)突变是耐乙胺丁醇产生的主要分子机制;链霉素耐药是由于其核糖体S12蛋白编码基因rpsL或16SrRNA编码基因rr8突变所致,80%耐链霉素结核分枝杆菌临床分离株可见rpsL突变。
结核分枝杆菌的临床检测一直以来主要依靠药物药敏试验,但传统的在固体培养基上进行的药物敏感试验周期长、敏感性低,严重影响了患者的早期诊断和治疗。基因芯片样本的制备和标记较繁琐,仪器昂贵,检测成本高。PCR-限制性片断长度多态性分析只能分析已知序列特异位点的基因突变。快速培养仪检测系统仪器和试剂依赖进口费用高昂。
高分辨溶解曲线(High Resolution Melting,HRM)技术是一种新兴的检测技术,HRM技术是在常规聚合酶链式反应(PCR)过程中饱和荧光染枓如Eva Green与DNA双链结合,当通过加热升温使DNA双链解离时,荧光染料从局部解链的DNA分子上释放,由于突变、SNP位点双链碱基间不匹配会使双链DNA在此位点首先解开,通过实时监测升温过程中的荧光强度,从荧光强度与时间轴曲线上便可判断是否存在突变或SNP。不同位点、杂合子与否、GC含量、扩增子长度等都会影响熔解曲线的峰形,所以HRM分析能够有效区分不同突变位点、SNP位点和拥有不同GC含量的扩增片段。其操作方法简便,样品经PCR扩增后直接进行HRM,PCR产物无需转入其它分析装置,可直接在同一个PCR管内进行分析,实现闭管式操作,不会产生气溶胶污染。是一种可以快速、准确、操作简便、灵敏度高和避免交叉污染的检测技术。
技术实现要素:
为此,本发明要解决的技术问题在于克服现有技术中结核分枝杆菌耐药性检测周期长、敏感度低的问题,从而提供一种基于HRM技术快速准确检测结核分枝杆菌多重耐药性的试剂盒,以准确可靠、快速、简便地检测结核杆菌耐药性及多重耐药性。
本发明提供了一种基于HRM技术检测结核分枝杆菌耐药性基因突变的引物组,所述引物组包含至少一种选自以下的引物组:
引物组1:包含碱基序列如SEQ NO.1所示的引物katG315-F和碱基序列如SEQ NO.2所示的引物katG315-R;
引物组2:包含碱基序列如SEQ NO.3所示的引物inhA94-F和碱基序列如SEQ NO.4所示的引物inhA94-R;
引物组3:包含碱基序列如SEQ NO.5所示的引物rpsL43-F和碱基序列如SEQ NO.6所示的引物rpsL43-R;
引物组4:包含碱基序列如SEQ NO.7所示的引物embB330-F和碱基序列如SEQ NO.8所示的引物embB330-R;
引物组5:包含碱基序列如SEQ NO.9所示的引物embB630-F和碱基序列如SEQ NO.10所示的引物embB630-R。
所述引物组特异性识别结核分枝杆菌耐药性基因包括katG基因、inhA基因、rpsL基因和embB基因。
所述引物组1特异性识别katG基因,所述引物组2特异性识别inhA基因,所述引物组3特异性识别rpsL基因,所述引物组4特异性识别embB基因,所述引物组5特异性识别embB基因。
所述引物组1扩增序列如SEQ NO.11所示,可检测耐异烟肼相关的katG基因突变;所述引物组2扩增序列如SEQ NO.12所示,可检测耐异烟肼相关的inhA基因突变;所述引物组3扩增序列如SEQ NO.13所示,可检测耐链霉素相关的rpsL基因突变;所述引物组4和引物组5扩增序列分别如SEQ NO.14和SEQ NO.15所示,可检测耐乙胺丁醇相关的embB基因突变。
本发明提供了一种检测结核分枝杆菌耐药性的试剂盒,包括上述的五个引物组中至少一组引物组。
所述的试剂盒,还包括:非标记荧光PCR反应液、阴性标准品、阳性标准品。
所述的试剂盒,所述非标记荧光PCR的反应液,包括:
Green-2-Go qPCR Mastermix,5μl
引物F,10μM,0.1μl
引物R,10μM,0.1μl
ddH2O,4.3μl。
所述的试剂盒,所述的Green-2-Go qPCR Mastermix中含有Eva Green染料。
所述的试剂盒,所述阴性标准品和阳性标准品按照如下方法制备:
分别合成基因katG、inhA、rpsL、embB野生型和突变型的序列,将合成的序列片段与载体pMD18-T连接,将连接产物转化至感受态细胞,筛选得到单菌落,挑选单菌落至含抗生素的液体培养基,过夜培养,提取质粒,以提取的重组质粒DNA为模板进行PCR鉴定,并对重组质粒进行测序鉴定。提取验证正确的重组阳性质粒和重组阴性质粒即为阳性标准品和阴性标准品。
本发明提供了所述的引物组或所述的试剂盒在结核分枝杆菌耐药基因预定位点进行突变检测的应用,包括如下步骤:
(1)提取待测样品的基因组DNA;
(2)使用所述的引物组或所述的试剂盒对所述基因组DNA进行非标记荧光PCR扩增;
(3)采用genescan或calling软件对PCR扩增产物进行HRM分析,综合扩增曲线与Tm值判定结果。
所述的应用,所述耐药基因的预定位点包括:katG基因315位点、inhA基因94位点、rpsL基因43位点、embB基因330位点和embB基因630位点。
所述应用的判定分析如下:
对katG基因的突变分析结果如图1所示,野生型katG基因Tm值>katG基因AGC→ACC突变Tm值>katG基因AGC→ATC突变和/或katG基因AGC→CGC突变Tm值>katG基因AGC→AAC突变Tm值;
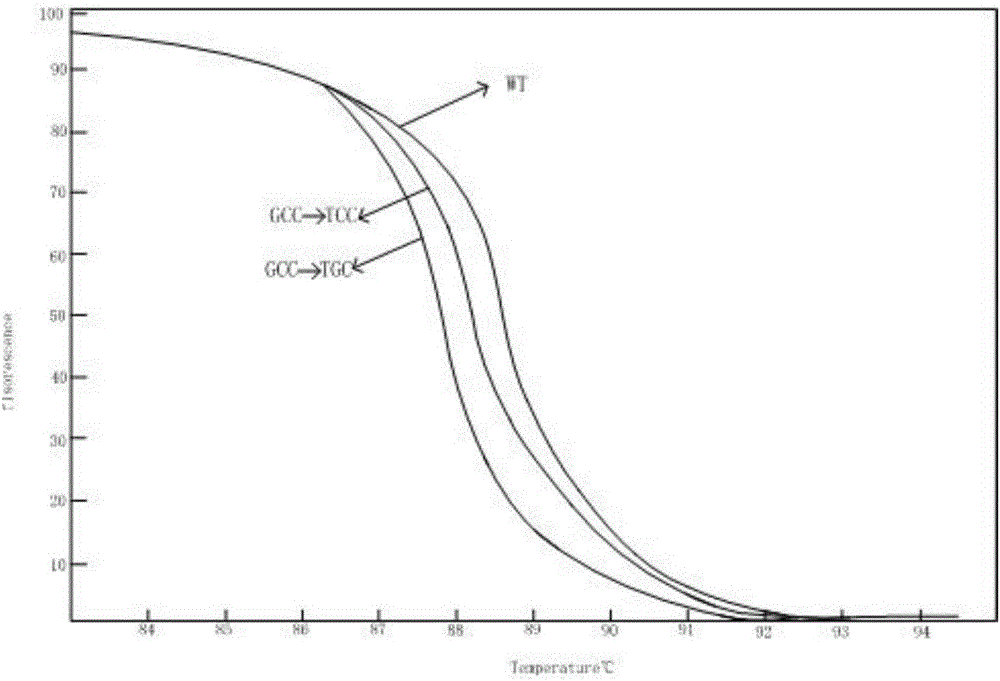
对inhA基因的突变分析结果如图2所示,野生型inhA基因Tm值>inhA基因GCC→TCC突变Tm值>inhA基因GCC→TGC突变Tm值;
对rpsL基因的突变分析结果如图3所示,野生型rpsL基因Tm值>inhA基因AAG→AGG突变Tm值>rpsL基因AAG→ACG突变Tm值;
对embB基因的突变分析结果如4所示,野生型embB基因Tm值>embB基因TTC→TTA突变Tm值;
对embB基因的突变分析结果如图5所示,野生型embB基因Tm值>embB基因ACC→ATC突变Tm值。
所述的应用,所述非标记荧光PCR扩增的程序:94℃预变性3min,94℃变性10s,60℃退火/延伸20s。
所述的应用,所述HRM分析的程序:94℃变性90s,60℃复性30sec,熔解温度以0.06℃/s从83℃升至94℃,并在熔解过程中实时检测荧光信号。
优选的,在所述步骤(2)中,所述待测样品的基因组DNA的加入量为0.5μl。
本发明还提供了一种检测结核分枝杆菌耐药性的方法,包括以下步骤:
a、取待测样品进行液化和培养,然后提取待测样品中的基因组DNA;
b、使用上述试剂盒中的非标记荧光混合液分别对重组阴性质粒、重组阳性质粒和待测样品的基因组DNA进行PCR扩增,PCR反应程序为:94℃预变性3min,94℃变性10s,60℃退火/延伸20s;
c、收集重组阴性质粒、重组阳性质粒和待测样品的荧光数据,进行HRM分析,HRM分析程序:94℃变性90s,60℃复性30sec,熔解温度以0.06℃/s从83℃升至94℃,并在熔解过程中实时检测荧光信号。
优选的,在所述b步骤中,重组阴性质粒、重组阳性质粒和待测样品的基因组DNA各自的加入量为0.5μl。
所述待测样品为痰液。
本发明相比现有技术,具有以下优点:
1)本发明所述的一种基于HRM技术检测结核分枝杆菌耐药性基因突变的引物组,所述引物组可以特异性识别katG、inhA、rpsL、embB基因,可以利用HRM-PCR检测上述的结核分枝杆菌耐药性基因是否发生突变,进而得出所述结核分枝杆菌的耐药性,整个检测周期短、敏感度高,可以准确可靠、快速、简便地检测结核杆菌耐药性及多重耐药性;
2)本发明所述的一种基于HRM技术检测结核分枝杆菌耐药性的试剂盒,利用所述试剂盒采用HRM-PCR检测结核分枝杆菌耐药性基因,简化了检测流程,大大缩短了检测周期和检测成本,且检测准确可靠性高;
3)本发明所述的引物组或所述的试剂盒在结核分枝杆菌耐药基因预定位点进行突变检测的应用,采用HRM方法进行分析时,待测样品经PCR扩增后直接进行HRM分析,与其他多重常规PCR通过电泳区分PCR扩增产物片段大小相比,整个过程时间短,检测效率高,PCR产物无需再转入其它分析装置,实现闭管操作,避免交叉污染,而且可同时完成定量分析;
4)本发明所述的引物组或所述的试剂盒在结核分枝杆菌耐药基因预定位点进行突变检测的应用,HRM只需设计PCR引物,进行PCR反应,无需序列特异性探针,无需测序,也不受突变碱基位点与类型的局限;相比传统的探针法荧光PCR,本方法大大降低了使用成本;
5)本发明所述的引物组或所述的试剂盒在结核分枝杆菌耐药基因预定位点进行突变检测的应用,HRM只检测PCR样品中荧光强度的变化,不消耗任何PCR样品,不损伤PCR扩增产物,PCR产物可以进行下游分析;
6)本发明所述的检测结核分枝杆菌耐药性的方法,利用所述的引物组或所述的试剂盒检测所述结核分枝杆菌耐药基因预定位点的突变,检测周期短、敏感度高,说明书中验证了灵敏度为2%,可以准确可靠、快速、简便地检测结核杆菌耐药性及多重耐药性。
附图说明
图1为使用本发明PCR引物组1对katG基因进行扩增后应用高分辨熔解曲线分析对该基因的突变进行检测的结果图;
图2为使用本发明PCR引物组2对inhA基因进行扩增后应用高分辨熔解曲线分析对该基因的突变进行检测的结果图;
图3为使用本发明PCR引物组3对rpsL基因进行扩增后应用高分辨熔解曲线分析对该基因的突变进行检测的结果图;
图4为使用本发明PCR引物组4对embB基因进行扩增后应用高分辨熔解曲线分析对该基因的突变进行检测的结果图;
图5为使用本发明PCR引物组5对embB基因进行扩增后应用高分辨熔解曲线分析对该基因的突变进行检测的结果图;
图6为本发明试剂盒灵敏度检测的结果图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1引物的设计与合成
结合以往文献报道,确定用于鉴别结核分枝杆菌多重耐药性的各基因及相应变异位点,所检测结核分枝杆菌耐药基因为:耐异烟肼(katG基因和inhA基因)、耐乙胺丁醇(embB基因)和耐链霉素(rpsL基因)。在NCBI中,可获得katG、inhA、embB和rpsL的标准序列(序列来自标准菌株H37Rv,NC_000962.2),在四种基因耐药性突变位点的上游以及下游设计引物,四种基因的突变位置信息、突变类型、引物序列以及扩增区域如下表1:
表1结核分枝杆菌耐药基因的突变位置信息、突变类型、引物序列以及扩增区域
实施例2试剂盒的制备
本实施例提供了一种基于HRM技术检测结核分枝杆菌耐药性的试剂盒,所述试剂盒包括上述实施例1中的基于HRM技术检测结核分枝杆菌耐药性基因突变的引物。
所述试剂盒中包括非标记荧光PCR扩增过程中的反应液(10μl体系,不包括DNA模板)由以下组分组成:
Green-2-Go qPCR Mastermix(含EvaGreen),5μl;
引物F,10μM,0.1μl;
引物R,10μM,0.1μl;
ddH2O,4.3μl;
所述试剂盒中还包括阴性标准品和阳性标准品,所述标准品的制备方法包括如下步骤:
1、根据各结核耐药基因野生型与耐药型的基因变异,结合本发明中所使用的引物,确定各基因野生型与耐药变异型标准序列,其中野生型序列SEQ NO.11~SEQ NO.15所示,耐药变异型序列SEQ NO.16~SEQ NO.25所示。
2、将上述合成各基因野生型与耐药变异型的DNA片段与pMD18-T(大连宝生物公司提供)进行连接,采用如下连接体系进行配制:
pMD18-T,1μL
DNA,2μL
SolutionI,5μL
ddH2O,2μL
总体积,10μL
配制完成后置于16℃进行过夜连接反应,得到连接产物,备用。
3、重组质粒的转化以及PCR鉴定
(1)从-80℃的超低温冰箱中取出冻存的DH5α感受态细胞,置于冰盒上使其解冻;
(2)取所述连接产物10μL加入含有50μL的DH5α感受态细胞的1.5ml EP管中,轻轻摇匀后置冰浴30分钟;
(3)42℃水浴热激90秒,热激后立即置冰上冷却2min;
(4)向1.5ml EP管中加入预冷的1ml的不含抗性的LB液体培养基吹打混匀后,37℃120转轻摇培养90min;
(5)将上述培养液短暂离心吸去900μL后取剩余的100μL涂布于含Amp抗生素的LB平板上,正面向上放置30min,待菌液完全被培养基吸收后,倒置培养皿37℃恒温箱培养过夜。
(6)从所述LB平板上挑取单克隆菌落于500μL的Amp抗性LB液体培养基的1.5ml EP管中,37℃下220rpm振荡培养5-6小时;
(7)取1μL作为模板进行菌液PCR鉴定,将鉴定为阳性的菌液加入到20ml的LB液体培养基中进行扩摇;
(8)选用实施例1中设计的对应各所述耐药基因的引物扩增上述稀释菌液,扩增程序/反应条件:94℃预变性5min,94℃保持30s、60℃保持30s、72℃保持30sec,35个循环,72℃10min,PCR产物采用2%琼脂糖凝胶电泳,通过检测PCR产物鉴定阳性转化子,采用北京百泰克公司生产的质粒制备试剂盒提取重组阴性质粒、重组阳性质粒,进行HRM分析,HRM分析程序:94℃变性90s,60℃复性30sec,熔解温度以0.06℃/s从83℃升至94℃,并在熔解过程中实时检测荧光信号。
katG基因通过引物组1扩增的重组阳性质粒和重组阴性质粒的结果如图1所示,inhA基因通过引物组2扩增的重组阳性质粒和重组阴性质粒的结果如图2所示,rpsL基因通过引物组3扩增的重组阳性质粒和重组阴性质粒的结果如图3所示,embB基因通过引物组4扩增的重组阳性质粒和重组阴性质粒的结果如图4所示,embB基因通过引物组5扩增的重组阳性质粒和重组阴性质粒的结果如图5所示,上述图1-图5中的横坐标为温度(℃),纵坐标为溶解温度(Tm)。图1中的“AGC→ATC,CGC”表示katG基因315位的AGC突变为ATC或CGC,“WT”表示野生型扩增序列(标准序列),其他附图同理。
4、重组阴性质粒和重组阳性质粒提取
采用北京百泰克公司生产的质粒制备试剂盒提取重组质粒,测定浓度和纯度,利用北京百泰克生物科技有限公司的超微量紫外可见分光光度计(ND5000)对提取的质粒测定浓度,根据A260/A280判断质粒的纯度。A260/A280=2.01,然后进行冻存,同时取10μL纯化质粒送至上海生物工程有限公司进行测序,确定插入片段的基因序列与目的序列一致。
实施例3试剂盒的使用
本实施例提供了一种利用实施例2的试剂盒在结核分枝杆菌耐药基因预定位点进行突变检测的应用,包括如下步骤
(1)收集痰液样本进行液化和培养,提取所述痰液样本中的基因组DNA,制备痰样的DNA提取物:
1)在生物安全柜内将1-2mL痰液转移至处理管中,加入1-4倍体积的质量浓度为4%的氢氧化钠溶液,漩涡震荡30s至充分液化,静置15min;
2)加入PBS至中性,转移至5ml离心管中,6480g离心15min,丢弃上清液;
3)向步骤2)中加入0.5mlPBS混匀,用注射器吸取0.1ml,注入结核培养瓶中培养42d;
4)阳性标本转移至罗氏培养基,培养后用于PCR检测;
(2)使用所述试剂盒中非标记荧光混合液分别对重组阴性质粒、重组阳性质粒和痰液样本的培养产物进行PCR扩增,所述重组阴性质粒、重组阳性质粒和痰液样本的培养产物各自加入量为0.5μL,PCR反应程序为:94℃预变性3min,94℃变性10s,60℃退火/延伸20s;
(3)收集重组阴性质粒、重组阳性质粒和痰液样本的荧光数据,进行HRM分析,HRM分析程序:94℃变性90s,60℃复性30sec,熔解温度以0.06℃/s从83℃升至94℃,并在熔解过程中实时检测荧光信号。应用带HRM模块的荧光定量PCR仪,包括Corbett Rotor公司的Gene6000、Roche公司LightCycler 480等,采用genescan或calling软件对PCR扩增产物进行HRM分析,综合扩增曲线与Tm值判定结果。
获得的所述痰液样本的TM值根据如下判定分析,若所述痰液样本的TM值曲线与下述的任一曲线重合,则所述痰液样本中的结核分枝杆菌与该重合的曲线的结核分枝杆菌类型相同,如所述痰液样本的TM值曲线与katG基因AGC→ACC突变Tm值重合,则所述痰液样本的结核分枝杆菌为katG基因的315位的AGC突变为ACC,若所述痰液样本的TM值曲线与落入两个相邻的曲线之间,则所述痰液样本中的结核分枝杆菌同时有该相邻的两曲线的结核分枝杆菌类型,如所述痰液样本的TM值曲线位于katG基因AGC→ACC突变Tm值和katG基因AGC→ATC突变和/或katG基因AGC→CGC突变Tm值之间,则所述痰液样本的结核分枝杆菌为katG基因的315位的AGC突变为ACC,ATC,CGC,再如所述痰液样本的TM值曲线位于katG基因AGC→ACC突变Tm值和野生型katG基因Tm值之间,则所述痰液样本的中一部分结核分枝杆菌为katG基因的315位的AGC突变为ACC,一部分结核分枝杆菌为野生型katG基因。所述应用的判定分析如下:
对katG基因的突变分析结果如图1所示,野生型katG基因Tm值>katG基因AGC→ACC突变Tm值>katG基因AGC→ATC突变和/或katG基因AGC→CGC突变Tm值>katG基因AGC→AAC突变Tm值;
对inhA基因的突变分析结果如图2所示,野生型inhA基因Tm值>inhA基因GCC→TCC突变Tm值>inhA基因GCC→TGC突变Tm值;
对rpsL基因的突变分析结果如图3所示,野生型rpsL基因Tm值>inhA基因AAG→AGG突变Tm值>rpsL基因AAG→ACG突变Tm值;
对embB基因的突变分析结果如4所示,野生型embB基因Tm值>embB基因TTC→TTA突变Tm值;
对embB基因的突变分析结果如图5所示,野生型embB基因Tm值>embB基因ACC→ATC突变Tm值。
本实施例提供了一种检测结核分枝杆菌耐药性的方法,使用实施例2中所述的试剂盒按照上述应用中的方法检测结核分枝杆菌耐药性。
实施例4灵敏度检测
将实施例2中制备的重组阳性质粒和重组阴性质粒均稀释至50ng/μl,然后二者混合进行梯度稀释,重组阳性质粒体积占比依次为50%、25%、12.5%、5%、2%和1%,按照上述实施例3中的HRM-PCR反应体系和参数进行扩增,分析突变检出范围,即灵敏度。结果参照图6,实验数据显示,当阳性质粒与阴性质粒体积比分别为1:1、1:3、1:7、1:19、1:49时,能检测出阳性质粒,所以本发明所述的检测结核分枝杆菌耐药性的试剂盒的所用HRM检测方法的灵敏度为2%。
SEQUENCE LISTING
<110> 苏州百源基因技术有限公司
<120> 基于HRM技术检测结核分枝杆菌耐药性的试剂盒及引物
<130> SHA201700107
<160> 25
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
gtggatcact gagcacacca 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
gaaagtcacg agccaacagc 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
ctcaggtctg gtgcggtatg 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
gtaaaagatc aggtcgccgc 20
<210> 5
<211> 18
<212> DNA
<213> 人工序列
<400> 5
cgcagcgtcg tggtgtat 18
<210> 6
<211> 21
<212> DNA
<213> 人工序列
<400> 6
tcgacctgac tcgtcaactt c 21
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<400> 7
gccggctaca tgtccaacta 20
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<400> 8
gtcgctgaca tgggtcatca 20
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<400> 9
gttggtatcc ccatcggtgc 20
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<400> 10
gagacatacc accagccgtt 20
<210> 11
<211> 125
<212> DNA
<213> 人工序列
<400> 11
gtggatcact gagcacacca cccactgggg actgcagatc gaccacttct ggtggaccgc 60
gatctgggcg gcgatcttgt tgtcgatcgt cagctggatc ctgtcgctgt tggctcgtga 120
ctttc 125
<210> 12
<211> 127
<212> DNA
<213> 人工序列
<400> 12
ctcaggtctg gtgcggtatg ccttcgccgg ggtcggcgtg ctgatcccgc ggttctccgg 60
tgatcagtac aacgccggtc gccacgttcc gcccgctgag gccaagcgcg gcgacctgat 120
cttttac 127
<210> 13
<211> 103
<212> DNA
<213> 人工序列
<400> 13
cgcagcgtcg tggtgtatgc acccgcgtgt acaccaccac tccgaagaag ccgaactcgg 60
cgcttcggaa ggttgcccgc gtgaagttga cgagtcaggt cga 103
<210> 14
<211> 99
<212> DNA
<213> 人工序列
<400> 14
gccggctaca tgtccaacta tttccgctgg ttcggcagcc cggaggatcc cttcggctgg 60
tattacaacc tgctggcgct gatgacccat gtcagcgac 99
<210> 15
<211> 114
<212> DNA
<213> 人工序列
<400> 15
gttggtatcc ccatcggtgc tgcgctggtc gcgcaaccgg atggcgttcc tggcggcgtt 60
attcttcctg ctggcgttgt gttgggccac caccaacggc tggtggtatg tctc 114
<210> 16
<211> 125
<212> DNA
<213> 人工序列
<400> 16(katG基因的315位点AGC突变为ACC)
gtggatcact gagcacacca cccactgggg actgcagatc gaccacttct ggtggaccgc 60
gatctgggcg gcgatcttgt tgtcgatcgt cacctggatc ctgtcgctgt tggctcgtga 120
ctttc 125
<210> 17
<211> 125
<212> DNA
<213> 人工序列
<400> 17(katG基因的315位点AGC突变为AAC)
gtggatcact gagcacacca cccactgggg actgcagatc gaccacttct ggtggaccgc 60
gatctgggcg gcgatcttgt tgtcgatcgt caactggatc ctgtcgctgt tggctcgtga 120
ctttc 125
<210> 18
<211> 125
<212> DNA
<213> 人工序列
<400> 18(katG基因的315位点AGC突变为AAC)
gtggatcact gagcacacca cccactgggg actgcagatc gaccacttct ggtggaccgc 60
gatctgggcg gcgatcttgt tgtcgatcgt catctggatc ctgtcgctgt tggctcgtga 120
ctttc 125
<210> 19
<211> 125
<212> DNA
<213> 人工序列
<400> 19(katG基因的315位点AGC突变为CGC)
gtggatcact gagcacacca cccactgggg actgcagatc gaccacttct ggtggaccgc 60
gatctgggcg gcgatcttgt tgtcgatcgt ccgctggatc ctgtcgctgt tggctcgtga 120
ctttc 125
<210> 20
<211> 127
<212> DNA
<213> 人工序列
<400> 20(inhA基因的94位点GCC突变为TCC)
ctcaggtctg gtgcggtatg ccttcgccgg ggtcggcgtg ctgatcccgc ggttctccgg 60
tgatcagtac aactccggtc gccacgttcc gcccgctgag gccaagcgcg gcgacctgat 120
cttttac 127
<210> 21
<211> 127
<212> DNA
<213> 人工序列
<400> 21(inhA基因的94位点GCC突变为TGC)
ctcaggtctg gtgcggtatg ccttcgccgg ggtcggcgtg ctgatcccgc ggttctccgg 60
tgatcagtac aactgcggtc gccacgttcc gcccgctgag gccaagcgcg gcgacctgat 120
cttttac 127
<210> 22
<211> 103
<212> DNA
<213> 人工序列
<400> 22(rpsL基因的43位点AAG突变为AGG)
cgcagcgtcg tggtgtatgc acccgcgtgt acaccaccac tccgaggaag ccgaactcgg 60
cgcttcggaa ggttgcccgc gtgaagttga cgagtcaggt cga 103
<210> 23
<211> 103
<212> DNA
<213> 人工序列
<400> 23(rpsL基因的43位点AAG突变为ACG)
cgcagcgtcg tggtgtatgc acccgcgtgt acaccaccac tccgacgaag ccgaactcgg 60
cgcttcggaa ggttgcccgc gtgaagttga cgagtcaggt cga 103
<210> 24
<211> 99
<212> DNA
<213> 人工序列
<400> 24(embB基因330位TTC突变为TTA)
gccggctaca tgtccaacta tttccgctgg ttcggcagcc cggaggatcc cttaggctgg 60
tattacaacc tgctggcgct gatgacccat gtcagcgac 99
<210> 25
<211> 114
<212> DNA
<213> 人工序列
<400> 25(embB基因630位ACC突变为ATC)
gttggtatcc ccatcggtgc tgcgctggtc gcgcaatcgg atggcgttcc tggcggcgtt 60
attcttcctg ctggcgttgt gttgggccac caccaacggc tggtggtatg tctc 114
- 还没有人留言评论。精彩留言会获得点赞!