一种膦腈碱介导制备1,5‑立构规整聚三唑的方法与流程
本发明属于高分子聚合物制备领域,具体涉及一种膦腈碱介导制备1,5-立构规整聚三唑的方法。
背景技术:
自从2002年,Meldal和Sharpless课题组分别独立发现了一价铜催化叠氮与端炔的环加成反应(C.W.,Christensen,C.,Meldal,M..Peptidotriazoles on Solid Phase:[1,2,3]-Triazoles by Regiospecific Copper(I)-Catalyzed 1,3-Dipolar Cycloadditions of Terminal Alkynes to Azides[J].J.Org.Chem.,2002,67,3057;Kolb,H.C.,Finn,M.G.,Sharpless,K.B..Click Chemistry:Diverse Chemical Function from a Few Good Reactions[J].Angew.Chem.Int.Ed.,2001,40,2004)。该反应作为一个典型的点击反应而得到了广泛的关注和应用,因其反应条件温和、官能团耐受性强、产物杂质少易纯化、有很强的立体选择性等。
随后发展金属催化点击聚合反应已经成功的构建出具有多种多样结构和性能的线型和超支化聚三唑。但是,聚合物中残留的金属催化剂难以完全除去,这不仅使所得产物的溶解性变差,而且会影响它们的光学及电学性能。此外,一价铜催化的点击聚合制备的聚三唑都是1,4-异构体为主,而聚合物结构上的微小差别将可能导致其发光性能、力学性能、结晶行为等性质上的巨大差异。1,5-异构体为主或单一的聚三唑的合成方法却鲜有报道,因此探索无金属催化制备1,5-异构体为主的聚三唑的合成方法显得尤为必要。
技术实现要素:
为了克服上述现有技术的缺点和不足,本发明的目的在于提供一种膦腈碱介导制备1,5-立构规整聚三唑的方法;该点击聚合方法工艺简单,操作方便。
本发明的目的通过下述技术方案实现:
一种膦腈碱介导制备1,5-立构规整聚三唑的方法,包括以下步骤:
(1)惰性气体保护下,在膦腈碱的介导下,将二元炔基化合物和二元叠氮基化合物在有机溶剂中进行点击聚合反应,后续处理,得到1,5-立构规整聚三唑;
所述的二元炔基化合物的结构通式如式(II):
所述的二元叠氮基化合物如式(III):
N3-R2-N3 (1II)
所述的1,5-立构规整聚三唑的结构如式(I):
式(I)~(III)中,n为大2~200的整数,R1,R2为相同或不同的有机基团。
作为优选,所述式(I)~(III)中,R1,R2选自以下化学结构式1~22中的任意一种;
其中,m、h、k、i为1~15的正整数;*表示取代位置。
所述膦腈碱为t-BuP1,t-BuP2,t-BuP3和t-BuP4的一种或一种以上,优选的,膦腈碱为t-BuP4;所述膦腈碱与二元炔基化合物的摩尔比为(0.01~1):1。
膦腈碱是一类非质子强碱,其结构中至少包含一个P原子和四个N原子,P原子和N原子通过共价键结合起来。根据分子中P=N的个数不同,将膦腈碱命名为P1到P5。
所述点击聚合反应的温度为25~120℃,优选的,温度为80℃。所述点击聚合反应的时间为6~30小时,优选为24小时。
所述二元炔基化合物与二元叠氮基化合物的摩尔比为1:(1~1.1);所述的二元炔基化合物在有机溶剂中的浓度为0.05~0.25mol/L。
所述有机溶剂为二甲基亚砜,N,N-二甲基甲酰胺、四氢呋喃、二氯甲烷、氯仿、甲苯和1,4-二氧六环中的一种以上;优选的,有机溶剂为二甲基亚砜。
所述后续处理是指反应完毕后,将产物溶解在有机溶剂中,萃取,取有机相,浓缩,然后加入到沉淀剂中进行沉淀,收集沉淀物,干燥至恒重。
所述沉淀剂为正己烷;所述萃取是指采用饱和食盐水进行萃取。
所述有机溶剂为二甲基亚砜,N,N-二甲基甲酰胺、四氢呋喃、二氯甲烷、氯仿、甲苯和1,4-二氧六环中的一种以上。
与现有技术相比,本发明具有如下优点:
1.本发明的制备方法反应原料易得,可直接购买或通过简单的反应制备;
2.通过本发明的方法可以制备出以1,5-异构体为主或专一的聚三唑;1,5-立构规整聚三唑产率高,产物中杂质少;
3.发明的聚合过程无副产物生成,符合原子经济性。
附图说明
图1是实施例2制备的1,5-立构规整聚三唑P2与其相应单体的红外谱图;其中A为二元叠氮基化合物即单体1a的红外谱图,B为二元炔基化合物即单体2b的红外谱图,C为1,5-立构规整聚三唑P2的红外谱图;
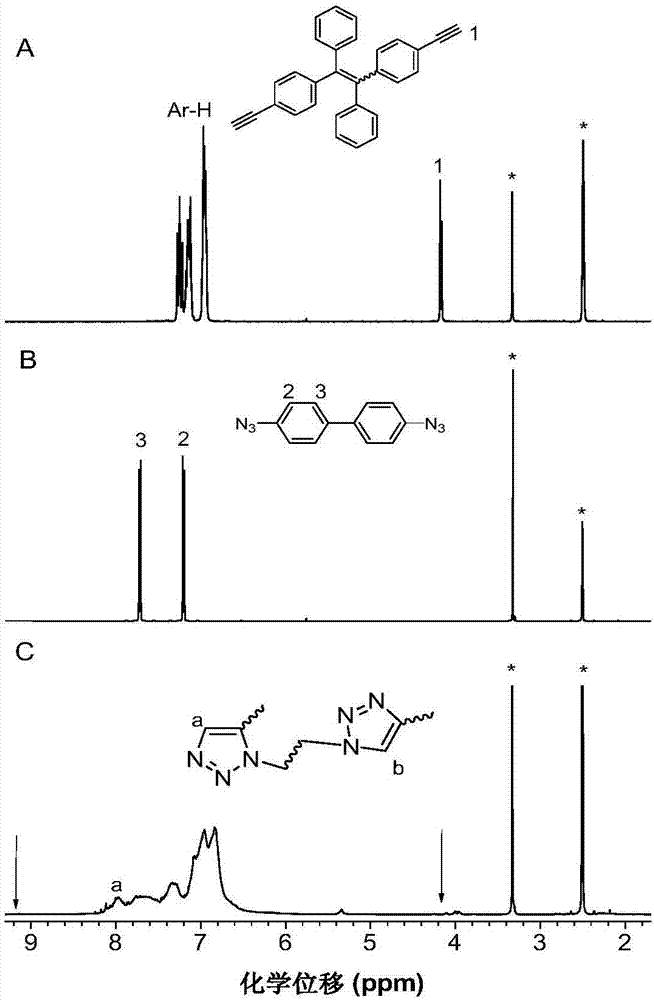
图2是实施例2制备的1,5-立构规整聚三唑P2与其相应单体在CDCl3中的核磁共振氢谱图;其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1a的谱图,C为1,5-立构规整聚三唑P2的谱图(图中化合物的结构为1,5-立构规整聚三唑P2主要结构的示意图);
图3是实施例2制备的1,5-立构规整聚三唑P2与其相应单体在CDCl3中的核磁共振碳谱图;其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1a的谱图,C为1,5-立构规整聚三唑P2的谱图;
图4是实施例5制备的1,5-立构规整聚三唑P5与其相应单体在CDCl3中的核磁共振氢谱图;其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1b的谱图,C为1,5-立构规整聚三唑P5的谱图(图中化合物的结构为1,5-立构规整聚三唑P5主要结构的示意图);
图5是实施例6制备的1,5-立构规整聚三唑P6与其相应单体在CDCl3中的核磁共振氢谱图;其中A为二元炔基化合物即单体2c的谱图,B为二元叠氮基化合物即单体1b的谱图,C为1,5-立构规整聚三唑P6的谱图(图中化合物的结构为1,5-立构规整聚三唑P6主要结构的示意图)。
具体实施方式
下面结合实施例和附图对本发明进行具体地描述,但本发明的保护范围不限于以下实施例。
实施例1
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2a)制备聚三唑(P1),合成路线如下:
其中,二元叠氮基化合物即单体1a的合成方法按照已公开的文献中(Yuan,W.Z.,Mahtab,F.,Gong,Y.Y.,etal.Synthesis and self-assembly of tetraphenylethene and biphenyl based AIE-active triazoles[J].J.Mater.Chem.,2012,22,10472)的合成方法合成;二元炔基化合物即单体2a的合成方法按照已公开的文献中(Yao,B.C.,Mei,J.,Li,J.,etal.Catalyst-Free Thiol–Yne Click Polymerization:A Powerful and Facile Tool for Preparation of Functional Poly(vinylene sulfide)s[J].J.Mater.Chem.2011,21,4056;Macromolecule 2014,47,1325)的合成方法合成。
利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2a)制备聚三唑(P1)的方法,包括以下步骤:
在10ml的聚合管中加入23.6mg(0.1mmol)单体1a,45.6mg(0.1mmol)单体2a,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的温度具体为40℃),得到聚三唑P1,其中1,5-异构体含量为89%。经测定分析,最终产物聚三唑P1的产率为95%,重均分子量为9200,分子量分布为1.50。
实施例2
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2b)制备聚三唑P2,合成路线如下:
二元叠氮基化合物即单体1a的合成方法按照已公开的文献中(Yuan,W.Z.,Mahtab,F.,Gong,Y.Y.,etal.Synthesis and self-assembly of tetraphenyle thene and biphenyl based AIE-active triazoles[J].J.Mater.Chem.,2012,22,10472)的合成方法合成;二元炔基化合物即单体2a的合成方法按照已公开的文献中(Yao,B.C.,Mei,J.,Li,J.,etal.Catalyst-Free Thiol–Yne Click Polymeri zation:A Powerful and Facile Tool for Preparation of Functional Poly(vinyle ne sulfide)s[J].J.Mater.Chem.2011,21,4056;Macromolecule 2014,47,1325)的合成方法合成。
利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2b)制备聚三唑(P2)的方法,包括以下步骤:
在10ml的聚合管中加入23.6mg(0.1mmol)单体1a,38.0mg(0.1mm ol)单体2b,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的具体温度为40℃),得到1,5-立构规整聚三唑P2。经测定分析,最终产物聚三唑P2的产率为98%,重均分子量为9300,分子量分布为1.42。
本实施例制备的1,5-立构规整聚三唑P2与其相应单体(单体1a,单体2b)的红外谱图见图1,其中A为二元叠氮基化合物即单体1a的红外谱图,B为二元炔基化合物即单体2b的红外谱图,C为1,5-立构规整聚三唑P2的红外谱图。图1中,2098cm-1是单体1a中叠氮的伸缩振动峰,2104cm-1是2b三键的伸缩振动峰,3290cm-1是单体2b三键炔氢的振动峰;图1C中看出,此三峰的强度均有大大的减弱或消失。
本实施例制备的1,5-立构规整聚三唑P2与其相应单体(单体1a,单体2b)在CDCl3中的核磁共振氢谱图(*代表溶剂峰)如图2所示,其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1a的谱图,C为1,5-立构规整聚三唑P2的谱图。从图2A看出,在化学位移4.18ppm处的炔氢峰消失,图2C中在化学位移7.98ppm处的1,5构型的三唑峰出现。
本实施例制备的1,5-立构规整聚三唑P2与其相应单体(单体1a,单体2b)在CDCl3中的核磁共振碳谱图(*代表溶剂峰)如图3所示,其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1a的谱图,C为1,5-立构规整聚三唑P2的谱图。从图3中可知,化学位移83.2ppm和81.1ppm处对应的单体2b碳碳叁键上两个碳的特征峰在1,5-立构规整聚三唑P2的谱图中大大减弱。从图2和3的结构表征结果说明,炔和叠氮在膦腈碱t-BuP4介导下,得到了100%1,5-立构规整的聚三唑。
实施例3
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2c)制备聚三唑P3,合成路线如下:
其中二元叠氮基化合物即单体1a的合成方法按照已公开的文献中(Yuan,W.Z.,Mahtab,F.,Gong,Y.Y.,etal.Synthesis and self-assembly of tetraphenylethene and biphenyl based AIE-active triazoles[J].J.Mater.Chem.,2012,22,10472)的合成方法合成;二元炔基化合物即单体2c的合成方法按照已公开的文献中(Zhao,E.G.,Li,H.K.,Wu,H.Q.,etal.Structure-dependent emission of polytriazoles[J].Polym.Chem.,2014,5,2301)的合成方法合成。
利用膦腈碱t-BuP4介导二元叠氮基化合物(1a)与二元炔基化合物(2c)制备聚三唑P3的方法,包括以下步骤:
在10ml的聚合管中加入23.6mg(0.1mmol)单体1a,43.8mg(0.1mm ol)单体2c,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的具体温度为40℃),得到聚三唑P3,1,5-异构体的含量为93%。经测定分析,最终产物聚三唑P3的产率为94%,重均分子量为20800,分子量分布为2.21。
实施例4
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2a)制备聚三唑P4,合成路线如下:
其中二元叠氮基化合物即单体1b的合成方法按照已公开的文献中(Liu,Y.,Wang,J.,Huang,D.,etal.Synthesis of 1,5-regioregular polytriazoles by efficient NMe4OH-mediated azide–alkyne click polymerization[J].Polym.Chem.,2015,6,5545)的合成方法合成;二元炔基化合物即单体2a的合成方法按照已公开的文献中(Yao,B.C.,Mei,J.,Li,J.,etal.Catalyst-Free Thiol–Yne Click Polymerization:A Powerful and Facile Tool for Preparation of Functional Poly(vinylene sulfide)s[J].J.Mater.Chem.2011,21,4056;Macromolecule 2014,47,1325)的合成方法合成。
利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2a)制备聚三唑P4的方法,包括以下步骤:
在10ml的聚合管中加入35.2mg(0.1mmol)单体1b,45.6mg(0.1mm ol)单体2a,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的具体温度为40℃),得到聚三唑P4,其中1,5-异构体含量为83%。经测定分析,最终产物聚三唑P4的产率为97%,重均分子量为9600,分子量分布为1.44。
实施例5
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2b)制备聚三唑P5,合成路线如下:
其中二元叠氮基化合物即单体1b的合成方法按照已公开的文献中(Liu,Y.,Wang,J.,Huang,D.,etal.Synthesis of 1,5-regioregular polytriazoles by efficient NMe4OH-mediated azide–alkyne click polymerization[J].Polym.Chem.,2015,6,5545)的合成方法合成;二元炔基化合物即单体2b的合成方法按照已公开的文献中(Yao,B.C.,Mei,J.,Li,J.,etal.Catalyst-Free Thiol–Yne Click Polymerization:A Powerful and Facile Tool for Preparation of Functional Poly(vinylene sulfide)s,J.Mater.Chem.2011,21,4056;Macromolecule 2014,47,1325)的合成方法合成。
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2b)制备聚三唑P5,合成路线如下:
在10ml的聚合管中加入35.2mg(0.1mmol)单体1b,38.0mg(0.1mmol)单体2b,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的具体温度为40℃),得到1,5-立构规整聚三唑P5。
经测定分析,最终产物聚三唑P5的产率为99%,重均分子量为12000,分子量分布为1.43。1,5-立构规整聚三唑P5与其相应单体在CDCl3中的核磁共振氢谱对比图(*代表溶剂峰)见图4;其中A为二元炔基化合物即单体2b的谱图,B为二元叠氮基化合物即单体1b的谱图,C为1,5-立构规整聚三唑P5的谱图。从图4中看出,图4C中化学位移4.18ppm处(图4A)的炔氢峰消失,图4C中在化学位移8.01ppm处的1,5-立构规整的三唑峰出现。
实施例6
本实施例利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2c)制备聚三唑P6,合成路线如下:
其中二元叠氮基化合物即单体1b的合成方法按照已公开的文献中(Liu,Y.,Wang,J.,Huang,D.,etal.Synthesis of 1,5-regioregular polytriazoles by efficient NMe4OH-mediated azide–alkyne click polymerization[J].Polym.Chem.,2015,6,5545)的合成方法合成;二元炔基化合物即单体2c的合成方法按照已公开的文献中(Zhao,E.G.,Li,H.K.,Wu,H.Q.,etal.Structure-dependent emission of polytriazoles[J],Polym.Chem.,2014,5,2301)的合成方法合成。
利用膦腈碱t-BuP4介导二元叠氮基化合物(1b)与二元炔基化合物(2c)制备聚三唑P6的制备方法,包括如下步骤:
在10ml的聚合管中加入35.2mg(0.1mmol)单体1b,43.8mg(0.1mm ol)单体2c,抽真空换氮气3次,用注射器注入62.5μl(0.05mmol)t-BuP4,然后用注射器注入2mL二甲基亚砜,待单体完全溶解后,放入以恒定在80℃的油浴锅中,反应24小时;反应结束后,将反应夜用氯仿稀释到50ml,用饱和食盐水100ml*3萃取,合并有机相,将有机相浓缩到5ml,滴加到500转/分钟搅拌的正己烷中,静置,过滤,干燥(干燥的具体温度为40℃),得到1,5-立构规整聚三唑P6。
经测定分析,最终产物聚三唑P6的产率为98%,重均分子量为26600,分子量分布为2.04。1,5-立构规整聚三唑P6与其相应单体在CDCl3中的核磁共振氢谱对比图(*代表溶剂峰)见图5;其中A为二元炔基化合物即单体2c的谱图,B为二元叠氮基化合物即单体1b的谱图,C为1,5-立构规整聚三唑P6的谱图。从图5看出,图5C中在化学位移4.24ppm处(图5A)的炔氢峰消失,图5C中在化学位移8.10ppm处的三唑峰出现。
- 还没有人留言评论。精彩留言会获得点赞!