提高氮素高效利用的真菌TrGDH蛋白及其应用的制作方法
本发明属于植物基因工程领域。具体的说,本发明涉及在水稻(Oryza sativa L.)中异源表达真菌Trichurus的谷氨酸脱氢酶基因TrGDH,可以提高水稻的氮素高效利用和改善水稻的生长。
背景技术:
水稻(Oryza sativa L.)是氮肥用量最多的粮食作物之一,也是对干旱极度敏感的作物。据世界粮农组织(FAO 2001)统计,中国1995-1997年水稻种植面积年均31.7×106hm2,占世界水稻种植面积的20%,而水稻氮肥用量占全球水稻氮肥总用量的37%,成为世界上施用无机氮肥最多的国家。中国单季稻田氮肥用量平均为180kg/hm2,比世界稻田氮肥平均用量约高75% (彭少兵等 2002)。水稻的氮肥低效利用与超量施用的现实,加剧了诸如富营养化、空气污染等严重环境问题;同时,我国水稻生产受干旱的威胁日益严重。因此,培育氮高效利用和抗旱性强的水稻新品种对提高我国粮食产量和维持农业可持续发展非常重要(Bates et al. 2008; Xu et al. 2012)。
植物的氮源主要来自于无机氮化物,如铵盐(NH4+)和硝酸盐(NO3-)。但是水稻在大田中能利用的无机氮源主要形式为铵盐(NH4+)。水稻体内NH4+同化包括两个途径:谷氨酰胺合成酶(GS)-谷氨酸合酶(GOGAT)途径[8]和谷氨酸脱氢酶(GDH)途径(江立庚等 2002; Qiu et al. 2009)。高等植物体内NH4+同化的主要途径为GS/GOGAT,而GDH可能是辅助NH4+同化,并参与调控体内的碳氮代谢的平衡(Lea 和Miflin 1974;Abiko et al. 2005;Qiu et al. 2009)。谷氨酸脱氢酶(GDH;E.C.1.1.4.1)催化反应为:α-酮戊二酸 + NH4+ + NAD(P)H + H+→谷氨酸 + H2O + NAD(P)+。在生物体中,GDH分为2类:一类为以NADPH为辅酶的NADPH-GDH,主要作用于谷氨酸的合成; 另一类为以NADH为辅酶的NADH-GDH,主要作用于谷氨酸的分解(Loulakakis et al. 1991; Bernard et al. 2009)。本发明中以下所指的GDH就是NADPH-GDH。在高等植物中虽存在GDH基因,但由于其GDH对NH4+的亲和力低(Km 为10 mM-80 mM),而来源于真菌的GDH对NH4+的亲和力非常高(Km 为0.2 mM-4.5 mM),预示真菌GDH在低NH4+浓度时的氨同化能力比高等植物强(Abiko et al. 2010; Zhou et al. 2014)。因此,利用外源谷氨酸脱氢酶(主要是细菌和真菌)提高植物氮肥利用率是现在国内外生物工程研究的热点之一。Lightfoot et al. (2001)将大肠杆菌(E. coli)的gdhA基因在烟草中表达,发现转基因植株能够增强对PPT (phosphinothricin herbicides)的耐受力,而且氮素利用效率明显提高。Lightfoot et al.(2007)将大肠杆菌E.coligdhA 基因转入玉米中,发现转基因植株在明显缺水的季节里的萌发率和生物产量均比对照高,其氮素利用效率也明显提高,说明该基因在植株中高效表达即可以提高氮素利用效率,又可以使植物耐旱性增强。特别是在半干旱地区,作物谷氨酸脱氢酶改造具有很好的应用前景。朱冰等(2000)克隆了地衣芽孢杆菌(Bacillus licheniformis)谷氨酸脱氢酶基因并研究了其表达和功能。王芳和田波(2001)通过RT-PCR方法克隆了真菌中间脉孢霉(Neurospora intermedia)、好食脉孢霉(Neurospora sitophila)、粗糙脉孢霉(Neurospora crassa)的谷氨酸脱氢酶基因。重组谷氨酸脱氢酶活性分析表明:Ni-GDH具有更高的酶活性,其Km值在0.3-0.45 mmol/L左右。将其转入烟草,发现它能促进烟草在低氮水平下的生长。黄国存等利用RT-PCR方法从小球藻(Chlorella sorokiniana)中克隆了NADPH-GDH基因,并转入烟草(Nicotiana tabacumL.)。研究表明, 在低氮培养基或在低氮蛭石中其生长速度和叶片数明显高于对照。同时,铵毒性实验表明,无论在低铵或高铵条件下,接种在MS固化培养基上的转基因绿叶圆片存活时间长,叶绿素含量高(黄国存等,2002)。以上这些研究结果表明,外源NADPH-GDH在提高植物氮素的吸收和利用能力上具有巨大潜力和应用价值。
外源GDH在水稻中的应用方面,已有多个真菌GDH基因已转入水稻并展现了较好的应用前景。Abiko等(2010)将黑曲霉(Aspergillus niger)的GDH基因表达于水稻中,显著提高了水稻的氮同化效率和产量。同时,Zhou等(2015)将埃伦柱孢(Cylindrocarpon ehrenbergii)的CeGDH基因转入水稻,获得了氮素同化效率和谷物产量均显著提高的转基因株系,尤其在低氮大田中其增产效果非常显著。然而,Zhou等(2014)将鲍鱼菇(Pleurotus cystidiosus)的PcGDH基因转入水稻,获得了氮同化效率和谷蛋白含量显著提高的转基因株系,而其产量提高不明显。另外,Du等(2014)粗糙脉孢杆菌(Neurospora crassa)的NcGDH基因导入水稻,却发现转基因水稻的生长受到抑制,但是其耐除草剂Basta的能力显著提高。以上研究发现,真菌GDH基因虽能增强水稻的氮同化效率,但是并不一定能增加产量,甚至有时还降低产量。因此,筛选和鉴定既能增强氮同化效率又能增加产量的新的真菌GDH基因仍显得十分紧迫,而且也具有现实意义。
技术实现要素:
本发明的目的是提供一种真菌Trichurus的谷氨酸脱氢酶基因及其编码蛋白,该基因命名为TrGDH,所编码的相应蛋白命名为TrGDH蛋白。TrGDH序列全长为1359 bp,编码452个氨基酸。
本发明所提供的谷氨酸脱氢酶蛋白,名称为TrGDH,来源于真菌Trichurus,是具有下述氨基酸残基序列之一的蛋白质:
1)序列表中的SEQ ID No:2;
序列表SEQ ID No:2中的序列由452个氨基酸残基组成。
TrGDH的编码基因也属于本发明的保护范围。
TrGDH的cDNA基因,可具有下述核苷酸序列之一:
1)序列表中SEQ ID No:1的DNA序列;
2)编码序列表中SEQ ID No:2蛋白质序列的多核苷酸;
3)在高严谨条件下可与序列表中SEQ ID No:1限定的DNA序列杂交的核苷酸序列;
4)与序列表中 SEQ ID No:1限定的 DNA序列具有 70%以上同源性,且编码相同功能蛋白质的DNA序列。
序列表中的序列1由1359个碱基组成。
所述高严谨条件为在 0.1×SSPE (或0.1×SS),0.1×SDS的溶液中,在65℃下杂交并洗膜含有TrGDH基因的表达载体,细胞系和宿主菌均属于本发明的保护范围。
真菌Trichurus的谷氨酸脱氢酶基因(TrGDH)及其编码蛋白属于本发明的保护范围,且扩增TrGDH基因中任意片段的引物也在本发明的保护范围之内。
利用任何一种可以引导外源基因在植物中表达的载体,将本发明所提供的提高水稻氮素高效利用的基因TrGDH导入植物细胞,可获得改善水稻氮素高效利用及生长的转基因植株。本发明的基因在构建到植物表达载体中时,在其转录起始核苷酸前可加上任何一种一般性启动子、增强启动子或诱导型启动子。为了便于对转基因植物或转基因植物细胞进行鉴定及筛选,可对所使用的载体进行加工,如加入可选择性标记(GUS基因、GFP、YFP、As-Red和荧光素酶基因等)或具有抗性的抗生素标记基因(潮霉素、庆大霉素、卡那霉素、氨苄青霉素、博莱霉素等)。为了转基因植物释放的安全性,在构建植物表达载体时也可不携带任何标记基因,在苗期进行特定PCR分子标记筛选。含有本发明的TrGDH的表达载体可通过使用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导或基因枪等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。被转化的植物宿主既可以是单子叶植物,也可以是双子叶植物,如:水稻、小麦、玉米、黄瓜、番茄、杨树、草坪草、苜蓿等。
本发明的TrGDH蛋白异源表达在水稻中通过提高水稻的总NADP(H)-GDH酶活从而促进水稻对氮素的吸收进而改善水稻幼苗的生长及成熟期水稻的有效穗和千粒重。因此,通过基因工程的方法异源表达真菌Trichurus的谷氨酸脱氢酶在水稻中,可提高水稻在低氮条件下氮素的高效利用,从而使水稻在低氮的条件下能正常生长,提高氮肥的利用率,减少环境污染。本发明中的TrGDH蛋白对于提高水稻的氮素高效利用,进一步提高水稻的产量具有重要的作用。
下面结合附图及实施例对本发明做进一步说明。
附图说明
图1为TrGDH蛋白的进化树分析。
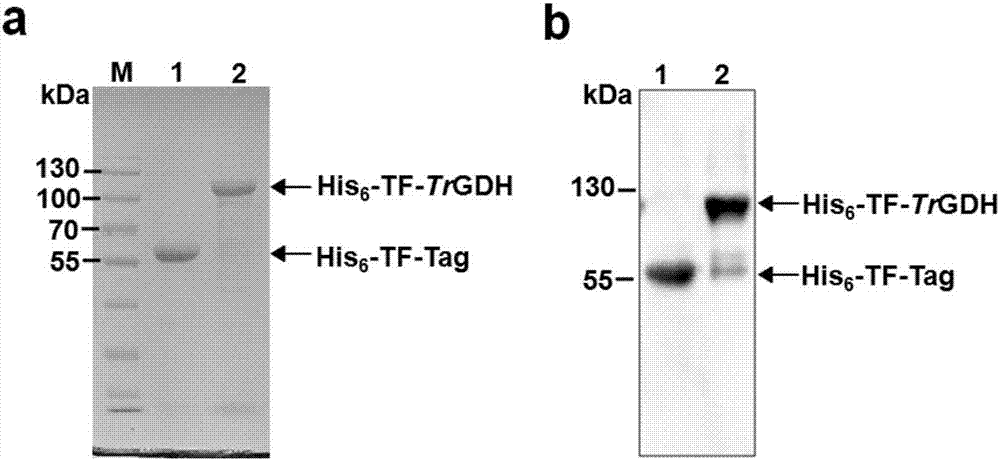
图2a 为His6-TF-TrGDH蛋白的纯化与鉴定。
图2b 为His6-TF-TrGDH蛋白的western blot鉴定。
图3a为His6-TF-TrGDH在不同NH4Cl浓度梯度下的动力学分析。
图3b为His6-TF-TrGDH在不同α-酮戊二酸(2-OG)浓度梯度下的动力学分析。
图3c为His6-TF-TrGDH在不同L-谷氨酸浓度梯度下的动力学分析。
图3d为His6-TF-TrGDH与水稻内源OsGDH在不同NH4Cl浓度梯度下的动力学比较分析。
图4a为异源表达TrGDH的双元载体pCAMBIAL1300-TrGDH图谱。
图4b为异源表达TrGDH的半定量RT-PCR分析。
图4c为异源表达TrGDH的western blot分析。
图4d为异源表达TrGDH对水稻内源GDHs(GDH1,GDH2,GDH3)表达影响的定量RT-PCR分析。
图5a 为不同NH4Cl浓度梯度下过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13的表型分析。
图5b 为过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13根与地上部分GDH酶活性分析。
图5c为不同NH4Cl浓度梯度下过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13的氮含量检测。
图5d为不同NH4Cl浓度梯度下过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13的湿重分析。
图5e为不同NH4Cl浓度梯度下过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13的干重分析。
图6为不同NH4Cl浓度梯度下过表达植株Ubi::TrGDH-4与Ubi::TrGDH-13种子谷清蛋白的含量分析。
具体实施方式
下述实施例中提到的实验方法如无特别说明均为常规方法。
TrGDH基因的克隆
通过对已经测序的真菌菌株的GDH基因的序列找到GDH 基因的保守区,并设计简并引物。简并引物的正向引物从开放阅读框的起始密码子开始,序列为5'- ATGTCCCACCTGCCTTTCGARCCNGARTT -3';简并引物的反向引物位于开放阅读框3’端的后面,序列为5'- CCACCAGTCACCCTGGTCRTGCATNGC -3'。以真菌Trichurus的cDNA为模板,利用RT-PCR的方法克隆出TrGDH基因。根据Chen et al (2006)的方法将TrGDH基因克隆到Gateway入门载体pGWC中然后测序。经序列分析发现,该基因在NCBI数据库里没有收录,它有完整的开放阅读框(ORF)并能够通读,是一个本发明人首次发现的新基因,我们将其命名为TrGDH。由于真菌和水稻它们对密码子的偏爱性不一样,所以为了使TrGDH基因更好的在水稻植株内表达,根据网站http://www.kazusa.or.jp/codon/中的方法找出需要改变的密码子,然后分析序列的结构域,将在功能域中的原真菌密码子变成水稻偏爱的密码子。采用设计点突变引物并运用重叠PCR技术将TrGDH序列中的原真菌密码子变成水稻偏爱的密码子,同时为了增强真菌PcGDH基因在转基因水稻植株内的翻译水平,我们在起始密码子ATG前面添加了kozark序列(GCCACC)。其克隆全长引物如下:TrGDH-F:GCCACCATGTCCCACCTGCCTTTCGA,TrGDH-R:CCACCAGTCACCCTGGTCGT。将添加了kozark序列并进行了水稻偏爱密码子修饰后的TrGDH序列再克隆到pGWC载体中,并将其通过Gateway的LR反应重组到改造后的pCAMBIA1301载体中。改造后的pCAMBIA1301载体含有潮霉素抗性筛选基因HPT和红色荧光蛋白筛选标记基因AsRed,并且将gateway cassette sequence克隆到pCAMBIA1301载体多克隆位点SacI和SacII之间,然后在gateway cassette sequence的3’末端加上2个FLAG标签序列(图2)。将构建好的pCAMBIA1301-TrGDH电击转入EHA105农杆菌并转化水稻(Oryza sativa cv. Kitaake)。
TrGDH基因的功能验证
(1) TrGDH基因的进化树分析
为了分析TrGDH基因与其他真菌及物种GDH基因的同源性关系,我们收集了真菌、E.coli、藻类、水稻和拟南芥GDH蛋白的氨基酸序列(表1:为进化树分析所用蛋白序列的具体信息),然后运用CLUSTAL X 和 MEGA 5软件构建进化树。结果表明,TrGDH与已有文献报道的对NH4+有很高亲和力的gdhA(Aspergillus niger), gdhA(Aspergillus nidulans)和NiGDH(Neurospora intermedia)的同源性很高,而与植物内源的GDH同源性不高(图1)。
表1.进化树分析所用蛋白序列的具体信息
(2)TrGDH的原核表达及酶促动力学分析
为了分析TrGDH的NADP(H)酶活,我们构建了原核表达载体pCold-TF-TrGDH并转化E. coli (BL21)。体外诱导表达TrGDH并通过SDA-PAGE检测纯化的蛋白并经western blot鉴定,由图2a-b可知纯化的TrGDH蛋白很单一,可用于测定NADP(H)-GDH酶活性和Km值 (图3a-d,表2)。GDH酶活性分析结果表明,TrGDH在体外正反应的酶活性大于逆反应的酶活性,说明TrGDH倾向于利用NH4+ 将α-酮戊二酸转化为谷氨酸,并且由Km值可知TrGDH对NH4+ 的亲和力大于对谷氨酸的亲和力。
表2. His6-TF-TrGDH蛋白对不同底物的动力学参数分析
(3) TrGDH基因的水稻转化
为了研究TrGDH基因对水稻氮素利用的影响,将构建好的pCAMBIA1301-TrGDH(图4a)电击转入农杆菌(Agrobacterium)菌株EHA105。然后用含有重组质粒pCAMBIA1301-TrGDH的农杆菌侵染水稻愈伤组织,在黑暗处28 ℃培养3天后,在含有 50 mg/L潮霉素的选择培养基上筛选抗性愈伤组织和转基因植株。将潮霉素抗性植株在阴凉处炼苗1周,然后移栽至大田中。
(4) 转基因植株的筛选和分子鉴定
收获T0代转基因水稻的种子(T1代),将种子在水中浸种2天后,移入37 ℃培养箱催芽3天,然后将幼苗进行半定量RT-PCR和western blot分析(图4b-c)。实验结果表明,TrGDH在转基因株系Ubi::TrGDH-4和Ubi::TrGDH-13中表达量较高,因此选这2个株系做下一步的实验研究。为了研究外源的TrGDH对水稻内源GDHs(GDH1,GDH2,GDH3)表达的影响,我们利用定量RT-PCR分析了水稻内源GDHs(GDH1,GDH2,GDH3)的表达变化(图4d),结果发现转入TrGDH降低了水稻内源GDHs(GDH1,GDH2,GDH3)的转录水平。为了确定TrGDH在转基因植株体内是否具有GDH酶活性,我们提取了转基因植株的总蛋白检测NADP(H)-GDH酶活性(图5b)。实验结果表明,转基因植株的NADP(H)-GDH酶活力大于野生型,并且在转基因株系和野生型中都是正反应的酶活大于逆反应的酶活,说明TrGDH蛋白在转基因植株体内发挥了功能。
(5)转基因植株的表型分析
将上一步得到的转基因水稻植株Ubi::TrGDH-4和Ubi::TrGDH-13以及野生型分别在不同氮素条件下进行水培和大田实验观察表型(图5a)。在水培实验中,转基因植株的干重、湿重、氮素含量以及谷清蛋白等都比野生型要好(图5c-e; 图6)。田间实验结果中,转基因植株的有效穗和千粒重比野生型的要高,但结实率比野生型略低,从而导致转基因水稻的产量和野生型相比没有明显的提高(表3)。
表3.野生型和TrGDH转基因水稻的田间农艺性状的统计分析
3. TrGDH基因的应用
基于经济效益和环境保护的考虑,近年来水稻的氮素利用效率引起了大家的重视。目前水稻氮素利用研究主要集中在肥料施用方法和时期的探索、缓释复合肥的研发和施用、以及水稻联合工程固氮菌的培育和使用等方面,而且也取得了一定进展。上世纪80年代产生的转基因技术由于直接在基因水平上改造植物的遗传物质、可定向改造植物的遗传性状,外源基因的转入打破了物种之间的生殖隔离障碍、丰富了基因资源等优点而弥补了常规育种方法的不足,得到了前所未有的发展。由于水稻本身的谷氨酸脱氢酶(GDH)对NH4+的亲和力低的特性,决定了水稻氮素利用效率不高。目前,国内外的研究工作证实通过外源GDH基因在转化植物中高效表达能够提高氮素利用率。到目前为止,虽然已有多个真菌GDH基因已转入水稻并展现了较好的应用前景,但是真菌GDH基因并不一定能增加产量。因此,发掘既能增强氮同化效率又能增加产量的新的真菌GDH基因仍显得十分紧迫。我们通过农杆菌介导的遗传转化方法将真菌Trichurus的GDH基因(TrGDH)转入水稻,在提高水稻氮素利用和改善水稻生长及农艺性状方面取得了良好的效果。
<110>湖南大学
<120>提高氮素高效利用的真菌TrGDH蛋白及其应用
<160> 2
<210> 1
<211> 1359
<212> cDNA
<213>毛束霉菌(Trichurus)
<400> 1
ATGTCCCACCTGCCTTTCGAGCCTGAGTTCGAGCAGGCTTACAACGAGCTTGCCACCACGCTCGAGAACTCGACCCTCTTCCAGAAGCACCCCGAGTATCGCACCGCGCTCAAGGTTTCCGCCATCCCCGAGCGTGTCATCCAGTTCCGCGTTGTCTGGGAGGACGATGCGGGCAACCTGCAGGTCAACCGCGGTTACCGCGTTCAGTTCAACTCCGCGCTAGGCCCTTACAAGGGTGGCCTGCGCCTCCACCCCTCGGTCAACCTGTCTATTCTTAAGTTCCTTGGCTTCGAGCAGATCTTCAAGAATGCGCTCACTGGTCTTTCCATGGGCGGCGGCAAGGGAGGCGCCGATTTCGACCCCAAGGGCAAGAGCGACGGCGAGATCCGCCGTTTCTGCACCTCTTTCATGCGTGAGCTTGGAAAGCACATCGGTGCCGACACTGACGTGCCCGCTGGTGACATCGGTGTGGGCGGTCGCGAGATCGGCTACCTGTTCGGTGCCTACCGCAAGGACCGCAACAAGTTCGAGGGTGTCCTGACCGGCAAGGGCCTCAGCTGGGGCGGCAGCCTGATCAGGCCCGAGGCCACCGGCTACGGTCTCGTCTACTACGTTGACCTCATGCTCCAGCACATGGGCAAGGGCGGCTTCGCTGGCAAGCGCGTCGCCATCTCCGGCTCCGGCAACGTCGCCCAGTACGCGGCGCTCAAGTGCATTGAGCTCGGTGCCACCGTCGTCTCTCTCTCCGACTCCACCGGTGCCCTCGTCCTCGACGGTGCGGAGGACTCCTTCACTCCCGAGGATATCAGCGCCATCATGAGCCTCAAGGAGAAGCGCAAGGCCATCACTGAGTTCAGCGGCAACGGCAAGCACAGGTACATCGCCGGCGCCAGGCCGTGGGTGTACGTCGGCAAGGTCGACATCGCGCTCCCCTGCGCGACCGAGAACGAGGTCAGCAAGGAGGAGGCCGAGGTGCTCGTCCGCAACGGCTGCTACGTCGTCGCTGAGGGCTCCAACATGGGCTGCACCCAGGAGGCCATCGACCTCTTCGAGGCCGAGAGGCAGACCAAGGGCAGCTCCGCCATCTGGTACGCCCCCGGCAAGGCCGCCAACTGCGGTGGTGTCGCCGTCTCGGGTCTCGAGATGGCCCAGAACAGCCAGCGCCTCCGGTGGACCCGTGAGGTCGTCGACGAGAGGCTCAAGGACATCATGAAGGACGCCTTCGAGGCCGGTCTCAAGAGCGCCGCCGAGTACGTCGAGACCAAGGAGGGCGAGCTTCCTTCGCTCGTTGCCGGTAGCAACATCGCCGGCTTCATCAAGGTCGCGGAGGCTATGCACGACCAGGGTGACTGGTGGTGA
<210> 2
<211> 452
<212> PRT
<213>毛束霉菌(Trichurus)
<400> 2
MSHLPFEPEFEQAYNELATTLENSTLFQKHPEYRTALKVSAIPERVIQFRVVWEDDAGNLQVNRGYRVQFNSALGPYKGGLRLHPSVNLSILKFLGFEQIFKNALTGLSMGGGKGGADFDPKGKSDGEIRRFCTSFMRELGKHIGADTDVPAGDIGVGGREIGYLFGAYRKDRNKFEGVLTGKGLSWGGSLIRPEATGYGLVYYVDLMLQHMGKGGFAGKRVAISGSGNVAQYAALKCIELGATVVSLSDSTGALVLDGAEDSFTPEDISAIMSLKEKRKAITEFSGNGKHRYIAGARPWVYVGKVDIALPCATENEVSKEEAEVLVRNGCYVVAEGSNMGCTQEAIDLFEAERQTKGSSAIWYAPGKAANCGGVAVSGLEMAQNSQRLRWTREVVDERLKDIMKDAFEAGLKSAAEYVETKEGELPSLVAGSNIAGFIKVAEAMHDQGDWW
- 还没有人留言评论。精彩留言会获得点赞!