硫酸化透明质酸2-辛基十二醇酯的制作方法
本发明涉及高分子载体材料领域和药物制剂领域,具体涉及一种硫酸化透明质酸2-辛基十二醇酯及其制备方法和作为药物载体的应用。
背景技术:
透明质酸(Hyaluronan,HA)是一种由N-乙酰-D-葡萄糖胺和D-葡萄糖醛酸经β-1,4糖苷键连接而成的天然线性多糖。HA具有良好的水溶性,生物相容性好,容易进行化学修饰,已作为多种药物载体被广泛应用。肿瘤细胞表面的HA受体CD44有过量表达,透明质酸与受体之间可以特异性结合,可以使纳米粒靶向到肿瘤,同时由CD44介导的细胞内吞作用可以使药物进入肿瘤细胞,增加难溶性药物的生物利用度。但是不同分子量的HA本身对肿瘤细胞的增殖和转移的影响可能表现为促进,也可能表现为抑制,所以HA衍生物材料对肿瘤细胞的影响有待进一步研究。
Anaid Benitez等发现硫酸化透明质酸可以抑制前列腺癌细胞如LNCaP,LNCaP-Al,DU145,LAPC-4的增殖、迁移和入侵。(Anaid Benitez,et al.,Targeting Hyaluronidase for Cancer Therapy:Antitumor Activity of Sulfated Hyaluronic Acid in Prostate Cancer Cells,Cancer Research,2011,71(12);4085-95)。Stephanie等合成硫酸化透明质酸,作用于I型疱疹病毒,说明其有抗病毒活性,且抗病毒活性随着硫酸化程度的提高而增强(Stephanie Michaela,et al,Synthesis and Antiherpetic Activity of Carboxymethylated and Sulfated Hyaluronan Derivatives.Carbohydrate Polymers,2012,90(2012):608-615)。但是上述的硫酸化透明质酸仍旧是亲水性的,不适用于难溶性药物的包封及选择性转运。
两亲性聚合物胶束由其疏水端聚集形成的内核,包载难溶性药物,增强脂溶性药物的溶解度;亲水端聚合形成的外壳能够有效防止药物被人体网状内皮细胞吞噬,使药物顺利运送到病灶部位,提高生物利用度,减少药物对正常组织的毒副作用。目前两亲性聚合物胶束材料主要有线性聚合物和非线性聚合物,研究表明,线性聚合物疏水链分子量越大,疏水链越长,纳米粒通过疏水作用的载药量就越高,但同时胶束的粒径也会随之增大,当粒径过大时容易被网状内皮系统捕获,也很难通过EPR效应实现肿瘤部位的药物释放,限制了胶束作为药物载体的应用。此时具有独特结构的非线性聚合物的出现有望解决胶束载药和粒径不可兼得的问题。由于线性聚合物与非线性聚合物的拓扑结构不同,当它们具有相同的相对分子质量时,非线性聚合物组装形成的纳米载体粒径要比线性聚合物形成的纳米载体粒径要小的多,可以实现在不增加纳米载体粒径的同时携载更多的疏水性药物(Svenson S.Dendrimers as versatile platform in drug delivery applications.Eur J Pharm Biopharm,2009,71(3):445-462)。
本发明是将透明质酸上的羟基进行硫酸化,并在HA羧基上接枝Y型化合物2-辛基十二醇,得到硫酸化透明质酸2-辛基十二醇酯。它是两亲性聚合物纳米材料,引入的硫酸根有利于改善材料本身的亲水性,形成亲水性外壳,提高药物对癌细胞的靶向作用;通过接枝Y形基团2-辛基十二醇,形成非线性聚合物胶束,相比于线型聚合物胶束,更有利于形成疏水内核,形成更大的疏水空腔,可以包裹更多的药物;同时硫酸化透明质酸2-辛基十二醇酯有利于提高HA的抗肿瘤活性,且无毒,生物相容性好。
目前尚没有将硫酸化透明质酸接枝Y型脂肪醇酯作为抗肿瘤纳米材料的报道。
技术实现要素:
本发明描述并要求一种新型硫酸化透明质酸2-辛基十二醇酯、其制备方法以及作为药物纳米载体的应用;它是一种安全性好、可生物降解、临界胶束浓度低的两亲性聚合物,可在水中自组装形成聚合物纳米粒,作为纳米药物传递系统,同时材料本身具有抑制肿瘤生长的作用。
本发明的目的在于提供一种硫酸化透明质酸2-辛基十二醇酯及其制备方法。
本发明的目的在于提供硫酸化透明质酸2-辛基十二醇酯在药物制剂领域的应用。
本发明涉及的硫酸化透明质酸2-辛基十二醇酯,其特征是在透明质酸骨架上接枝疏水的Y形基团2-辛基十二烷醇以及亲水基团硫酸根,使其具有两亲性,可在水中自组装形成聚合物胶束,作为难溶性药物的载体。
本发明所述的硫酸化透明质酸2-辛基十二醇酯,其特征是将疏水的Y形基团2-辛基十二烷醇通过酯键接枝到透明质酸中葡萄糖醛酸-N乙酰葡萄糖胺重复单元的羧基上,亲水性基团硫酸根取代透明质酸重复单元上的羟基。
本发明所述的硫酸化透明质酸2-辛基十二醇酯,其中接枝的疏水Y型基团2-辛基十二烷醇的总取代度为1%~30%。
本发明所述的硫酸化透明质酸2-辛基十二醇酯,其中硫酸化率为1~13%。
本发明所述的硫酸化透明质酸2-辛基十二醇酯,其特征在于选用的HA分子量为5×103~5×105Da,优选5×103Da。
具体地,本发明提供了一种硫酸化透明质酸2-辛基十二醇酯的制备方法,包括以下过程:
透明质酸四丁铵盐(HA-TeBA)的制备:称取适量透明质酸钠(HA-Na)溶于双蒸水中,磁力搅拌溶解;称取一定量的DowexWX8阳离子交换树脂(四丁铵型)加入HA-Na中,室温下磁力搅拌3h,过滤,冷冻真空干燥24h,40℃真空干燥12h,即得;
硫酸化透明质酸(sHA)的制备:精密称取适量HA-TeBA溶于N,N’-二甲基甲酰胺(DMF)中,50℃磁力搅拌2h使其溶解;另精密称取一定量的硫酸化试剂(三氧化硫N,N’-二甲基甲酰胺络合物)溶于DMF中,室温下搅拌溶解后,加入上述HA-TeBA溶液中,充氮气保护,0℃冰浴下磁力搅拌1h;1M NaOH溶液调节pH至中性,加入2-3倍体积乙醇静置过夜,离心后取沉淀,蒸馏水透析1d,冷冻真空干燥24h;
硫酸化透明质酸2-辛基十二醇酯(sHA-OCD)的制备:精密称取适量sHA溶于甲酰胺中,室温磁力搅拌溶解,然后冰浴,加一定量的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),冰浴下搅拌2h;另精密量取一定量2-辛基十二烷醇(OCD)溶于DMF中,将其逐滴加入sHA溶液中,35℃磁力搅拌24h;反应液加入乙醇沉淀离心,沉淀用水溶解后蒸馏水透析,冷冻真空干燥。
本发明所述的硫酸化透明质酸2-辛基十二醇酯,可包载难溶性药物(如多西紫杉醇等),制成载药聚合物胶束。
本发明所述的载药聚合物纳米粒是将硫酸化透明质酸2-辛基十二醇酯溶于双蒸水,自组装成浓度为2~8mg/mL的空白胶束溶液,将难溶或微溶性药物溶于少量有机溶剂后,逐滴加入上述的空白胶束溶液中,经超声处理后,置于双蒸水中透析除去有机溶剂,透析液经离心、过滤后,制得粒径为100~300nm的聚合物载药胶束,载药量可达1%~19%,包封率均在80%以上。
上述硫酸化透明质酸2-辛基十二醇酯,具有抑制肿瘤生长,易形成载药纳米粒,制备工艺简便,胶束稳定性好,包封率高,给药途径多等特点。
附图说明
图1硫酸化透明质酸的IR图谱
图2硫酸化透明质酸2-辛基十二醇酯的1H-NMR图谱
图3硫酸化透明质酸2-辛基十二醇酯的I371/I382与聚合物对数浓度关系图
图4硫酸化透明质酸的细胞抑制作用图
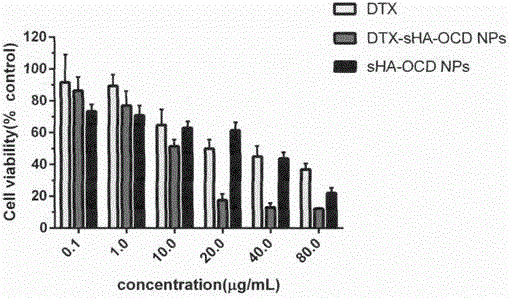
图5硫酸化透明质酸2-辛基十二醇酯空白纳米粒及其载药纳米粒的细胞抑制作用图
具体实施方式
通过下面实施例说明本发明的具体实施方式,但本发明的保护范围,不局限于此。
实施例1透明质酸四丁铵盐的制备
透明质酸钠(MW5000,HA-Na,2.0g)溶于400mL双蒸水中,室温下磁力搅拌过夜;另称取20gDowexWX8阳离子交换树脂(四丁铵型)加入HA-Na中,室温下磁力搅拌过夜,过滤,冷冻真空干燥,40℃下真空干燥,得透明质酸四丁铵盐(HA-TeBA)。
实施例2硫酸化透明质酸(sHA)的制备
精密称取实施例1中的HA-TeBA(MW5000,1000mg)溶于50mlN,N’-二甲基甲酰胺(DMF)中,50℃磁力搅拌2h使其溶解;另精密称取1540mg的硫酸化剂三氧化硫DMF络合物(SO3·DMF)溶于50mLDMF中,室温下搅拌至溶解后,加入HA-TeBA中,充氮气保护,冰浴后磁力搅拌1h;1M NaOH溶液调节pH至中性,加入乙醇沉淀、离心,蒸馏水透析2d,冷冻真空干燥,得硫酸化透明质酸(sHA)。IR图谱确认sHA结构(见图1)。元素分析法测定硫酸化程度,硫含量(S%)为4.392%。
实施例3硫酸化透明质酸2-辛基十二醇酯(sHA-OCD)的制备
精密称取实施例2中的sHA(100mg)溶于5ml甲酰胺中,室温磁力搅拌20min使其溶解,然后冰浴,加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,95mg)、N-羟基琥珀酰亚胺(NHS,58mg),冰浴下反应2h;另精密量取一定量2-辛基十二烷醇(OCD)溶于9mLDMF中,将其逐滴加入sHA溶液中,35℃磁力搅拌24h;反应液加入乙醇沉淀、离心,沉淀用水溶解后蒸馏水透析2d,冷冻真空干燥得硫酸化透明质酸2-辛基十二醇酯(sHA-OCD)。1H-NMR图谱(见图2)确认sHA-OCD结构,取代度约为10%。
实施例4sHA-ODA临界胶束浓度的测定
精密称取10mg sHA-ODA,分散于少量蒸馏水中,磁力搅拌24h,冰浴超声30min(超声功率195W,工作2s,间歇3s),定容至10mL,得1mg/mL的空白胶束溶液;将1mg/mL的空白胶束溶液稀释至sHA-OCD浓度(C)为1×10-3、2.5×10-3、5×10-3、1×10-2、2.5×10-2、5×10-2、1×10-1、2.5×10-1、5×10-1mg/mL的系列胶束溶液,分别加入定量的芘(终浓度为5×10-6mol/L)中,混合液超声30min,40℃避光水浴过夜,利用荧光分光光度计测定芘的荧光强度。激发波长为334nm,发射波长I1为371nm,I3为382nm,狭缝宽度EX为5nm,EM为5nm。
以1gC(g/L)与芘在371nm和382nm出的荧光强度比值(I371/I382)作图(见图3),曲线的拐点对应的聚合物浓度即为该聚合物材料的临界胶束浓度(CMC)。计算得sHA-OCD的CMC值为31.62μg/mL。由此表明sHA-OCD胶束的临界胶束浓度比较小,说明制备的载药胶束具有较好的稀释稳定性。
实施例5sHA-OCD纳米粒的制备
按2~8mg/mL的浓度称取适量sHA-OCD溶于一定体积的蒸馏水中,经超声处理制备成粒径为100~300nm的空白胶束纳米粒溶液(sHA-OCD NPs)。
实施例6载药sHA-OCD纳米粒的制备
16mg sHA-OCD溶于蒸馏水制得浓度4mg/mL的空白胶束溶液,将2.0mg的多西紫杉醇(DTX)溶于400μL甲醇中,逐滴加入到上述空白胶束溶液中,冰浴超声30min(超声功率195W,工作2s,间歇3s),置于蒸馏水中透析除去甲醇,透析液经离心,过滤后,制得粒径为100~300nm的载药sHA-OCD胶束纳米粒(DTX-sHA-OCD NPs)。表1是DTX-sHA-OCD纳米粒及空白纳米粒的一些性质。
表1 载药纳米粒(DTX-sHA-OCD NPs)和空白纳米粒(sHA-OCD NPs)的性质
结果显示,硫酸化透明质酸2-辛基十二醇酯(sHA-OCD)这种两亲性材料,可在水中自发形成胶束,且纳米粒粒径小于250nm,药物包封率高(>80%),对多西紫杉醇有明显的增溶作用。
实施例7sHA和DTX-sHA-OCD NPs体外对肿瘤细胞的抑制作用
纳米制剂组:DTX-sHA-OCD NPs,培养液稀释至浓度为0.1μg/mL~80μg/mL。
原料药组:多西紫杉醇溶液(DTX),培养液稀释至浓度为0.1μg/mL~80μg/mL。
空白纳米粒组:sHA-ODA NPs,培养液稀释至上述相同浓度。
硫酸化透明质酸组:sHA,培养基稀释至浓度为20~320μg/mL。
透明质酸对照组:HA,培养基稀释至浓度为20~320μg/mL。
取处于指数生长期状态良好的人结肠癌RKO细胞,加入0.25%胰蛋白酶消化液,消化使贴壁细胞脱落,计数制成细胞悬液;分别以6×103~1×104个/孔的密度接种于96孔培养板中,置CO2培养箱中培养24h;按上述实验方案分别给予所需浓度的纳米制剂组、原料药组、空白纳米粒溶液、sHA组、HA对照组,每一浓度平行6孔,继续培养。48h后,向每孔加入10μLMTT液,放入细胞培养箱孵育4h后,向每孔加入150μLDMSO,使用酶标仪检测490nm处吸光度。处理数据,绘制图表(见图4、5),计算半数抑制浓度IC50值(见表2)。
表2 体外对人结肠癌RKO细胞增殖的抑制作用(IC50值)
结果显示,sHA以及sHA-OCD空白纳米粒组对于RKO细胞的生长具有一定的抑制作用。DTX-sHA-OCD NPs制剂组的IC50小于多烯紫杉醇原料药,说明载药sHA-OCD NPs能使多西紫杉醇对RKO毒性明显增强,可能是通过CD44受体介导的主动靶向作用将药物递送至肿瘤细胞,提高抗肿瘤活性。
以上对本发明的具体实施例进行了详细描述,但只是作为范例,本发明并不限制于以上描述的具体实施例。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!