小麦抗旱基因TaH2A.9及其应用的制作方法
本发明属于生物基因工程技术领域,尤其涉及一种小麦抗旱基因(基因TaH2A.9)及其应用。
背景技术:
干旱严重影响农作物产量,特别是随着工业的发展,干旱灾害愈来愈严重,而且土壤盐渍化也加剧了干旱灾害,使得干旱变成了一个全球关注的社会问题。我国人口众多,而干旱灾害更为严重,已经成为制约我国经济和社会发展的重要因素。因此,除了加快科学灌溉系统建设、缓解土壤盐渍化以外,培育抗旱作物新品种已成为当前一个十分迫切的任务。
利用转基因技术改良植物将新的性状转入高生物量植物中,以此开发高效的转基因植物新品种并用于在旱地种植,是一项具有广阔应用前景的技术。
目前,利用基因工程技术开展植物抗旱方面的研究已取得了较大的进展,克隆了大量相关基因,并将这些基因转入植物中,用于抗旱机制研究。一些实验表明,将植物本身以及其它生物中与抗旱相关的基因转入植物中,其转录和翻译产物可以使转基因植物的抗旱能力得到提高。
检索表明已发现了一些能显著提高植物抗旱能力的基因,但有关H2A基因在植物抗旱过程中的作用报道较少。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种抗旱基因——小麦基因TaH2A.9及其应用。
本发明的技术方案是:从小麦中分离得到基因TaH2A.9,然后将该基因转化到拟南芥中,进行转基因功能验证(拟南芥转化筛选及旱胁迫表性分析),以实现研究H2A基因的功能以及抗旱机理。
本发明所述的小麦抗旱基因,其特征在于:所述基因命名为小麦抗旱基因TaH2A.9,该基因cDNA的核苷酸序列如SEQ ID No.1所示。
本发明还提供了一种含有上述小麦抗旱基因TaH2A.9的植物表达载体pSTART-TaH2A.9。
本发明所述小麦抗旱基因TaH2A.9以及含有所述小麦抗旱基因TaH2A.9的植物表达载体pSTART-TaH2A.9在培育抗旱植物中的应用,其中,所述植物优选是普通小麦或拟南芥。
本发明所述的小麦抗旱基因TaH2A.9以及含有所述小麦抗旱基因TaH2A.9的植物表达载体pSTART-TaH2A.9可广泛用于培育抗旱农作物品种。
将本发明所述小麦抗旱基因TaH2A.9导入植物细胞,植物即可相应地获得抗旱能力。为了便于对转基因植物或细胞系进行筛选,可以对含有所述基因TaH2A.9的植物表达载体(pSTATR-TaH2A.9)进行加工,如可以加入选择标记(GUS等)或者具有抗性的抗生素标记物(潮霉素,卡那霉素,庆大霉素等)等。
实际上,任何一种可以将外源基因导入植物中表达的载体都可以应用,本发明优选的载体是pSTART。
本发明的有益效果是:利用现有的植物基因工程技术,本发明首次克隆得到了小麦抗旱基因TaH2A.9,并通过根瘤农杆菌介导的方法将该基因转入拟南芥,经过比较分析证明,转基因植株的抗旱能力明显提高,证实本发明的基因具有广泛的应用前景。
附图说明
图1:TaH2A.9基因全长cDNA序列的扩增结果
其中:M为λDNA/(BamH I+Sac I)Marker,下同;-:阴性对照。
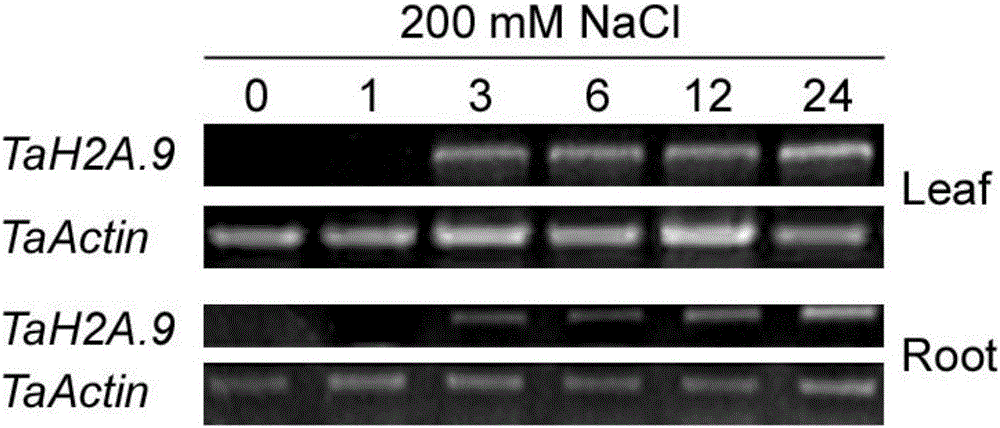
图2:NaCl胁迫下小麦中TaH2A.9的RT-PCR分析
其中:Leaf表示叶;Root表示根;TaActin表示小麦Actin基因(内参);数字表示胁迫时间(小时)。
图3:pSTART-TaH2A.9拟南芥表达载体构建过程
其中:A为带酶切位点的TaH2A.9片段扩增;B为Xba I和BamH I对pSTART-TaH2A.9载体进行双酶切条带;C为转化了pSTART-TaH2A.9大肠杆菌的菌体PCR验证;D为转化了pSTART-TaH2A.9农杆菌的菌体PCR验证。
图4:拟南芥TaH2A.9转基因植株的基因组PCR和RT-PCR检测
其中:V为空载体转基因株系;T1、T2为两个独立的转基因株系;C为野生型拟南芥;AtActin为拟南芥Actin基因内参;Genomic PCR为通过基因组PCR验证TaH2A.9整合到拟南芥基因组;RT-PCR为通过RT-PCR验证TaH2A.9在转基因株系中正常表达。数据显示,在转基因株系中能够扩增出TaH2A.9条带,而在空载体转基因株系及野生型中不能扩增出条带,表明TaH2A.9整合到拟南芥基因组中并且正常表达。
图5:干旱胁迫下转基因植株的生长状况
其中:WT为未转化拟南芥植株;T1/T2为两个独立的转基因株系;VC为空载体对照。数据表明,转化TaH2A.9的转基因拟南芥的抗旱能力明显增加。
具体实施方式
实施例1、TaH2A.9的克隆和表达分析
1.1提取小麦Total RNA
1.将组织材料放入液氮预冷的研钵中,在液氮中充分研磨成粉末;
2.待液氮挥发干,立即转移到2ml的离心管中,每100mg材料约加入1ml的Invitrogen公司的TRIzol提取液,融化后,用加样枪反复吸吹,剧烈振荡混匀样品,使样品充分裂解,室温放置5分钟;
3.加入0.2ml氯仿,剧烈振荡混匀15秒,室温放置10分钟;
4. 4℃,12000rpm离心15分钟;
5.用移液器小心吸出上层水相,加入新的1.5ml的离心管中,加入500μl的异丙醇(1:1体积),充分混匀,-20℃,沉淀30min或过夜;
6. 4℃,12000rpm离心10min,小心弃去上清液;
7. RNA沉淀用1ml的75%乙醇洗涤;4℃,8000rpm离心10min收集沉淀;
8.重复用75%乙醇洗涤一次RNA沉淀;
9.去上清,RNA沉淀于无菌操作台上晾干约10-15分钟,RNA略显透明,加入适当体积(30-50μl)的RNase-free水充分溶解(可放于-80℃长期保存);
10.紫外分光光度计及1%Agrose凝胶电泳检测RNA浓度及质量。
注:a)用紫外分光光度计检测RNA的产量,在260nm处的吸光度,1OD=40μg/ml。根据在260nm和280nm处的吸光值,检测RNA的纯度,纯RNA的OD260/OD280比值应接近2.0(比值最好在1.9~2.1之间)。
b)用1%Agrose凝胶电泳检侧RNA的质量及大小。吸取1μl RNA加入3μl的RNase-free水,加1μl上样缓冲液65℃变性5分钟。电泳后用EB染色,另取3μl的1kb DNA Marker作为对照。
1.2cDNA反转录
反转录酶:M-MLV Reverse Transcriptase(Invitrogen)。
1. 12μl反应体系
2. 65℃变性5min,迅速插入冰中,然后依次加入:
5×First-Strand Buffer 4μl
0.1M DTT 2μl
RNaseOUT(Invitrogen) 1μl
3.轻轻混匀,37℃反应2min;
4.加入1μl M-MLV RT,混匀,37℃反应50min;
5. 70℃温育15min使M-MLV RT失活;
6.加入1μl RNase H(Invitrogen),37℃反应20min;
7.用超纯水稀释至合适浓度。作为PCR模板。
1.3开放阅读框的克隆和序列测定
1.引物序列:根据测序结果,设计基因上下游引物,扩增基因的开放阅读框。
2. PCR反应体系(50μl):
3. PCR反应程序为:94℃预变性5min;94℃变性45sec,55℃复性45sec,72℃延伸1.5min,循环35次;72℃延伸7min。
4.扩增片段回收后与pMD-18T载体连接并转化大肠杆菌DH10B,测序由上海Invirtron公司完成。结果见图1。
1.4基因表达分析(RT-PCR)
1. RNA的提取
山融3号和济南177小麦种子正常萌发,Hangload培养液培养至株高约10cm时(约3周时间)开始施加盐胁迫(200mM NaCl),处理0、1、6、12、24小时取幼嫩的叶片和根系提取RNA。
2.反转录(RT)产生cDNA
反转录产生cDNA,方法同上。
3. PCR反应及电泳
(1)以cDNA为模板,进行PCR反应。
(2)PCR体系:
(3)PCR程序:
95℃5min;25~30cycles 95℃20s,57℃60s,72℃60s;72℃7min。
根据内参Actin的扩增情况确定PCR的循环数,调整cDNA模板的加入量。
(4)PCR产物在1%琼脂糖凝胶上电泳,EB染色。结果见图2。
实施例2、植物表达载体的构建
利用植物表达载体pSTART,选用XbaI和BamHⅠ分别对pSTART和含有目的基因的pMD18-T载体进行双酶切;回收载体大片段和目的基因小片段,用T4DNA连接酶连接后转化大肠杆菌DH10B感受态细胞,鉴定重组子后即得到带有目的基因的植物表达载体。
1.双酶切,以pSTART空载体和pMD18-T为例
碱裂解法提取pSTART空载体和pMD18-T质粒,各取10μg酶切,酶切体系如下:
于30℃恒温水浴锅酶切2小时以上。双酶切后以1×TAE为电泳缓冲液,将酶切产物进行0.8%琼脂糖凝胶电泳。在紫外透射仪下用洁净刀片切下pSTART中14kb的载体大片段和pMD18-T中大约0.45kb的目的基因条带,回收该条带。结果见图3A。
2. pSTART质粒酶切回收的载体大片段的脱磷。
3.经酶切和脱磷的pSTART载体片段(约14kb)和pMD18-T双酶切回收片段(约0.45kb)以摩尔比1:4的比例进行16℃连接过夜。
4.利用热激法将连接产物转化大肠杆菌DH10B感受态细胞,转化菌在含50μg/ml Kan的LB固体平板上37℃培养16小时左右。
5.重组子的鉴定
(1)质粒的PCR验证
挑取单菌落分别接种于5ml含Kan的LB液体培养基中37℃振荡培养过夜,碱变性法提取质粒,用基因特异引物进行PCR扩增。
PCR反应条件:预变性94℃3min;94℃30sec,55℃30sec,72℃1min,35个循环;72℃延伸10min。PCR产物用1.0%琼脂糖凝胶电泳鉴定。结果间图3C。
(2)质粒酶切鉴定
提质粒进行XbaI和BamHI双酶切,酶切体系同上。0.8%琼脂糖凝胶电泳,检测是否含有预期分子量大小的片段,验证载体的正确构建。结果见图3B。
实施例3、农杆菌感受态的制备与转化
3.1农杆菌AGL1/EHA105感受态的制备
1.从YEP平板(含50μg/ml利福平)上挑取根癌农杆菌单菌落,接种于YEP液体培养基(含50μg/ml利福平)中,200rpm/min,28℃培养过夜。
2.取2ml过夜培养液接种于50ml含相同抗生素的YEP液体培养基中在相同条件下培养至OD600达0.5。
3.菌液冰浴30min,4℃,5000rpm离心10min,收集菌体。
4.将菌体重悬于冰浴的10ml 0.15mol/L的NaCl中,离心收集菌体。
5.再悬浮于1ml 20mmol/L冰预冷的CaCl2溶液中,以200μl/管将菌液分装在1.5ml Eppendorf管中,置液氮中速冻1min,-70℃保存备用。
3.2冻融法转化根癌农杆菌AGL1/EHA105
1.在室温下融化农杆菌感受态细胞,加入1μg表达载体质粒DNA,混匀后冰浴30min。
2.置液氮速冻1min,迅速移至37℃保温3min。
3.加入无抗生素的YEP 800μl,28℃震荡培养3小时。
4. 7000rpm离心30s收集菌体,涂于含50μg/ml利福平、50μg/ml Kan的YEP平板上,28℃倒置暗培养2-3天。
3.3菌体PCR鉴定
挑取2.4的单菌落转移到如前所述的PCR体系(不加DNA模板)中,用基因特异引物进行PCR扩增。PCR反应条件:预变性94℃3min;94℃30sec,55℃30sec,72℃1min,35个循环;72℃延伸10min。PCR产物用1.0%琼脂糖凝胶电泳鉴定。结果见图3D。
实施例4、转基因功能验证-拟南芥转化筛选及抗旱表型分析
4.1拟南芥种植
将种子放入EP管中,70%乙醇中浸泡5min,洗涤10-15min,无菌水冲洗4次,4℃春化72h。向消毒好的种子中加入0.5%agarose(冷却至40℃),铺于1/2MS固体培养基上,超净台上吹干。转入人工气候室中培养一周左右,可移栽。将人工土壤装入合适大小的培养钵,70℃烘干2小时以上,然后将培养钵放在营养液中,使其充分吸水,将在1/2MS固体培养基上生长7-10天的幼苗移栽于饱含营养液的人工土壤中,盖上保鲜膜,转入人工气候室中培养。1-2天后揭去保鲜膜。隔几天浇一次水(浇在培养钵底下的托盘里)。
4.2拟南芥转化
1.当拟南芥(哥伦比亚野生型)花序形成时,将花序顶端减掉以诱导测花序的生成,转化前将材料浇透营养液。
2.转化前一天,取2ml活化的农杆菌AGL1加到含相应抗生素的200ml YEP培养基中,过夜培养至OD600=1.0-1.2。
3.离心收集菌体,并重悬于浸染液(5%蔗糖,0.04%Silwet L-77)中,使OD600=0.8。
4.将花序浸入浸染液30秒,其间前后摆动花序,使花序上形成一层膜。
5.用保鲜膜覆盖花序,暗培养一天后揭去保鲜膜,至于19-22℃培养室培养。
6.隔5-7天再同法浸染一次。
7.大约一个月后收获种子。
4.3小麦和拟南芥转化阳性株系筛选
1.收获的T0代种子消毒后,铺于含50μg/ml Kan的MS筛选培养基上(方法同上)。
2. 4℃春化48h,移到人工气候室生长7-10天。将抗性小苗移到土中继续生长。
3.等植物绝大多数花苞已经结果荚,用小绳将植物单株绑起,以便单株收种子T1代种子。
4. PCR扩增以转化株系的基因组DNA为模板,使用基因特异引物进行基因组PCR,鉴定阳性克隆。结果见图4。
5.T1种子处理同前,在T2代植物中挑选抗性比为3:1的单插入独立株系。
6.将T2代植株种子按照上述方法,铺于含50μg/ml Kan的MS筛选培养基上,筛选全部Kan抗性的系,移栽到培养钵中,收获T3带纯系种子,用于后续分析。
7.从T3带纯系株系上取下1片叶子,按照上述方法提取RNA,进行RT-PCR分析,鉴定转基因的表达情况。结果见图4。
4.4拟南芥阳性株系抗旱表型分析
1.按照上述方法将拟南芥种子消毒、铺在1/2MS培养基上培养,得到7-10天幼苗,移栽到培养钵中培养至一月大小,进行控水试验。
2.控水试验:停止浇水10天后,正常浇水,观察转基因和非转基因株系生长情况。结果见图5。
序列表
<110>山东大学
<120>小麦抗旱基因TaH2A.9及其应用
<141>2017-03-16
<160> 1
<210> 1
<211>456
<212>cDNA
<213>小麦
<221>小麦抗旱基因TaH2A.9
<222>(1)…(456)
<400>1
atggccggaa ggaagggagg cgacaggaag aaggcggtga ccaggtccgt caaggccggg 60
gttctccagt tccccgtcgg ccgcatcggg cgctacctca agaagggccg ctacgcgcag 120
cgcgtcggct ccggcgcccc cgtctacctc gccgccgtcc tcgagtacct cgccgctgag 180
gttcgcctgg agcttgccgg caacgcggcc aaggacaaca agaagacccg gatcatcccg 240
cgacacctgc tgctcgccgt ccgcaacgac caggagctcg gaaggctgct cgccggcgtc 300
accatcgtcg cccacggcgg cgtgatcccc aacatcaact ccgtgctgct cccaaagaag 360
tcccccatcg ccgccgccga gaaggaggcc aagtcgccca agaagaagac caccgccaag 420
tcccccaaga agaaggtcgc cgccaccaag gagtag 456
- 还没有人留言评论。精彩留言会获得点赞!