耐热赖氨酸氨肽酶的发酵方法与流程
本发明涉及生物工程技术领域,尤其涉及一种耐热赖氨酸氨肽酶的发酵方法。
背景技术:
赖氨酸氨肽酶作为一种外切型蛋白酶,在食品、医药和化工等多种领域都有很重要的应用。可用于去除蛋白水解液中的苦味、蛋白质的深度水解、生物活性肽的制备或用作重组蛋白固定剂或蛋白序列测定所需的工具酶等,在食品、医药保健与化工行业应用前景广阔。
毕赤酵母,作为一种被广泛应用的宿主,已经成功的表达了上百种外源蛋白,能够进行高密度发酵,提高外源蛋白的表达水平。与传统的摇瓶发酵相比,毕赤酵母高密度发酵具有如下特点:(1)较高的生物量;(2)反应体系所需空间小,成本低;(3)可通过提供纯氧和补料,使发酵过程中溶氧和营养更充分满足菌体产酶。
具备耐热特点的蛋白水解酶类在提取及水解蛋白原料方面有很明显的优势。譬如原料水解前预处理后不需降温就可以加酶水解,蛋白结构变性后更有利于蛋白水解酶的快速作用,大大提高了水解效率,且赖氨酸作为一种必须氨基酸和强化营养食品中的常用氨基酸,其制备与应用方面的研究意义重大。但目前使用毕赤酵母发酵产出耐热赖氨酸氨肽酶的方法过程较复杂,产量不高,极大的限制了其应用和研究。
此外,采用现有技术分离耐热赖氨酸氨肽酶时,会出现使酶失活的现象,因而也限制了该酶的应用研究。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种耐热赖氨酸氨肽酶的发酵方法,采用本发明的发酵方法,能够提高胞外赖氨酸氨肽酶的表达水平,且本发明的纯化步骤能够保证赖氨酸氨肽酶的活性不受影响,本发明的赖酸氨肽酶与内切酶协同水解蛋白时,能够先水解赖氨酸,然后再水解亮氨酸。
在一方面,本发明提供了一种耐热赖氨酸氨肽酶的发酵方法,包括以下步骤:
(1)将重组毕赤酵母种子液按8-12%接种量接种至bsm培养基中发酵培养,重组毕赤酵母为含有来源于铜绿假单胞菌nj-814的赖氨酸氨肽酶基因的毕赤酵母菌,铜绿假单胞菌nj-814的保藏编号为cgmccno.7638;
(2)当培养基中的初始甘油耗完后,流加甘油补料培养基,当od600达到350-450后停止流加,然后流加甲醇水溶液进行诱导培养,当酶活下降时停止发酵培养,得到耐热赖氨酸氨肽酶。
进一步地,在步骤(1)中,在初始转速为450-550r·min-1,通气量为2vvm,30℃的条件下发酵培养。
进一步地,在步骤(2)中,甘油补料培养基的流加速度为17-19ml·h-1·l-1。
进一步地,在步骤(1)中,重组毕赤酵母种子液的制备方法包括以下步骤:将活化后的重组毕赤酵母在bmgy培养基中,于25-35℃,200-250r·min-1的转速下培养。
进一步地,在步骤(2)中,流加甲醇水溶液之前还包括饥饿培养1.5-2.5h的步骤,饥饿培养时不流加任何碳源。
进一步地,在步骤(2)中,流加甲醇水溶液时,在1-2h内,甲醇水溶液流加速度为1.0-1.5ml·h-1·l-1,2h-3h时,甲醇水溶液流加速度1.5-2.5ml·h-1·l-1,3h后恒速流加,且恒速流加速度为2.5-3.0ml·h-1·l-1。在诱导初期的低流速流加控制,避免了过高的甲醇浓度对重组酵母的毒害作用,有利于甲醇利用酶系的合成并逐步提高菌体对甲醇的耐受能力。
进一步地,在步骤(2)中,甘油补料培养基包括质量分数为45-55%的甘油和1.0-1.5%的ptm1。优选的,甘油的质量分数为50%。
进一步地,在步骤(2)中,甲醇水溶液中含有质量分数为1.0-1.5%的ptm1。每100mlptm1微量盐溶液中含有以下质量百分比的各组分:0.008%nai,0.3%mnso4·h2o,0.6%cuso4·5h2o,0.02%na2moo4,0.002%硼酸,2%znso4·7h2o,0.05%cocl2,6.5%feso4·7h2o,5ml硫酸,0.02%生物素。
进一步地,在步骤(2)中,发酵培养过程中溶氧为20%-30%。通过控制转速、通气量和罐压维持溶氧。
进一步地,耐热赖氨酸氨肽酶的基因序列如seqidno.1所示。
进一步地,在步骤(2)之后,还包括以下纯化步骤:
(s1)用质量分数为40%-60%的硫酸铵对耐热赖氨酸氨肽酶进行盐析,然后透析;
(s2)对透析得到的产物进行阴离子交换层析;
(s3)浓缩、过滤层析得到的耐热赖氨酸氨肽酶液,然后经凝胶过滤层析。
进一步地,在步骤(s2)中,采用hitrapqhp阴离子交换柱进行阴离子交换层析。
进一步地,在步骤(s2)中,阴离子交换层析时使用50mmtris-hcl缓冲液,其中,除杂时,缓冲液中含有质量分数为28%的nacl;洗脱目的蛋白时,缓冲液中含有质量分数为42%的nacl。
进一步地,在步骤(s3)中,过滤时使用的膜的截留分子量为20-40kda。
进一步地,在步骤(s3)中,采用superdextm7510/300gl过滤柱进行凝胶过滤层析。
进一步地,在步骤(s1)中,耐热赖氨酸氨肽酶还可以为摇瓶发酵获得的粗酶液。
粗酶液的制备方法包括以下步骤:将重组毕赤酵母的单菌落在bmgy培养基中230rpm下培养18h,然后转入bmmy培养基中在25℃、ph=5.0的条件下培养120h,每隔24h向培养液中添加终浓度1.5%的甲醇进行诱导,将得到的发酵液离心后,上清液即为赖氨酸氨肽酶粗酶液,其中重组毕赤酵母为含有来源于铜绿假单胞菌nj-814的赖氨酸氨肽酶基因的毕赤酵母菌,铜绿假单胞菌nj-814的保藏编号为cgmccno.7638,毕赤酵母菌为巴斯德毕赤酵母菌株gs115。
由于本发明涉及的耐热赖氨酸氨肽酶的n端与c端挂组氨酸标签后,其活性会受到影响,因此采用上述方法进行纯化。
采用上述纯化方法所制备的耐热赖氨酸氨肽酶可水解酪蛋白,具体包括以下步骤:
将耐热赖氨酸氨肽酶与碱性蛋白酶在80℃下协同水解酪蛋白,水解时间为3h,酪蛋白的浓度为10%,耐热赖氨酸氨肽酶的添加量为90u/g。
进一步地,每升bmgy培养基中包括以下质量的各组分:蛋白胨20g,甘油10g,酵母膏10g,ynb(无氨基酵母氮源),)13.4g,生物素0.4g,100mm磷酸盐缓冲液(ph6.0)。
进一步地,每升bmmy培养基中包括以下质量的各组分:蛋白胨20g,甲醇10g,酵母膏10g,ynb13.4g,生物素0.4g,100mm磷酸盐缓冲液(ph6.0)。
进一步地,每升bsm培养基中包括以下质量百分比的各组分:4%甘油,1.49%mgso4·7h2o,0.413%koh,1.82%k2so4,2.67%85%磷酸,0.093%caso4,0.435%ptm1。
进一步地,每100mlptm1微量盐溶液中含有以下质量百分比的各组分:0.008%nai,0.3%mnso4·h2o,0.6%cuso4·5h2o,0.02%na2moo4,0.002%硼酸,2%znso4·7h2o,0.05%cocl2,6.5%feso4·7h2o,5ml硫酸,0.02%生物素。
本发明涉及的重组毕赤酵母由申请号为201510379603.1的中国专利所公开的方法所构建。铜绿假单胞菌nj-814的保藏编号为cgmccno.7638保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.7638。
借由上述方案,本发明至少具有以下优点:
本发明提供了一种耐热赖氨酸氨肽酶的发酵方法的高密度发酵方法,在有效解决该耐热赖氨酸氨肽酶基因在细菌中无法高效表达的难题基础上,进一步提高赖氨酸氨肽酶产量;由于该酶上游构建n端与c端挂组氨酸标签后活性受到影响,因此纯化时不能用金属螯合亲和层析法,本发明采用经反复优化获得的特定条件下的组合纯化方案:分级盐析—hitrapqhp离子交换层析—superdex75凝胶过滤层析,得到纯化的酶,解决了上述难题,从而为研究耐热赖氨酸氨肽酶的特性、构效等提供了良好的基础;本发明提供了耐热赖氨酸氨肽酶在水解酪蛋白原料中的应用,为进一步拓宽该酶协同水解蛋白原料的研究建立了良好基础。
本发明发酵产出的赖氨酸氨肽酶,不仅具有很好的遗传稳定性,且具有良好的温度稳定性,为氨肽酶的产业化和在食品领域中的应用奠定了良好基础。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
图1是甘油补料阶段重组毕赤酵母的生长曲线;
图2是赖氨酸氨肽酶的产量与甲醇诱导时间的关系曲线;
图3是不同纯化程度的酶的电泳图;
图4是纯化后的赖氨酸氨肽酶的sds-page测试结果;
图5是纯化后的赖氨酸氨肽酶在不同温度下的酶活测试结果;
图6图示了纯化后的赖氨酸氨肽酶的温度稳定性结果。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
(1)本发明赖氨酸氨肽酶的酶活力测定方法如下:
以l-亮氨酸-对硝基苯胺为底物,加入2mlph=9.0的tris-hcl缓冲液,取1ml稀释酶液和1ml底物(底物浓度为2mm),于80℃反应10min,然后在405nm处测定吸光值,计算酶活力。其中,赖氨酸氨肽酶的酶活是指:在一定条件下,其每分钟分解l-赖氨酸-对硝基苯胺产生1μm的对硝基苯胺所需要的酶量,即为一个酶活单位,计算公式如下:
其中abs为405nm处吸光值。
(2)本发明菌体湿重测定方法:精确吸取1ml菌液于已称重的2mlep管中,高速离心5min后弃去上清,所得重量减去空离心管重量为酵母湿重(单位为g·ml-1)。
(3)本发明所使用的培养基涉及以下几种:
md培养基(g/l.h):葡萄糖20,琼脂20,ynb13.4,生物素0.4;
mm培养基(g/l):甲醇5ml/l,琼脂20,ynb13.4,生物素0.4;
bmgy培养基(g/l):蛋白胨20,甘油10,酵母膏10,ynb13.4,生物素0.4,100mm磷酸盐缓冲液ph6.0;
bmmy培养基(g/l):蛋白胨20,甲醇10,酵母膏10,ynb13.4,生物素0.4,100mm磷酸盐缓冲液ph6.0;
bsm上罐培养基:4%甘油,1.49%mgso4·7h2o,0.413%koh,1.82%k2so4,2.67%85%磷酸,0.093%caso4,0.435%ptm1。
甘油补料培养基:50%甘油,1.2%ptm1。
ptm1微量盐溶液(100ml):0.008%nai,0.3%mnso4·h2o,0.6%cuso4·5h2o,0.02%na2moo4,0.002%硼酸,2%znso4·7h2o,0.05%cocl2,6.5%feso4·7h2o,5ml硫酸,0.02%生物素,微孔滤膜过滤,4℃保存。
本发明使用的菌株包括:大肠杆菌e.colijm109、毕赤酵母gs115、申请号为201510379603.1的中国专利所公开的方法构建重组毕赤酵母菌。
实施例1耐热赖氨酸氨肽酶的高密度发酵
采用重组毕赤酵母菌作为发酵菌株,具体发酵方法如下:
(1)挑取活化的重组毕赤酵母到25ml的bmgy摇瓶中(共培养18瓶),于30℃、230r·min-1的摇床中培养20h,所得发酵液即为上罐种子液。
(2)将装有4lbsm培养基的7l发酵罐灭菌处理,待仪器连接后,泵流加氨水至ph电极的显示值为5.0,控制初始转速为500r·min-1,通气量为2vvm,发酵温度为30℃。分批加入17.4ml过膜除菌的ptm1溶液和种子液,种子液按10%接种量接种至发酵罐中,校准溶氧电极。通过控制转速、通气量和罐压维持溶氧在20%以上。
(3)do值是反映酵母生长的重要参数,do值开始极速上升表明发酵液中的甘油已消耗完全,此时需要补加甘油来获得更多的菌体。此阶段流加含12ml·l-1ptm1的甘油补料培养基,其中甘油的质量分数为50%,甘油补料培养基流加速度为18.15ml·h-1·l-1,定期取样测各参数。
(4)当od600达到400后,立即停止甘油补料,然后饥饿培养2h。酵母只在无甘油的培养基中代谢甲醇,所以待溶氧急速上升时,需饥饿培养一段时间以耗尽甘油。
(5)当甘油耗尽后,加甲醇水溶液进行诱导培养。开始甲醇诱导时,调节温度为28℃,以泵流加方式加入含12ml·l-1的ptm1的甲醇溶液。设置初始2h内的甲醇流加速度为1ml·h-1·l-1,随后通过空气泵逐渐提高甲醇流加速度,3h内甲醇流加速度达到3ml·h-1·l-1,此后以该流加速度继续流加甲醇。甲醇诱导阶段每隔12h取样,测发酵液od600、菌体湿重、氨肽酶酶活以及蛋白含量,当酶活下降时(流加甲醇后84h)停止发酵培养。
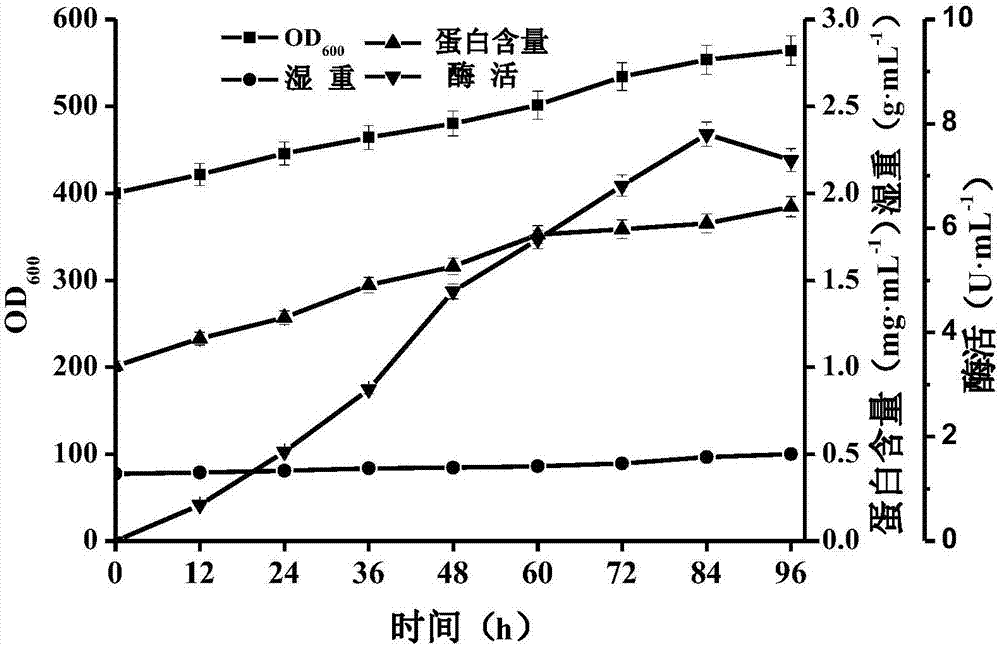
图1是甘油补料阶段重组毕赤酵母的生长曲线,如图1所示,在甘油补料过程中,发酵液od600、菌体湿重以及蛋白含量均保持上升。图2是赖氨酸氨肽酶的产量与甲醇诱导时间的关系曲线,图2表明,当初始诱导菌体量od600为400时,诱导84h后上清液氨肽酶酶活达到最高,其为7.8u·ml-1,是摇瓶产酶水平的2.14倍。
对上述获得的耐热赖氨酸氨肽酶进行纯化,选择40%-60%的硫酸铵进行盐析后过夜透析。然后收集透析液,使透析液经过hitrapqhp阴离子交换层析,用含有nacl的50mm的tris-hcl缓冲液((ph8.5)进行洗脱,首先使用含有质量分数为28%的nacl的缓冲液进行除杂,然后用含有质量分数为42%的nacl缓冲液洗脱目的蛋白;收集酶活最高的洗脱峰,然后利用30kda超滤管浓缩,过膜后使用superdextm7510/300gl凝胶过滤层析进一步分离纯化,得到纯化后的耐热赖氨酸氨肽酶。
实施例2耐热赖氨酸氨肽酶的纯化及性质研究
采用申请号为201510379603.1的中国专利所公开的方法构建重组毕赤酵母菌,将重组毕赤酵母菌单菌落在bmgy培养基中230rpm震荡18h,积累菌体后于25mlbmmy(ph=5.0)培养基中25℃培养120h,每隔24h向培养液中添加终浓度1.5%的甲醇进行甲醇诱导。将获得的发酵液在10000rpm条件下离心5min,上清即为耐热赖氨酸氨肽酶粗酶液。
将上述粗酶液以10%的梯度进行硫酸铵分级盐析,并检测每步残留酶活,最终选择40%-60%的硫酸铵进行盐析后过夜透析。然后收集透析液,使透析液经过hitrapqhp阴离子交换层析,用含有nacl的50mm的tris-hcl缓冲液((ph8.5)进行洗脱,首先使用含有质量分数为28%的nacl的缓冲液进行除杂,然后用含有质量分数为42%的nacl缓冲液洗脱目的蛋白;收集酶活最高的洗脱峰,然后利用30kda超滤管浓缩,过膜后使用superdextm7510/300gl凝胶过滤层析进一步分离纯化,得到纯化后的耐热赖氨酸氨肽酶。其比酶活达36.42u/mg,纯化倍数达3.95,纯化结果见图3。图3是不同纯化程度的酶的电泳图,其中,图中m代表marker(标记);图中1对应凝胶过滤层析后的电泳结果;图中2对应hitrapqhp阴离子交换层析后的电泳结果;图中3对应原始发酵液,图中4代表硫酸铵盐析后的电泳结果。从图中看出,采用组合分离手段,其纯化程度大大提高。
表1是耐热赖氨酸氨肽酶的纯化结果,表1表明,经过盐析、hitapqhp柱层析及superdex75柱层析纯化后,比酶活从粗酶液的9.21提高到36.41,纯化倍数达3.95倍。其中盐析及q柱除去了大量杂蛋白,而凝胶柱superdex75对赖氨酸氨肽酶起了精制作用。
表1耐热赖氨酸氨肽酶的纯化结果
将上述纯化后的赖氨酸氨肽酶与去糖基化酶endohf混合,37℃恒温加热4h。加热变性后,取样进行sds-page测试,结果如图4所示,从图4中可看到大的蛋白条带消失,只存在小的蛋白条带,说明该酶发生了部分糖基化。
将上述纯化后的赖氨酸氨肽酶置于不同温度下进行酶活测定,并将酶液在不同温度(30℃、60℃、70℃、80℃)下分别保温1h、2h和3h,检测残留酶活,将测得的最高酶活定义为100%,其他酶活占最高酶活的百分比为相对酶活,结果如图5-6,图5表明,在80℃下,赖氨酸氨肽酶的酶活最高,随着温度的升高,其酶活逐渐增大,温度高于80℃后,其酶活略有下降,说明其最适温度为80℃。从图6可看出,该氨肽酶在50℃-70℃保留2h时,残留酶活在80%以上,说明该重组氨肽酶在70℃以下依然具有良好的稳定性。与原始菌产酶相比,采用去糖基化酶水解和电泳分析验证该赖氨酸氨肽酶,可发生部分的糖基化,虽没有进一步提高其温度稳定性,但对其正确折叠及胞外分泌的高效表达有一定的帮助。
实施例3耐热赖氨酸氨肽酶的酶解应用
用50mmph=9.0的tris-hcl溶液配制10%的酪蛋白溶液,添加3000u·g-1(e/s)的碱性蛋白酶粉末,50℃反应3h,沸水浴15min,冷却。加入90u·g-1的耐热赖氨酸氨肽酶,80℃恒温震荡3h,沸水浴10min,12000r·min-1条件下离心取上清,然后测水解产物的多肽分布。将上清液与10%三氯乙酸1:1混合,静置1h,15000r·min-1离心后取上清,测氨基酸含量。结果见表2-3。
表2是水解产物的多肽分布测试结果,从表中可看出,双酶水解液(即同时使用耐热赖氨酸氨肽酶和碱性蛋白酶)中180da以下的多肽含量明显增加,进一步比较双酶协同以及单独使用内切碱性蛋白酶的两组实验结果,可发现该酶的另外一个水解特点,即在有内切酶存在时,该酶会优先水解赖氨酸再水解亮氨酸,使用耐热赖氨酸氨肽酶和碱性蛋白酶的协同水解和使用内切酶单独水解的结果相比,前者的亮氨酸提高幅度为2.5倍,而赖氨酸含量则提高了8倍,这种协同水解的规律和特点给今后特定蛋白原料水解的选择提供了依据。
表2水解产物的多肽分布测试结果
表3是水解产物的氨基酸含量测试结果,结果表明水解液中总氨基酸含量大幅度提高且其中的赖氨酸和亮氨酸含量提高比例最大,符合该酶的水解特色。与不加酶的空白对照(未酶解)相比,使用氨肽酶、碱性蛋白酶、双酶水解液中的游离氨基酸总量均显著增加,分别为空白对照的10.5倍、22.5倍和65倍。
表3水解产物的氨基酸含量测试结果
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
序列表
<110>江南大学
<120>耐热赖氨酸氨肽酶的发酵方法
<160>2
<170>patentinversion3.3
<210>1
<211>1500
<212>dna
<213>赖氨酸氨肽酶基因序列
<400>1
atgggcaaacccaacccgtcgatctgcaaatcgccgttgctggtcagcaccccgcttggc60
ctgccgcgctgcctgcaagccagcaacgtggtcaagcgcctgcagaagctggaggacatc120
gccagtctcaacgacggcaaccgcgccgccgccacgccgggctaccaggcctccgtcgac180
tacgtgaagcagaccctgcagaaagccggctacaaggtcagcgtgcagcccttcccgttc240
accgcctactacccgaaaggcccgggtagcctgagcgccaccgtgccgcagccggtcacc300
tacgaatgggagaaggacttcacctacctgtcgcagaccgaggcaggcgacgtcaccgcc360
aaggtggtcccggtggacctgtccctcggcgccggcaacacctccaccagcggttgcgag420
gcggaagacttcgccaacttcccggccggctcgatcgcgctgatccagcgcggcacctgc480
aacttcgagcagaaggccgagaacgccgcggccgccggcgccgccggggtgatcatcttc540
aaccagggcaacaccgacgaccgcaagggcctggagaacgtcaccgtgggcgagtcctac600
gagggcggcatcccggtgatcttcgccacctacgacaacggcgtggcctggtcgcagacc660
ccggacctgcagttgcacctggtggtcgacgtggtacgcaagaagaccgagacctacaac720
gtggtcgccgagacccgtcgcggcaacccgaacaacgtggtgatggtcggcgcgcacctc780
gactcggtgttcgaaggccccggtatcaacgacaacggttcgggcagcgccgcccaactg840
gagatggccgtgctgctggccaaggcgctgccggtcaacaaggtgcgcttcgcctggtgg900
ggcgccgaggaagccggcctggtgggctcgacccactacgtgcagaacctcgccccggaa960
gagaagaagaagatcaaggcctacctgaacttcgacatgatcggctcgccgaacttcggc1020
aacttcatctatgacggcgacggttccgacttcggcctccagggtccgcccggctcggcc1080
gccatcgagcgcctgttcgaagcctacttccgcctgcgcggccagcaatcggaaggcacc1140
gagatcgacttccgctccgactacgccgagttcttcaacagcggcatcgccttcggcggc1200
ctgttcaccggcgccgagggcctgaagaccgaagagcaggcgcagaagtacggcggcacc1260
gccggcaaggcctacgacgagtgctaccacagcaagtgcgacggcatcgccaacatcaac1320
caggacgccctggagatccacagcgacgccatggccttcgtgaccagttggctgtcgctg1380
tcgaccaaggtggtcgacgacgagatcgccgccgccggccagaaagcacaatcgcggtcg1440
ctgcagatgcagaagagcgccagccagatcgaacgctggggtcacgacttcatcaagtaa1500
- 还没有人留言评论。精彩留言会获得点赞!