一种促进农作物生长的拮抗木霉菌及其应用的制作方法
本发明属于微生物领域,具体涉及一种促进农作物生长的拮抗木霉菌及其应用。
背景技术:
禾谷丝核菌,拉丁名rhizoctoniacerealis,属无孢霉目真菌类。可引起小麦、大麦、玉米、水稻的纹枯病,是我国小麦种植区普遍发生、危害严重的一种土传性真菌病害。
禾谷丝核菌侵染引起的小麦纹枯病是一种世界性病害。在我国近20个省(市)都有不同程度的发生和危害,以江苏、浙江、安徽、山东、河南、陕西、贵州、湖北及四川等省麦区发生普遍,危害严重,轻者产量损失5%-10%,重者减产20%-40%。甚至造成枯孕(白)穗而颗粒无收。近年来,由于小麦品种、栽培措施和肥水条件的改变,纹枯病危害逐渐加重,己成为影响小麦稳产高产的重要障碍。目前对小麦纹枯病的防治是在农业防治的基础上进行药剂防治,药剂防治主要用三唑类杀菌剂迸行“一喷一拌”。由于纹枯病发生在小麦茎基部,防治方法不当则效果不理想。而且长期连续地使用化学农药,易导致一系列严重后果:使病菌产生抗药性、农药残留造成环境污染以及威胁人类的健康等。生物防治则是利用生物及其代谢产物防治植物病虫害,可避免化学农药使用带来的一系列环境和能源方面的问题,促进农业的可持续发展。小麦纹枯病的生物防治研究目前还处于开始阶段,筛选有效控制小麦纹枯病的生防菌、研究生防菌的控病机理将为小麦纹枯病的生物和生态防治提供一定的理论基础,使其成为小麦纹枯病综合治理中的重要环节。
黄色镰孢菌(fusariumculmorum)、层出镰孢菌(fusariumproliferatum)、尖孢镰孢菌(fusariumoxysporum)不仅可以引起小麦的根腐病,还可以侵染玉米、水稻、多种蔬菜甚至牧草,引起根腐病。这种病害的生物防治也是当前农业生产的一大重要课题。
小麦根腐病是一种典型的土传性真菌病害,根据小麦不同受害时期、发病部位及症状的不同又被称为黑胚病、根腐叶枯病等,小麦根腐病菌能够危害小麦的各个部位,根部受害最为严重。
70年代以前,小麦根腐病国外研究主要是专指由单一病菌长蠕孢菌导致的病害,随着研究的不断深入,80年代后,逐渐认识到小麦根腐病不是由单一病原菌引起的病害,而是多种病原菌混合发生相互影响复合侵染的一类病害,并且近几年来许多国外学者将这一类病害作为复合根病加以研究。
国内研究,小麦根腐病也由单一病原向多病原发展,其中主要致病菌不下3种(赵宜谦等,1993)。研究表明,小麦根腐病一种病原菌是由麦根腐蠕孢菌(bipolarissorokiniana)引起的蠕孢根腐病(白金铠等,1982;张景春等,1988),另一种是由镰孢菌属(fusariumspp.)真菌引起的镰孢根腐病(李良等,1989;王树权等,1991;樊少华等,2007)。近年,小麦根腐病发生严重,小麦种子的带菌率比较高,一般病田发病率为1%~5%,较重病田发病率在10%左右。小麦根腐病对小麦产量的影响比较大,一般病田减产10%~30%,严重地块会减产30%~70%(李可凡等,2003)。
在我国,防治小麦根腐病比较常用的农药有三唑酮、三唑醇、克菌丹、福美砷、退菌特、赛力散等,一般采用药剂拌种的方法,采用药剂拌种与田间药剂喷施相结合的方法,能更有效的减轻小麦根腐病的为害程度。李可凡等(2003)小麦开花始期施用喷洒25%粉锈宁可湿性粉剂或50%的福合剂,每公顷用商品药量1500g,可控制叶部病害的发展,有较好的防病增产的效果。朱统泉等(2005)研究发现,使用立克秀、禾果利拌种对小麦纹枯病和根腐病的防治效果较好。但是使用农药,受限于农药的施用量、施药方式以及降解等因素,化学防治还容易致使病原菌产生抗药性。
小麦纹枯病是一种常见的危害性很强的土传病害,危害小麦生长,引起小麦根部乃至全株的病害,从而造成重大的经济损失。在病害防治中,化学农药拌种对土传病害有一定的效果,但是,化学农药的使用会造成环境污染、农药残留,同时化学农药的长期并且超标使用,严重危害甚至破坏农业生态系统,同时杀死了环境中的有益微生物,提高了植物病原菌的抗药性,最终导致防治效果下降甚至防治失败。发展生物防治是当前研究的一大趋势。
技术实现要素:
为解决现有技术上的不足,本发明目的是提供一种促进农作物生长的拮抗木霉菌,不仅可以促进农作物多的生长,而且可以防治小麦或其他农作物病害,减少化学农药的使用,保护生态环境。
本发明的技术方案如下:
一种促进农作物生长的拮抗木霉菌,其特征在于:包括保藏编号为cgmccno.9774的深绿木霉(trichoderma.atroviride)h18-1-1和/或cgmccno.9775的深绿木霉(trichoderma.atroviride)tf28。
所述深绿木霉h18-1-1和/或tf28在促进小麦等农作物生长中的应用。
所述深绿木霉h18-1-1和/或tf28在农业生物防治中的应用。
优选的,所述深绿木霉h18-1-1和/或tf28在防治禾谷丝核菌、黄色镰孢菌、层出镰孢菌和/或尖孢镰孢菌等引起病害中的应用。
优选的,所述深绿木霉h18-1-1和/或tf28在防治小麦纹枯病和/或小麦根腐病中的应用。
所述深绿木霉h18-1-1和/或tf28制备的木霉菌菌剂。
优选的,木霉菌菌剂,其活性成分为如下(a)、(b)、(c)、(d)和(e)中的至少一种:
(a)权利要求1所述木霉菌;
(b)权利要求1所述木霉菌的发酵上清液;
(c)权利要求1所述木霉菌的发酵培养物;
(d)权利要求1所述木霉菌的发酵上清液的提取物;
(e)权利要求1所述木霉菌的发酵培养物的提取物。
本发明的有益效果是:本发明是一种促进农作物生长,并且高效拮抗禾谷丝核菌、黄色镰孢菌、层出镰孢菌和/或尖孢镰孢菌等多种农业病原菌的木霉菌,在小麦、玉米、水稻等多种病害的生物防治上具有重要意义,本发明的应用可以减轻化学防治带来的生态环境污染、人畜危害等问题,降低农业生产投入,减轻环境压力,提高农作物的产量和品质。
生物样品保藏信息如下:
深绿木霉(trichoderma.atroviride)h18-1-1和tf28,于2014年10月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号中科院微生物研究所,保藏编号为cgmccno.9774和9775。
附图说明
图1是木霉菌株tf28对峙小麦纹枯病菌-207图。
图2是木霉菌株tf28对峙丝核菌wk-207图。
图3是木霉菌株tf28对峙黄色镰孢菌正面图。
图4是木霉菌株tf28对峙黄色镰孢菌反面图。
图5是木霉菌株tf28对峙尖孢镰孢菌图。
图6是木霉菌株h18-1-1对峙尖孢镰孢菌图。
图7是木霉菌株tf28对峙层出孢镰孢菌图。
图8是木霉菌株h18-1-1对峙层出镰孢菌图。
图9是木霉菌株t11-1-3对峙尖孢镰孢菌图。
图10是tf28木霉在不同ph培养基中生长图。
图11是h18-1-1木霉菌丝图。
图12是h18-1-1菌株在pda上培养性状图。
图13是拮抗木霉tf28和h18-1-15.8srdna-its区核苷酸序列分析树状聚类图。
图14是木霉处理对小麦超氧化物歧化酶活性的影响图。
图15是木霉处理对小麦过氧化物酶活性的影响图。
图16是木霉处理对小麦过氧化氢酶活性的影响图。
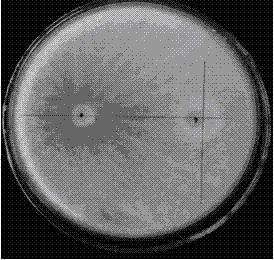
图17是是小麦根际木霉菌的定殖检测图。
具体实施方式
实施例1拮抗木霉菌来源和筛选
1.试验菌株来源
2012年从山东地区的济宁、德州、聊城、菏泽、泰安、淄博、滨州、潍坊等地区采集小麦田根部土壤,每个地区选取2-3个县进行土壤的采集,共计50余份,对土样采用稀释平板法分离得到70株木霉菌。
实验室保存的10株优良木霉菌株、t10菌株为友人所赠送。
2.木霉菌分离
2.1土壤样品的采集
小麦纹枯病和根腐病发病比较严重的地块,采样时,先除去土壤表层1~2cm的土层铲去,然后取土,每份土壤取三个点,取出的各点土壤充分混匀后置入无菌取样袋中,带回实验室放置4℃冰箱中保存,一个月内尽快分离木霉。
2.2木霉菌的分离采用稀释平板法
(1)称取10g土壤,加入到90ml无菌水的三角瓶中,160rpm/min,振荡30min,土壤悬浮液稀释10倍。(2)吸取土壤悬浮液1ml置入装有9ml无菌水的试管中,稀释倍数为102的悬浮液,一直稀释至103为止。(3)每100ml的pda培养基中加入链霉素使其达到50µg/ml,取100µl稀释后的土壤悬浮液加入其中,涂布器涂布均匀,同时将灭菌的麦秆置于培养皿中间,每份土样涂3皿。(4)25℃生化培养箱中培养5d后,体视镜下镜检,挑单孢到pda培养基上纯化菌种。
3.木霉菌的初次筛选
将分离得到的木霉菌和实验室保存的10株菌株,以小麦纹枯病菌wk-207为指示菌,采用平板对峙法,筛选生防效果较好的菌株,为后期的复筛工作提供依据。
表1木霉菌株对峙小麦纹枯病菌wk-207抑制率
表1可见,对小麦纹枯病菌wk-207抑制率最高的是从泰安肥城分离的tf28,抑制率为60.72%,其次是实验室保存的h18-1-1菌株。从表中选择抑制效果最好的7株木霉菌株进行下一步的复筛,这7株木霉菌对小麦纹枯病病菌的抑制率在46.86%到60.72%之间,编号分别为tf28、tw18、t28-1-3、t35-2-3、h18-1-1、t28-1-1、t11-1-3。
4.木霉菌的复筛
木霉菌的复筛,主要测量木霉菌的生长速度、抑制率、产孢量、耐温性、耐酸碱性、对多菌灵的耐性、挥发性代谢物对病原菌抑制率等9个性状,采用灰色关联度分析法综合评价,筛选综合性状最优菌株。
(1)生长速度的测定
木霉菌株的生长速度是在培养基上单独接种木霉菌株48h后菌株的生长直径距离表示,生长三天后的木霉,用0.5cm打孔器取培养皿边缘的菌丝片接种在无菌的pda平板上,设置3次重复,48h测定木霉菌落直径,求平均值。
(2)对病原菌的抑制率通过采用平板对峙培养法测定
1)将所要对峙的木霉菌与病原菌同时扩大培养,三天后,同时接种培养,用直径5mm的打孔器取新鲜培养的木霉菌和小麦纹枯病菌的菌丝块,即培养皿边缘的菌块生长基本一致。
2)将木霉菌与病原菌分别同时接入平板,两菌块距离4cm,重复3次。
3)分别以小麦纹枯病菌wk-207和木霉菌在平板中的纯培养作为对照,25℃恒温培养,观察病原菌菌落生长。
4)48h后,采用十字交叉法测量病原菌的菌落直径,计算木霉的抑菌率。筛选生长速度快、抑制率高的木霉菌。
抑菌率(%)=[(对照菌落直径-对峙菌落直径)/对照菌落直径]×100。
(3)产孢量
将培养7d的木霉菌株,用10ml无菌水清洗培养皿,使用移液抢缓慢抽吸打出,将皿中的孢子清洗下来,然后转移到10ml的离心管中,依次稀释,用血球计数板计数,取三次均值。
(4)耐温性测定
直径5mm的菌块木霉菌,移至pda平板中央,重复3次,5℃、25℃、10℃和35℃恒温培养生长72h后测量菌落半径。
(5)木霉菌耐酸碱性的测定
直径5mm的菌块木霉菌,移至ph为4、6、9、10的pda平板中央,重复3次,25℃下培养,生长48h后,测量木霉的菌落半径。
(6)木霉菌耐药性的测定
直径5mm的菌块木霉菌,移至含有0.1mg/l多菌灵的平板中央,重复3次,25℃培养,加入1ml无菌水为对照,48h测量木霉的菌落直径。
(7)挥发性代谢产物对病原菌的抑制作用
采用培养皿对扣培养法测定(dennis,1971)。在培养皿的皿盖和皿底分别倒入适量培养基。冷却凝固后,在皿盖中心接入直径5mm的木霉菌块,在皿底中心接入直径5mm的病原菌菌块,25℃培养箱倒置培养,对照仅接种病原菌。观察病原菌及木霉菌丝的生长状况,对扣培养5d后采用十字交叉法测量病原菌的菌落直径,计算抑制率。
抑制率(%)=(对照病原菌的菌落直径-处理病原菌的菌落直径)/对照病原菌的菌落直径×100。
5灰色关联度分析法
5.1构造理想菌株
根据灰色系统理论,把7株木霉看做一个灰色系统,把每个菌株做为该系统中的一个因素。木霉菌对病原菌的生防效果和实际生长情况确定各性状比较理想的值为参考数列x0,以参比木霉的各种性状指标构成比较数列xi,不同性状用k表示。
5.2数据无量纲化处理
根据上述方法,供试菌株主要生防性状的初始化变换值,将木霉菌的生长速度、抑制率、产孢量、ph的酸碱耐性、高低温耐性、对多菌灵的耐性、挥发性等9个指标按上限性状。
5.3计算参试菌株与参考菌株的灰色关联系数
首先计算性状差序列值和性状两极差,性状差序列值
最大性状极差
5.4确定各木霉菌株综合评估关联系数
即
5.5.拮抗木霉菌的复筛结果与分析
利用灰色关联度分析法,综合分析评价7株木霉菌株,测定结果如下:
5.5.17株木霉生长速度的测定结果
生长速度测定检结果见表2,木霉菌的生长速度非常快,各菌株差异明显,从表中可以观察到,生长速度最快的菌株为h18-1-1和tf28,生长直径为9cm。木霉生防机制中,快速生长的菌丝能够迅速地占领生态位点,争夺营养,从而抑制病原菌的生长,达到生物防治的目的。
5.5.27株木霉菌株对4种病原菌的拮抗效果
7株供试木霉菌株对小麦纹枯病菌起到不同程度的抑制效果。由表2可以看出,木霉菌株tf28、h18-1-1表现出较好的抑制作用,tf28对小麦纹枯病菌的抑制率最大,可达到60.72%,h18-1-1次之为58.26%;与黄色镰孢菌对峙中,tf28抑制率最高,为36.50%,其次t11-1-3和h18-1-1,抑制率相同,为33.96%;与尖孢镰孢菌对峙中,h18-1-1抑菌效果最好,达到40%,其次是tf28和和t11-1-3,抑制率分别为39.17%和38.75%;与层出镰孢菌对峙中,t11-1-3表现出较好的抑制效果,抑制率为38.21%,其次为h18-1-1和tf28两株菌株。
表2供试木霉菌株的生长速度测定和对4种病原菌的抑制率
在与小麦纹枯病菌对峙试验中,tf28生长速度最快(见图1,图2),能够迅速包围病原菌,24h后其菌落半径就超过了小麦纹枯病菌的直径,在与小麦纹枯病菌对峙的方向,wk-207受到木霉菌的影响,菌丝停止生长。72h后可以看到木霉菌的菌丝在病原菌的菌落上生长,木霉菌长满整个培养皿,并产生大量的浅绿色孢子。木霉对小麦纹枯病菌的抑制作用,一方面来自于其迅速生长的能力,占据空间,争夺营养;另一方面是木霉具有重寄生能力,能够在小麦纹枯病菌上面寄生,破坏菌丝体;最后可能木霉能够产生一些抗菌的物质的代谢产物,对小麦纹枯病菌有抑制作用。
在与黄色镰孢菌的对峙中,木霉菌和黄色镰孢菌菌丝接触后,能形成明显的抑制,接触部位菌落颜色变暗黄(见图3、图4)。可能是木霉菌株分泌抗生物质和重寄生作用,抑制镰孢菌菌丝,黄色镰孢菌在与木霉对峙的方向上,菌丝生长缓慢,可见木霉菌对病原菌的拮抗抑制作用明显。96h后,木霉越过黄色镰孢菌,在其菌丝上生长。
由图5可以看到,tf28木霉在接触到尖孢镰孢菌后,迅速包围其菌落,然后占据皿中大部分位置,被包围的尖孢镰孢菌菌落边缘出现消解的迹象,本已经隆起的气生菌丝开始塌陷,然后木霉菌丝迅速开始覆盖其表面。木霉菌株h18-1-1在对峙尖孢镰孢菌的过程中与tf28菌株相似(见图6),虽然在48h没有出现菌落塌陷的迹象,但是随着木霉菌丝的迅速扩张,已经逐步开始覆盖尖孢镰孢菌的边缘,同时发现在尖孢镰孢菌的顶端出现了类似黄色油滴状物质,可能是木霉菌消解其菌丝而产生的水滴。
木霉与层出镰孢菌对峙中,t11-1-3表现出旺盛的生长态势(见图9)。其能够迅速占领生长空间,在镰孢菌的周围产生深绿色的孢子,并在其菌落上面产生绿色孢子,菌丝覆盖在镰孢菌上,但是之后层出镰孢菌的气生菌丝没有显示出塌陷或者变色的迹象,但就对层出镰孢菌菌丝的消解能力相比菌株tf28和h18-1-1来说表现较差(见图7、图8),两株木霉均能够立即包围层出镰孢菌,并对其菌丝进行消解。
5.5.37株木霉菌耐性测定结果
表37株木霉菌株耐性测定结果
(1)7株木霉菌产孢量测定结果
7株木霉菌产孢量从表3可见,t35-2-3菌株的产孢量最大,达到8.675×107cfu/ml,其次是t28-1-3、h18-1-1、tf28,孢子量均能够达到1×107cfu/ml。
(2)7株木霉菌株对温度的适应性结果
由表3可知,10℃培养24h时,木霉菌株均有所生长。在48h后,木霉的生长速度出现了差异,t28-1-1、t11-1-3、tw18菌株长势良好。在35℃条件下,只有菌株t28-1-3、t35-2-3生长明显,其它菌株生长速度比较慢。72h后木霉的菌落明显老化,气生菌丝少,孢子排列紧密,整个菌株菌落开始发白,菌落底部变黄,并停止了生长。
(3)7株木霉菌对酸碱度的适应性结果
在ph为4培养基中,木霉菌株h18-1-1和tf28生长速度最快,48h后菌落的直径均达到9cm,说明这两株木霉的耐酸性比较好;在ph为10的pda培养皿中,tf28和h18-1-1的菌落直径分别为7.47cm和7.03cm,明显高于其他菌落,表明这两株菌株对酸性环境具有良好的耐性,同时对碱性环境具有良好的耐性(见图10)。
(4)7株木霉菌株对多菌灵的适应性结果
对多菌灵的耐性测定中,各个菌株均表现出较强的耐性,6株木霉菌株均长满培养皿,其中h18-1-1和tf28的生长速度最快,是72h后,木霉菌株基本长满培养皿,对多菌灵的有强的耐性。
(5)挥发性代谢物的抑菌作用
培养96h后,对小麦纹枯病菌wk-207的抑制率最好的菌株为h18-1-1,其挥发性物质对纹枯病菌wk-207的抑制率达到了83.44%,其次是tw18和tf28,抑制率分别为78.67%和76.67%。
5.5..4利用灰色关联度分析法综合评价7株木霉菌株
木霉菌株的生长速度、耐低温、耐高温性、耐酸、耐碱性、对多菌灵的耐性及挥发性物质对纹枯病菌的抑制率(见表3)。
表47株木霉菌株的生防性状测定结果
表5供试菌株主要生防性状初值化变换值
表6供试菌株与参考菌株的关联系数
表7供试菌株的灰色关联度及排序
表5和表6是灰色关联度分析的中间计算过程。其中,表5的数据经初值化转化而得到的,表6数据是根据关联系数公式计算而得到的关于供试菌株与参考菌株各测定性状的灰色关联度系数ξi(k)。
根据灰色关联度分析方法原则,关联度越大的菌株,其与参考菌株的接近程度就越大,综合评价也越高。由表7可以看出,木霉菌株h18-1-1的灰色关联度ri=0.7751最大,其次是tf28和t35-2-3,其灰色关联度分别为0.7727和0.7584。其中,木霉菌株h18-1-1和tf28的关联度与参考菌株的接近程度较大,是较理想的拮抗病原菌的木霉菌。因此,本实验选取灰色关联度最高两个的木霉菌株h18-1-1和tf28,进行下一步生防效果的测定。
实施例2木霉菌形态和分子鉴定
1木霉菌形态的培养鉴定
纯化木霉菌在培养产孢后,挑取孢子及产孢梗,在显微镜下观察孢子,查阅原始文献进行鉴定。
菌落在pda平板上生长快,菌丝层较厚,致密丛束状,初期为白色,平坦,后期因产生分生孢子而呈深绿色。菌落背面无色,有时呈浅黄色。菌丝透明,有隔,细胞壁光滑,分生孢子梗由菌丝直立生出,二至三级分枝,整体像树枝;分枝与分生孢子梗的夹角近似直角,末端为小梗。小梗瓶形,分生孢子球形或长椭圆形。
2木霉菌分子鉴定
所有供试菌株首先移植到pda平板上,在25℃生化培养箱内培养3d后,取3块直径为5mm的菌落块移植于铺有玻璃纸的培养基中,在25℃下培养4d,用液氮研磨后,采用ctab(cetyltriethylamoiumbromide)法提取dna。
2.1dna提取试剂
(1)液氮
(2)ctab提取缓冲液(2%ctab、1.4mnacl、20mmedta(ph8.0)、100mmtris.hcl(ph8.0)
(3)氯仿:异戊醇(24:1)
(4)异丙醇
(5)75%乙醇
(6)te缓冲液(2mtris.hcl、0.5medta、ddh2o)
(7)饱和酚:氯仿:异戊醇(25:24:1)
(8)无水乙醇
(9)4m的naac
(10)加样显色液(0.25%溴酚蓝、40%蔗糖水溶液)
(11)tbe电泳缓冲液5×浓贮液(54gtris碱、27.5g硼酸、20ml0.5medta)。
2.2dna提取步骤
(1)取0.2g左右的木霉菌丝置于液氮中迅速研磨成干粉状。
(2)把粉末转入1.5ml的离心管中,加700μlctab提取缓冲液上下轻轻颠倒数次使之混匀。
(3)65℃水浴保温40min,每20min轻轻颠倒混匀一次。
(4)冷却至室温,加入等体积(700μl)的氯仿:异戊醇(24:1)轻轻混匀10min。
(5)离心(10000rpm,10min),去沉淀,将上清液转入另一离心管中。
(6)加入等体积异丙醇(-20℃),轻轻颠倒混匀,室温放置10-20min。
(7)离心去上清(10000rpm,10min)
(8)加200μl70%乙醇洗涤2次,去盐控干。
(9)加入600μltebuffer,使沉淀溶解。
(10)用等体积饱和酚:氯仿:异戊醇(25:24:1),抽提1-3次,离心(条件同上)取上清,弃下液,将上清转入另一管。
(11)等体积氯仿:异戊醇(24:1),抽提1-3次,离心(条件同上)取上清弃下液,将上清液转入另一离心管。
(12)上清液加1/4体积4mnaac溶液后,再加2×体积无水乙醇,混匀,-20℃放置45min。
(13)离心(10000rpm,5min)沉淀dna,弃上清。
(14)沉淀用75%乙醇(-20℃洗涤2-3次,37℃保温箱中干燥后融于100μlte缓冲液中,4℃备用。
将提取的dna用1%的琼脂糖凝胶进行电泳,紫外灯下观测所提取dna的质量及数量,将提取成功的菌株的dna溶液保存于-20℃冰箱中保存。
2.3pcr扩增
采用真菌生物核糖体dna通用引物its1/its4分别扩增10个供试菌株5.8srdna-its区的序列。其序列如下
its1序列为:5’-tccgtaggtgaacctgcgg-3’
its4序列为:5’-tcctccgcttattgatatgc-3’
选用50μl反应体系,各组分的成分如下:
表8pcr扩增反应体系
扩增反应条件:
扩增结果用1%的琼脂糖凝胶电泳检测,tbe为电泳缓冲液,加样8μl。
2.4特异性扩增片段的回收
采用康宁生命科学(吴江)有限公司提供的axyprepdnagelextractionkit试剂盒进行扩增产物的回收纯化。具体操作按照试剂盒说明进行。
(1)在紫外灯下切下含有目的dna的琼脂糖凝胶,用纸巾吸尽凝胶表面液体-并切碎。计算凝胶重量(提前记录1.5ml离心管重量),该重量作为一个凝胶体积(如100mg=100ul体积)
(2)加入3个凝胶体积的bufferde-a,混合均匀后与75℃加热(低熔点琼脂糖凝胶于40℃加热),间断混合(每2-3min),直至凝胶块完全熔化(约6-8min)
(3)加入0.5个bufferde-a体积的bufferde-b,混合均匀。当分离的dna片段小于400bp时,需再加入1个凝胶体积的异丙醇。
(4)吸取步骤3中的混合液,转移到dna制备管(置于2ml离心管)中,12000×g离心一分钟。弃滤液。
(5)将制备管置回2ml离心管,加入500ulbufferw1,12000×g离心30s,弃滤液。
(6)将制备管置回2ml离心管,加入700ulbufferw2,12000×g离心30s,弃滤液。以同样的方法再用700ulbufferw2洗涤一次12000×g离心1min。
(7)将制备管置回2ml离心管中,12000×g离心1min。
(8)将制备管置于洁净的1.5ml离心管中,在制备膜中央加25-30uleluent或去离子水,室温静置1min。12000×g离心1min洗脱dna。
2.5回收产物检测
1%琼脂糖凝胶电泳,加样1µl进行回收产物的检测。
2.6特异扩增片段的克隆
克隆载体采用的peasy-t3载体,克隆感受态细胞为大肠杆菌dh5α,均由北京全式金生物技术有限公司提供。
2.7克隆反应体系的建立
在微型离心管中一次加入pcr回收产物3.7µl,peasy-t3克隆载体0.3µl,轻轻混合,室温反应10min,然后将离心管置于冰上反应5min。
2.8转化
(1)加连接产物于50µldh5α感受态细胞中,轻轻混匀,冰浴反应25min。
(2)42℃热激90s,立即置于冰上5min。
(3)加入800µllb液体培养基,200rpm,37℃孵育1h。
(4)8000rpm离心2min,去除部分上清,保留100-150µl,轻弹悬浮菌体,取全部菌液均匀涂布lb平板(含氨苄青霉素),培养过夜。
2.9单克隆检测
挑取平板上长出的单克隆于lb/amp+液体培养基中,200rpm,37℃过夜培养。以培养的菌液为模板,进行pcr检测。
2.10序列测定及分析
将含有目的片段的克隆送北京博尚生物技术有限公司进行测序。每一序列用dnaclub软件对正向(5’-3’)和反向(3’-5’)序列进行核对并生成5’-3’的完整序列。用bioedit软件进行多重序列比较,mega4.1软件构建供试菌株的系统发育树。
2.11木霉菌h18-1-1和tf28分子鉴定结果
以提取的木霉菌丝基因组dna为模板,利用its1和its4序列引物进行pcr扩增,扩增得到特异性条带,将pcr产物连接转化后,单克隆子菌液送测,并对测序结果进行blast比对,菌株tf28its片段长度608bp,h18-1-1的片段长度608bp。通过在genebank核酸序列数据库进行比对,利用mega并构建系统进化树,待测菌株与深绿木霉(登录号为hq229943)同源性达到100%。确定高效拮抗木霉菌株tf28和h18-1-1是深绿木霉(trichoderma.atroviride)(图13)。
实施例3拮抗木霉菌株的促生及防病效果测定
1.木霉固体发酵产物和纹枯病菌接种体制备
(1)木霉固体发酵物制备
小麦麸皮:秸秆粉:玉米粉为物料,将木霉孢子悬浮液加入到已灭菌的物料中,发酵一周后,产生大量的绿色孢子,孢子浓度达1×109cfu/g。
(2)木霉孢子悬浮液制备
将制备好的木霉固体发酵物,称取一定量,按照所需浓度要求,用水中稀释至所需浓度。
(3)纹枯病菌接种体制备
将小麦粒蒸煮30min后,分别装入三角瓶,每瓶200g,葡萄糖2g,121℃高压灭菌20min后,待其温度凉至后,接入小麦纹枯病菌wk-207,培养两周后备用。
2.高效拮抗木霉菌株的促生及防病效果测定
2.1温室盆栽测定筛选木霉菌株的生防效果
小麦处理设计如下:
处理1:ck只接种小麦;
处理2:ck+小麦纹枯病菌接种体;
处理3:小麦纹枯病菌接种体+施入tf28木霉孢子悬浮液;
处理4:小麦纹枯病菌接种体+施入h18-1-1木霉孢子悬浮液。
小麦播种的同时接种小麦纹枯病菌,21d后,按照设置的不同处理方案将木霉孢子悬浮液施加到小麦中,每盆加100ml木霉孢子悬浮液,孢子悬浮液浓度为2×107cfu/ml,覆盖1cm厚的基质与土的混合物。
温室盆栽测定tf28和h18-1-1的防病效果及小麦防御酶系的影响,主要测量小麦发病率和小麦叶片的超氧化物歧化酶、过氧化物酶、过氧化氢酶:
(1)采用氮蓝四唑(nbt)法测定小麦叶片超氧化物歧化酶(sod)活性;
(2)愈创木酚法检测小麦的过氧化物酶(pod);
(3)紫外吸收法检测小麦过氧化氢酶(cat)活性;
(4)小麦纹枯病菌的发病率测定每盆作为一个处理单元,每盆播种10株小麦,每处理重复3次。
2.1.1木霉菌对小麦超氧化物歧化酶活性的影响
表9木霉处理对小麦超氧化物歧化酶活性的影响
由图14可以看出,施入木霉菌处理后,小麦的超氧化物歧化酶活性上升趋势明显高于对照,三天后,达到顶峰,h18-1-1处理的小麦超氧化物岐化酶活性是对照的2倍。表明,木霉菌能使小麦的超氧化物歧化酶活性增高。
2.1.2木霉菌对小麦过氧化物酶活性的影响
表10木霉处理对小麦过氧化物酶活性的影响
由图15可以看出,施入h18-1-1和tf28菌株4天后,小麦过氧化物酶活性达到顶峰,高于对照处理。说明,h18-1-1和tf28均能够使小麦过氧化物酶活性提高(见图15)。
2.1.3木霉菌对小麦过氧化氢酶活性的影响
表11木霉处理对小麦过氧化氢酶活性的影响
由图16可见,施入木霉3天后,h18-1-1和tf28处理的小麦过氧化氢酶活性达到顶峰,明显高于空白对照,之后活性开始降低,酶活性变化趋于平缓。表明,h18-1-1和tf28均能够使小麦过氧化氢酶活性的提升。
2.1.4木霉菌对小麦纹枯病的防病情况
表12不同木霉处理对小麦纹枯病防病效果
由表12可知,h18-1-1处理的小麦,小麦纹枯病发病率低,防病效果达到63.63%,tf28的防治效果为54.45%,表明,h18-1-1和tf28两株木霉菌能有效降低小麦纹枯病菌的发病率,减轻纹枯病对小麦的危害。
2.2沙培麦苗法测定木霉菌株的促生效果
试验处理设计如下:
处理1:空白对照ck(只接种小麦);
处理2:小麦ck+200mlpd;
处理3:小麦苗用木霉tf28孢子悬浮液沾根+200mlpd培养基;
处理4:小麦苗用木霉h18-1-1孢子悬浮液沾根+200mlpd培养基。
将麦粒用水浸泡后,挑选饱满度一致并且露白的麦粒播种于水培纱网上,72h后将根长4cm的小麦在木霉孢子悬浮液中沾根,木霉孢子悬浮液的浓度1.0×107cfu/ml,然后将水培箱将水置换为灭菌的沙土,同时加入200mlpd培养基利于木霉孢子的萌发,5周后检测小麦生长指标。
每个处理随机选取培养箱中的20株小麦进行以下的促生指标的测试:
(1)小麦根系的活力测定,采用氯化三苯基四氮唑(ttc)方法。
(2)测量小麦根数、鲜重、株高等指标。
表13不同木霉处理对小麦生长性状的影响
由表13可见,h18-1-1和tf28处理小麦根系活力,明显高于对照,其中h18-1-1处理根系活力最高,达到了378.76ug/(g.h)。但是,各处理间小麦的株高、地上部和地下部鲜重没有显著差异。
2.3田间试验测定优良木霉菌株的生防效果
处理设计如下:
处理1:空白对照ck(鲁麦21,纹枯病易感品种);
处理2:小麦播种3周,施入tf28木霉孢子悬浮液;
处理3:小麦播种3周,施入t10木霉孢子悬浮液。
处理4:小麦播种3周,施入h18-1-1木霉孢子悬浮液;
试验设在山东农业大学植物保护试验站(常年人工接纹枯病菌,土壤中纹枯病菌有较多的积累),每个处理设置三个重复,每个小区的面积是2.5×2.5m2,每小区种植10行小麦,行长2.5米。配制木霉菌孢子悬浮液的浓度为2×108cfu/ml,每行小麦浇灌200ml悬浮液。
田间样品的采集与测定:
分别于小麦分蘖初期、拔节初期及灌浆后期取样测定小麦的生长性状指标、发病率、病情指数及千粒重、穗粒数等指标,评价不同木霉菌株的防病促生效果。
(1)分蘖期主要测定不同处理小麦的株高、根数、地上部鲜重、地下部鲜重等指标及不同木霉菌株在小麦根际的定殖情况。
(2)拔节初期主要测定不同处理小麦的株高、根数、地上部鲜重、地下部鲜重、地上部干重、地下部干重及小麦纹枯病的发病率。
(3)灌浆后期,测定不同处理小麦的千粒重、穗粒数及纹枯病的病情指数。
2.3.1分蘖初期不同木霉菌株对小麦性状的影响
(1)采用五点取样法对每个小区随机采集20株小麦,室内测定小麦的分蘖数、根数、株高、鲜重等指标。
表14不同木霉菌株对小麦苗期性状的影响
由表14中可知,h18-1-1菌株处理对小麦的分蘖数、根数、株高、鲜重等指标有明显的促生效果,在分蘖数、根数多于对照,株高也明显高于对照,整体生长性状优于对照处理。此外接种的菌株tf28和t10对小麦的生长性状有一定的促生效果。
(2)小麦根际木霉菌的定殖检测
施入木霉孢子悬浮液30天后,采集小麦根际土壤,稀释平板法分离木霉菌,如图16,tf28、t10及h18-1-1处理分离的木霉菌落,菌落数量多,重复间菌落一致性强;纯化后,经过形态学上的观察与对比,与所施入的h18-1-1、t10及tf28菌落形态一致;对照处理培养皿中木霉菌落稀少,重复间菌落形态不一。说明施入土壤中的木霉菌株在小麦根际能够定殖。
2.3.2拔节初期木霉对小麦的促生和防病效果
采用五点采样法,小区内随机采取20株小麦植株,带回实验室,测定小麦的分蘖数、根数、株高、鲜重、干重、发病率。
表15不同木霉处理对小麦生长性状的影响
由表15可以看出,h18-1-1处理在分蘖数、根数、株高、鲜重、干重等生长指标,均优于对照处理,促生效果显著。此外,tf28和t10与对照相比也有较明显的促生效果。
木霉处理对小麦纹枯病发病率的防治效果如下表。
表16不同木霉处理对小麦纹枯病的防效
由表16中可见,h18-1-1处理的小麦发病率最低,发病率为56.67%,其防病效果最高,达到27.66%,其次是t10处理,防病效果为25.53%,再次是tf28处理,防病效果为17.02%,对照处理的小麦患病最严重,发病率达到78.33%。说明木霉能够降低小麦纹枯病的发病率,减轻小麦纹枯病对小麦的危害。
2.3.3灌浆后期木霉对小麦的促生和防病效果
表17不同木霉处理对小麦纹枯病的防效
由表17可以看出,对照处理小麦的纹枯病病情指数为27.33,小麦患病严重。h18-1-1处理的小麦,其纹枯病的病情指数最低,病指为9.33,防病效果最好。其次是tf28和t10处理的小麦,其对纹枯病的防治效果也有较好的防治效果。说明木霉能够减轻小麦纹枯病的病情,从而促进小麦健康生长。
- 还没有人留言评论。精彩留言会获得点赞!