一种基于液滴微流控芯片的单细胞分离方法与流程
本发明属于微流控技术和细胞生物学领域,具体涉及一种基于液滴微流控芯片的单细胞分离方法。
背景技术
微流控芯片实验室是把化学和生物等领域中所涉及的样品制备、反应、分离、检测及细胞培养、分离、分裂等基本操作单元集成到一块几平方厘米(甚至更小)的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以取代常规化学和生物实验室的各种功能的一种技术平台。微流控芯片的基本特征和最大优势是多种单元技术在整体可控的微小平台上灵活组合、规模集成。高通量是规模集成的一种形式,只是被集成的操作单元或单元群是相同的。
近几年的生物学和医学研究发现,针对单个细胞的细胞生物学研究有着重要的意义。同一种细胞,不同细胞个体之间也可能有很大的差异,而变异最显著的细胞往往能够揭示重要生物学现象或者提示重大疾病的发生,揭示癌症发病机制,懂得细胞分化与组织发育原理,识别基因表达特性与细胞特征。因此,准确捕获差异显著的单细胞群体并进行精确鉴定是生物医学研究中急需的关键技术。
随着液滴微流控技术的迅速发展,为人们提供了一种操纵微米尺度流体的方法,其在单细胞分析中的应用引起了越来越多的关注。液滴可作为独立的单细胞微反应器,能够有效控制扩散,提高检测灵敏度,已被成功应用于多种单细胞分析中。此外,从大量的样本(例如血液)中准确捕获特定细胞并对其进行鉴定鉴定,也是传统技术(如流式细胞仪)难以实现的。
本发明利用聚合物芯片和液滴微流控技术实现单细胞的高通量分离,整个装置结构简单,无需任何复杂和昂贵的设备,可实现高通量,操作方便,可快速分离悬浮培养的单细胞、减少细胞损伤且便于进行后期的细胞实验。
技术实现要素:
本发明的目的是提供一种基于液滴微流控芯片的单细胞分离方法,以解决以往单细胞分离过程中存在的操作步骤繁琐复杂、容易造成细胞损伤、捕获效率低等局限,本发明制备过程稳定,操作简单,集成度高。
一种液滴微流控芯片,由两层组成,上层为液滴生成单元,下层为液滴捕获单元;
所述芯片液滴生成单元具体设置有下述结构:分散相入口、连续相入口、分散相进液通道、连续相进液通道、液滴生成十字通道、液体流出通道、出液口、储液池;所述芯片的分散相入口连接分散相进液通道;
所述芯片的连续相入口连接连续相进液通道;
所述芯片的两个进液通道交汇处呈“十”字交叉,形成液滴生成十字通道;
所述芯片的液体流出通道连接液滴生成十字通道和出液口;
所述芯片包含一个开放式储液池,储液池连接出液口,位于液滴捕获单元上方。
所述芯片的液滴捕获单元为圆柱形的凹陷小坑结构,共有5000~10000个;
所述液滴捕获单元的直径为100~300μm,高度为100~200μm,每个单元间距为50~100μm;
一种基于液滴微流控芯片的单细胞分离方法,具体步骤如下:
a.将单细胞悬液从分散相入口流入分散相进液通道;所述芯片分散相流速为0.5~10μl/min;
b.将油相液体从连续相入口流入连续相进液通道;连续相流速为0.5~20μl/min;
c.两相汇合形成包裹单细胞的液滴,随着储液池中大量液滴生成,液滴流经液滴捕获单元上方,静置2~5min,当液滴慢慢沉降入液滴捕获单元,将多余液滴吸出;
d.将捕获单细胞的液滴芯片置于37℃培养箱培养,随后加入dapi进行核染,检测单细胞捕获率。
所述芯片的分散相成分为单细胞悬液,单细胞悬液直径为10~20μm,单细胞悬液密度为103cells/ml~108cells/ml。
所述芯片的连续相的矿物油中含有0.01~0.1g/ml的span80;
所述芯片制备出的包裹单细胞的液滴为油包水乳化液滴,液滴直径为80~300μm;
所述芯片的液滴捕获单元尺寸仅应略大于液滴尺寸,确保每个液滴捕获单元只有一个液滴存在。
所述单细胞包裹于液滴中,随后进入液滴捕获单元内,液滴及液滴捕获单元的尺寸可满足细胞长期生长、增殖;
所述芯片的单细胞分离效率由单细胞悬液流速和单细胞悬液密度协同影响;
所述芯片可用作高通量单细胞捕获,可进行单细胞原位培养、给药、增殖、诱导分化、单细胞测序等研究。
本发明的优点在于:
1、操作简便、快捷;
2、细胞与试剂用量少,实验成本低廉;
3、高度集成化;
4、应用范围广泛;
附图说明
图1为芯片结构示意图整体结构图,
图2为微流控芯片上层结构图;
图3为微流控芯片下层结构图;
图4为十字通道处为局部放大图;
图5为微流控芯片的前视图;
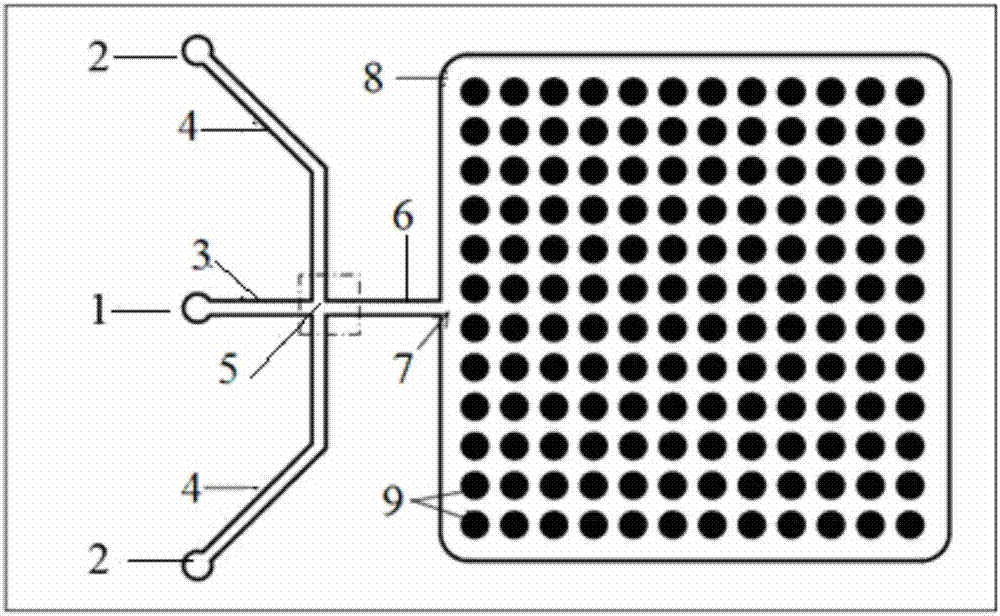
其中:1为分散相入口、2为连续相入口、3为分散相进液通道、4为连续相进液通道、5为液滴生成十字通道、6为液体流出通道、7为出液口、8为储液池、9为液滴捕获单元。
图6为微流控芯片实物图。
图7为微流控芯片捕获单细胞流程图,
图8为微流控芯片捕获的液滴图片,
图9为液滴微流控芯片捕获单细胞的局部荧光图片,
图10为单细胞捕获率的统计图。
具体实施方式
一种液滴微流控芯片,如图1~6所示,所述芯片由两层组成,上层为液滴生成单元,下层为液滴捕获单元;
所述液滴生成单元具体设置有下述结构:分散相入口1、连续相入口2、分散相进液通道3、连续相进液通道4、液滴生成十字通道5、液体流出通道6、出液口7、储液池8;
所述芯片的分散相入口1连接分散相进液通道3;
所述芯片的连续相入口2连接连续相进液通道4;
所述芯片的两个进液通道交汇处呈“十”字交叉,形成液滴生成十字通道5;
所述芯片的液体流出通道6连接液滴生成十字通道5和出液口7;
所述芯片包含一个开放式储液池8,储液池连接出液口7,位于液滴捕获单元9上方。
所述芯片由两层组成,上层为液滴生成单元,下层为液滴捕获单元;所述芯片包含下述结构:分散相入口1、连续相入口2、分散相进液通道3、连续相进液通道4、液滴生成十字通道5、液体流出通道6、出液口7、储液池8、液滴捕获单元9。
实施例1
一种用于单细胞分离的液滴微流控芯片的制备
芯片的上层结构su-8模板的制备:微流控芯片采用光刻和腐蚀方法制备出通道部分突起的su-8模板;首先,在硅片上甩一层su-8胶,厚度为100μm,95℃前烘20min,自然降温,将掩膜置于su-8胶平板上面,紫外曝光30s,95℃后烘20min,自然降温;采用乳酸乙酯将上述su-8胶显影10min,180℃坚膜2h,自然降温备用。
芯片的下层结构su-8模板的制备:首先,在硅片上甩一层su-8胶,厚度为150μm,95℃前烘30min,自然降温,将掩膜置于su-8胶平板上面,紫外曝光45s,95℃后烘30min,自然降温;采用乳酸乙酯将上述su-8胶显影10min,180℃坚膜2h,自然降温备用。
实施例2:
用于单细胞分离的pdms芯片的制备
将pdms与引发剂以体积比10:1混合均匀,浇注于前期制备的两个su-8模板,80℃烘箱固化30min,将pdms与su-8模板剥离,得到带有结构的上层芯片和下层芯片;将上层pdms芯片沿着储液池边缘切割成通透的正方形大坑,用打孔器在分散相入口和连续相入口打孔;将芯片上下层带结构一侧经等离子处理120s,键合封接备用。
实施例3
单细胞悬液密度为104cells/ml时,芯片自动捕获单细胞实验
上述制备的微流控芯片经75%乙醇浸泡,紫外照射1h灭菌处理后,随后,将人胶质瘤细胞(u87)单细胞悬液以104cells/ml的细胞密度从分散相入口1流经分散相进液通道3,流速为1μl/min;将含有3%(w/w)span80的矿物油从连续相入口2流经连续相进液通道4,流速为3.5μl/min,两相液体于十字通道5交叉处汇合,单细胞悬液被矿物油切成油包水液滴;单细胞截留于液滴中,液滴经过液体流出通道6,从出液口7流入到储液池8;随着大量包裹单细胞的液滴生成,液滴流经液滴捕获单元9上方,静置3min,由于重力作用,慢慢沉降入液滴捕获单元,待全部液滴都充满液滴捕获单元时,吸出多余的液滴,将芯片置于37℃培养箱培养,随后加入dapi进行核染,检测单细胞捕获率。
实施例4
单细胞悬液密度为105cells/ml时,芯片自动捕获单细胞实验
上述制备的微流控芯片经75%乙醇浸泡,紫外照射1h灭菌处理后,随后,将人胶质瘤细胞(u87)单细胞悬液以105cells/ml的细胞密度从分散相入口1流经分散相进液通道3,流速为0.5μl/min;将含有3%(w/w)span80的矿物油从连续相入口2流经连续相进液通道4,流速为2μl/min,两相液体于十字通道5交叉处汇合,单细胞悬液被矿物油切成油包水液滴;单细胞截留于液滴中,液滴经过液体流出通道6,从出液口7流入到储液池8;随着大量包裹单细胞的液滴生成,液滴流经液滴捕获单元9上方,静置3min,由于重力作用,慢慢沉降入液滴捕获单元,待全部液滴都充满液滴捕获单元时,吸出多余的液滴,将芯片置于37℃培养箱培养,随后加入dapi进行核染,检测单细胞捕获率。
图7为微流控芯片捕获单细胞流程图,图8为微流控芯片捕获的液滴图片。图9为微流控芯片捕获单细胞的局部荧光图片,图10为单细胞捕获率的统计图。根据所统计的2000个液滴捕获单细胞的荧光数据可知,所制备的液滴尺寸固定,直径为150μm;细胞密度为104cells/ml时,芯片的单细胞捕获效率为1.00%;细胞密度为105cells/ml时,芯片的单细胞捕获效率为9.10%;由此可知,当液滴生成尺寸不变时,单细胞悬液密度在一定范围内时,细胞密度越大,捕获单细胞的效率越高。此单细胞捕获芯片可实现高效率单细胞捕获,同时,可实现单细胞在芯片内原位长期培养以及后期的分析评价。
- 还没有人留言评论。精彩留言会获得点赞!