一种可拮抗DDX3蛋白RNA结合活性的多肽DIP‑13及其应用的制作方法
本发明涉及肿瘤靶向治疗领域,更特别地,涉及一种可拮抗ddx3蛋白rna结合活性的多肽及其应用。
背景技术:
肿瘤是严重威胁人类生命健康的疾病,随着工业化的进程,肿瘤的发病率逐年攀升。根据国际癌症研究中心(iarc)报告:未来几十年内,癌症发病人数仍将快速增长,预计2030年全球将有2136万癌症新发病例,死亡病例将达1315万,肿瘤治疗的需求将持续快速增长。传统手术、化疗、放疗是治疗肿瘤的主要手段,然而这些方法在治疗的同时,往往会带来很多副作用,给肿瘤患者及其家庭带来了极大的痛苦。因此,疗效显著、副作用少、特异性高的肿瘤靶向性治疗成为了目前研究的热点。
肿瘤靶向治疗是指针对已明确的致癌位点(蛋白或dna),设计相应的靶向治疗药物,因其特异性高、副作用少,可显著降低肿瘤病人痛苦,在肿瘤治疗方面具有非常重要的应用前景。分子靶向治疗又被称为“生物导弹”,药物通过特异性地识别致癌位点来发挥作用,使肿瘤细胞特异性死亡,而对正常组织细胞几乎没有损伤。要满足这种要求,靶向药物成分的选择成为了关键,而多肽具有血浆清除速度快、亲和力高、组织细胞穿透性强、易于摄取、免疫原性低等特点,非常适合靶向药物的开发。
ddx3蛋白由ddx3基因编码,属于dead-box蛋白家族,在进化过程中高度保守,是一种atp依赖的rna解旋酶,几乎参与了rna在细胞内的所有生物代谢过程,包括前体mrna的剪切和拼接、mrna的转运、核糖体的组装以及mrna的翻译等过程。近年来,大量研究表明:dead-box蛋白家族在肿瘤的发生、发展过程中发挥着非常重要的作用,而ddx3作为dead-box蛋白家族中至关重要的成员,逐渐成为了研究热点。临床研究发现,ddx3在包括胃癌、肝癌、乳腺癌、结肠癌等多种肿瘤组织中异常高表达,大数据生存分析显示:高表达ddx3患者的预后普遍较低表达ddx3患者的预后差。鉴于ddx3在研发肿瘤靶向治疗药物的巨大潜能,美国约翰霍普金斯大学医学院的研究团队在2016年研发出针对ddx3的抑制剂rk-33,这种化合物可竞争性结合ddx3的atp结合功能区,并抑制其rna结合能力,在肿瘤细胞和小鼠模型中均展现显著的抑癌功能;然而这种化合物由于缺乏特异性,无法满足肿瘤靶向治疗的需求。
因此,需要构建一种既能靶向肿瘤细胞,又能高效入胞的新型多肽。
技术实现要素:
为解决以上问题,发明人制备了一种生物活性肽,并将该多肽与细胞穿膜肽通过共价键连接起来,达到既有靶向肿瘤细胞,又具有高效入胞的效果。
基于该研究,本发明提供了一种可拮抗ddx3蛋白rna结合活性的多肽,其氨基酸序列如seqidno:1所示。实验证明,该多肽可竞争性拮抗促癌基因ddx3与rna的结合,并在细胞及动物水平表现出明显的肿瘤抑制作用。
本发明还提供了上述可拮抗ddx3蛋白rna结合活性的多肽在制备抗肿瘤药物中的应用。
本发明还提供了一种抗肿瘤多肽,其包括肿瘤细胞杀伤结构域和穿膜结构域,所述肿瘤细胞杀伤结构域的氨基酸序列如seqidno:1所示。
优选地,所述穿膜结构域的氨基酸序列如seqidno:2所示。
优选地,所述穿膜结构域连接于所述肿瘤细胞杀伤结构域的n端。
本发明还提供了上述抗肿瘤多肽在制备抗肿瘤药物中的应用。
本发明的优点在于,抗肿瘤多肽的穿膜结构域本身没有细胞毒性,但连接ddx3的rna结合活性肽段后,在细胞水平和动物水平均可观察到明显的肿瘤抑制效应。本发明的抗肿瘤多肽,不仅可以单独作为抗肿瘤的生物治疗药物,还有望结合其他治疗方式来抑制肿瘤。
附图说明
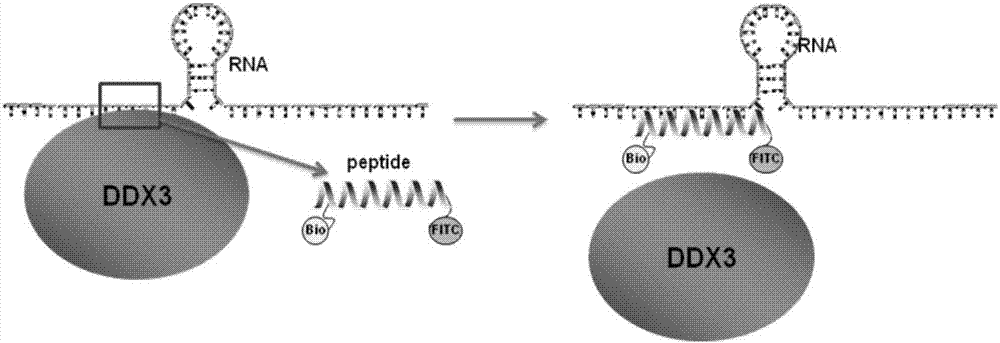
图1为dip-13竞争性拮抗ddx3蛋白与rna相互作用原理的示意图;
图2为对照肽和dip-13处理hela细胞48小时后的荧光显微镜照片;
图3为不同浓度的dip-13或对照肽处理hela细胞24小时后的mtt比色统计图;
图4为20μmol/l的dip-13或对照肽处理hela细胞24小时后的mtt比色统计图;
图5为平板克隆形成实验照片;
图6为根据图5计算的细胞克隆数的统计图;
图7为transwell细胞侵袭实验照片;
图8为根据图7计算的肿瘤细胞的迁移数目的统计图;
图9为小鼠体内实验中对照肽和dip-13对肿瘤重量影响的统计图;
图10为小鼠体内实验中对照肽和dip-13对肿瘤体积影响的统计图;
图11为对照肽和dip-13对ddx3与rna(hotair)结合水平的影响的统计图。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
1.抗肿瘤多肽的合成
通过固相合成法合成一种抗肿瘤多肽,其包括一个肿瘤细胞杀伤结构域和一个穿膜结构域,其中肿瘤细胞杀伤结构域序列如seqidno:1所示,穿膜结构域序列如seqidno:2所示,连接于肿瘤细胞杀伤结构域的n端,所得到的序列为:氨基酸序列为ygrkkrrqrrr-vlaptrelavqik(seqidno:3),命名为dip-13。为了研究方便,我们在抗肿瘤多肽的c端连接异硫氰酸荧光素标记fitc,n端连接生物素标记biotin。
dip-13竞争性拮抗ddx3蛋白与rna相互作用的原理如图1所示。
2.dip-13的细胞定位检测
取对数生长期的hela细胞,用无菌1×pbs重悬,经过计数后按每孔10000个细胞种植于内置无菌爬片的24孔板内,吹打均匀后置于37℃恒温培养箱、含10%胎牛血清的高糖dmem培养基中培养,培养过夜后加入20μmol/l的多肽,维持24小时和48小时。弃去上清,1×pbs洗两次后采用4%多聚甲醛固定,室温固定30分钟后弃甲醛,用1×pbs洗两次,然后采用dapi染核,3-5分钟后再次用1×pbs洗两次,然后纯甘油制片,整个操作过程均要求严格避光;制片结束后在激光共聚焦显微镜下观察带有fitc荧光基团的多肽在细胞内的定位。实验结果如图2所示,dip-13能够有效被细胞摄取,48小时后多肽积聚于肿瘤细胞的细胞核,呈现强胞核染色。
3.mtt比色法分析检测dip-13对肿瘤细胞生长的抑制作用
采用人宫颈癌细胞hela细胞,进行mtt细胞活力比色实验。取对数生长期的hela细胞,用无菌1×pbs重悬,经过计数后按每孔5000个细胞种植于96孔板内,每个样品设定10个复孔,吹打均匀后置于37℃恒温培养箱、含10%胎牛血清的高糖dmem培养基中培养,培养过夜后分别加入不同浓度的多肽,该浓度梯度为0、5μmol/l、10μmol/l、15μmol/l、20μmol/l及25μmol/l,维持24小时后收细胞;然后多肽以20μmol/l加入到培养基中,分别在0、24、48、72及96小时收获细胞。
到达标定时间后,弃去上清,每孔加入90μldmem培养基和10μlmtt溶液,置于37℃培养箱中反应4小时,反应结束后弃上清,用1×pbs洗两次,向样品孔中加入100μl二甲基亚砜(dmso)溶液,10分钟后用酶标仪检测490nm吸光度值。
结果如图3和4所示,与对照组多肽相比,dip-13多肽处理的实验组肿瘤细胞的活力显著降低,并且该作用呈时间和剂量依赖性,说明该新型多肽可有效降低肿瘤细胞的细胞活力;当处理细胞时间相同时,多肽浓度为20-25μmol/l的细胞活力抑制率较高;当处理细胞浓度相同时,多肽处理时间为72小时的细胞活力抑制率较高。
4.平板克隆形成实验检测dip-13对肿瘤细胞增殖活性的抑制作用
取对数生长期的hela细胞,用无菌1×pbs重悬,经过计数后按每孔1000个细胞种植于6孔板内,吹打均匀后置于37℃恒温培养箱、含10%胎牛血清的高糖dmem培养基中培养,培养过夜后分别加入不同浓度的多肽,该浓度梯度为0μmol/l、10μmol/l及20μmol/l,培养10-14天待其形成细胞克隆集落后收集细胞。
实验结果如图5和6所示,与对照组多肽相比,dip-13多肽处理的实验组肿瘤细胞的克隆集落形成显著降低,并且该作用呈剂量依赖性,说明该新型多肽可有效抑制肿瘤细胞的增殖能力。
5.transwell实验检测dip-13对肿瘤细胞迁移活性的影响
采用hela细胞进行多肽transwell细胞侵袭实验。在24孔培养板中放置transwell小室,向底层加入含15%胎牛血清的dmem高糖完全培养基,并向培养基中加入不同浓度的多肽。取对数期生长的hela细胞,用无血清培养基重悬,经过计数后按每孔10000个细胞均匀种植于transwell小室内,吹打均匀后置于37℃恒温培养箱中培养,24小时后取出小室放入4%多聚甲醛中常温固定15分钟,1×pbs洗两次,置于0.5%结晶紫染色液染色,1小时后染色结束,再用棉签轻轻擦去小室上层中未穿过多孔膜的细胞,在倒置显微镜下观察计数,比较差异。
结果如图7和8所示,与对照组多肽相比,dip-13处理的实验组肿瘤细胞的迁移数目明显降低,说明该新型多肽可有效抑制肿瘤细胞的迁移能力。
6.裸鼠皮下成瘤治疗实验
采用人前列腺细胞pc-3细胞进行多肽裸鼠皮下成瘤治疗实验。收集大量对数期生长的pc-3细胞,用1×无菌pbs重悬细胞,细胞终浓度约为1000万/ml,采用blab/c裸鼠品系作为动物模型,选取4周龄、体重约15g的blab/c裸鼠,随机分为两组,每组5只,在其右上肢内侧皮下注射pc-3细胞悬液100μl,约3-5天后可在细胞注射处观察到小皮丘,直径约2mm。
一周后落实皮下瘤体直径约4mm,此时开始进行多肽干预治疗,两组裸鼠体重和瘤体大小在多肽干预之前无统计学差异,实验组多肽和对照组均以3mg/kg·体重在瘤体周围皮下注射,每周两次,一共4周,动态观察裸鼠皮下瘤体的体积大小。
结果如图9和10所示,与对照组多肽相比,dip-13处理的实验组裸鼠中瘤体的体积和重量都明显减小,说明该新型多肽在动物水平亦可有效抑制肿瘤细胞的成瘤能力,具有显著的肿瘤抑制功能。
7.dip-13抑制肿瘤的作用机制
rna免疫共沉淀(rip)实验检测dip-13对ddx3结合rna(本发明实施例以hotair为例)的影响:ddx3蛋白几乎参与了rna所有的代谢过程,现采用hotair(hoxtranscriptantisenseintergenicrna)进行rip验证,检测该新型多肽对ddx3结合rna能力的影响。
采用人宫颈癌细胞hela细胞进行rip实验。将对数期生长的hela细胞种植于100mm培养皿内,37℃恒温培养箱中培养,待其密度为70%时按照20μmol/l的浓度加入多肽,24小时后收集细胞,用ripbuffer裂解细胞,将细胞上清分装备用,取10%的细胞上清作为阳性对照组input,剩下的分别用ddx3抗体和igg抗体进行免疫共沉淀,最后收集样品用蛋白酶k处理后,利用酚-氯仿-异丙醇抽提的方法提取rna,经过逆转录之后进行普通pcr和实时定量pcr实验检测不同处理组之间ddx3对rna的富集水平差异。
结果如图11所示,与对照组多肽相比,dip-13多肽可明显降低ddx3与rna(hoxair)的结合水平,说明本发明实施例设计的多肽可显著拮抗ddx3结合rna的能力,进而降低ddx3在细胞内结合、影响rna的生物学活性的功能,发挥肿瘤抑制的功能。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>华中科技大学同济医学院附属协和医院
<120>一种可拮抗ddx3蛋白rna结合活性的多肽dip-13及其应用
<130>1
<160>3
<170>patentinversion3.5
<210>1
<211>13
<212>prt
<213>人工序列
<400>1
valleualaprothrarggluleualavalglnilelys
1510
<210>2
<211>11
<212>prt
<213>人工序列
<400>2
tyrglyarglyslysargargglnargargarg
1510
<210>3
<211>24
<212>prt
<213>人工序列
<400>3
tyrglyarglyslysargargglnargargargvalleualaprothr
151015
arggluleualavalglnilelys
20
- 还没有人留言评论。精彩留言会获得点赞!