核磁共振显像化合物、核磁共振显像剂及应用、以及核磁共振成像方法与流程
本发明涉及核磁共振显像化合物、核磁共振显像剂及应用、以及核磁共振成像方法。
背景技术:
雌激素能够调节正常组织和细胞生长、复制、发育、分化等多种生理过程,还参与多种肿瘤的发生和发展。雌激素主要通过雌激素受体(estrogenreceptor,er)α和β这两种er亚型作用于细胞。异常的雌激素信号转导可以促进多种肿瘤的发生和发展。雌激素和雌激素受体是影响乳腺癌、子宫内膜癌和垂体腺瘤等多种激素敏感性肿瘤生物学行为的重要因素,并且是多种肿瘤的重要药物靶点。垂体腺瘤占所有脑肿瘤的10-15%,是颅内第二大肿瘤。无功能腺瘤(nfpa)是最常见的亚型,缺乏明显的激素相关临床症候群,发现时多为大腺瘤或巨大腺瘤。临床表现多为肿瘤压迫症状,主要损害患者视力及内分泌功能,严重影响患者生活质量,给家庭及社会造成重大的疾病负担。目前的治疗主要以手术为主,相当一部分患者手术效果不佳,术后有残留及复发,是目前神经科难以突破的一个问题。前期利用表达谱芯片和蛋白质组学均证实雌激素受体相关通路为无功能垂体腺瘤中关键通路,并且利用组织芯片大样本实验证实,超过70%的垂体腺瘤患者雌激素受体高表达。因此,雌激素受体是无功能垂体腺瘤的潜在药物治疗的重要靶点。然而,由于脑部肿瘤位置的特殊性,无法做到像其他部位实体肿瘤通过活检检测受体表达从而指导靶向药物治疗,因此如何实时无创进行分子水平的显像诊断,事先了解脑内病灶中雌激素受体的表达水平,是垂体腺瘤药物治疗需要解决的关键临床问题。然而,在现有技术中,尚不能够准确实时无创检测脑内雌激素受体的分布密度。
cn106366075a公开了一种苯甲酰胺甲基吡咯烷类核磁共振显像化合物,并报道了该类化合物能够特异性的与多巴胺d2受体结合,靶向识别多巴胺d2受体,多巴胺d2受体在prl型垂体腺瘤中存在高表达,可应用于对垂体腺瘤磁共振检测或核磁共振检测中。但是,该类苯甲酰胺甲基吡咯烷类核磁共振显像化合物无法穿透细胞膜而进入细胞核内部进行显像。
技术实现要素:
本发明提供一种新型的订书肽类核磁共振显像化合物,其能够穿透细胞膜,进入细胞核,与定位于细胞核内的雌激素受体进行结合,特异性靶向选择性的进行细胞内显像。
本发明一方面提供一种式(i)所示的化合物、或其药学上可接受的盐:
其中,
r1选自:亚烷基;
r2选自:氢、氨基和下式(ii)所示的基团、下式(iii)所示的基团、下式(iv)所示的基团;
其中,x1选自:亚烷基;
r3选自:氨基、烷酰氨基、羧基、酰甲胺、酰乙胺;
xaa选自:甘氨酸残基、丙氨酸残基、β-氨基丙酸残基、γ-氨基丁酸残基、6-氨基己酸残基、或缺失;
ln选自:gd或eu;
glu为谷氨酸残基,lys为赖氨酸残基,his为组氨酸残基,iie为异亮氨酸残基,leu为亮氨酸残基,arg为精氨酸残基,asp为天冬氨酸残基,ser为丝氨酸残基,s5为(s)-α-戊烯基丙氨酸残基;
所述“亚烷基”为优选为c1-c10直链或支链亚烷基,优选地,为c1-c8直链或支链亚烷基,优选地,选自亚乙基、亚丙基、亚丁基、亚戊基、亚己基;优选地,选自亚甲基、亚乙基、亚正丙基、亚异丙基、亚正丁基、亚异丁基、亚叔丁基、亚仲丁基、亚正戊基,亚异戊基、亚新戊基、亚正戊基、亚正己基;优选地,选自亚乙基、亚正丙基、亚正丁基、亚正戊基、亚正己基。
可选地,所述式(i)所示的化合物为下式(ia)所示的化合物:
可选地,所述式(ii)所示的基团为下式(iia)所示的基团
可选地,所述式(i)所示化合物具有式(ia)所示结构,
可选地,
r1选自:亚乙基、亚丙基、亚丁基、亚戊基、亚己基;
r2选自:氢、氨基、下式(iia)所示的基团,下式(iii)所示的基团、下式(iv)所示的基团
其中,x1选自:亚乙基、亚丙基、亚丁基、亚戊基、亚己基;
r3选自:氨基、羧基;
xaa选自:甘氨酸残基、丙氨酸残基、β-氨基丙酸残基、γ-氨基丁酸残基、6-氨基己酸残基、或缺失;ln选自gd或eu。
优选地,上述式(i)化合物、或其药学上可接受的盐,选自下述化合物1-化合物7::
优选地,所述药学上可接受的盐包括式i化合物的阴离子盐和阳离子盐;
优选地,所述药学上可接受的盐包括式i化合物的碱金属的盐、碱土金属的盐、铵盐;优选地,所述碱金属包括钠、钾、锂、铯,所述碱土金属包括镁、钙、锶;
优选地,所述药学上可接受的盐包括式i化合物与有机碱形成的盐;优选地,所述有机碱包括三烷基胺、吡啶、喹啉、哌啶、咪唑、甲基吡啶、二甲氨基吡啶、二甲基苯胺、n-烷基吗啉、1,5-二氮杂双环[4.3.0]壬烯-5(dbn)、1,8-二氮杂双环[5.4.0]十一碳烯-7(dbu)、1,4-二氮杂双环[2.2.2]辛烷(dabco);优选地,所述三烷基胺包括三甲胺、三乙胺、n-乙基二异丙胺;优选地,所述n-烷基吗啉包括n-甲基吗啉;
优选地,所述药学上可接受的盐包括式i化合物与酸形成的盐;优选地,所述酸包括无机酸、有机酸;优选地,所述无机酸包括盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、碳酸;优选地,所述有机酸包括甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、柠檬酸、枸橼酸、酒石酸、碳酸、苦味酸、甲磺酸、乙磺酸、对甲苯磺酸、谷氨酸、双羟萘酸。
本发明另一方面,提供一种核磁共振显像剂,其包括上述的式(i)化合物或其药学上可接受的盐;
可选地,所述的核磁共振显像剂用于雌激素受体的检测;
可选地,所述的核磁共振显像剂用于雌激素受体表达相关疾病的诊断;可选地,所述疾病为垂体腺瘤。
本发明另一方面,提供一种式(i)化合物或其药学上可接受的盐,或上述的核磁共振显像剂用于核磁共振成像、检测方面的用途;
可选地,所述核磁共振检测包括雌激素受体成像、雌激素受体检测、或垂体腺瘤检测。
本发明另一方面,提供一种式(i)化合物或其药学上可接受的盐,或上述的核磁共振显像剂用于疾病诊断方面的用途;
本发明另一方面,提供式(i)化合物或其药学上可接受的盐,或上述的核磁共振显像剂在制备疾病诊断试剂中的用途;可选地,所述疾病为与雌激素受体表达相关疾病,可选地,所述疾病为垂体腺瘤。
本发明另一方面,提供一种核磁共振成像方法,其中采用上述的式(i)化合物或其药学上可接受的盐作为核磁共振显像剂。
本发明另一方面,提供一种雌激素受体的核磁共振检测方法,其中采用上述的式(i)化合物或其药学上可接受的盐作为核磁共振显像剂。
本发明所述式(i)化合物、或其药学上可接受的盐具有与雌激素受体结合,并依靠分子内的螯合基团形成的钆、铕螯合结构,特异性的在核磁共振成像中增强雌激素受体高表达组织在图像上的对比度,有利于诊断病变类型。
本发明中以中文或英文缩写氨基酸时,采用本领域通用的氨基酸名称及英文缩写形式,如无明确说明,单独的氨基酸名称及氨基酸英文缩写代表其为l型氨基酸,如苏氨酸或苏胺酰(thr)表示其为l-型苏氨酸或l-型苏氨酰;本发明在以三字符英文缩写氨基酸时,采用本领域通用的氨基酸名称及英文缩写形式,当其右侧为“-oh”时表示氨基酸为游离羧酸形式,当其左侧为“h-”时表示氨基酸为游离氨基形式,如“h-thr-oh”表示其为氨基和羧基皆为游离形式的l-型苏氨酸。
本发明在以三字符英文缩写由多个氨基酸形成的肽链时,采用本领域通用的氨基酸名称及英文缩写形式,当其右侧为“-oh”时表示多肽为游离羧酸形式,当其左侧为“h-”时表示多肽为游离氨基形式,如“h-gly-trp-oh”表示其为氨基和羧基皆为游离形式的甘氨酰-色氨酸二肽。
本发明通式结构或具体化合物中,除另有说明,各氨基酸左侧的-nh-或-nh2基团表示该氨基酸结构中的基团,例如“-nh-glu-”中的-nh-表示为谷氨酸中的氨基基团,氨基酸右侧的氨基表示与氨基酸结构中羧基部分以酰胺键连接的氨基,例如-ser-nh2中的-nh2为丝氨基酸酰胺中酰胺部分的氨基。
本发明所引述的所有文献,他们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍对涉及到的术语和短语进行说明和解释,并在与公知含义不一致时以本发明所表述的含义为准。以下为本发明对术语的定义,并适用于整个说明书,除非在具体情况中另作说明。
附图说明
图1为体外细胞毒性试验中不同浓度的化合物1-5与细胞存活率之间的量效关系图。
图2为不同浓度化合物1及gd-dtpa对比剂施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后的显像剂荧光数值。
图3为不同浓度化合物1施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后活体荧光成像图。
图4为不同浓度化合物1施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后t1加权成像图。
图5为多巴胺受体显像剂1h和实施例化合物1在细胞中的定位情况图。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于示例性地对本发明进行说明,并不用于限制本发明。
具体实施方式中采用以下仪器及试剂:
thermoexactiveplus(esi/obi-trap)液质联用仪;
德国sartorius-bsa型电子天平;
cemdiscoverysps微波多肽合成仪;
eyela旋转蒸发仪;
vacumbrand隔膜真空泵;
多肽化合物的纯化采用gilsongx-281制备色谱系统。
无水溶剂为市售分析纯试剂经puresolv.溶剂纯化系统除水制备,其它试剂均为市售分析纯。
半制备色谱通法条件:kromasil21.2×250mmc185μ反相半制备色谱柱(流动相a:0.1%tfa水溶液,b:0.1%tfa乙腈溶液,流速15ml/min,检测波长220nm);
相关缩写代表的含义如下:
s5表示(s)-α-戊烯基丙氨酸,相应的fmoc-s5-oh为(s)-n-芴甲氧羰基-α-戊烯基丙氨酸。
aca表示为6-氨基己酸,abu表示4-氨基丁酸,lys(n3)表示δ-叠氮基赖氨酸。
hctu为o-1-羟基-6-氯苯并三氮唑-四甲基脲六氟磷酸酯。
cl-hobt为-1-羟基苯并三氮唑。
tfa为三氟乙酸。
dmf为n,n-二甲基甲酰胺。
thf为四氢呋喃。
tesi为三乙基硅烷。
dcm为二氯甲烷。
dipea为n,n-二异丙基乙胺。
cy5-oh为下述结构
grubbsi代催化剂为:benzylidene-bis(tricyclohexylphosphino)-dichloro-ruthenium。
具体实施方式中所用的制备方法:
1.洗涤通法。以下固相树脂的“洗涤”指滤出反应液后以dmf×2次,dcm×2两次,dmf×2次交替洗涤树脂三次,每次洗涤2~3min。
2.缩合通法。以下对固相树脂的缩合的一般方法为:将3倍过量的保护氨基酸、3倍过量的缩合剂(除单独说明的以外均为hctu)、3倍过量的cl-hobt溶于适量dmf中得到0.25mmol/ml溶液,向该溶液中加入6倍过量的dipea,搅拌反应1分钟后将其加入到脱除n端保护的树脂中,室温摇摆混合反应2小时并按“洗涤通法”洗涤。
3.脱保护通法。以下对固相树脂脱除n-fmoc保护基的一般方法为:向树脂中加入适量20%哌啶/dmf溶液,室温摇摆混合反应10分钟后滤除溶液,再向树脂中加入20%哌啶/dmf溶液,再次摇摆混合反应10分钟后滤除溶液并按“洗涤通法”洗涤。
4.rcm环合通法。以下采用grubbsi代催化剂进行烯烃复分解反应环合的一般方法为:向干燥的树脂中间体中加入适量无水二氯乙烷,通过固相反应管的下口通入氮气或氩气除去溶解的氧气,向该混合液中加入相当于树脂中间体摩尔量20%的grubbsi代催化剂并通过调整溶剂的量使催化剂浓度为5mg/ml,通入氮气或氩气鼓泡混合反应2小时后滤除反应液并以二氯乙烷洗涤树脂2次后再次加入与第一次相同浓度及摩尔量的grubbsi代催化剂再次鼓泡反应2小时后以二氯乙烷洗涤2次,取少量树脂(约2mg)加入tfa:tesi:h2o=95:2.5:2.5(体积比)的裂解液1ml,搅拌反应1小时后过滤除去树脂后氮气吹干加入甲醇溶解进行液质分析,确定无原料(未环合的多肽)后将其余树脂并按“洗涤通法”洗涤。
5.肽缩合循环。以下肽链合成每增加一个氨基酸残基的合成步骤为一个肽缩合循环,其中包括缩合一个按照“缩合通法”缩合n-fmoc保护氨基酸后按照“脱保护通法”脱除n端fmoc保护基,除非特殊说明,以下只列举每个参与缩合的氨基酸的质量和摩尔量,不对具体的操作过程进行重复说明。
6.裂解通法。以下裂解树脂的一般方法为:将肽树脂中间体干燥后按树脂重(g):裂解液体积(ml)为1:10的比例加入tfa:tesi:h2o=95:2.5:2.5(体积比)的裂解液,搅拌反应3小时后滤出反应液并以适量tfa洗涤树脂2次,合并所有滤液后旋转蒸发浓缩得油状物,向该油状物中加入50-100倍体积的冰冷无水乙醚使多肽固化沉淀,经离心(转速4000rpm)后将上清液倾出,下层固体再以无水乙醚研磨并离心,弃除上清液后将固体真空干燥后得粗肽产物。
各实施例化合物的合成
制备例1.n-叔丁氧羰基(o-苄基)丝氨酰二乙胺(1a)的制备
将11.814g(40mmol)n-叔丁氧羰基(o-苄基)丝氨酸boc-ser(bzl)-oh,5.06gn-羟基琥珀酰亚胺(hosu)和6.715g二环己基碳二亚胺(dcc)溶于100ml无水dcm中,冰水外浴下加入dipea搅拌反应30分钟后,恢复室温搅拌反应8小时,抽滤反应液将滤液依次以1mol/l盐酸,饱和nahco3水溶液、饱和nacl水溶液各洗涤3次,有机层以na2so4干燥后过滤,滤液浓缩后真空干燥箱45℃真空干燥,将所得产物溶于200ml无水dcm中,滴入18.4ml乙二胺溶液中,冰水外浴搅拌反应,滴完后撤去冰浴,室温反应4小时。加入水100ml后搅拌反应20分钟,转至分液漏斗,有机相保留,水相以dcm萃取3次后合并有机相,以na2so4干燥后过滤,滤液浓缩后以硅胶中压柱层析分离,流动相dcm:meoh(甲醇)=50:1(体积比),收集目标馏分后浓缩得棕色油状物10.048g收率74.5%。
产物分析:1hnmr(400mhz,cdcl3)δ7.32(m,5h),6.79(s,1h),6.24(s,1h),5.13(t,j=7.0hz,1h),4.91(d,j=12.4hz,1h),4.45(d,j=12.3hz,1h),4.19(dd,j=12.5,7.0hz,1h),3.78(td,j=12.2,3.1hz,1h),3.60(dd,j=12.4,6.9hz,1h),3.05(td,j=12.1,3.1hz,1h),2.91(m,2h),1.42(d,j=18.4hz,11h).;esi-ms:计算值338.20[m+h]+,实测值:338.20。
制备例2.(o-苄基)丝氨酰二乙胺盐酸盐(1b)的制备
将9.418g(27.9mmol)制备例1制备的化合物1a中加入10ml甲醇,加入3mol/l饱和hcl的乙酸乙酯溶液,冰水外浴搅拌反应3小时后浓缩反应液,真空干燥箱45℃干燥12小时,得淡黄色固体8.118g,收率93.7%。
产物分析:esi-ms:计算值238.15[m+h]+,实测值:238.15。
制备例3.(r)-2-氨基-3-((2-氨乙基)-氨基)-1-丙醇)(1c)的制备
将6.724g(21.67mmol)制备例2制备的化合物1b悬溶于50ml无水thf中,滴加9.89mmol/ml浓度的硼烷二甲硫醚溶液11ml,滴加完毕后65℃回流反应36小时,滴加6mol/lhcl水溶液11ml,加热回流30分钟后旋转蒸发至干,将上述产物以离子交换树脂dowax50wx2纯化得棕色油状物,将该油状物加入100ml6nhcl水溶液中封管90℃反应4小时后将反应液浓缩,真空干燥箱中干燥,得棕色油状物3.34g,收率63.4%。
产物分析:1hnmr(400mhz,d2o)δ3.86(ddd,j=12.3,7.0,5.1hz,1h),3.54(ddd,j=12.3,7.0,5.1hz,1h),2.98(m,2h),2.85(m,2h),2.72(m,2h),2.61(dd,j=12.3,7.0hz,1h).。
制备例4.n,n,n’,n’,n”,n”-五叔丁氧羰甲基-(r)-2-氨基-3-((2-氨乙基)-氨基)-1-丙醇(1d)的制备
将3.34g(13.77mmol)制备例3制备的化合物1c溶于40ml无水dmf中,加入dipea36ml,氮气保护下室温搅拌反应,滴加溴乙酸叔丁酯15ml,完毕后室温反应16小时,将反应液浓缩后加入饱和nacl水溶液,以乙酸乙酯萃取3次,有机层以蒸馏水,饱和nahco3水溶液,饱和nacl水溶液各洗涤3次,na2so4干燥,过滤后浓缩将残余物置于真空干燥箱中干燥,得棕色油状物6.555g,收率67.7%。
产物分析:esi-ms:计算值704.46[m+h]+,实测值:704.46。
制备例5.n,n,n’,n’,n”,n”-五叔丁氧羰甲基-(r)-2-氨基-3-((2-氨乙基)-氨基)-1-(o-炔丙基)丙醇(1e)的制备
将2.9g(4.1mmol)制备例4制备的化合物1d溶于10ml无水dmf中,氩气保护下加入60%nah0.656g,搅拌反应15分钟后,滴加溴丙炔0.962ml,完毕后室温反应16小时,加入100mldcm以饱和nacl水溶液洗涤3次,有机层以na2so4干燥后过滤,滤液浓缩得棕红色油,以中压硅胶制备色谱分离,流动相dcm:meoh=20:1(体积比),收集目标物馏分后浓缩,得棕色油状物0.89g,收率29.3%。,
产物分析:esi-ms:计算值742.49[m+h]+,实测值:742.49。
制备例6.n-芴甲氧羰基-α-(4-叠氮丁基)甘氨酸(fmoc-lys(n3)-oh)的制备
将2.34g(5mmol)fmoc-lys(boc)-oh溶于10ml80%三氟乙酸的二氯甲烷溶液中,冰水外浴搅拌反应1小时后,蒸干反应液,以无水乙醚研磨得白色固体,抽滤后红外灯下干燥,得白色固体2.278g。将该固体溶于15ml甲醇中,加入1.129g咪唑磺酰基叠氮盐酸盐,和12mg五水硫酸铜,1.175gnahco3,氩气保护下搅拌反应5小时后用2mol/l盐酸水溶液调ph至1~2,以乙酸乙酯萃取水层3次,有机层以1mol/l盐酸水溶液洗涤3次,饱和nacl水溶液洗涤3次,na2so4干燥后过滤,浓缩后至于冰箱中固化为白色固体1.41g,产率73%。
产物分析:esi-ms:计算值395.17[m+h]+,实测值:395.17。1h-nmr:(400mhz,chloroform-d)δ8.83(s,1h),7.81(d,j=7.6hz,2h),7.75–7.53(m,2h),7.45(t,j=7.5hz,2h),7.36(t,j=7.5hz,2h),5.38(d,j=8.3hz,1h),4.47(t,j=6.0hz,2h),4.27(t,j=6.9hz,1h),3.29(dt,j=29.3,6.5hz,2h),2.05–1.89(m,1h),1.88–1.22(m,6h).13cnmr(101mhz,cdcl3)δ176.89,156.12,143.80,143.65,141.35,127.79,127.11,125.06,120.06,77.38,77.26,77.06,76.75,67.17,53.53,51.08,47.16,31.86,28.37,22.47.
制备例7.n-芴甲氧羰基-α-(4-叠氮丙基)甘氨酸(fmoc-orn(n3)-oh)的制备
将2.272g(5mmol)fmoc-orn(boc)-oh溶于10ml80%三氟乙酸的二氯甲烷溶液中,冰水外浴搅拌反应1小时后,蒸干反应液,以无水乙醚研磨得白色固体,抽滤后红外灯下干燥,得白色固体2.144g。将该固体溶于15ml甲醇中,加入1.125g咪唑磺酰基叠氮盐酸盐,和12mg五水硫酸铜,1.175gnahco3,氩气保护下搅拌反应5小时后用2mol/l盐酸水溶液调ph至1~2,以乙酸乙酯萃取水层3次,有机层以1mol/l盐酸水溶液洗涤3次,饱和nacl水溶液洗涤3次,na2so4干燥后过滤,浓缩后至于冰箱中固化为白色固体1.481g,产率82%。
产物分析:esi-ms:计算值381.15[m+h]+,实测值:381.16。1h-nmr:(400mhz,chloroform-d)δ8.83(s,1h),7.86(d,j=7.6hz,2h),7.72–7.55(m,2h),7.45(t,j=7.5hz,2h),7.33(t,j=7.5hz,2h),5.24(d,j=8.3hz,1h),4.45(t,j=6.0hz,2h),4.35(t,j=6.9hz,1h),3.29(dt,j=29.3,6.5hz,2h),2.11–1.95(m,1h),1.92–1.32(m,4h).13cnmr(101mhz,cdcl3)δ174.89,156.15,143.56,143.46,141.18,140.38,127.07,126.38,125.48,121.08,66.72,54.34,51.98,47.08,29.55,25.36.
制备例8.订书肽树脂a的制备
取rinkamide树脂(取代度0.55mmol/g)0.91g,按脱保护通法脱除fmoc保护基。按照“肽缩合循环”的方法,依次顺序连接各1.5mmol的、fmoc-ser(tbu)-oh、fmoc-asp(otbu)-oh、fmoc-s5-oh、fmoc-leu-oh、fmoc-leu-oh、fmoc-arg(pbf)-oh、fmoc-s5-oh、fmoc-leu-oh、fmoc-ile-oh、fmoc-lys(boc)-oh、fmoc-his(trt)-oh、fmoc-lys(boc)-oh、fmoc-glu(otbu)-oh,之后按照“rcm环合通法”进行环合,之后按照“脱保护通法”脱除fmoc保护基,得到订书肽树脂a。
实施例1.化合物1的制备:
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-aca、fmoc-lys(n3)-oh,之后按照“脱保护通法”脱除fmoc保护基,然后按照“裂解通法”裂解树脂,得到粗肽产物0.625g。对粗肽使用半制备色谱通法hplc进行分离,得到纯化肽134mg。将纯化肽和由制备例5得到的化合物1e0.585g溶于叔丁醇和水(体积比2:1)的溶液,加入1.78mg硫酸铜和1.26mg抗坏血酸,搅拌反应12小时,以半制备色谱通法进行分离,流动相比例35%b,时间15分钟,收集目标峰所得产物,将所得产物冻干后溶于15mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液得棕色油状物,加无水乙醚研磨,得淡黄色粉末169mg,产率95%。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入18mggdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以制备hplc分离,然后冻干,得白色固体187mg,收率86.3%。
产物分析:esi-ms:计算值1241.61[m+2h]2+,实测值:1241.61,分子离子峰显示为钆同位素特征信号。
实施例2.化合物2的制备:
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法缩合6-叠氮基-1-己酸,然后按照“裂解通法”裂解树脂,得到粗肽产物0.325g。对粗肽使用半制备型hplc进行分离,得到纯化肽86mg。将纯化肽和由制备例5得到的化合物1e0.585g溶于叔丁醇和水(体积比2:1)的溶液,加入1.2mg硫酸铜和0.9mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于15mltfa(三氟乙酸)中,室温搅拌反应2小时,然后浓缩反应液,得棕色油状物,加无水乙醚研磨,得淡黄色粉末104mg,产率96%。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入18mggdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以制备hplc分离,然后冻干,得白色固体92mg,收率82.1%。
产物分析:esi-ms:计算值1177.56[m+2h]2+,实测值:1177.56,分子离子峰显示为钆同位素特征信号。
实施例3.化合物3的制备
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-aca、fmoc-lys(n3)-oh,6-叠氮基-1-己酸,然后按照“裂解通法”裂解树脂,得到粗肽产物0.325g。将纯化肽47mg和由制备例5得到的化合物1e0.264g溶于叔丁醇和水(体积比2:1)的溶液,加入8mg硫酸铜和1.8mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于15mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液,得棕色油状物,加无水乙醚研磨,得淡黄色粉末420mg,产率89%。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入83mggdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以制备hplc分离,然后冻干,得白色固体26mg,收率56.2%。
产物分析:esi-ms:计算值1078.78[m+3h]3+,实测值:1078.79分子离子峰显示为钆同位素特征信号。
实施例4.化合物4的制备
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-aca、fmoc-orn(n3)-oh,之后按照“脱保护通法”脱除fmoc保护基,然后按照“裂解通法”裂解树脂,得到粗肽产物0.384g。对粗肽使用半制备型hplc进行分离,得到纯化肽89mg。将纯化肽和由制备例5得到的化合物1e0.039g溶于叔丁醇和水(体积比2:1)的溶液,加入1.24mg硫酸铜和0.88mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于10mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液,得棕色油状物,加无水乙醚研磨,得淡黄色粉末113mg,产率92%。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入13.3mggdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以制备hplc分离,然后冻干,得白色固体88mg,收率78.5%。
产物分析:esi-ms:计算值1235.10[m+2h]2+,实测值:1235.11,分子离子峰显示为钆同位素特征信号。
实施例5.化合物5的制备:
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-abu-oh、fmoc-orn(n3)-oh,之后按照“脱保护通法”脱除fmoc保护基,然后按照“裂解通法”裂解树脂,得到粗肽产物0.296g。对粗肽使用半制备型hplc进行分离,得到纯化肽87mg。将纯化肽和由制备例5得到的化合物1e0.037g溶于叔丁醇和水(体积比2:1)的溶液,加入1.23mg硫酸铜和0.86mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于10mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液,得棕色油状物,加无水乙醚研磨,得淡黄色粉末99mg,产率91%。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入12.5mggdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以制备hplc分离,然后冻干,得白色固体80mg,收率76.5%。
产物分析:esi-ms:计算值1228.09[m+2h]2+,实测值:1228.10,分子离子峰显示为钆同位素特征信号。
实施例6.化合物6的制备:
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-abu-oh、fmoc-lys(n3)-oh、fmoc-abu-oh,之后按照“脱保护通法”脱除fmoc保护基,向树脂中加入250mg5-fam(0.5mmol)、90mghobt(0.6mmol)和1.2mmoldic,室温反应12小时,抽干树脂并以通法洗涤树脂,然后按照“裂解通法”裂解树脂,得到粗肽产物0.096g。对粗肽使用半制备型hplc进行分离,得到纯化肽28mg。将纯化肽和由制备例5得到的化合物1e10mg溶于叔丁醇和水(体积比2:1)的溶液,加入0.3mg硫酸铜和0.2mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于10mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液,得棕色油状物,以半制备hplc分离,得纯化产物39mg。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入2.63mg(10μmol)gdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以c18固相萃取分离,然后冻干,得黄色固体8mg。
产物分析:esi-ms:计算值1463.15828[m+2h]2+,实测值1463.16543[m+2h]2+,分子离子峰显示为钆同位素特征信号。
实施例7.化合物7的制备:
将由制备例8制备的订书肽树脂a按照“肽缩合循环”的方法依次缩合fmoc-abu-oh、fmoc-lys(n3)-oh、fmoc-abu-oh,之后按照“脱保护通法”脱除fmoc保护基,向树脂中加入80mg(0.135mmol)cy5-oh、24μldiepa(137μmol),室温反应4小时,抽干树脂,并以通法洗涤树脂,然后按照“裂解通法”裂解树脂,得到粗肽产物0.124g。对粗肽使用半制备型hplc进行分离,得到纯化肽34mg。将纯化肽和由制备例5得到的化合物1e12.75mg溶于叔丁醇和水(体积比2:1)的溶液,加入0.4mg硫酸铜和0.3mg抗坏血酸,搅拌反应12小时,以半制备型hplc进行分离,将所得产物冻干后溶于10mltfa(三氟乙酸)中,室温搅拌反应2小时后,浓缩反应液,得棕色油状物,以半制备hplc分离,得纯化产物9mg。向其中加入nahco3,调ph至6.5,冰水外浴搅拌下滴入2.63mg(10μmol)gdcl3的水溶液1ml,滴完后移去冰浴,ph=5.5,反应3小时后,以c18固相萃取分离,然后冻干,得蓝色固体9.6mg。
产物分析:hrms:计算值1015.85817[m+3h]3+,实测值1015.75880[m+3h]3+,分子离子峰显示为钆同位素特征信号。
实验例1.体外细胞毒性试验
1.1细胞及试剂:
大鼠垂体瘤细胞系gh3为美国atcc公司产品。dmem培养基和优质胎牛血清购自gibco公司,二甲基亚砜(dimethylsulphoxide,dmso),胰蛋白酶购自美国sigma公司,mtt购自美国genview公司,青霉素、链霉素购自华北制药公司,其他试剂均为市售分析纯。
1.2实验仪器及设备:
heracell150型co2细胞培养箱(贺力氏公司,德国),imt-2型倒置显微镜(奥林巴斯公司,日本),550型酶联免疫检测仪(bio-rad公司,美国);耗材为培养皿,96细胞孔培养板(costar公司,美国)。
1.3垂体腺瘤细胞gh3的常规培养与传代
取冻存的大鼠垂体瘤细胞系gh3细胞进行复苏,用含100ml/l胎牛血清和100u/ml青霉素、100u/ml链霉素的dmem培养基在37℃、5%co2及饱和湿度条件的恒温培养箱内培养,根据生长情况定期传代,采用第3次传代后的细胞进行实验。
1.4.实施例制得的化合物1-5对垂体腺瘤gh3细胞增殖的影响
5组实验组:用含10%胎牛血清的dmem培养基将化合物1-5均配制成5种不同的最终浓度:1μm/l、5μm/l、10μm/l、50μm/l、500μm/l;
1组空白对照组(空白组):仅加入含10%胎牛血清的dmem培养基;
将第3次传代的垂体腺瘤gh3细胞分为6组(5组实验组和1组对照组)。将传代细胞按每孔4000个/100ul分别接种于3个96孔细胞培养板中,按上述分组方案分为6组,每组设8个重复。24h细胞贴壁后换液,分别加入上述相应浓度的化合物1-5,置于37℃、5%co2及饱和湿度条件恒温培养箱内培养。在72小时后,分别在所需检测的培养孔内每孔加入20μl浓度为5mg/ml的mtt溶液(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名为噻唑蓝,溶剂为二甲基亚砜),37℃继续孵育4h,终止培养,吸取孔内培养上清液,每孔加入100μl二甲基亚砜(dmso),振荡10min。选择490nm波长,在酶联免疫检测仪上测定各孔吸光度值od490。
实验结果如图1所示,受试化合物在1-500μm/l浓度下对垂体腺瘤细胞增殖的无明显影响,此系列化合物具有低细胞毒作用。由此可知,本发明式(i)化合物作为造影剂用于垂体腺瘤细胞的核磁共振显像具有低毒性。
实验例2.核磁共振弛豫率检测
配制浓度相同的实施例化合物1-5及钆喷酸葡胺(gd-dtpa,二乙烯五胺乙酸钆,临床用核磁造影剂)对比剂,将实施例化合物1-5和gd-dtpa分别用pbs(磷酸缓冲溶液,浓度为0.01mol/l,ph为7.2)各配制成0、5μm、10μm、50μm、500μm和5mm的最终浓度,重悬于0.5ml微量离心管(其为eppendof管,以下也简称为eppendof管)中。将eppendof管放入bruker小动物核磁共振机(德国bruker公司)上进行磁共振扫描t1加权成像。
测量化合物1-5及gd-dtpa对比剂信号,分别选择每组样本量中大小一致的感兴趣区(roi,returnoninteresting)测量信号强度(t1弛豫时间),实验重复3次,取测量结果的平均值。将实施例化合物1-5及gd-dtpa对比剂的信号强度进行相关回归直线分析,其斜率即为化合物1-5及gd-dtpa对比剂的弛豫率(r)。实施例化合物1-5中任一种化合物与gd-dtpa对比剂的弛豫率的比值即信号差异。结果如表1所示,实施例化合物1-5中任一种化合物/gd-dtpa信号比值均大于1,该结果表明,实施例化合物1-5弛豫率显著优于gd-dtpa的弛豫率。显示实施例化合物1-5与对比剂相比,在相同浓度下核磁共振t1成像对比度增强的效果。即在常温下,实施例化合物1-5优于gd-dtpa对比剂的核磁显像效果。表明本发明式(i)化合物具有很好的造影能力,可以作为磁共振显像的造影剂。
需要说明的是,钆喷酸葡胺(gd-dtpa)是当前普遍应用的一种小分子核磁共振或磁共振造影剂,是一种无选择性非特异对比剂。
表1实施例化合物1h-5h及gd-dtpa对比剂弛豫率比值
实验例3.体外靶向性检测
将雌激素受体表达阴性的乳腺癌mda-mb-231细胞(来源于atcc公司)和雌激素受体表达阳性的乳腺癌mcf-7细胞(来源于atcc公司)分别用含100ml/l胎牛血清和100u/ml青霉素、100u/ml链霉素的dmem培养基在37℃、5%co2及饱和湿度条件的恒温培养箱内培养,根据生长情况定期传代,采用第3次传代后的细胞进行实验。
将mda-mb-231和mcf-7细胞分别以1*106个/ml细胞密度种于六孔板中,待细胞贴壁后将不同浓度的耦合荧光基团后的实施例化合物实施例化合物1及gd-dtpa对比剂(1μm、5μm、10μm、50μm、100μm和500μm,溶剂为浓度0.01mol/l,ph7.2的pbs)分别加入mda-mb-231和mcf-7细胞培养基中孵育2h,而后用上述的pbs冲洗3次,用0.25%胰蛋白酶完全消化细胞,1200rpm离心4min,重悬于0.5mleppendof管中。将eppendof管放入小动物活体荧光机器(德国pe公司)上进行活体荧光成像。将eppendof管放入bruker小动物核磁共振机(德国bruker公司)上进行磁共振扫描t1加权成像。
实验结果:
图2显示不同浓度化合物1及gd-dtpa对比剂施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后的显像剂荧光数值。如图2所示,gd-dtpa对比剂在雌激素受体表达情况存在差异的mda-mb-231和mcf-7细胞中核磁信号强度无明显差异,而实施例化合物1在含有雌激素受体的mcf-7细胞中呈现浓度梯度依赖的荧光信号强度升高,而在雌激素受体表达阴性的mda-mb-231细胞中无明显荧光信号强度。同时在雌激素受体表达阳性的mcf-7细胞中荧光信号强度显著高于在雌激素受体表达阴性的mda-mb-231细胞中荧光信号强度。
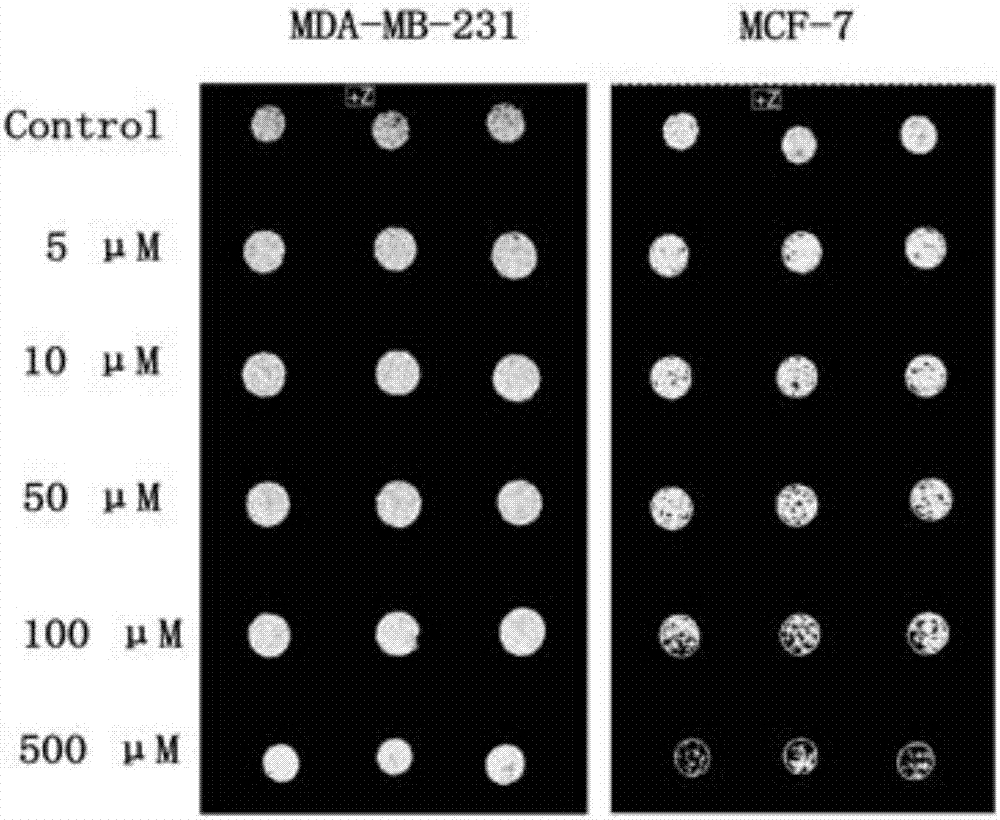
图3为不同浓度化合物1施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后活体荧光成像图。结果如图3所示,0-500μm浓度的实施例化合物1在雌激素受体表达阳性的mcf-7细胞中荧光信号强度显著高于在雌激素受体表达阴性的mda-mb-231细胞中荧光信号强度。mcf-7细胞从化合物1浓度为10μm开始有荧光信号出现,而mda-mb-231细胞一直没有荧光信号出现。并且,随着化合物1浓度的升高,mcf-7细胞中的荧光信号强度逐渐增强。
图4为不同浓度化合物1施用于具有不同雌激素受体表达量的mda-mb-231和mcf-7细胞后t1加权成像图。结果如图4所示,0-500μm浓度实施例化合物1在雌激素受体表达阳性的mcf-7细胞中核磁信号强度显著高于在雌激素受体表达阴性的mda-mb-231细胞中核磁信号强度。t1加权成像图中,红色点越密集代表核磁信号强度越强,从图中可以看出,随着化合物1浓度的升高,mcf-7细胞中的核磁信号强度逐渐增强。
以上结果表明,相较于gd-dtpa对比剂,在体外细胞水平上,实施例化合物1具有雌激素受体靶向性,可以靶向核磁显示雌激素受体水平。
实验例4.靶向特异性的携带显像分子进入细胞内
将雌激素受体表达阳性的乳腺癌mcf-7细胞(来源于atcc公司)和多巴胺受体表达阳性的pc12细胞分别用含100ml/l胎牛血清和100u/ml青霉素、100u/ml链霉素的dmem培养基在37℃、5%co2及饱和湿度条件的恒温培养箱内培养,根据生长情况定期传代,采用第3次传代后的细胞进行实验。
将mcf-7和pc12细胞分别进行细胞爬片,待细胞贴壁后将50μm的耦合荧光基团后的实施例化合物1及多巴胺受体靶向显像剂1h(cn106366075a中公开的显像剂)分别加入mcf-7和pc12细胞培养基中孵育2h,pbs漂洗3次之后,4%多聚甲醛固定10min。pbs漂洗5min,重复三次。3%tritonx-100室温孵育10min,pbs漂洗5min,重复三次。封片,荧光显微镜下观察。
实验结果:
图5为多巴胺受体显像剂1h和实施例化合物1在细胞中的定位情况图。
如图5a所示,红色荧光代表多巴胺d2受体,绿色荧光为fitc(是指异硫氰酸荧光素)耦合的多巴胺受体显像剂1h,蓝色荧光为dapi(是指4',6-二脒基-2-苯基吲哚荧光染料)定位的细胞核。图5a中的绿色荧光颗粒都集中于细胞膜外部。表明多巴胺受体显像剂1h难以进入细胞内部,多巴胺受体显像剂1h只能结合细胞膜表面多巴胺d2受体。
如图5b所示,红色荧光代表雌激素受体,绿色荧光为fitc耦合的实施例化合物1,蓝色荧光为dapi定位的细胞核。图5b中的绿色荧光颗粒在细胞膜表面和细胞核内部均有分布。表明实施例化合物1既能够结合细胞膜表面的雌激素受体,同时也能够进入细胞内,并穿透核膜,进入细胞核,与定位于细胞核内的雌激素受体进行结合(图5b中,绿色荧光与红色荧光重合,表明实施例化合物1与雌激素受体共定位)。
以上结果表明,相较于多巴胺受体显像剂1h,实施例化合物1可以使大分子显像基团进入细胞内部,结合细胞核内的雌激素受体,因此能对雌激素受体进行特异性靶向选择性的细胞内显像。
结合实施例3和实施例4的实验结果可知,本发明式(i)化合物及其药学上可接受的盐,可特异性的与雌激素受体结合,即本发明式(i)化合物及其药学上可接受的盐,可靶向识别雌激素受体。进一步说明,本发明式(i)类化合物及其药学上可接受的盐,可应用于雌激素受体靶向磁共振检测或核磁共振检测中。
虽然已参照某些实施方案描述了本发明的技术方案,但是本领域的技术人员将理解的是,在不脱离本发明范围的情况下,可进行多种变化。这些变化应当视为未超出本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!