一种通过转基因提高玉米抗旱性的方法与流程
本发明属于植物基因工程领域,具体涉及一种通过转基因调高玉米抗旱性的方法。
背景技术:
玉米是重要的粮食作物和饲料作物,也是全世界总产量最高的农作物。随着饲料与工业需求的增加,玉米需求呈强劲地增长态势,当前中国已从玉米净出口转变为玉米净进口。至2011年,玉米的播种面积已超过水稻,成为中国第一大农作物品种(王全忠等,2016)。玉米生长中需水量较大,在整个生长周期内,一般需要至少2500mm的降水量,而且生长期内的需水量变化很大,除苗期可适当干旱(蹲苗)外,从拔节到成熟都应保证良好的水分供应(王士谦,2005)。我国每年种植的玉米面积中,受到干旱影响的面积占了大约60%,造成减产20%-30%(高志勇等,2016)。因此通过玉米抗旱的遗传和生理基础研究,挖掘抗旱相关基因资源,培育高抗旱性玉米品系,对我国玉米生产具有重要意义。
染色质重塑是在维持基因组稳定性、染色质结构和表达调控中起关键作用。kim等通过染色质免疫共沉淀(chip)分析发现,干旱胁迫可诱导rd29a和rd29b基因启动子处核小体密度降低和h3k4me3与h3k9ac修饰的升高,而该区域包含一个关键的胁迫应答因子abre(aba-responsiveelement)的结合位点,促使胁迫应答转录因子如dreb、abre等迅速招募到基因启动子处,激活rd29a和rd29b基因表达;在盐胁迫时,dreb2a、rd29a和rd29b基因的组蛋白h3k9me2水平降低、h3k4me3水平升高,在从而调节了这些基因的表达,以适应胁迫环境(kimetal.,2008;kimetal.,2012)。相反的,在同样的条件下,这些相关位点的核小体定位(nucleosomeoccupancy)急剧下降(kimetal.,2010),说明染色质重塑和组蛋白修饰需要密切的协调,从而调控基因表达(tightlycoordinatedtoregulategeneexpression)。
技术实现要素:
为解决上述问题,本发明提供了一种通过转基因调高玉米抗旱性的方法。
为实现上述目的,本发明采取的技术方案为:
一种通过转基因提高玉米抗旱性的方法,其特征在于,通过将chb101基因的编码区转入到玉米基因组中,在玉米叶片中诱导表达chb101基因,即然后利用ubi启动子组成型表达chb101基因,从而促进叶片气孔在干旱条件下快速闭合,有利于玉米植株保持水分,从而提高玉米的抗旱性,同时还不会影响玉米在正常水分条件下的生长发育,提高玉米的抗旱性。具体包括如下步骤:
s1、总rna的提取:
s11、取4叶期玉米叶片剪碎液氮研磨成粉,转入1.5ml离心管内,加入1mltrizol,充分混匀,室温放置5-10分钟后,加入rnaisoplus的1/5体积量的氯仿,盖紧离心管盖,用手剧烈振荡15秒(氯仿沸点低、易挥发,振荡时应小心离心管盖突然弹开),待溶液充分乳化,无分相现象后,再室温静置5分钟;12,000g4℃离心15分钟;
s12、从离心机中小心取出离心管,此时匀浆液分为三层,即:无色的上清液、中间的白色蛋白层及带有颜色的下层有机相;吸取上清液转移至另一新的离心管中,切忌吸出白色中间层;
s13、向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,在15~30℃下静置10分钟后,12,000g4℃离心10分钟,小心弃去上清,缓慢地沿离心管壁加入75%的乙醇1ml(切勿触及沉淀),轻轻上下颠倒洗涤离心管管壁,12,000g4℃离心5分钟后小心弃去乙醇(为了更好地控制rna中的盐离子含量,应尽量除净乙醇);
s14、室温干燥沉淀2~5分钟,使酒精完全挥发后,用10-15μldepc-h2o溶解rna,视沉淀量而定;
s2、反转录试剂盒购自invitrogen公司,实验操作如下:
s21、用dnasei处理rna,10μl反应体系包含:
dnasei1μl;
dnaseibuffer1μl;
rna10μg;
depc-h2oupto10μl;
轻轻混匀后瞬时离心,室温放置15min后,加入1μl25mm的edta,65℃处理10min,使dnasei失活;
s22、在冰上于pcr管中加入以下试剂:
0.5μg/μl的oligodtnv1μl;
10mm/each的dntps1μl;
去除dna的rna5μg;
depc-h2oupto12μl;
轻轻混匀后,65℃处理5min后,迅速转移到冰上冷却2min;
s23、在上述体系中加入:
5×rtbuffer4μl
0.1mdtt2μl
rnaseinhibitor1μl
37℃预热2min,加入m-mlvrtase1μl,37℃温浴50min,70℃处理15min,使酶失活后,反应产物加入40μl1×te稀释,充分混匀,保存于-30℃备用;
s3、以反转录产物为模板,通过pcr方法扩增获得玉米chb101基因,得克隆的chb101基因;对克隆的chb101基因进行测序,通过与chromdb数据库提供的chb101基因cds序列进行比较,发现我们克隆的chb101基因cds序列缺少33bp(即缺少序列表seqidno:1的1739-1771位置)。本发明中所述克隆的chb101基因cds序列全长为2349bp(序列表seqidno:2),编码782个氨基酸组成的蛋白(序列表seqidno:3),编码的蛋白带有swirm和sant保守结构域,以及一个zinc-binding结构域(如图1所示);
s4、玉米染色质重塑蛋白基因chb101的过表达载体构建
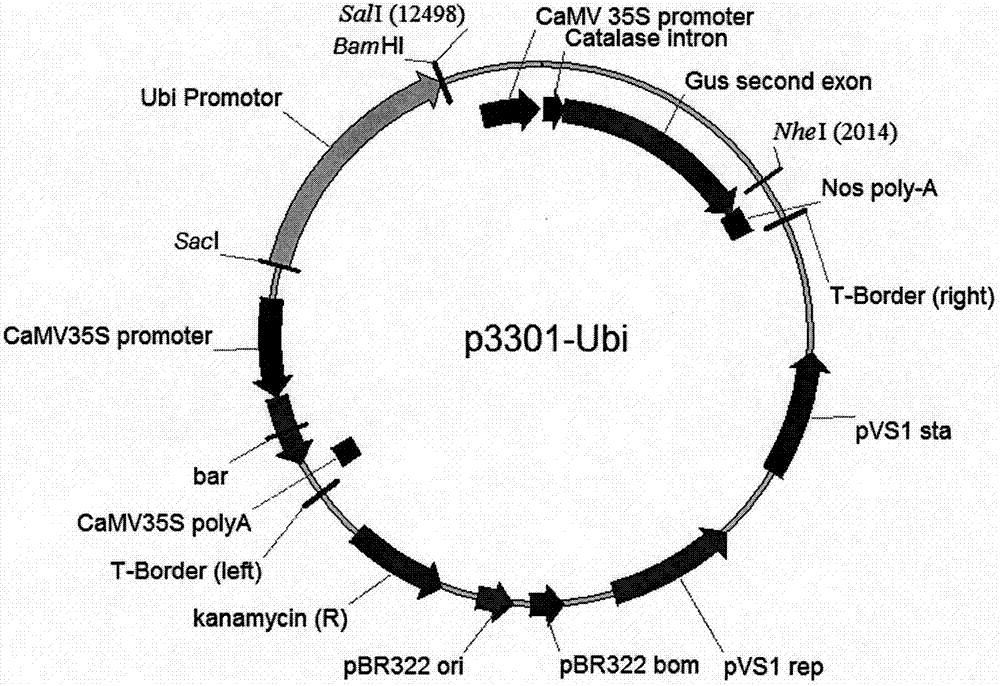
在通用双元载体pcambia3301基础上改造获得的遗传转化载体;首先将玉米泛素基因(ubiquitin)启动子(序列表seqidno:4)通过saci和bamhi酶切位点插入pcambia3301中,得到改造遗传转化载体p3301-ubi(如图2所示);对p3301-ubi载体用限制性内切酶sali和nhei进行酶切,去掉camv35s启动子和gus基因;将上述克隆所得的玉米chb101基因用sali和nhei消化并回收包含完成chb101阅读框的dna片段,在把该片段连入上一步的酶切后p3301-ubi载体,得到chb101基因的过表达载体p3301-ubi-chb101;
s5、利用pds-1000台式基因枪进行玉米(h99,以下也称为野生型玉米)幼胚转基因操作,具体步骤如下:
1)材料选取:根据授粉时间,取授粉后11天玉米h99种子的幼胚,此时玉米幼胚长约2mm;
2)冲洗玉米穗:加1滴tween20,在清水下浸泡、冲洗30min,然后用75%的乙醇泡30min,再用无菌水冲洗三遍;
3)预培养:将经过2)处理后的幼胚,胚轴向下,盾面向上,放在铺有滤纸(2x2cm)的含有愈伤组织诱导培养基n6e的培养皿中,30个幼胚/培养皿;缠好封口膜,置于培养箱,28℃,暗培养3天;得到预培养后幼胚;
4)高渗预培养:
将预培养后幼胚(即成形并膨大的幼胚,认为开始形成typeii愈伤组织)转入含有n6osm培养基的培养皿(直径3.5cm)中,28℃,暗培养,进行高渗处理8h,得到高渗预培养后幼胚;
5)载体处理
在高渗处理期间,灭菌holder和阻挡网,在金粉子弹中加入5μl已等摩尔比预混好的混合载体dna,混匀,准备好后放在冰上,得到包裹了质粒的金粉悬液;
6)将所得的高渗预培养后幼胚放入基因枪,在载体膜上滴加步骤5)得到的包裹了质粒的金粉悬液,基因枪真空度27~28psi,用650psi和1100psi可裂膜各轰击一次,可裂膜至靶点距离:6cm/9cm;得到轰击后幼胚;
7)将轰击后幼胚(在滤纸上)在n6som培养基上28℃再次高渗预培养20h,采用暗培养,得到轰击后高渗处理幼胚;
8)将轰击后高渗处理幼胚转移至无滤纸的n6e培养基上进行筛选培养,筛选培养条件为28℃暗培养14天,得到筛选培养幼胚;
10)将筛选培养幼胚转移至n6s培养基上传代培养,传代培养条件为28℃暗培养3周/次,共传代3次,得到愈伤组织(抗除草剂biolaphos);
11)将愈伤组织(选择易碎的typeii愈伤组织,直径4mm以内)转移到分化诱导培养基rmi上进行分化培养,分化培养的条件为25℃,暗培养3周,得到生长出幼叶的成熟的体细胞胚;
12)将生长出幼叶的成熟的体细胞胚转移至rmii培养基中生根培养,生根培养条件为25℃18h光6h光照培养15天,光照强度为4000lux,即可长出幼苗;
13)待幼苗长到3cm以上,根系完整时,将幼苗从rmii培养基移栽到盛有土的纸杯中,25℃,光培养,每天观察土表面,待彻底干燥后浇水;当纸杯中幼苗长到25cm高时即可移栽到大盆中,撕掉纸杯,将土和苗一移栽倒花盆或者实验田里,得到250株t0代转基因玉米;将空载体pb7rwg采用同样的方法转入野生型玉米中,得到转空载体玉米。
其中,
所述愈伤组织诱导培养基n6e的按照如下方法制备:向n6基本培养基中添加终浓度为2.76g/l脯氨酸、终浓度为100mg/l肌醇、终浓度为2mg/l2,4-d、终浓度为100mg/l水解酪蛋白、终浓度为25um硝酸银、终浓度为30g/l蔗糖和终浓度为2.5g/l植物凝胶,用水补足体积,调节培养基ph值为5.8。
所述n6基本培养基具体组分及各组分的终浓度如下:硫酸铵463mg/l,硼酸1.6mg/l,无水氯化钙125.33mg/l,二水乙二胺四乙酸二钠37.25mg/l,七水硫酸铁27.85mg/l,无水硫酸镁90.37mg/l,一水硫酸锰3.3mg/l,碘化钾0.8mg/l,硝酸钾2830mg/l,磷酸钾400mg/l,七水硫酸锌1.5mg/l,甘氨酸2mg/l,烟酸0.5mg/l,盐酸吡哆醇0.5mg/l。
所述n6osm培养基配方及终浓度具体如下:n6基本培养基、0.69g/l脯氨酸、100mg/l肌醇、2mg/l2,4-d、100mg/l水解酪蛋白、36.4g/l山梨醇、36.4g/l甘露醇、29mg/l(25um)硝酸银、30g/l蔗糖、终浓度为2.5g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
所述混合载体dna的浓度为1μg/μl,载体的加入量为5μg;0.5mg金粉包裹5μg。其中,金粉与混合载体的质量比为100∶1;等摩尔比预混好的混合载体dna为按照摩尔比1∶1∶1∶1∶1混合的5种载体ptrauxbar、pgt1-bt2、pisa-sh2、pb1hor-sh1和phmw-gbssiia;
所述n6s培养基配方具体如下:n6基本培养基、100mg/l肌醇、2mg/l2,4-d、2mg/lbialaphos+6mg/l(5um)硝酸银、30g/l蔗糖、2.5g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
所述分化诱导培养基rmi具体配方如下:ms基本培养基、6-ba1mg/l、100mg/l肌醇、3mg/l双丙胺膦(bialaphos)、60g/l蔗糖、终浓度为3g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
所述ms基本培养基具体配方为:硝酸钾1900mg/l,硝酸铵1650mg/l,磷酸二氢钾170mg/l,七水硫酸镁370mg/l,二水氯化钙440,碘化钾0.83mg/l,硼酸6.2mg/l,四水硫酸锰22.3mg/l,七水硫酸锌8.6mg/l,二水钼酸钠0.25mg/l,五水硫酸铜0.025mg/l,六水氯化钴0.025mg/l,乙二胺四乙酸二钠37.25mg/l,七水硫酸亚铁27.85mg/l,甘氨酸2mg/l,盐酸硫胺素0.1mg/l,盐酸吡哆醇0.5mg/l,烟酸0.5mg/l;用水补足体积。
所述rmii培养基配方为:ms基本培养基、100mg/l肌醇、60g/l蔗糖、终浓度为3g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
本发明具有以下有益效果:
通过将chb101基因的编码区转入到玉米基因组中,可以在玉米叶片中诱导表达chb101基因,从而促进叶片气孔在干旱条件下快速闭合,有利于玉米植株保持水分,从而提高玉米的抗旱性,同时还不会影响玉米在正常水分条件下的生长发育。
附图说明
图1为本发明实施例中chb101结构域。
图2为本发明实施例中p3301-ubi图谱。
图3为本发明实施例中chb101相对表达量。
图4为本发明实施例中干旱胁迫生存率。
图5为本发明实施例中叶片失水率。
具体实施方式
为了使本发明的目的及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
玉米染色质重塑蛋白基因chb101的克隆
本实验室前期研究发现:玉米chb101基因的表达在干旱环境下显著上升,因此,我们利用已公布的chb101基因序列(chromdb数据库,http://www.chromdb.org/)对现有玉米基因组公共数据库(https://www.maizegdb.org/;
http://ensembl.gramene.org/zea_mays/info/index?db=core)进行同源性搜索比对分析,未发现在这两个公共数据库中注释有chb101基因。在chb101基因开放阅读框(orf)核苷酸长度为2382bp(序列表seqidno:1),编码由793个氨基酸组成的swi3类染色质重塑蛋白。
根据chb101在chromdb数据库中的cds序列设计可以扩增全长orf的一对引物chb101-full-f(5’atgttcgaggccgtccga3’)和chb101-full-r(5’tcagctggtgggccgag3’)。为了用于chb101基因的过表达载体构建,在上述引物两端分别加入限制性内切酶酶切位点(sali和nhei)和保护性碱基,以获得载体构建用克隆引物chb101-clone-f和chb101-clone-r。
提取总rna所用的试剂trizol购自上海生工生物工程技术有限公司,具体操作如下:(1)取4叶期玉米叶片剪碎液氮研磨成粉,转入1.5ml离心管内,加入1mltrizol,充分混匀,室温放置5-10分钟。(2)向上述步骤1的匀浆裂解液中加入氯仿(rnaisoplus的1/5体积量),盖紧离心管盖,用手剧烈振荡15秒(氯仿沸点低、易挥发,振荡时应小心离心管盖突然弹开)。待溶液充分乳化(无分相现象)后,再室温静置5分钟。(3)12,000g4℃离心15分钟。(4)从离心机中小心取出离心管,此时匀浆液分为三层,即:无色的上清液、中间的白色蛋白层及带有颜色的下层有机相。吸取上清液转移至另一新的离心管中(切忌吸出白色中间层)。(5)向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,在15~30℃下静置10分钟。(6)12,000g4℃离心10分钟。一般在离心后,试管底部会出现沉淀。(7)小心弃去上清,缓慢地沿离心管壁加入75%的乙醇1ml(切勿触及沉淀),轻轻上下颠倒洗涤离心管管壁,12,000g4℃离心5分钟后小心弃去乙醇(为了更好地控制rna中的盐离子含量,应尽量除净乙醇)。(8)室温干燥沉淀2~5分钟,使酒精完全挥发。用10-15μldepc-h2o溶解rna,视沉淀量而定。
反转录试剂盒购自invitrogen公司,实验操作如下:
(1)用dnasei处理rna,10μl反应体系包含:
dnasei1μl
dnaseibuffer1μl
rna10μg
depc-h2oupto10μl
轻轻混匀后瞬时离心,室温放置15min.,之后加1μl25mmedta,65℃处理10min.,使dnasei失活。
(2)在冰上于pcr管中加入以下试剂:
oligodtnv(0.5μg/μl)1μl
dntps(10mm/each)1μl
去除dna的rna5μg
depc-h2oupto12μl
轻轻混匀后,65℃处理5min.,之后迅速转移到冰上冷却2min。
(3)在上述体系中加入:
5×rtbuffer4μl
0.1mdtt2μl
rnaseinhibitor1μl
37℃预热2min,加入m-mlvrtase1μl,37℃温浴50min.后,70℃处理15min.使酶失活。
(4)反应产物加入40μl1×te稀释,充分混匀,保存于-30℃备用。
以反转录产物为模板,通过pcr方法扩增获得玉米chb101基因,扩增条件:
对克隆的chb101基因进行测序。通过与chromdb数据库提供的chb101基因cds序列进行比较,发现我们克隆的chb101基因cds序列缺少33bp(即缺少序列表seqidno:1的1739-1771位置)。本发明中克隆的chb101基因cds序列全长为2349bp(序列表seqidno:2),编码782个氨基酸组成的蛋白(序列表seqidno:3),编码的蛋白带有swirm和sant保守结构域,以及一个zinc-binding结构域(如图1所示)。
实施例2
玉米染色质重塑蛋白基因chb101的过表达载体构建
本发明所用载体是在通用双元载体pcambia3301基础上改造获得的遗传转化载体。首先将玉米泛素基因(ubiquitin)启动子(序列表seqidno:4)通过saci和bamhi酶切位点插入pcambia3301中,得到改造遗传转化载体p3301-ubi(如图2所示)。对p3301-ubi载体用限制性内切酶sali和nhei进行酶切,去掉camv35s启动子和gus基因。将实施例1中克隆的玉米chb101基因用sali和nhei消化并回收包含完成chb101阅读框的dna片段,在把该片段连入上一步的酶切后p3301-ubi载体,得到chb101基因的过表达载体p3301-ubi-chb101。
实施例3
基因枪法介导的玉米遗传转化与鉴定
利用pds-1000台式基因枪进行玉米(h99,以下也称为野生型玉米)幼胚转基因操作,具体步骤如下:
1)材料选取:根据授粉时间,取授粉后12天玉米h99种子的幼胚,此时玉米幼胚长约1.8mm;
2)冲洗玉米穗:加1滴tween20,在清水下浸泡、冲洗30min,然后用75%的乙醇泡30min,再用无菌水冲洗三遍;
3)预培养:将经过2)处理后的幼胚,胚轴向下,盾面向上,放在铺有滤纸(2x2cm)的含有愈伤组织诱导培养基n6e的培养皿中,30个幼胚/培养皿;缠好封口膜,置于培养箱,28℃,暗培养3天;得到预培养后幼胚;
愈伤组织诱导培养基n6e的按照如下方法制备:向n6基本培养基中添加终浓度为2.76g/l脯氨酸、终浓度为100mg/l肌醇、终浓度为2mg/l2,4-d、终浓度为100mg/l水解酪蛋白、终浓度为25um硝酸银、终浓度为30g/l蔗糖和终浓度为2.5g/l植物凝胶,用水补足体积,调节培养基ph值为5.8。
n6基本培养基具体组分及各组分的终浓度如下:硫酸铵463mg/l,硼酸1.6mg/l,无水氯化钙125.33mg/l,二水乙二胺四乙酸二钠37.25mg/l,七水硫酸铁27.85mg/l,无水硫酸镁90.37mg/l,一水硫酸锰3.3mg/l,碘化钾0.8mg/l,硝酸钾2830mg/l,磷酸钾400mg/l,七水硫酸锌1.5mg/l,甘氨酸2mg/l,烟酸0.5mg/l,盐酸吡哆醇0.5mg/l。
4)高渗预培养:
将预培养后幼胚(即成形并膨大的幼胚,认为开始形成typeii愈伤组织)转入含有n6osm培养基的培养皿(直径3.5cm)中,28℃,暗培养,进行高渗处理8h;得到高渗预培养后幼胚;
n6osm培养基配方及终浓度具体如下:n6基本培养基、0.69g/l脯氨酸、100mg/l肌醇、2mg/l2,4-d、100mg/l水解酪蛋白、36.4g/l山梨醇、36.4g/l甘露醇、29mg/l(25um)硝酸银、30g/l蔗糖、终浓度为2.5g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
5)载体处理
在高渗处理期间,灭菌holder和阻挡网,在金粉子弹中加入5μl已等摩尔比预混好的混合载体dna,混匀,准备好后放在冰上,得到包裹了质粒的金粉悬液。
混合载体dna的浓度为1μg/μl,载体的加入量为5μg;0.5mg金粉包裹5μg(金粉与混合载体的质量比为100∶1)。等摩尔比预混好的混合载体dna为按照摩尔比1∶1∶1∶1∶1混合的5种载体ptrauxbar、pgt1-bt2、pisa-sh2、pb1hor-sh1和phmw-gbssiia。
6)将4)得到的高渗预培养后幼胚放入基因枪,在载体膜上滴加5)得到的包裹了质粒的金粉悬液,基因枪真空度27~28psi,用650psi和1100psi可裂膜各轰击一次,可裂膜至靶点距离:6cm/9cm;得到轰击后幼胚;
7)将轰击后幼胚(在滤纸上)在n6som培养基上28℃再次高渗预培养20h,采用暗培养,得到轰击后高渗处理幼胚;
8)将轰击后高渗处理幼胚转移至无滤纸的n6e培养基上进行筛选培养,筛选培养条件为28℃暗培养14天,得到筛选培养幼胚;
10)将筛选培养幼胚转移至n6s培养基上传代培养,传代培养条件为28℃暗培养3周/次,共传代3次,得到愈伤组织(抗除草剂biolaphos)。
n6s培养基配方具体如下:n6基本培养基、100mg/l肌醇、2mg/l2,4-d、2mg/lbialaphos+6mg/l(5um)硝酸银、30g/l蔗糖、2.5g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
11)将愈伤组织(选择易碎的typeii愈伤组织,直径4mm以内)转移到分化诱导培养基rmi上进行分化培养,分化培养的条件为25℃,暗培养3周,得到生长出幼叶的成熟的体细胞胚;
分化诱导培养基rmi具体配方如下:ms基本培养基、6-ba1mg/l、100mg/l肌醇、3mg/l双丙胺膦(bialaphos)、60g/l蔗糖、终浓度为3g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
ms基本培养基具体配方为:硝酸钾1900mg/l,硝酸铵1650mg/l,磷酸二氢钾170mg/l,七水硫酸镁370mg/l,二水氯化钙440,碘化钾0.83mg/l,硼酸6.2mg/l,四水硫酸锰
22.3mg/l,七水硫酸锌8.6mg/l,二水钼酸钠0.25mg/l,五水硫酸铜0.025mg/l,六水氯化钴0.025mg/l,乙二胺四乙酸二钠37.25mg/l,七水硫酸亚铁27.85mg/l,甘氨酸
2mg/l,盐酸硫胺素0.1mg/l,盐酸吡哆醇0.5mg/l,烟酸0.5mg/l;用水补足体积。
12)将生长出幼叶的成熟的体细胞胚转移至rmii培养基中生根培养,生根培养条件为25℃18h光6h光照培养15天,光照强度为4000lux,即可长出幼苗;
rmii培养基配方为:ms基本培养基、100mg/l肌醇、60g/l蔗糖、终浓度为3g/l植物凝胶;用水补足体积,调节培养基ph值为5.8。
13)待幼苗长到3cm以上,根系完整时,将幼苗从rmii培养基移栽到盛有土的纸杯中,25℃,光培养,每天观察土表面,待彻底干燥后浇水;当纸杯中幼苗长到25cm高时即可移栽到大盆中,撕掉纸杯,将土和苗一移栽倒花盆或者实验田里,得到250株t0代转基因玉米。
将空载体pb7rwg采用同样的方法转入野生型玉米中,得到转空载体玉米。
2、转基因玉米的鉴定
(1)bar检测试剂盒检测
为了初步检测转基因是否成功,采用美国envirologix公司试剂盒quickstixtmkitfor
a.用试剂盒中disposabletissueextractortube的管盖和管帽夹住t0代转基因玉米的叶片,取下一个或两个圆形的叶片组织,用试剂盒中自带的研杵将叶片组织推入锥形管底部,装有样品的管用防水记号笔标记好;
b.将研杵插入盛有组织的管内,通过旋转研杵研磨叶片组织,持续20至30秒,直至叶片组织磨的足够碎;
c.向管内加入0.5mlextractionbuffer;
d.继续用研杵棒捣碎叶片,使捣碎的叶片组织与extractionbuffer充分混匀;
e.拿出研杵棒,将试纸条插入混匀的extractionbuffer和叶片组织中检测,等待一分钟左右,观察反应结果。
应用试剂盒对经过basta筛选的112株t0代转基因植株进行检测,两条带为阳性,只有一条说明是阴性;得到12株bar基因阳性t0代转基因玉米。
(2)转基因植株的bar基因pcr分析
为了进一步检测转基因是否成功,根据除草剂筛选标记bar基因设计了特异引物。引物序列为:上游引物p1:5’-gcaccatcgtcaaccactacatc-3’
下游引物p2:5’-agctgccagaaacccacgt-3’
以12株bar基因阳性t0代转基因玉米基因组dna为模板,用p1和p2为引物进行pcr扩增,得到433bp扩增产物为阳性,进一步证明得到12株bar基因阳性t0代转基因玉米。
3)实时荧光定量rt-pcr
将上述12个经鉴定bar检测试剂盒和pcr检测后阳性的t0代转基因玉米的胚乳分别提取rna,反转录得到cdna作为模板,用如下引物对分别进行real-timepcr,检测chb101基因表达情况。以转空载体玉米和野生型玉(h99)为对照。
chb101基因的实时荧光定量rt-pcr的检测引物为5’-ggcacgcaacgcctacgact和
5’-agcccgatgacagcgaccac;
内参基因使用玉米actin1基因,引物为
5’-cctgaagatcaccctgtgct和5’-gcagtctccagctcctgttc。
结果如图3所示,说明12株转基因阳性t0代玉米中(oe-1至oe-12),有6个chb101基因表达超过野生型玉米(wt)的2倍以上,而转空载体玉米和野生型玉米无显著差异。
通过上述方法初步证明玉米chb101基因表达盒已转入玉米基因组中,并超量表达。
实施例4
过表达chb101基因玉米的抗旱性分析
发明人依据chb101基因表达水平,对于过表达chb101成功的转基因玉米,选择chb101基因表达最高的两个转基因系,即oe-2和oe-3进行自交繁殖,获得纯合株系(t2代除草剂筛选不再分离)。然后对t3代oe-2和oe-3转基因系进行抗旱能力检测。玉米种子用1%浓度的次氯酸钠浸泡消毒5min,用去离子水洗3次,每次1分钟。将种子放在湿润滤纸上28℃下促进发芽。3天后将发芽的种子种到土(泥炭土∶蛭石=1∶1)中,温室内培养,16小时光照26℃,8小时黑暗20℃,相对湿度为70%。对于测量干旱胁迫下的生存率,生长至15天的玉米幼苗停止浇水15天,然后重新浇水,2天后测量生存率。结果发现相对于wt,oe-2和oe-3的生存率提高(如图4)。
为了检测过表达chb101对玉米叶片失水的影响,我们取四叶期玉米的第4片叶放入洁净平皿中,将平皿置于干燥的人工气候箱中(25℃,相对湿度30%)进行脱水,在0h,1h,2h,3h和8h时分别测量叶片鲜重,计算相对失水率。结果发现相对于wt,oe-2和oe-3的失水率明显下降(如图5)。
上述结果表明,过表达玉米chb101基因可以减少干旱条件下玉米叶片失水率,从而提高玉米的抗旱性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于环介导等温扩增消光技术的转基因玉米59122检测方法与流程
- 鉴定转基因植物或者转基因玉米双抗12‑5外源基因插入染色体位置的方法及其应用与流程
- CYP78A基因在增加玉米株高和增强植株长势中的应用的制作方法与工艺
- 转基因玉米次生代谢物的HPLC‑MS/MS检测方法与流程
- 一种区分转基因玉米和非转基因玉米的检测方法与流程
- 转基因玉米事件MON87419及其使用方法与流程
- 一种快速获取转基因玉米草甘膦耐受性表型的方法与流程
- 对应于转基因事件MON89034的玉米植物和种子及其检测和使用方法与流程
- 转基因玉米品系VCO‑01981‑5检测方法和试剂与制造工艺
- 一种快速创制转基因玉米双单倍体纯合后代的方法与制造工艺