温敏雄性核不育基因TMS5功能分子标记的开发与应用的制作方法
本发明属于农业生物技术领域,具体涉及一种基于高分辨率熔解曲线分析(high-resolutionmeltingcurveanalysis,hrm)的水稻温敏雄性核不育基因tms5的功能分子标记的开发,以及利用所述引物检测温敏雄性核不育基因tms5的方法及其应用。
背景技术:
水稻是人类主要粮食作物之一,超过一半的世界人口以水稻为主食。而中国人口众多,又是大米生产和消费大国,超过60%的人口以稻米为主食,因此水稻在粮食生产中具有举足轻重的地位。杂交水稻的研究与利用为人类粮食问题的解决提供了一条可行的途径。自上世纪70年代以来,三系杂交水稻一直是我国杂交水稻的主要类型,其在提高水稻产量方面已取得了巨大的成就。然而,有限的恢复系种质资源以及受恢保关系的影响,进一步限制了产量的提高,同时不利于对其性状进行改良。以光、温敏不育系为基础的两系法与三系法相比有明显的优势,两系法不受恢保关系制约,配组自由一系两用,不需要保持系。有研究表明,野败型不育系的保持谱仅1%,恢复谱仅5%,从而使得三系配套的频率仅为0.05%,而两系杂交稻因为不需要保持系,育性由单个细胞核基因控制,恢复谱达到98%,因此用两系法培育出理想品种的相对频率就要高得多,从而成为更有应用前景的杂种优势利用途径。目前,两系法杂交水稻已进入高速发展阶段,其中的温敏细胞核雄性不育系(tgms)因表现为高温条件下雄性不育,在适度低温条件下可育,已在两系杂交稻中被广泛利用。截至2014年,全国已有744个两系杂交稻组合通过审定,种植面积也在逐年扩大。
杂交水稻在保障我国的粮食安全中发挥了很重要的作用,但无论是三系还是两系杂交稻,获得高纯度的杂交种是充分发挥其杂种优势增产潜力的基础,但在实际使用杂交稻种子前往往需要对其纯度进行鉴定,这是由于两系不育系容易受到天气波动(如光、温等环境条件)的影响致使不育系部分自交结实,从而造成杂交稻种子纯度不达标,且在收获、装运等环节中也会因人为因素导致杂交稻的纯度受到严重影响。目前对杂交水稻种子的纯度鉴定通常是在海南进行田间鉴定,但田间小区种植鉴定周期过长,气候条件也会影响鉴定的准确性,而且种植鉴定在很大程度上依赖于鉴定人员的经验,不同的人对同一品种进行鉴定会得出不同的结果。有报道表明,在海南田间鉴定合格的种子,在本地大田种植表现为自交株严重超标,给生产带来严重的损失。并且田间小区种植鉴定是一种后控检验法,通常在海南进行的是越冬种植鉴定,一般在次年3月下旬才获得鉴定结果而滞后于种子的销售行为。因此,这种方法不能很好地满足种子生产经营的需要,从而使得探索一种准确、快速、能早期对杂交水稻种子进行鉴定的方法以保证其大面积推广应用变得越来越紧迫。
研究表明,两系不育系的育性由1或2对基因控制,为不育机理研究提供了方便。温敏雄性不育基因tms5定位于水稻第2染色体短臂an76与pl3之间约6.8kb的物理距离内,该基因已被成功克隆,其编码一个保守的rna酶zs1。rna酶zs1能够在体外和体内把3个泛素核糖体l40融合蛋白基因(ubl40)的mrna加工成多个片段。在高温条件或tms5突变体中,rna酶zs1功能缺失,导致ubl40mrna过度积累,产生花粉产量降低和水稻细胞核雄性不育的性状(zhouetal.,2014)。通过对28个常用的两系不育系材料的tms5基因序列进行分析,除了不育系pa64s,其他27个不育系均发生了tms5蛋白的编码提前终止,即tms5基因的第71位碱基由c变为a。在我国2011年推广的两系杂交稻中,tms5类型的两系不育系占83.8%,而其他类型的两系不育系只占到5.1%。以上结果说明,温敏雄性核不育基因tms5的突变在两系杂交稻应用中占据非常重要的地位。
高分辨率熔解曲线分析(highresolutionmelting,hrm)是近几年兴起的由犹他大学和爱德华科技公司合作开发的一种单核苷酸多态性(singlenucleotidepolymorphism,snp)以及突变研究的技术,它能够有效区分不同snp位点与不同基因型。这种检测方法不受突变碱基位点与类型的局限,在pcr结束后直接运行高分辨率熔解,即可完成对样品基因型的分析。该检测方法因其操作简便、快速、准确度高、分辨率高、易高通量检测、成本低等特点而受到普遍的关注。在植物育种方面,因hrm的操作与后期数据分析简单易懂,在突变扫描、基因分型、基于特定基因的种质资源鉴定等方面具有广阔的应用前景(罗文龙等,2011);同时,对于snp、indel等多种分子标记的开发和利用具有重要的价值,是更加经济高效的分子水平鉴定方法。
为了将tms5基因导入到更多的水稻材料中,创制更多的优良两系不育系,同时对一些两系不育系进行性状改良,用以更大程度地发挥杂交稻的杂种优势,人们开展了对tms5基因的分子标记辅助育种。但这些标记都是基于酶切和琼脂糖或聚丙烯酰胺凝胶电泳,对基因组dna模板的质量要求较高,且这些检测方法费时费力,效率低下。因此,本发明对我司具有的24份水稻材料的tms5基因的序列进行分析,寻找到了一个特异性变异位点,并将其开发成基于hrm技术检测的基因特异性分子标记,用以提高分子标记辅助选择育种的效率。另外,由于目前的两系不育系在制种过程中容易受天气条件的影响造成母本自交结实,存在杂交种纯度不合格而影响农业生产的风险,本发明利用上述分子标记可快速的对上市品种进行纯度鉴定,从而为杂交水稻种子是否适合上市推广提供理论依据。
技术实现要素:
水稻温敏雄性核不育基因tms5已经被成功克隆(http://www.ricedata.cn/gene/list/143.htm,国家水稻数据中心),其基因组序列可从themsuricegenomeannotationproject数据库中下载得到(http://rice.plantbiology.msu.edu/cgi-bin/orf_infopage.cgi?orf=loc_os02g12290),收录号为loc_os02g12290。为了开发出能快速检测水稻温敏雄性核不育基因tms5突变的hrm引物,我们在该基因的突变位点两端的基因组序列上设计了一对引物:tms5-1f:aacagcggcaagtcatcg(seqidno:1)和tms5-1r:ctcgtgctcctgaccaatct(seqidno:2),用上述引物对我司的24份待测水稻材料的基因组dna(具体品种名称见表1)进行扩增,通过对这些扩增产物的测序结果进行比对分析,发现突变体在第70、71位密码子处的碱基为ta,而野生型中该位置的碱基为tc和gc两种(
tms5-hrm-1f:aacagcggcaagtcatcg(seqidno:1);
tms5-hrm-1r:gaagatgacgcaggtctcct(seqidno:3);
tms5-hrm-2r:gctcagcgtcgggaagat(seqidno:4);
tms5-hrm-3r:aagatgacgcaggtctcct(seqidno:5);
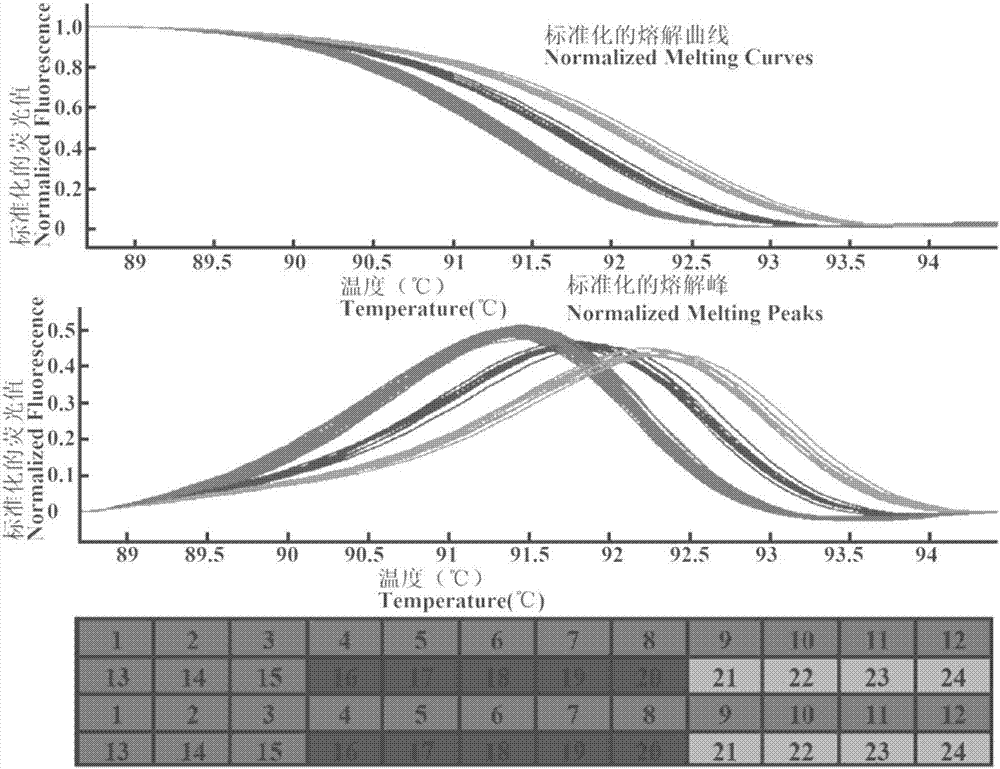
通过左引物分别与3条右引物配对对24份待检测水稻材料的基因组dna进行扩增和hrm检测,发现只有tms5-hrm-1f和tms5-hrm-1r引物对能很好地对该24份待检测水稻材料进行区分,即hrm的分型结果与扩增产物的测序结果完全一致(如图1和图2)。并且,为了验证利用上述引物进行hrm分型的稳定性和可靠性,我们对该扩增所用的模板设置了2个重复,如图2所示,每个模板的两个重复的hrm分型曲线几乎完全重叠,说明该引物的检测结果可靠性较高。
本发明提供一种利用分子标记快速、准确地鉴定和检测温敏雄性核不育基因tms5的方法,同时提供一对结合hrm用于检测水稻温敏雄性核不育基因tms5的分子标记引物,所述引物根据tms5基因的基因组序列的特异性变异设计,可以结合hrm用于水稻温敏雄性核不育基因tms5的分子辅助选择育种以及两系不育系亲本及相应杂交水稻种子的纯度鉴定,以提高分子标记辅助选择的效率和两系杂交稻种子纯度检测的效率。
本发明提供如下解决方案:
一对结合hrm用于检测和鉴定水稻温敏雄性核不育基因tms5的分子标记引物,其上、下游序列分为:
tms5-hrm-1f:5'-aacagcggcaagtcatcg-3'(seqidno:1);
tms5-hrm-1r:5'-gaagatgacgcaggtctcct-3'(seqidno:3);
上述引物是根据tms5基因序列的特异性变异设计的,其基因特异性变异序列分别位于tms5基因编码区的第70和第71位密码子(
上述引物的扩增产物的核苷酸序列如下(温敏雄性核不育基因tms5特异性snp突出显示):
一种结合hrm鉴定和检测水稻温敏雄性核不育基因tms5的方法:利用上述引物扩增24份待检测水稻材料的基因组dna(如表1),取扩增产物用hrm仪器lightscanner96进行高分辨率熔解曲线采集分析,发现24个水稻品种的扩增产物被分成了3种类型,其中1-15号水稻材料、16-20号水稻材料和21-24号水稻材料各为一种类型(见图2)。现有研究表明,第15号材料——光温敏感型核不育系“广占63s”含有温敏雄性核不育基因tms5。结合上述24份待检测水稻材料的测序结果可知,它们在序列上也被分为3种类型,且测序结果与hrm分型结果完全一致。这些结果说明,利用tms5-hrm-1f/1r扩增待检测水稻材料dna结合hrm的方法可以进行水稻温敏雄性核不育基因tms5的鉴定与检测:若待测材料的高分辨率熔解曲线与阳性对照“广占63s”(图3中的红色曲线)的熔解曲线完全一致,则待测水稻抗稻瘟病材料含有tms5基因;否则,待检测材料中不含有tms5基因。
同时,以光、温敏不育系为基础的两系法与三系法相比有明显的优势,两系法不受恢保关系的制约,恢复谱达到98%,杂交配组自由;且两系不育系的育性由单个细胞核基因控制,一系两用,不需要保持系,因此用两系法培育出理想品种的相对频率比三系法要高得多,是更有应用前景的杂种优势利用途径。随着生物技术和基因组学的发展,分子标记辅助选择育种在作物育种实践中发挥着越来越重要的作用。而目前的分子标记是建立在琼脂糖或聚丙烯酰胺凝胶检测基础之上的,成本高,效率低,且不能实现批量检测。本发明用tms5-hrm-1f/1r引物结合hrm检测的方法,将tms5基因快速高效地跟踪导入到不含有该基因的优质常规稻和保持系材料中,从而为更大可能地挖掘杂交水稻的杂种优势潜力,为优质、多抗和高产的高效育种奠定基础。
一种温敏雄性核不育水稻材料分子标记辅助选择育种的方法:以含有温敏雄性核不育基因tms5的水稻材料(本发明的供体亲本是广占63s)为亲本,与其他不含tms5基因的水稻材料(本发明的受体亲本有珍汕97b和黄华占)进行杂交,分别提取各自杂交f1代、回交bc1f1和bc3f2分离后代的基因dna,以引物tms5-hrm-1f/1r对它们进行pcr扩增和hrm分型。其中,图3和图4分别是广占63s/珍汕97b和广占63s/黄华占及其相应的f1代的hrm分型及测序结果;图5和图6分别是广占63s/珍汕97b和广占63s/黄华占的bc1f1分离群体的hrm分型结果;图7和图8分别是广占63s/珍汕97b和广占63s/黄华占的bc3f2分离群体的hrm分型结果。与阳性对照“广占63”的熔解曲线(红色曲线)相一致的表示后代个体中含有纯合的tms5基因,与阴性对照的熔解曲线(依次为珍汕97b——蓝色曲线、黄华占——绿色曲线)相一致的表示后代个体中不含有tms5基因;含有杂合型tms5的不同水稻材料个体,其高分辨率熔解曲线(灰色)相一致(见图3—图8)。图3和图4结果显示,hrm能够很好地对亲本和相应的杂合子进行分型,且其结果与测序的结果完全吻合;图5—图8结果显示hrm能够对两系不育系的改良过程进行很好的跟踪。珍汕97b和黄华占分别代表两种不含tms5基因的单倍型,通过对它们的后代在tms5基因变异位点的基因型分离进行分析发现,它们都满足1:2:1,结合前面对24份水稻材料中是否含有tms5基因的检测结果,说明分子标记tms5-hrm-1f/1r的hrm检测可以用于目前两系不育系的tms5基因的遗传转育和改良过程。
上述引物tms5-hrm-1f/1r可以优先对水稻苗期所提取的dna进行分子标记鉴定,检测后代个体中是否携带纯合型/杂合型温敏雄性核不育基因tms5,从而将不含有tms5基因的个体剔除,结合全基因组的背景扫描分析,可以更快的得到导入温敏雄性核不育基因tms5同时供体亲本背景导入最少的个体,从而提高水稻材料转育的效率。
一种温敏雄性核不育水稻材料分子标记用于两系杂交稻种子纯度检测的方法:将阳性对照广占63s两系不育系亲本种子和广占63s/黄华占杂交稻种子分别进行发苗、整株取样、提取dna,以引物tms5-hrm-1f/1r对上述dna样品进行pcr扩增和hrm分型,结果显示:279个不育系亲本群体样品中有1个表现为野生型带型,有1个表现为突变位点杂合型带型,即不育位点纯合度为99.28%,低于国家标准的99.9%(见图9);279个杂交组合群体样品中有2个杂株的突变位点表现为不育亲本的纯合带型,即杂交稻的不育位点杂合度也为99.28%,达到国家杂交稻组合标准的优质级别(见图10)。说明分子标记tms5-hrm-1f/1r的hrm检测可以用于区分绝大部分的两系不育系与其他恢复系,并能够较好的鉴定两系杂交稻及其不育系亲本种子的纯度。
本发明还提供了一种基于hrm技术的水稻tms5基因检测的pcr试剂盒,它包含引物tms5-hrm-1f:5'-aacagcggcaagtcatcg-3'(seqidno:1)和tms5-hrm-1r:5'-gaagatgacgcaggtctcct-3'(seqidno:3)以及pcr试剂和荧光染料,用于检测水稻材料中是否含有tms5基因。
本发明还提供了一种试剂盒的使用方法,它的步骤如下:提取待测样本dna;配制包含待测样本dna、引物对、pcr试剂盒和evagreen荧光染料的pcr反应体系进行pcr扩增和对pcr产物进行hrm分析扫描。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明提供的分子标记几乎不出现假阳性:传统的pcr扩增结合限制性内切酶的检测方法是以电泳条带的有无来判读基因的存在与否,往往假阳性较高。本发明提供的分子标记在检测上极具简便性和灵敏性,pcr产物直接进行高分辨率熔解曲线采集,达到零损失,其检测结果几乎不出现假阳性;
(2)本发明提供的分子标记在实际应用中具有低成本、高通量的特点:目前,高分辨率熔解曲线分析方法是仅次于dna芯片的中高通量snp检测方法,10min内即可一次性采集96个pcr产物样品的高分辨率熔解,明显比传统的酶切电泳检测方法要简便快捷;并且该分子标记的pcr体系仅需10μl,加上0.04元/体系的饱和荧光染料,其成本也并不高于普通pcr,特别适用于大规模分子辅助选择育种的生产实践中;
(3)该方法检测的是indel或snp类的变异,这类变异在个体中频率非常高,因此可以更容易找到适合作为跟踪基因的分子标记,大大提高分子标记辅助选择育种和两系杂交稻种子纯度鉴定的效率。
因此,本发明所提供结合hrm用于检测温敏雄性核不育基因tms5的分子标记引物,以及利用所述引物检测温敏雄性核不育基因tms5的分子标记方法在生产实践中具有广阔的应用前景,利用此标记可以提高该基因在分子标记辅助选择育种和两系不育系亲本及杂交稻种子纯度鉴定中的利用效率。
附图说明
图1、24份待检测水稻材料中温敏雄性核不育基因tms5的测序结果比对分析(红色框内代表tms5基因的特异性序列)。
图2、24份待检测水稻材料中温敏雄性核不育基因tms5的基因特异性序列的hrm多态性分析(红色曲线代表1-15号水稻材料含有的tms5基因的高分辨率熔解曲线及熔解峰,蓝色曲线代表16-20号水稻材料含有的tms5基因的高分辨率熔解曲线及熔解峰,绿色曲线代表21-24号水稻材料含有的tms5基因的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,方格代表对应样品tms5基因的检测情况,所用模板设置了2个重复)。
图3、引物tms5-hrm-1f/1r检测广占63s/珍汕97b及其f1代的tms5基因突变位点的hrm分型及测序结果(红色曲线代表阳性对照广占63s中tms5基因的高分辨率熔解曲线及熔解峰,蓝色曲线代表阴性对照珍汕97b中tms5基因的高分辨率熔解曲线及熔解峰,灰色曲线代表广占63s/珍汕97b的f1代个体中tms5基因的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,下部依次为广占63s、广占63s/珍汕97b的f1代个体和珍汕97b的测序峰图,黑色方框所标识的碱基为tms5基因的特异性序列)。
图4、引物tms5-hrm-1f/1r检测广占63s/黄华占及其f1代的tms5基因突变位点的hrm分型及测序结果(红色曲线代表阳性对照广占63s中tms5基因的高分辨率熔解曲线及熔解峰,绿色曲线代表阴性对照黄华占中tms5基因的高分辨率熔解曲线及熔解峰,灰色曲线代表广占63s/黄华占f1代个体中tms5基因的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,下部依次为广占63s、广占63s/黄华占f1代个体和黄华占的测序峰图,黑色方框所标识的碱基为tms5基因的特异性序列)。
图5、引物tms5-hrm-1f/1r检测广占63s/珍汕97b的bc1f1分离群体的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因的杂交bc1f1代分离群体的高分辨率熔解曲线及熔解峰,蓝色曲线代表阴性对照珍汕97b的高分辨率熔解曲线及熔解峰,灰色曲线代表含有杂合型tms5基因的杂交bc1f1代分离群体的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,方格代表对应样品tms5基因的检测情况,其中p1为广占63s,p2为珍汕97b,f1为广占63s/珍汕97b的杂交f1代个体对照)。
图6、引物tms5-hrm-1f/1r检测广占63s/黄华占的bc1f1分离群体的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因的杂交bc1f1代分离群体的高分辨率熔解曲线及熔解峰,绿色曲线代表阴性对照黄华占的高分辨率熔解曲线及熔解峰,灰色曲线代表含有杂合型tms5基因的杂交bc1f1代分离群体的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,方格代表对应样品tms5基因的检测情况,其中p1为广占63s,p3为黄华占,f1为广占63s/黄华占的杂交f1代个体对照)。
图7、引物tms5-hrm-1f/1r检测广占63s/珍汕97b的bc3f2分离群体的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因的杂交bc3f2代分离群体的高分辨率熔解曲线及熔解峰,蓝色曲线代表阴性对照珍汕97b的高分辨率熔解曲线及熔解峰,灰色曲线代表含杂合型tms5基因的杂交bc3f2代分离群体的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,方格代表对应样品tms5基因的检测情况,其中p1为广占63s,p2为珍汕97b,f1为广占63s/珍汕97b的杂交f1代个体对照)。
图8、引物tms5-hrm-1f/1r检测广占63s/黄华占的bc3f2分离群体的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因的杂交bc3f2代分离群体的高分辨率熔解曲线及熔解峰,绿色曲线代表阴性对照黄华占的高分辨率熔解曲线及熔解峰,灰色曲线代表含杂合型tms5基因的杂交bc3f2代分离群体的高分辨率熔解曲线及熔解峰,图上部代表标准化的熔解曲线,中部代表熔解峰,方格代表对应样品tms5基因的检测情况,其中p1为广占63s,p3为黄华占,f1为广占63s/黄华占的杂交f1代个体对照)。
图9、引物tms5-hrm-1f/1r检测两系不育系广占63s亲本种子不育位点纯度的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因个体的高分辨率熔解曲线及熔解峰,绿色曲线代表阴性对照黄华占和不含有tms5基因个体的高分辨率熔解曲线及熔解峰,灰色曲线代表广占63s/黄华占杂交f1代个体和含有杂合型tms5基因个体的高分辨率熔解曲线及熔解峰,图左部代表标准化的熔解峰,右部的方格代表对应279个样品tms5基因的检测情况,其中p1为广占63s,p3为黄华占,f1为广占63s/黄华占的杂交f1代个体对照)。
图10、引物tms5-hrm-1f/1r检测两系不育系杂交种广占63s/黄华占杂交稻种子不育位点纯度的hrm分型结果(红色曲线代表阳性对照广占63s和含有纯合型tms5基因个体的高分辨率熔解曲线及熔解峰,绿色曲线代表阴性对照黄华占和不含有tms5基因个体的高分辨率熔解曲线及熔解峰,灰色曲线代表广占63s/黄华占杂交f1代个体和含有杂合型tms5基因个体的高分辨率熔解曲线及熔解峰,图左部代表标准化的熔解峰,右部的方格代表对应279个样品tms5基因的检测情况,其中p1为广占63s,p3为黄华占,f1为广占63s/黄华占的杂交f1代个体对照)。
具体实施方式
下面结合具体的实施例及附图对本发明做进一步详细的描述。需要说明的是,这些实施例仅仅是为了说明本发明,而不能以任何方式解释为对本发明的限制。另外,除非特别说明,在下面的实施例中所涉及的方法为本领域技术人员所熟知的常规手段,可以参照《分子克隆实验指南》第三版或者相关产品进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:tms5等位基因编码区序列的比对及特异性变异序列分析
为了开发能快速检测水稻温敏雄性核不育基因tms5突变的hrm引物,我们在该基因的突变位点两端的基因组序列上设计了一对引物:tms5-1f:aacagcggcaagtcatcg(seqidno:1)和tms5-1r:ctcgtgctcctgaccaatct(seqidno:2)。用上述引物对我司24份待检测水稻材料的基因组dna(具体品种和编号见表1)进行扩增,通过对这些扩增产物的测序结果进行比对分析,结果发现存在三种类型的变异位点序列:第1-15号水稻材料tms5基因的第70位和第71位碱基为ta;第16-20号水稻材料tms5基因的第70位和第71位碱基为tc;和第21-24号水稻材料的tms5基因的第70位和第71位碱基为gc(见图1)。
实施例2:tms5功能特异性分子标记引物设计与hrm检测
(1)引物设计
根据hrm引物的设计原则,在tms5特异性变异序列的上游和下游分别设计引物,我们总共开发了1条左引物和3条右引物,引物序列如下:
tms5-hrm-1f:aacagcggcaagtcatcg(seqidno:1);
tms5-hrm-2r:gaagatgacgcaggtctcct(seqidno:3);
tms5-hrm-3r:gctcagcgtcgggaagat(seqidno:4);
tms5-hrm-4r:aagatgacgcaggtctcct(seqidno:5);
利用上述3对引物(即左引物分别与3条右引物配对)扩增上述24份待检测水稻材料的基因组dna(如表1),pcr扩增反应体系如下:
2×gcbuffer:10μl
dntps(2.5mmeach):2μl
tms5-hrm-f(10μm):0.5μl
tms5-hrm-r(10μm):0.5μl
takaraextaqtm(5u/μl):0.5μl
dna模板(50-100ng/μl):1μl
ddh2o:补足至20μl。
pcr温度循环条件如下:94℃3分钟;94℃30秒、58℃30秒、72℃30秒,35个循环;72℃2分钟。
测序结果分析显示(见图2):3对引物的扩增产物中,只有分子标记引物对tms5-hrm-1f和tms5-hrm-2r的扩增产物测序结果与hrm分型结果完全一致,该引物对的上游引物在7bp至24bp处,下游引物在131bp至150bp处。
(2)hrm检测
通过tms5功能特异性分子标记引物tms5-hrm-1f/1r对24份待检测水稻材料的基因组dna进行扩增,pcr扩增反应体系如下:
pcr扩增反应体系如下:
2×gcbuffer:5μl
dntps(2.5mmeach):0.1μl
tms5-hrm-f(10μm):0.1μl
tms5-hrm-r(10μm):0.1μl
20×evagreen:0.1μl
takarataqtm(5u/μl):0.1μl
dna模板(50-100ng/μl):1μl
ddh2o:补足至10μl。
为了防止体系蒸发,在pcr扩增前需滴加15μl-20μl矿物油覆盖。
pcr温度循环条件如下:94℃3分钟;94℃30秒、57℃30秒、72℃10秒,40个循环;72℃1分钟;95℃1分钟;25℃1分钟后转移至4℃冰箱保存。
pcr结束后,产物全部转移至白底黑框的96孔pcr板。为了方便后续校正96孔板的孔间温度差异,每个孔加入1μl温度内参(internaltemperaturecontrols)并补加15μl-20μl矿物油覆盖后,即可进行高分辨率熔解曲线采集及分析。
所述的温度内参碱基序列如下:
intemf:5'-
atcgtgatttctatagttatctaagtagttggcattaataatttcatttt-3'(seqidno:7);
intemr:5'-
aaaatgaaattattaatgccaactacttagataactatagaaatcacgat-3'(seqidno:8);
上述互补的寡聚核苷酸intemf和intemr合成后,1od的量用800μlddh2o溶解,然后反应体系如下:
饱和nacl:1μl
intemf:1μl
intemr:1μl
ddh2o:补足至10μl。
在95℃条件下变性3分钟后,自然冷却至室温复性,即可作为温度内参。
hrm分型结果分析(见图2):取扩增产物用hrm仪器lightscanner96进行高分辨率熔解曲线采集分析,发现24个水稻品种的扩增产物能被很好地分成3种类型,其中1-15号水稻材料、16-20号水稻材料和21-24号水稻材料各为一种类型。现有研究表明,第15号材料——光温敏感型核不育系“广占63s“含有温敏雄性核不育基因tms5。结合实施例1中的24份待检测水稻材料的测序结果可知,它们在序列上也被分为3种类型,且hrm分型结果与测序结果完全一致。这些结果说明,利用tms5-hrm-1f/1r扩增待测水稻材料dna结合hrm的方法可以进行水稻温敏雄性核不育基因tms5的鉴定与检测:若待测材料的高分辨率熔解曲线与阳性对照广占63s(第15号水稻样品,图3中的红色曲线)的熔解曲线完全一致,则待测水稻抗稻瘟病材料含有tms5基因;否则,待测材料中不含有tms5基因。
实施例3:tms5功能特异性分子标记在辅助育种中的应用分析
以光、温敏不育系为基础的两系法与三系法相比有明显的优势,两系法不受恢保关系的制约,杂交配组自由,一系两用,不需要保持系,且育性由单个细胞核基因控制,恢复谱达到98%,因此用两系法培育出理想品种的相对频率比三系法要高得多,是更有应用前景的杂种优势利用途径。作为辅助育种的分子标记,应该具有对亲本与杂交后代分型的能力,并且通过对tms5基因的变异序列进行测序发现,其存在3种类型的变异(见图1)。本发明可以通过分子标记辅助选择的手段,用tms5-hrm-1f/1r引物结合hrm检测的方法,将tms5基因跟踪导入到不含有该基因的优质常规稻和保持系材料中,从而更大可能地挖掘杂交水稻的杂种优势潜力,为优质、多抗和高产的高效育种奠定基础。
一种温敏雄性核不育水稻材料分子标记辅助选择方法:以含有温敏雄性核不育基因tms5的水稻材料(本发明的供体亲本是广占63s)为亲本,与其他不含tms5基因的水稻材料(本发明的受体亲本有珍汕97b和黄华占)进行杂交,分别提取各自杂交f1代、回交bc1f1和bc3f2分离后代的基因组dna,以引物tms5-hrm-1f/1r对它们进行pcr扩增和hrm分型。其中,图3和图4分别是广占63s/珍汕97b和广占63s/黄华占及其相应的f1代的分型及测序结果;图5和图6分别是广占63s/珍汕97b和广占63s/黄华占的bc1f1分离群体的hrm分型结果;图7和图8分别是广占63s/珍汕97b和广占63s/黄华占的bc3f2分离群体的hrm分型结果。与阳性对照“广占63s”的熔解曲线(红色曲线)相一致的表示后代个体中含有纯合的tms5基因,与阴性对照的熔解曲线(依次为珍汕97b——蓝色曲线、黄华占——绿色曲线)相一致的表示后代个体中不含有tms5基因;含有杂合型tms5的不同水稻材料个体,其高分辨率熔解曲线(灰色)相一致(见图3—图8)。图3和图4结果显示,hrm能够很好地对亲本和相应的杂合子进行分型,且其结果与测序的结果完全吻合;图5—图8结果显示,hrm能够对两系不育系的改良过程进行很好的跟踪。珍汕97b和黄华占分别代表了两种不含tms5基因的单倍型,通过对它们的后代基因型分离进行分析发现,它们都满足1:2:1,结合前面对24份水稻材料中是否含有tms5基因的检测结果,说明分子标记tms5-hrm-1f/1r的hrm检测可以用于目前两系不育系的tms5基因的遗传转育和改良过程。
实施例4:tms5功能特异性分子标记在两系不育系亲本及杂交稻种子纯度鉴定中的应用
国家标准gb4404.1-2008规定,用于两系杂交稻组合制种的不育系亲本的纯度≥99.9%,杂交稻种子的纯度≥96%为合格,纯度≥98%为优质,而两系杂交稻的杂株主要是不育系亲本的自交结实。将阳性对照广占63s两系不育系亲本种子和广占63s/黄华占杂交稻种子分别进行发苗、整株取样、提取基因组dna,并用引物tms5-hrm-1f/1r对所提dna样品进行pcr扩增和hrm分型,结果显示:在279个不育系亲本群体样品中,有1个表现为野生型带型,有1个表现为突变位点杂合型带型,即不育位点纯合度为99.28%,低于国家标准的99.9%(见图9);在279个杂交组合群体样品中,有2个杂株的突变位点表现为不育亲本的纯合带型,即杂交稻的不育位点杂合度也为99.28%,达到国家杂交稻组合标准的优质级别(见图10)。现有研究报道指出,对于两系杂交稻种子中混杂的不育系和恢复系,只需选用一对具有共显性的分子标记进行检测即可,而本发明提供的引物tms5-hrm-1f/1r能够区分目前绝大部分的两系不育系与其他恢复系,说明引物tms5-hrm-1f/1r结合hrm检测的方法可以用于较好的鉴定两系杂交稻及其不育系亲本种子的纯度。
表1、用于tms5基因多态性分析的品种名称
序列表
<110>深圳市作物分子设计育种研究院
深圳兴旺生物种业有限公司
<120>温敏雄性核不育基因tms5功能分子标记的开发与应用
<160>8
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>人工合成(artificialsynthesis)
<400>1
aacagcggcaagtcatcg18
<210>2
<211>20
<212>dna
<213>人工合成(artificialsynthesis)
<400>2
ctcgtgctcctgaccaatct20
<210>3
<211>20
<212>dna
<213>人工合成(artificialsynthesis)
<400>3
gaagatgacgcaggtctcct20
<210>4
<211>18
<212>dna
<213>人工合成(artificialsynthesis)
<400>4
gctcagcgtcgggaagat18
<210>5
<211>19
<212>dna
<213>人工合成(artificialsynthesis)
<400>5
aagatgacgcaggtctcct19
<210>6
<211>144
<212>dna
<213>oryzasativa
<400>6
aacagcggcaagtcatcgccggcggcgacctccaccaccgcgccgccaccgggtcggtag60
aaggcgaaggcgccgcccctcaccgtcgagggctaccccgtggagggcatctccatcggc120
gggcaggagacctgcgtcatcttc144
<210>7
<211>50
<212>dna
<213>人工合成(artificialsynthesis)
<400>7
atcgtgatttctatagttatctaagtagttggcattaataatttcatttt50
<210>8
<211>50
<212>dna
<213>人工合成(artificialsynthesis)
<400>8
aaaatgaaattattaatgccaactacttagataactatagaaatcacgat50
- 还没有人留言评论。精彩留言会获得点赞!