构建细胞全转录本扩增产物的方法及其应用与流程
本发明涉及生物
技术领域:
,具体地,本发明涉及构建细胞全转录本扩增产物的方法及其应用,更具体地,本发明涉及构建细胞全转录本扩增产物的方法、检测细胞中预定因子的方法、检测细胞中预定因子的系统以及检测前列腺癌循环肿瘤细胞中ar-v7的试剂盒。
背景技术:
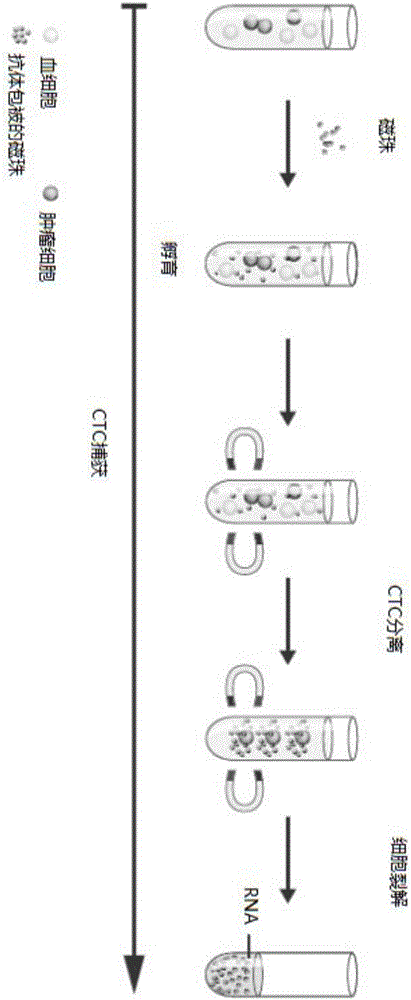
:前列腺癌是泌尿系统最常见的恶性肿瘤之一,在全球范围内其发病率居男性恶性肿瘤的第2位,死亡率居第5位。近十年来,随着我国人口老龄化和生活方式的改变,前列腺癌的发病率和死亡率呈明显的逐年上升趋势。雄激素受体(ar)在前列腺癌的发生、发展中起着重要作用,其通过调节下游基因的表达,促进前列腺癌的进展和转移。晚期前列腺癌的治疗方法主要是内分泌治疗,即雄激素剥夺治疗(adt)。但在前列腺癌的治疗过程中,常常对其产生耐药,并发展成为去势抵抗性前列腺癌(crpc)。在crpc中尽管雄激素水平被抑制,但ar信号通路在crpc中仍起着至关重要的作用。ar-v7(androgenreceptorsplicevariant7)是ar-vs(androgenreceptorsplicevariants)中的一种,结构类似于ar,但缺乏配体结合域,可以不依赖雄激素而持续地活化。antonarakis等人探讨了循环肿瘤细胞(ctc)中ar-v7的表达和crpc患者对ar靶向疗法的药物恩杂鲁胺或阿比特龙治疗反应之间的相关性。研究结果显示,恩杂鲁胺治疗组39%的患者和阿比特龙组19%的患者出现循环肿瘤细胞中ar-v7阳性。恩杂鲁胺组ar-v7阳性患者与阴性患者相比,psa(前列腺特异抗原)反应率明显降低(0%vs53%,p=0.004),psa无进展生存时间(1.4个月vs6个月,p<0.001),临床或影像学无进展生存时间(2.1个月vs6.1个月)和总体生存时间都明显缩短;阿比特龙组也出现相似的结果(antonarakises,luc,wangh,etal.ar-v7andresistancetoenzalutamideandabirateroneinprostatecancer[j].nengljmed.2014,371(11):1028-1038.)。这说明ar-v7参与了恩杂鲁胺和阿比特龙耐药性的发展。目前已有大量研究证明,对前列腺癌循环肿瘤细胞ar-v7的检测可以对crpc患者中ar靶向疗法的耐药性进行评估。因此,如何快速、准确地检测前列腺癌患者中循环肿瘤细胞(ctc)中的ar-v7,是指导前列腺癌患者用药的关键问题。技术实现要素:本发明旨在至少在一定程度上解决相关技术中的技术问题之一。在本发明的第一方面,本发明提出了一种构建细胞全转录本扩增产物的方法。根据本发明的实施例,所述方法包括:将细胞样品进行磁珠捕获处理,以便获得待处理细胞;以及将所述待处理细胞进行单细胞全转录本扩增,以便获得所述待处理细胞的全转录本扩增产物,其中,进行单细胞全转录本扩增之前,进一步包括将所述待处理细胞进行裂解处理,所述裂解处理是通过向所述待处理细胞中加入pbs和裂解液进行的,基于1~100个待处理细胞,所述pbs的用量为7微升,所述裂解液的用量为4微升,所述裂解液包括100mmtris-hcl、500mmkcl、25mmmgcl2、10%np40、0.1mdtt、rna酶抑制剂(40u/μl)、0.5μmup1引物、2.5mmdntp以及无核酸酶水。根据本发明实施例的方法,将磁珠捕获技术与单细胞全转录本扩增技术巧妙相结合,严格控制待处理细胞与裂解液和pbs的加入量,可稳定获得微量细胞(如循环肿瘤细胞)全转录本扩增产物。根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述细胞样品来源于外周血。根据本发明的实施例,所述外周血为肿瘤患者外周血。根据本发明的实施例,所述待处理细胞为循环肿瘤细胞。根据本发明的实施例,所述裂解处理包括用移液器对所述待处理细胞进行吸打重悬处理至少5次。进而对待处理细胞的裂解处理更加彻底。根据本发明的实施例,所述磁珠捕获处理是通过如下方式进行的:1)将5ml外周血与100μl磁珠进行第一混合,所述磁珠预先利用pbs进行第一重悬处理,所述第一混合是在5rpm的条件下进行30min;2)将所述第一混合产物在磁力架上静置3min,以便除去第一上清;3)将步骤2)所得沉淀进行第二重悬处理,所述第二重悬处理是在5mlpbs中进行的;4)将第二重悬处理产物在磁力架上静置1min,以便除去第二上清;5)重复步骤3)和4)两次;6)将步骤5)所得沉淀进行第三重悬处理,所述第三重悬处理是在1mlpbs中进行的;7)将第三重悬处理产物在磁力架上静置1分钟,以便获得所述循环肿瘤细胞;其中,所述磁珠包被有识别所述循环肿瘤细胞的抗体。根据本发明的具体实施例,所述抗体包括epcam、her2的至少之一。进而肿瘤患者外周血中的循环肿瘤细胞在上述操作顺序和操作条件下得到进一步地高效富集。根据本发明的实施例,所述单细胞全转录本扩增是通过如下方式获得的:1)将循环肿瘤细胞在24℃的条件下进行裂解5分钟,随后在95℃的条件下裂解3分钟,冷却至4℃;2)将步骤1)获得的裂解产物在磁力架上静置1分钟,吸取第三上清;3)将步骤2)所获得第三上清与2μlgdnawipeoutbuffer进行混合,所述混合是在42℃的条件下进行10分钟;4)将步骤3)所获得产物与6μlquantiscriptrtmix进行混合,所述混合是在42℃的条件下进行60分钟;5)将步骤4)所得产物在95℃的条件下孵育3分钟,放冰上冷置;6)在步骤5)所得产物与10μl的ligationmix混合,所述混合是在24℃条件下进行30分钟;7)将步骤6)所得产物在95℃条件下静置5分钟,放冰上冷置;8)将步骤7)所得产物与30μl的repli-gsensiphiamplificationmix进行混合,所述混合是在30℃条件下进行2h;9)将步骤8)所得产物在65℃的条件下孵育5分钟;10)将步骤9)所得产物进行纯化处理,以便获得所述循环肿瘤细胞全转录本扩增产物。进而所富集的循环肿瘤细胞在上述裂解条件下得到彻底裂解,循环肿瘤细胞中mrna得到充分释放,进一步依据上述的rna反转录条件和操作,对单个细胞或有限的样本进行高度均一的全转录本扩增(wta),可均一的扩增单个细胞(1至100个细胞)或纯化的总rna,覆盖全转录组,确保所得的rna真实反映了体内的基因表达谱。利用上述操作方式下的单细胞转录组扩增技术对捕获的ctc进行全转录本扩增,可提高ctc预定因子检测的敏感性。在本发明的第二方面,本发明提出了一种检测细胞中预定因子的方法。根据本发明的实施例,所述方法包括:按照前面所述的方法构建细胞全转录本扩增产物;以及基于所述全转录本扩增产物进行针对预定因子的pcr扩增,以便检测所述细胞中预定因子。利用根据本发明实施例的上述方法,可高效检测出微量细胞中的预定因子,检测效率显著提高。根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述细胞为前列腺癌循环肿瘤细胞。根据本发明的实施例,所述预定因子为ar-v7。根据本发明的实施例的上述方法可对5ml血液中含有2个及以上的ar-v7阳性细胞进行检出。根据本发明的实施例,所述pcr扩增为ddpcr扩增,ddpcr引物具有seqidno:1~2所示的核苷酸序列。cagcagaaatgattgcactattgat(seqidno:1)。ctggtcattttgagatgcttgcaat(seqidno:2)。根据本发明的实施例,ddpcr扩增的探针具有seqidno:3所示的核苷酸序列。aattccgaaggaaaaattgtccatctt(seqidno:3)。根据本发明的实施例,ddpcr扩增的反应条件为进而,在上述ddpcr扩增条件下,对ar-v7的检测效率进一步提高,根据本发明实施例的方法的准确度和可信度进一步提高。根据本发明的实施例,所述pcr扩增的引物具有seqidno:1或4所示的核苷酸序列;cagcagaaatgattgcactattgat(seqidno:1)。ccaggtttctccagactatccac(seqidno:4)。根据本发明的实施例,pcr扩增的反应条件为进而,在上述pcr扩增条件下,对ar-v7的检测效率进一步提高,根据本发明实施例的方法的准确度和可信度进一步提高。在本发明的第三方面,本发明提出了一种检测细胞中预定因子的系统。根据本发明的实施例,所述系统包括:构建细胞全转录本扩增产物装置,所述构建细胞全转录本扩增产物装置用于构建细胞全转录本扩增产物,以及pcr扩增装置,所述pcr扩增装置与所述构建细胞全转录本扩增产物装置相连,用于基于所述全转录本扩增产物进行针对预定因子的pcr扩增,以便检测细胞中预定因子。根据本发明的具体实施例,所述构建细胞全转录本扩增产物装置进一步包括:磁珠捕获单元,所述磁珠捕获单元用于捕获细胞样品中的待处理细胞;裂解单元,所述裂解单元与所述磁珠捕获单元相连,用于将所述待处理细胞进行裂解处理,所述裂解处理是通过向所述待处理细胞中加入pbs和裂解液进行的,基于1~100个待处理细胞,所述pbs的用量为7微升,所述裂解液的用量为4微升,所述裂解液包括100mmtris-hcl、500mmkcl、25mmmgcl2、10%np40、0.1mdtt、rna酶抑制剂(40u/μl)、0.5μmup1引物、2.5mmdntp以及无核酸酶水;单细胞全转录本扩增单元,所述单细胞全转录本扩增单元与所述裂解单元相连,用于对裂解处理产物进行单细胞全转录本扩增,以便获得细胞全转录本扩增产物。利用根据本发明实施例的上述系统,可高效检测出微量细胞中的预定因子,检测效率显著提高。在本发明的第四方面,本发明提出了一种检测前列腺癌循环肿瘤细胞中ar-v7的试剂盒。根据本发明的实施例,所述试剂盒包括:试剂,所述试剂包括核酸,所述核酸具有seqidno:1~3所示的核苷酸序列。利用根据本发明实施例的试剂盒,可在微量样品中实现ar-v7的高效检测。根据本发明的实施例,上述试剂盒还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述试剂进一步具有seqidno:4所示的核苷酸序列的核酸。利用根据本发明实施例的试剂盒,可在微量样品中实现ar-v7的高效检测。附图说明图1是根据本发明实施例的检测细胞中预定因子的方法中ctc捕获的流程示意图;图2是根据本发明实施例的检测细胞中预定因子的方法中对捕获的ctc进行全转录本扩增以及ar-v7检测的流程示意图。具体实施方式下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。下面描述的实施例利用adnatestprostatecancerselectkit(qiagen,395032)对前列腺癌患者血液进行ctc捕获,利用单细胞rna扩增的试剂盒repli-gwtasinglecellkit(qiagen,150063)对捕获的ctc进行裂解,得到的rna进行反转录及cdna扩增,设计ar-v7的ddpcr引物进行ar-v7检测。实现了对5ml血液中含有2个及以上的ar-v7阳性细胞进行检出。具体流程可参考图1和图2。实施例1、ctc捕获利用adnatestprostatecancerselectkit(qiagen,395032)进行ctc捕获。1)用移液器重悬prostateselectbeads1,不要涡旋振荡。2)将磁珠(每个样本100μl)加入1.5ml离心管中。超过10个样本需要增加一个1.5ml离心管。3)将离心管置于磁力架上1分钟,用移液器去除上清。4)加入1mlpbs反复吸打重悬磁珠。5)将离心管置于磁力架上1分钟,用移液器去除上清。6)重复步骤4)-5)两次(共三次)。7)将beads悬浮于pbs中至原始体积(每个样本100μl)。8)吸取5ml血液至15ml反应管中,加入100μl磁珠。9)在室温下缓慢离心(混匀仪约5rpm)30分钟。10)将反应管置于磁力架上3分钟,用移液器去除上清,不要接触到磁珠。11)加入5mlpbs,轻轻摇晃以重新悬浮bead/cell复合物。12)将反应管置于磁力架上1分钟,用移液器去除上清,不要接触到磁珠。13)重复步骤11)-12)(共三次)。14)加入1mlpbs重悬磁珠(轻摇混匀),转移到1.5ml离心管中。15)将离心管置于磁力架上1分钟,用移液器彻底去除上清。2、rna反转录及扩增利用repli-gwtasinglecellkit(qiagen,150063)进行rna反转录及扩增。1)在离心管加入7μlpbs和4μl的lysisbuffer,用移液器吸打重悬至少5次。2)24℃孵育5分钟,随后95℃孵育3分钟,冷却至4℃。3)将离心管置于磁力架上1分钟,用移液器转移上清至新的离心管中。4)加入2μlgdnawipeoutbuffer,混匀离心,42℃孵育10分钟。5)按照表1配置quantiscriptrtmix。表1:quantiscriptrtmix成分体积rt/polymerasebuffer4μloligodtprimer1μlquantiscriptrtenzymemix1μltotalvolume6μl6)每个裂解的细胞样本中加入新鲜配置的6μl的quantiscriptrtmix,轻轻混匀后离心,42℃孵育60分钟。7)95℃孵育3分钟,放冰上冷置。8)按照表2配置ligationmix。表2:ligationmix成分体积ligasebuffer8μlligasemix2μltotalvolume10μl9)在第7)步的反应液中每个样本加入新鲜配置的10μl的ligationmix,轻轻混匀后离心,24℃孵育30分钟。10)95℃孵育5分钟,放冰上冷置。11)按照表3准备repli-gsensiphiamplificationmix。表3:repli-gsensiphiamplificationmix成分体积repli-gscreactionbuffer29μlrepli-gsensiphidnapolymerase1μltotalvolume30μl12)在第10)步的反应液中每个样本加入新鲜配置的30μl的repli-gsensiphiamplificationmix,轻轻混匀后离心,30℃孵育2h。13)65℃孵育5分钟。14)纯化cdna与纯化大概70kb的gdna方法相同,用qubit进行定量。3、ar-v7检测利用微滴式pcr(ddpcr)仪器(qx200tmdropletdigitaltmpcr系统,bio-rad,1864001)对ar-v7进行检测,检测引物见表4。表4:ar-v7ddpcr检测引物1)按照表5配置20μlddpcr探针法定量反应体系。表5:ddpcr反应体系成分体积/量ddpcrtmsupermixforprobes10μl引物按照表4反应浓度加入体系步骤2第14步获得的cdna产物30ngh2o补足总体积20μl2)将一个新的dg8cartridge放入holder中,注意缺口方向;将20ul反应液加入到dg8cartridge的中间一排。3)在dg8cartridge最底下一排8个孔中各加入70μl微滴生成油(dgoil)。4)用胶垫封口。5)将以上holder轻轻地平稳放置于微滴生成仪(qx200tmdropletgenerator)中,开始生成微滴,注意仪器上指示灯状态,一般约2分钟。6)生产的微滴(40ul)全部转移到96孔板。7)将膜有红线标记的一面(反光亮面)朝上置于96孔板上并固定好,用预热好的px1热封仪对其进行封膜,推荐的运行程序为:180℃,10s,无需颠倒方向进行二次封膜;8)利用pcr仪按照如下反应条件进行扩增。9)利用ddpcrreader(qx200tmdropletreader)读取ar-v7阳性微滴数据,1μl反应液可检测10个以上阳性微滴。利用普通pcr仪器对ar-v7进行检测,检测引物见表6。表6:按照表7配置20μlddpcr反应体系。表7:pcr反应体系成分体积/量2xkapafastmultiplexmix2μl引物按照表6反应浓度加入体系步骤2第14步获得的cdna产物30ngh2o补足总体积20μl利用pcr仪按照如下反应条件进行扩增。利用agilent2100bioanalyzersystem对扩增产物进行检测。对比例1操作方法同实施例,只是rna反转录及扩增中只加入了4μl的lysisbuffer。发现,细胞裂解不充分,不能充分悬浮磁珠,所获得的cdna无法用于ar-v7检测。对比例2操作方法同实施例,只是rna反转录及扩增中加入了2μlpbs和4μl的lysisbuffer。发现细胞裂解不充分,不能充分悬浮磁珠,所获得的cdna无法用于ar-v7检测。对比例3操作方法同实施例,只是rna反转录及扩增中加入了13μlpbs和4μl的lysisbuffer。发现细胞裂解不充分,所获得的cdna无法用于ar-v7检测。对比例4操作方法同实施例,只是ar-v7ddpcr检测引物的反应浓度调整为900nm,如表8所示。表8:发现,改变反应浓度,ddpcr阳性微滴数量比实施例减少一半。对比例5操作方法同实施例,只是调整ar-v7ddpcr检测引物和探针序列,调整后的序列如表9所示。表9:名称序列(5’-3’)反应浓度ar-v7-f1cggaaatgttatgaagcagggatga500nmar-v7-r1ccaggtttctccagactatccac500nm探针1[6fam]tctgggagaaaaattccg[bhq1]250nm发现,改变引物和探针序列,ddpcr阳性微滴数量比实施例减少1/4。对比例6操作方法同实施例,只是调整ar-v7ddpcr检测的扩增反应的退火温度,调整后的反应条件如下所述:发现,改变退火温度,ddpcr阳性微滴数量比实施例减少一半。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。sequencelisting<110>北京莲和医学检验所有限公司<120>构建细胞全转录本扩增产物的方法及其应用<130>pidc3176275<160>4<170>patentinversion3.3<210>1<211>25<212>dna<213>artificial<220><223>ddpcr引物<400>1cagcagaaatgattgcactattgat25<210>2<211>25<212>dna<213>artificial<220><223>ddpcr引物<400>2ctggtcattttgagatgcttgcaat25<210>3<211>27<212>dna<213>artificial<220><223>ddpcr扩增的探针<400>3aattccgaaggaaaaattgtccatctt27<210>4<211>23<212>dna<213>artificial<220><223>pcr扩增的引物<400>4ccaggtttctccagactatccac23当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1