角膜上皮细胞群的制造方法与流程
本发明涉及一种角膜上皮细胞群的制造方法,涉及一种用于移植用角膜上皮细胞片的制作的高纯度角膜上皮细胞群的制造方法。
背景技术:
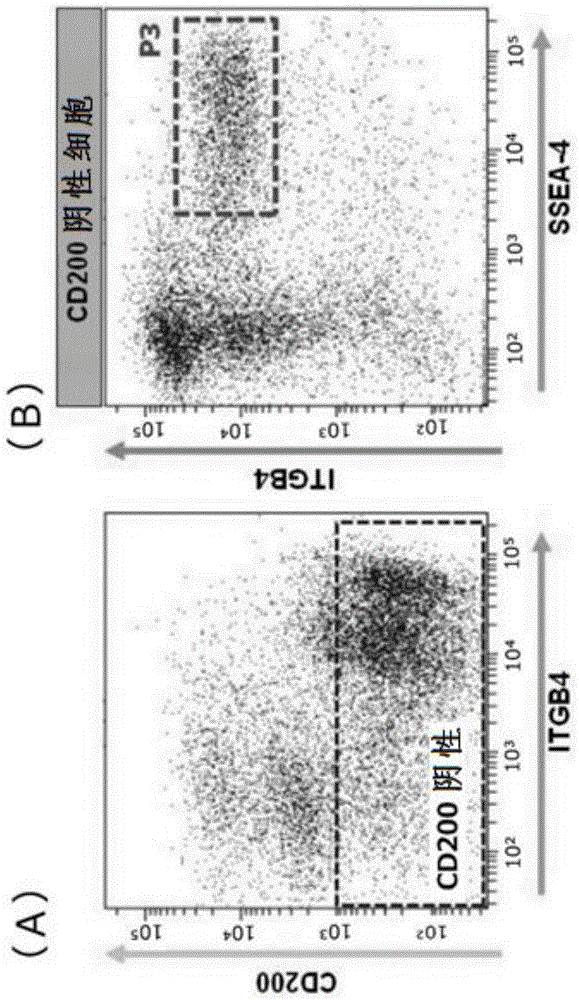
:角膜上皮细胞位于眼的最外层,起到对外界的防护功能等重要的功能。作为顽固的眼疾的一组,已知有作为角膜上皮干细胞缺损症的stevens-johnson综合症、眼类天疱疮、碱腐蚀等疾病。在角膜上皮干细胞缺损症中,因由外伤或自身免疫等造成的慢性炎症反应,存在于眼的角膜缘的角膜上皮干细胞陷入不可逆的功能不全、或消失,从而呈现角膜混浊的症状。作为其结果,眼的结膜上皮侵入角膜中央部,由此角膜失去本来所具有的透明性,导致显著的视力下降。作为用于恢复角膜上皮干细胞缺损症等严重的角膜疾病患者的视力的措施,一直以来施行角膜移植术。特别是对于双眼发病的双眼性的患者而言,现状是由于不存在来自患者本人的正常角膜,因此仅能够施行异体角膜移植术。然而,由于施行异体角膜移植术时,存在能够供给所需角膜的供体不足的问题、或存在对来自供体的角膜产生排斥反应的问题,因此期望开发使用自体细胞源的治疗法。作为针对角膜上皮干细胞缺损症等严重的角膜疾病的新型治疗法,本申请的发明人开发了由ips细胞制作角膜上皮细胞片的技术,并使用动物模型确认了其有效性(非专利文献1)。由于通过非专利文献1中记载的分化诱导法、由ips细胞生成的细胞为包括眼周围的各种细胞的细胞群,因此为了用于角膜上皮细胞片的制作,需要纯化角膜上皮细胞。因此,非专利文献1中,使用针对角膜上皮细胞特异性细胞表面标记的抗体,利用facs分选进行纯化。facs分选为利用液流使进行了抗体染色的细胞流动,通过激光的照射确认细胞表面抗原的表达并分拣特定的细胞的技术,但是难以保证细胞通过的全部流路的无菌性,存在可能有细胞污染的问题。并且,facs分选存在回收后的细胞的损伤大的问题。进一步,facs分选所使用的机器的维修需要专业的知识和技术。因此,在大量地制备用于移植用角膜上皮细胞片的制作的细胞的情况下,facs分选不一定是理想的方法,将非专利文献1的技术实用化及产业化时仍留有技术问题。现有技术文献专利文献非专利文献1:hayashietal.,nature.2016mar17;531(7594):376-80.doi:10.1038/nature17000.epub2016mar9.技术实现要素:本发明要解决的技术问题本发明的技术问题在于,提供一种不使用facs分选,通过短时间且简便的操作,由包含角膜上皮细胞的细胞群大量制造能够在移植用角膜上皮细胞片的制作中使用的高纯度且安全、损伤少的角膜上皮细胞群的方法。解决技术问题的技术手段为了解决上述的技术问题,本发明包括以下的发明。[1]一种制造用于制作移植用角膜上皮细胞片的角膜上皮细胞群的方法,其特征在于,其包括以下的工序(1)~(3):(1)制备包含角膜上皮细胞的细胞群的工序;(2)将工序(1)中制备的细胞群供于磁性细胞分离,获得cd200阴性/ssea-4阳性细胞的工序;及(3)使工序(2)中获得的细胞与选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段接触,获得粘附细胞的工序。[2]根据所述[1]所述的制造方法,其中,所述工序(3)为:(3-1)使工序(2)中获得的细胞与具有α2链的层粘连蛋白或其e8片段接触而获得非粘附细胞的工序;及(3-2)使得到的非粘附细胞与选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段接触,获得粘附细胞的工序。[3]根据所述[1]或[2]所述的制造方法,其中,所述包含角膜上皮细胞的细胞群为将多能干细胞分化诱导为眼周围细胞而得到的细胞群。[4]根据所述[1]~[3]中任一项所述的制造方法,其中,所述用于制作移植用角膜上皮细胞片的角膜上皮细胞群中的pax6阳性/p63阳性细胞的比例为50%以上。[5]根据所述[1]~[4]中任一项所述的制造方法,其中,选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段为层粘连蛋白α3β3γ2的e8片段、层粘连蛋白α4β1γ1的e8片段或层粘连蛋白α5β1γ1的e8片段。[6]根据所述[2]所述的制造方法,其中,具有α2链的层粘连蛋白或其e8片段为层粘连蛋白α2β1γ1的e8片段。[7]一种移植用角膜上皮细胞片的制造方法,其特征在于,其包括对通过所述[1]~[6]中任一项所述的制造方法制造的角膜上皮细胞群进行培养的工序。发明效果根据本发明,能够不使用facs分选,通过短时间且简便的操作,由包含角膜上皮细胞的细胞群大量地制造能够在移植用角膜上皮细胞片的制作中使用的高纯度且安全、损伤少的角膜上皮细胞群。附图说明图1为示出通过facs分选对由ips细胞分化诱导的眼周围细胞中的cd200阴性/ssea-4阳性/itgb4阳性细胞进行分离的结果的图,为(a)表示cd200阴性细胞的区域、(b)表示cd200阴性/ssea-4阳性/itgb4阳性细胞的区域的图。图2为示出将通过facs分选分离的cd200阴性/ssea-4阳性/itgb4阳性细胞培养3周的结果的图,为(a)表示利用相差显微镜观察细胞的结果、(b)表示对得到的细胞片的表达蛋白进行分析的结果的图。图3为示出针对由ips细胞分化诱导的眼周围细胞、通过磁性细胞分离从该眼周围细胞中去除cd200阳性细胞而成的细胞以及通过磁性细胞分离分拣了ssea-4阳性细胞的细胞,通过facs分别对cd200、ssea-4及itgb4的表达进行分析的结果的图。图4为将图3的facs分析结果制成图表的图。图5为示出将由ips细胞分化诱导的眼周围细胞接种于涂布有各种层粘连蛋白e8片段的板,分别回收非粘附细胞,通过facs对cd200、ssea-4及itgb4的表达进行分析的结果的图。图6为示出将由ips细胞分化诱导的眼周围细胞接种于涂布有层粘连蛋白211-e8片段的板,并对非粘附细胞的角膜上皮细胞率进行分析的结果的图。图7为示出将由ips细胞分化诱导的眼周围细胞接种于涂布有层粘连蛋白211-e8片段的板,并对粘附细胞的角膜上皮标记基因及非角膜上皮标记基因的表达进行分析的结果的图。图8为示出使用由ips细胞分化诱导的眼周围细胞,在通过本发明的制造方法制造角膜上皮细胞群的过程中,对各阶段的细胞群的角膜上皮标记基因及非角膜上皮标记基因的表达进行分析的结果的图。图9为示出将通过本发明的制造方法制造的角膜上皮细胞群在层粘连蛋白511-e8片段上培养3周,并用相差显微镜观察成为融合(confluent)状态的细胞的结果的图。图10为示出将通过本发明的制造方法制造的角膜上皮细胞群在层粘连蛋白511-e8片段上培养3周,并对得到的细胞片的表达蛋白进行分析的结果的图。图11为示出将通过本发明的制造方法制造的角膜上皮细胞群及通过facs分选分离的cd200阴性/ssea-4阳性/itgb4阳性细胞分别在层粘连蛋白511-e8片段上培养3周后,剥离并分散细胞,通过facs对k14阳性细胞及k12阳性细胞进行分析的结果的图。图12为示出将由通过本发明的制造方法制造的角膜上皮细胞群(mls(322)、mls(511))制作的细胞片的形态与由其他细胞群制作的细胞片的形态进行比较的结果的图。图13为示出使用各种层粘连蛋白e8,对从作为上皮干细胞标记物的p63的egfp共表达基因敲入ips细胞分化诱导的眼周围细胞进行角膜上皮细胞的纯化而得到的细胞的相差显微镜图像及荧光显微镜图像的图。图14为示出使用各种层粘连蛋白e8,对从作为上皮干细胞标记物的p63的egfp共表达基因敲入ips细胞分化诱导的眼周围细胞进行角膜上皮细胞的纯化,算出得到的细胞中的p63阳性细胞率的结果的图。具体实施方式在非专利文献1中,发明人为了从由ips细胞分化诱导的眼周围细胞群中纯化角膜上皮细胞,通过facs回收不表达在未分化的ips细胞中表达的tra-1-60的细胞(tra-1-60阴性细胞),进一步,将通过facs回收在角膜上皮细胞中表达的ssea-4及整合素β4(以下也记作“itgb4”)的共阳性细胞而得到的细胞群用作角膜上皮细胞群。然而,已知对tra-1-60阴性/ssea-4阳性/itgb4阳性细胞群进行培养时,有时会观察到由与角膜上皮细胞不同的不纯细胞生成的菌落,不能说必定被充分纯化。因此,发明人详尽地对在tra-1-60阴性/ssea-4阳性/itgb4阳性细胞群的培养中生成的角膜上皮细胞菌落与不纯细胞菌落的表达基因进行了分析,并将cd200鉴定为在不纯细胞菌落中的表达高的基因。至今并未报告cd200在多能干细胞中表达而不在角膜上皮细胞中表达,可知cd200为与已知的tra-1-60相比能够更广泛地去除不纯细胞的、非常优异的选择性标记物(selectedmarker)。因此,本申请发明的“角膜上皮细胞”与“cd200阴性/ssea-4阳性/itgb4阳性细胞”同义。本发明提供用于制作移植用角膜上皮细胞片的角膜上皮细胞群的制造方法(以下,记作“本发明的制造方法”)。本发明的制造方法只要包括以下的工序(1)、工序(2)及工序(3)即可:(1)制备包含角膜上皮细胞的细胞群的工序;(2)将工序(1)中制备的细胞群供于磁性细胞分离,获得cd200阴性/ssea-4阳性细胞的工序;(3)使工序(2)中获得的细胞与选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段接触,获得粘附细胞的工序。工序(1)中,制备包含角膜上皮细胞的细胞群。包含角膜上皮细胞的细胞群能够通过由多能干细胞进行分化诱导而制备。此外,能够由包括供体角膜等角膜的组织制备。作为多能干细胞,只要为具有可分化为存在于生物体的全部细胞的多能性、且兼具增殖能力的干细胞即可。例如可列举出胚胎干细胞(es细胞)、通过核移植得到的来自克隆胚胎的胚胎干细胞(ntes细胞)、精子干细胞(gs细胞)、胚胎生殖细胞(eg细胞)、诱导性多能干细胞(ips细胞)、培养成纤维细胞或骨髓干细胞来源的多潜能细胞(muse细胞)等。优选es细胞、ntes细胞及ips细胞,更优选ips细胞。多能干细胞优选为哺乳动物的多能干细胞。哺乳动物并无特殊限定,可列举出人类、小鼠、大鼠、牛、猪等。其中,优选人类。通过使用人类多能干细胞,能够获得可用于人类的再生医疗的安全的角膜上皮细胞群。通过分化诱导而由多能干细胞制备包含角膜上皮细胞的细胞群的方法并无特殊限定,能够从公知的方法中适当地选择使用。例如,能够适当地使用本申请的发明人开发的将多能干细胞分化诱导为眼周围细胞的方法(非专利文献1)。该分化诱导方法为用包含人角质细胞生长因子(keratinocytegrowthfactor:kgf)及人成纤维细胞生长因子-2(fibroblastgrowthfactor-2:fgf-2)的培养基来培养进行过维持培养的人ips细胞的方法。另外,在非专利文献1所记载的分化诱导方法中,角膜上皮细胞的诱导中fgf-2不是必须的,即使非专利文献1中记载的培养基不包含fgf-2,也能够由人ips细胞分化诱导包含角膜上皮细胞的细胞群(参见参考例1)。除此以外,即使使用例如以下的文献(a)~(e)中记载的分化诱导方法等,也能够由多能干细胞制备包含角膜上皮细胞的细胞群。(a)shalom-feuerstein,r.,serror,l.,delaforestdivonne,s.,petit,i.,aberdam,e.,camargo,l.,damour,o.,vigouroux,c.,solomon,a.,gaggioli,c.,etal.(2012).pluripotentstemcellmodelrevealsessentialrolesformir-450b-5pandmir-184inembryoniccorneallineagespecification.stemcells30,898-909.(b)hewitt,k.j.,shamis,y.,carlson,m.w.,aberdam,e.,aberdam,d.,andgarlick,j.a.(2009).three-dimensionalepithelialtissuesgeneratedfromhumanembryonicstemcells.tissueeng.parta15,3417-3426.(c)hayashi,r.,ishikawa,y.,ito,m.,kageyama,t.,takashiba,k.,fujioka,t.,tsujikawa,m.,miyoshi,h.,yamato,m.,nakamura,y.,andnishida,k.(2012).generationofcornealepithelialcellsfrominducedpluripotentstemcellsderivedfromhumandermalfibroblastandcorneallimbalepithelium.plosone7,e45435.(d)hanson,c.,hardarson,t.,ellerstro¨m,c.,nordberg,m.,caisander,g.,rao,m.,hyllner,j.,andstenevi,u.(2013).transplantationofhumanembryonicstemcellsontoapartiallywoundedhumancorneainvitro.actaophthalmol.(copenh.)91,127-130.(e)ahmad,s.,stewart,r.,yung,s.,kolli,s.,armstrong,l.,stojkovic,m.,figueiredo,f.,andlako,m.(2007).differentiationofhumanembryonicstemcellsintocornealepithelial-likecellsbyinvitroreplicationofthecornealepithelialstemcellniche.stemcells25,1145-1155.由包括供体角膜等角膜的组织进行制备的方法并无特殊限定,能够从公知的方法中适当地选择使用。例如可列举出使用镊子等、在实体显微镜下从供体角膜的强角膜组织中刮出角膜上皮细胞并供于培养的方法(hayashir,etal.,tissueengpartcmethods.16(4):553-560,2010.)等。作为在本发明的制造方法中使用的包含角膜上皮细胞的细胞群,优选通过非专利文献1中记载的方法制备的细胞群、即将人ips细胞分化诱导为眼周围细胞而得到的细胞群。工序(2)中,将工序(1)中制备的细胞群供于磁性细胞分离(magnetic-activatedcellsorting,以下也记作“macs”),获得cd200阴性/ssea-4阳性细胞。能够使用市售的磁性细胞分离装置来进行工序(2)。虽然通常采用在去除cd200阳性细胞后回收ssea-4阳性细胞的方法,但是并非限定于此。作为利用macs去除cd200阳性细胞的方法,可列举出如下方法:利用抗cd200抗体将工序(1)中制备的细胞群染色,使其与能够结合于该抗cd200抗体的磁性微珠(例如,结合有抗免疫球蛋白抗体的磁性微珠)接触后,通入磁性细胞分离装置的磁性柱,将通过柱的细胞回收并作为去除了cd200阳性细胞的细胞群(cd200阴性细胞群)。抗cd200抗体可被标记,在使用标记抗cd200抗体的情况下,能够使用与标记物结合的磁性微珠。此外,在能够使用结合有抗cd200抗体的磁性微珠的情况下,能够省略利用抗cd200抗体对细胞进行染色的操作。接着,可列举出如下方法:利用抗ssea4抗体对回收的cd200阴性细胞群进行染色,使其与能够结合于该抗ssea4抗体的磁性微珠(例如,结合有抗免疫球蛋白抗体的磁性微珠)接触后,通入磁性细胞分离装置的磁性柱,将保持在柱内的细胞回收并作为cd200阴性/ssea-4阳性细胞。保持在柱内的细胞能够通过使柱从磁场分离并用适当的缓冲溶液进行洗脱而回收。抗ssea4抗体可被标记,在使用标记抗ssea4抗体的情况下,能够使用与标记物结合的磁性微珠。此外,在能够使用结合有抗ssea4抗体的磁性微珠的情况下,能够省略利用抗ssea4抗体对细胞进行染色的操作。工序(3)中,使工序(2)中获得的细胞与选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段接触,获得粘附细胞。此外,也可以使工序(2)中获得的细胞与具有α2链的层粘连蛋白或其e8接触而获得非粘附细胞,使得到的非粘附细胞与选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段接触,获得粘附细胞。进一步,也可以不立刻剥离并回收粘附于选自由具有α3链的层粘连蛋白、具有α4链的层粘连蛋白及具有α5链的层粘连蛋白组成的组中的层粘连蛋白或其e8片段的细胞,去除非粘附细胞并直接在层粘连蛋白或其e8片段上继续培养,然后再回收其后繁殖的细胞。能够用于移植用角膜上皮细胞片的制作的高纯度的角膜上皮细胞群由工序(3)中获得的细胞构成。层粘连蛋白为由α链、β链及γ链的3条亚链组成的异三聚体分子。已知α链为α1~α5的5种、β链为β1~β3的3种、γ链为γ1~γ3的3种,它们的组合中至少存在12种以上的亚型(参见表1)。本说明书中,层粘连蛋白的各亚型例如记作层粘连蛋白111。此外,在本说明书中,仅记作“层粘连蛋白”时,意为“全长层粘连蛋白”。[表1]层粘连蛋白e8片段(以下,记作“层粘连蛋白e8”或“e8”)为形成利用弹性蛋白酶将小鼠层粘连蛋白111消化而得到的异三聚体的片段,其被鉴定为具有强细胞粘附活性的片段(edgardetal.,j.cellbiol.,105:589-598,1987)。虽然推测利用弹性蛋白酶对除小鼠层粘连蛋白111以外的层粘连蛋白进行消化时,也存在有相当于小鼠层粘连蛋白111-e8的片段,但并没有利用弹性蛋白酶消化除小鼠层粘连蛋白111以外的层粘连蛋白并分离、鉴定e8的报告。因此,用于本发明的制造方法的层粘连蛋白e8不需要为层粘连蛋白的弹性蛋白酶消化产物,只要为具有与小鼠层粘连蛋白111-e8同样的细胞粘附活性、具有类似的结构的层粘连蛋白片段即可。层粘连蛋白e8为从α链的c末端片段去除球状结构域4及5而成的片段(α链e8)、β链的c末端片段(β链e8)及γ链的c末端片段(γ链e8)形成三聚体的片段。虽然三聚体的分子量并无特殊限定,但通常为约150~约170kda。从γ链e8的c末端部分数起的第三位的谷氨酸残基对层粘连蛋白e8的整合素结合活性而言是必须的(hiroyukiidoetal.,thejournalofbiologicalchemistry,282,11144-11154,2007)。虽然层粘连蛋白可为任意生物的层粘连蛋白,但是优选为哺乳动物的层粘连蛋白。层粘连蛋白e8也相同。作为哺乳动物,例如可列举出人类、小鼠、大鼠、牛、猪等,但是并无限定。其中优选人类。其理由在于,为了制造用于制作对人安全的移植用角膜上皮细胞片的角膜上皮细胞群,要求在制造工序中排除使用来自不同种生物的成分。层粘连蛋白可为天然型,也可为维持其生物学活性且1个或1个以上的氨基酸残基被修饰的修饰型。层粘连蛋白e8也相同。层粘连蛋白的制造方法并无特殊限定,例如可列举出从层粘连蛋白高表达细胞纯化的方法,或以重组蛋白质的形式进行制造的方法等。层粘连蛋白e8的制造方法也无特殊限定,例如可列举出利用弹性蛋白酶等蛋白质分解酶消化全长层粘连蛋白并对目标片段进行分拣、纯化的方法,或以重组蛋白质的形式进行制造的方法等。从制造量、品质的均匀性、制造成本等角度出发,优选层粘连蛋白及层粘连蛋白e8均以重组蛋白质的形式进行制造。通过适当地使用公知的基因重组技术,能够制造重组层粘连蛋白、重组层粘连蛋白e8。作为重组层粘连蛋白、重组层粘连蛋白e8的制造方法,例如能够通过下述方式进行制造:分别获得编码α链、β链及γ链的各全长蛋白质的dna或编码各个链的e8片段的dna,将其分别插入表达载体,将得到的3种表达载体共同导入适当的宿主细胞并使其表达,利用公知的方法纯化形成三聚体的蛋白质。作为重组层粘连蛋白(全长)的制造方法,例如可列举出井户等人(hiroyukiidoetal.,thejournalofbiologicalchemistry,279,10946-10954,2004)的方法等,但并不限定于此。作为重组层粘连蛋白e8的制造方法,例如可列举出井户等人(hiroyukiidoetal.,thejournalofbiologicalchemistry,282,11144-11154,2007)的方法,但并不限定于此。编码构成主要的哺乳动物的层粘连蛋白的α链、β链、γ链的基因的碱基序列信息及各个链的氨基酸序列信息能够从公知的数据库(genbank等)获得。表2示出了构成人类的层粘连蛋白的各个链的登录号。除此以外的各种生物的层粘连蛋白构成链的碱基序列信息及氨基酸序列信息也同样能够从公知的数据库(genbank等)获得。[表2]氨基酸序列碱基序列人层粘连蛋白α1链np_005550nm_005559人层粘连蛋白α2链np_000417nm_000426人层粘连蛋白α3链np_000218nm_000227人层粘连蛋白α4链np_002281nm_002290人层粘连蛋白α5链np_005551nm_005560人层粘连蛋白β1链np_002282nm_002291人层粘连蛋白β2链np_002283nm_002292人层粘连蛋白β3链np_000219nm_000228人层粘连蛋白γ1链np_002284nm_002293人层粘连蛋白γ2链np_005553nm_005562人层粘连蛋白γ3链np_006050nm_006059具有α2链的层粘连蛋白包含层粘连蛋白211及层粘连蛋白221。具有α3链的层粘连蛋白包含层粘连蛋白332、层粘连蛋白311及层粘连蛋白321。具有α4链的层粘连蛋白包含层粘连蛋白411及层粘连蛋白421。具有α5链的层粘连蛋白包含层粘连蛋白511及层粘连蛋白521。作为为了获得非粘附细胞而使用的层粘连蛋白或层粘连蛋白e8,优选层粘连蛋白211e8。作为为了获得粘附细胞而使用的层粘连蛋白或层粘连蛋白e8,优选层粘连蛋白332e8、层粘连蛋白411e8或层粘连蛋白511e8,更优选层粘连蛋白332e8或层粘连蛋白511e8。在工序(3)中,使细胞与层粘连蛋白或层粘连蛋白e8接触的方法并无特殊限定。例如可列举出将层粘连蛋白或层粘连蛋白e8涂布在培养用陪替氏培养皿等培养容器的培养面,向其中添加细胞悬液,静置一定时间的方法。此外,可列举出将层粘连蛋白或层粘连蛋白e8涂布于例如微珠等载体,将该载体加入包含工序(1)中制备的角膜上皮细胞的细胞群的细胞悬液而使其接触的方法。层粘连蛋白或层粘连蛋白e8的涂布浓度并无特殊限定,只要适当地选择使用能够达到目的的涂布浓度即可。例如,能够在约0.1~约2.0μg/cm2的范围内进行选择。涂布层粘连蛋白e8的情况下,可为约0.25~约1.0μg/cm2,也可为约0.5~约1.0μg/cm2。使层粘连蛋白或层粘连蛋白e8与细胞接触的时间并无特殊限定,只要能够根据所使用的涂布浓度适当地选择达到目的的时间即可。在本发明的制造方法中使用层粘连蛋白e8的情况下,通常在约1分钟~约30分钟的范围内进行选择。优选为约3分钟~约20分钟。回收未粘附于层粘连蛋白或层粘连蛋白e8的细胞(非粘附细胞)的方法并无特殊限定。在使用涂布有层粘连蛋白或层粘连蛋白e8的培养容器的情况下,例如,通过离心分离等对利用pbs等多次清洗回收的培养基及涂布表面而得到的清洗液中所包含的细胞进行回收。在将涂布有层粘连蛋白或层粘连蛋白e8的载体加入细胞悬液的情况下,能够通过离心分离等回收残留于回收过载体的细胞悬液中的细胞。回收粘附于层粘连蛋白或层粘连蛋白e8的细胞(粘附细胞)的方法并无特殊限定,能够适当地选择使用剥离粘附细胞的公知的方法。在使用涂布有层粘连蛋白或层粘连蛋白e8的培养容器的情况下,例如,能够在去除非粘附细胞后,通过在层粘连蛋白或层粘连蛋白e8的涂布面添加edta液、胰蛋白酶液等公知的细胞剥离用溶液并进行移液等来使细胞剥离,从而进行回收。在使用涂布有层粘连蛋白或层粘连蛋白e8的载体的情况下,能够通过向细胞剥离用溶液中加入载体并进行移液等来使细胞剥离,从而进行回收。在使用涂布有层粘连蛋白或层粘连蛋白e8的培养容器并直接培养粘附细胞的情况下,只要去除非粘附细胞即可。通过本发明的制造方法制造的细胞群若直接培养,则为能够制作移植用角膜上皮细胞片的高纯度的角膜上皮细胞群。此处,要求“用于制作移植用角膜上皮细胞片的角膜上皮细胞群”由对制作至少一个眼(单眼)用的角膜上皮细胞片而言所必要的1×105个以上的细胞构成。但是,如果考虑本申请发明在产业上的利用,则期望“用于制作移植用角膜上皮细胞片的角膜上皮细胞群”具有对制作多个眼用的角膜上皮细胞片而言所必要的细胞数。因此,构成“用于制作移植用角膜上皮细胞片的角膜上皮细胞群”的细胞数优选为2×105个以上、4×105个以上、6×105个以上、8×105个以上、1×106个以上。此外,“用于制作移植用角膜上皮细胞片的角膜上皮细胞群”的不纯细胞的含有率优选小于50%,优选小于45%、小于40%、小于35%、小于30%。移植用角膜上皮细胞片能够通过下述方式制作:在使用6孔板的情况下以1.5×105~6.0×105个细胞/孔接种通过本发明的制造方法制造的细胞群、在使用12孔板的情况下以0.5×105~1.0×105个细胞/孔接种通过本发明的制造方法制造的细胞群,培养5~12天直到融合为止。通过本发明的制造方法制造的细胞群中的角膜上皮细胞的纯度,能够通过测定相对于细胞群的总细胞数的、cd200阴性/ssea-4阳性/itgb4阳性细胞数而求出。然而,将在本发明的制造方法的工序(3)中粘附于层粘连蛋白或层粘连蛋白e8的细胞从陪替氏培养皿剥离并供于facs分选时,细胞表面的标记蛋白因用于剥离的酶等受到损伤,结果在特异性抗体不能识别标记蛋白的情况下,无法正确测定cd200阴性/ssea-4阳性/itgb4阳性细胞的细胞数。因此,本发明中,也可根据在工序(3)中粘附于层粘连蛋白或层粘连蛋白e8的细胞中的pax6阳性/p63阳性细胞的比例求出角膜上皮细胞的纯度。已知pax6为眼关联转录因子,p63为上皮干细胞标记物。本申请的发明人确认到,由cd200阴性/ssea-4阳性/itgb4阳性细胞制作的细胞片中,pax6及p63均为阳性(参见参考例1的图2、实施例1的图10)。求出粘附于层粘连蛋白或层粘连蛋白e8的细胞中的pax6阳性/p63阳性细胞的比例的方法并无特殊限定,例如,能够通过下述方式算出:用多聚甲醛等固定粘附状态的细胞、并用抗pax6抗体及抗p63抗体进行染色,进一步用hoechst33342或dapi等对核进行染色后,计数核被染色的总细胞数以及pax6与p63均为阳性的共阳性细胞数。粘附于层粘连蛋白或层粘连蛋白e8的细胞中的pax6阳性/p63阳性细胞的比例为50%以上即可,也可为55%以上、60%以上、65%以上、70%以上。如果使用本发明的制造方法,则能够在更短时间内大量地制造纯度与通过facs分选分离cd200阴性/ssea-4阳性/itgb4阳性细胞而制备的角膜上皮细胞群相当的角膜上皮细胞群。例如,将角膜上皮细胞率为5%左右的细胞群供于sony制造的细胞分选仪sh800,通过facs分选制造用于制作移植用角膜上皮细胞片的角膜上皮细胞群时,为了获得对制作一个眼(单眼)用的角膜上皮细胞片而言所必要的1×105个的cd200阴性/ssea-4阳性/itgb4阳性细胞,认为最初的细胞群的细胞数需要为2×106个以上,分选需要30分钟~1小时左右。另一方面,在为本发明的制造方法、即为macs法与层粘连蛋白或层粘连蛋白e8粘附法的组合的情况下,市售的磁性细胞分离装置能够以更短时间处理细胞数比供于上述facs分选的细胞数(2×106个)高1~2个数量级(order)的细胞群。层粘连蛋白或层粘连蛋白e8粘附法可通过增加板数而在短时间内处理大量的细胞。因此,本发明的制造方法为比facs分选更适于实用化及产业化的非常有用的制造方法。此外,若使用本发明的制造方法,则能够制造比利用facs分选进行纯化而得到的角膜上皮细胞群更安全且损伤少的角膜上皮细胞群。通过facs分选回收的细胞的损伤大是公知的,在以往,寻求利用与facs分选不同的方法获得同等纯度的细胞群。通过将macs法与层粘连蛋白或层粘连蛋白e8粘附法组合,本发明的制造方法能够制造纯度与facs分选相当的角膜上皮细胞群。并且,由于本发明的制造方法具有获得粘附于特定的层粘连蛋白或层粘连蛋白e8的细胞的工序,因此能够期望细胞被活化、存活率(viability)得以提高。层粘连蛋白或层粘连蛋白e8与细胞经由细胞表面的整合素而粘附。已知这种依赖整合素的对层粘连蛋白的细胞粘附抑制细胞的凋亡、维持细胞的生存,同时激活促进细胞增殖的细胞内信号传导通路(gujetal.thejournalofbiologicalchemistry277:19922-19928,2002)。因此,与facs分选相比,本发明的制造方法具有如下较大优点,即能够制造处于维持了高存活率的状态的角膜上皮细胞群。通过本发明的制造方法制造的角膜上皮细胞群能够直接用作移植用角膜上皮细胞片的制造原料。因此,本申请发明中包含移植用角膜上皮细胞片的制造方法,其包括培养通过本发明的制造方法制造的角膜上皮细胞群的工序。用于由通过本发明的制造方法制造的角膜上皮细胞群来制造移植用角膜上皮细胞片的培养方法并无特殊限定。例如,能够通过下述方式制作:在使用6孔板的情况下以1.5×105~6.0×105个细胞/孔接种通过本发明的制造方法制造的细胞群、在使用12孔板的情况下以0.5×105~1.0×105个细胞/孔接种通过本发明的制造方法制造的细胞群,通过培养5~12天直到融合为止。培养基交换优选以2天1次的频率进行。板能够使用常规的细胞培养用板。此外,也可使用细胞片回收用温度响应性细胞培养(cellseedinc.公司制造的“upcell(商品名称)”)。实施例以下,通过实施例对本发明进行详细说明,但是本发明并非限定于此。[参考例1:基于facs分选的cd200阴性/ssea-4阳性/itgb4阳性细胞的分离与角膜上皮细胞标记物的分析](1)从ips细胞出发的眼周围细胞的分化诱导从ips细胞出发的眼周围细胞的分化诱导中使用了自我形成外胚层自主性多区结构(self-formedectodermalautonomousmulti-zone)(seam)法(hayashietal.nature.2016mar17;531(7594):376-80.)。将人ips细胞株(201b7)以300-440个细胞/cm2的密度接种于以0.5μg/cm2的浓度涂布了层粘连蛋白511e8(i-matrix;nippi)的6或12孔板,在stemfit培养基(味之素)中维持8-10天后,在分化培养基(dm;含10%knockout血清替代物(ksr,lifetechnologies)、1mm丙酮酸钠(lifetechnologies)、0.1mm非必需氨基酸(lifetechnologies)、2mml-谷氨酰胺(lifetechnologies)、1%青链霉素溶液(lifetechnologies)及55μm2-巯基乙醇(lifetechnologies)的gmem(lifetechnologies))中培养4周。接着,在角膜分化培养基(cdm;含20ng/ml的kgf(wako)、10μmy-27632(wako)、1%青链霉素溶液的dm与cnt-20或cnt-pr(不含egf及fgf2)(cellntecadvancedcellsystems)的1:1混合培养基)中培养4周后,进一步在角膜上皮维持培养基(cem;含2%b27细胞培养添加剂(lifetechnologies)、1%青链霉素溶液、20ng/mlkgf,10μmy-27632的dmem/f12(2:1)(lifetechnologies))中培养2-5周。(2)经分化诱导的眼周围细胞悬液的制备使用accutase(lifetechnologies)对分化诱导后的细胞进行处理,再悬浮于kcm培养基(含5%fbs(japanbioserum,hiroshima,japan)、0.4μg/ml琥珀酸氢化考的松(wako)、2nm3,3’,5-三碘-l-甲状腺原氨酸钠盐(mpbiomedicals,santaana,ca)、1nm霍乱霉素(listbiologicallaboratory,campbell,ca)、2.25μg/ml牛饱和铁转铁蛋白(bovinetransferrinholoform)(lifetechnologies)、2mml-谷氨酰胺、0.5%转铁蛋白胰岛素硒溶液(lifetechnologies)、1%青链霉素的dmem/f-12,无谷氨酰胺(thermofisherscientific))。使其通过细胞筛(40μm,bdbiosciences,sandiego,ca),将用pbs制备的眼周围细胞悬液供于以后的工序。(3)基于facs分选的cd200阴性/ssea-4阳性/itgb4阳性细胞的分离利用pe-cy7标记抗cd200抗体(bdpharmingen)、fitc标记抗ssea-4抗体(biolegend)及alexafluor647标记抗cd104抗体(抗itgb4抗体)(biolegend或bdpharmingen)对上述(2)中制备的眼周围细胞悬液进行染色后,供于facsverse(bdbiosciences),如图1所示,回收cd200阴性细胞(图1的(a)的虚线包围的部分),进一步回收ssea-4及itgb4共阳性细胞(图1的(b)的虚线包围的p3部分)。(4)cd200阴性/ssea-4阳性/itgb4阳性细胞的形态及角膜上皮标记物的表达将回收的cd200阴性/ssea-4阳性/itgb4阳性细胞以1×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了层粘连蛋白511e8(i-matrix;nippi)的12孔板,在角膜上皮维持培养基中培养3周。通过相差显微镜观察细胞的形态后,去除培养基,利用pbs进行清洗,添加2.4u/ml的含分散酶的dmem(lifetechnologies)并在37℃下孵育10分钟。去除培养基,使用pvdf膜环(membranering)回收片,包埋于oct化合物,制作冷冻切片。在载玻片上用第一抗体(抗k12抗体(n-16,santacruz)、抗pax6抗体(prb-278p,covance)、抗p63抗体(4a4,santacruz))在4℃下孵育过夜。利用tbs清洗后,用第二抗体(分别为alexafluor488,568,647标记抗体)在室温下孵育1小时,利用tbs清洗后,利用荧光显微镜(axioobserverd1)进行观察。(5)结果将结果示于图2。(a)为利用相差显微镜观察培养3周后的细胞的结果,(b)为对角膜上皮细胞片中的标记基因的表达进行分析的结果。如(a)所示,利用相差显微镜观察培养3周后的细胞时,均匀的细胞多层化而形成片,未观察到由不纯细胞生成的菌落。此外,如(b)所示,得到的细胞片表达作为上皮干细胞标记物的p63、作为眼关联转录因子的pax6以及在角膜上皮特异性表达的k12(角蛋白12)。能够确认到形成了角膜上皮细胞片。[参考例2:基于磁性细胞分离的角膜上皮细胞的纯化](1)抗体染色利用pe-cy7标记抗cd200抗体(bdpharmingen)、fitc标记抗ssea-4抗体(biolegend)及pe标记抗cd104抗体(抗itgb4抗体)(biolegend或bdpharmingen)对参考例1的(1)及(2)中制备的眼周围细胞悬液进行染色后,将细胞再悬浮于macs缓冲液(含0.5%bsa及2mmedta的pbs),供于磁性细胞分离装置(miltenyibiotec)。在前期的cd200阳性细胞的去除中,利用抗cy7微珠(miltenyibiotec)在4℃下标记15分钟后,利用macs缓冲液进行清洗,通过设置于磁场的ms柱或ls柱(miltenyibiotec)去除标记细胞,回收非标记细胞。在后期的ssea-4阳性细胞的分拣中,利用抗fitc微珠(miltenyibiotec)在4℃下标记15分钟后,利用macs缓冲液进行清洗,通过设置于磁场的ms柱或ls柱,并利用macs缓冲液清洗柱后,使被捕集在柱上的细胞远离磁场,使用macs缓冲液进行回收。(2)facs分析将抗体染色后macs分离前的细胞群、利用macs去除了cd200阳性细胞的细胞群以及利用macs从去除cd200阳性细胞后的细胞中回收了ssea-4阳性细胞的细胞群供于细胞分选仪sh800(sony)或facsverse(bdbiosciences),分析各标记物的阳性率。(3)结果将结果示于图3及图4。图3及图4均为显示facs分析的结果的图,图中bulk为抗体染色后macs分离前的细胞群、耗尽cd200(cd200depletion)为利用macs去除了cd200阳性细胞的细胞群、macs后(图3)及耗尽cd200/选择ssea4(图4)为利用macs从去除cd200阳性细胞后的细胞中回收了ssea-4阳性细胞的细胞群的结果。图4中,ssea4+为在图3上段的各直方图的垂直线右侧的细胞的比率,itgb4+为在图3上段的各直方图的水平线上侧的细胞的比率,ssea4+/itgb4+为在图3上段的各直方图的右上部分的细胞的比率,cd200+为在图3下段的各直方图的横曲线上侧的细胞的比率。图3及图4显示:虽然在利用macs从去除cd200阳性细胞后的细胞中回收了ssea-4阳性细胞的细胞群中,ssea-4及itgb4共阳性细胞以高比率存在,但是仍残留有cd200阳性细胞。[参考例3:利用层粘连蛋白e8的角膜上皮细胞的纯化](1)层粘连蛋白e8使用层粘连蛋白111e8(以下记作“ln111e8”。其他层粘连蛋白e8也以相同方式记载)、ln211e8、ln332e8、ln411e8及ln511e8这5种层粘连蛋白e8。ln511e8(i-matrix;nippi)使用市售品,除ln511e8以外,接受来自大阪大学的关口清俊教授的共享。(2)板的涂布以1ml/孔向12孔板(bdfalcon)中添加pbs,以使涂布浓度为0.5μg/cm2的方式添加各亚型的层粘连蛋白e8,在37℃下静置1-3小时来进行涂布。(3)非粘附细胞的facs分析以与参考例2的(1)相同的方式,利用pe-cy7标记抗cd200抗体(bdpharmingen)、fitc标记抗ssea-4抗体(biolegend)及pe标记抗cd104抗体(抗itgb4抗体)(biolegend或bdpharmingen)对参考例1的(1)及(2)中制备的眼周围细胞悬液进行染色后,悬浮于角膜上皮维持培养基,以5×105个细胞/孔接种于上述涂布板。作为对照,使用未进行任何涂布的板。在37℃下孵育5-30分钟后,回收非粘附细胞。用pbs将回收的细胞再悬浮,利用细胞分选仪sh800(sony)进行facs分析。另外,发明人确认到,即使预先使抗体结合于细胞,本实验中使用的抗itgb4抗体也不会影响细胞与层粘连蛋白e8的粘附。(4)结果将非粘附细胞的facs分析结果示于图5。图中,bulk为抗体染色后未接种于板的细胞群、no为接种于未进行涂布的板的细胞群。结果,将各处理组中的ssea4+、itgb4+、ssea4+/itgb4+及cd200+组分的比例以相对于bulk中的它们的比例的比率进行表示。根据图5可知,相对于ln332e8(图中为ln332)、ln411e8(图中为ln411)及ln511e8(图中为ln511)的非粘附细胞中,cd200阳性细胞的比例增加,ssea4阳性细胞、itgb4阳性细胞及ssea4/itgb4共阳性细胞的比例降低。与此不同,相对于ln211e8(图中为ln211)的非粘附细胞中,虽然cd200阳性细胞的比例与bulk相同,但是显示出itgb4阳性细胞、ssea4及itgb4共阳性细胞的比例增加的倾向。相对于no、ln111e8(图中为ln111)的非粘附细胞几乎与bulk相同。该结果暗示了:通过去除相对于ln332e8、ln411e8及ln511e8的非粘附细胞,能够提高ssea4/itgb4共阳性的纯度的可能性。[参考例4:利用ln211e8的角膜上皮细胞的纯化](1)板的涂布以1ml/孔向12孔板(bdfalcon)中添加pbs,以使涂布浓度为0.5-5.0μg/cm2的方式添加ln211e8,在37℃下静置1-3小时来进行涂布。(2)非粘附细胞的角膜上皮细胞率以与参考例2的(1)相同的方式,利用pe-cy7标记抗cd200抗体(bdpharmingen)、fitc标记抗ssea-4抗体(biolegend)及pe标记抗cd104抗体(抗itgb4抗体)(biolegend或bdpharmingen)对参考例1的(1)及(2)中制备的眼周围细胞悬液进行染色后,悬浮于角膜上皮维持培养基,以5×105个细胞/孔接种于上述涂布板。作为对照,使用未进行任何涂布的板。在37℃下孵育10分钟后,回收非粘附细胞。用pbs将回收的细胞再悬浮,利用细胞分选仪sh800(sony)进行facs分析,算出cd200阴性/ssea-4阳性/itgb4阳性细胞率(角膜上皮标记物阳性率)。(3)结果将结果示于图6。图中bulk为抗体染色后未接种于板的细胞群。由于ln211e8非粘附细胞的角膜上皮标记物阳性率变得比原来的细胞群及未进行任何涂布的板的角膜上皮标记物阳性率更高,因此暗示了:通过回收未粘附于ln211e8的细胞,能够提高ssea4/itgb4共阳性细胞的纯度的可能性。(4)粘附细胞的基因表达分析使用qiazol裂解试剂(qiagen)从残留于回收了非粘附细胞的板的粘附细胞中提取rna,在总量为20μl的反应体系中,使用taqmanassay(lifetechnologies),对使用用于qrt-pcr的superscriptiii第一链合成supermix制作的cdna进行qrt-pcr。作为角膜上皮标记基因,分析了k12及tp63。作为非角膜上皮标记基因,分析了itga7及波形蛋白。(5)结果将结果示于图7。(a)为k12、(b)为tp63、(c)为itga7、(d)为波形蛋白的结果。粘附于ln211e8(图中为211)的细胞中,作为角膜上皮标记基因的k12及tp63的表达量低,作为非角膜上皮标记基因的itga7及波形蛋白的表达量高。该结果表明,通过使用ln211e8涂布板去除粘附细胞并回收非粘附细胞,能够提高ssea4/itgb4共阳性细胞的纯度。[实施例1:基于磁性细胞分离与层粘连蛋白e8粘附法的组合的角膜上皮细胞的纯化]1-1角膜上皮细胞的纯化(1)基于磁性细胞分离的纯化利用pe-cy7标记抗cd200抗体(bdpharmingen)对参考例1的(1)及(2)中制备的眼周围细胞悬液进行染色后,再悬浮于macs缓冲液,供于磁性细胞分离装置(miltenyibiotec)。首先,去除cd200阳性细胞,接着分拣ssea-4阳性细胞。cd200阳性细胞的去除中,利用抗cy7微珠(miltenyibiotec)在4℃下标记15分钟后,利用macs缓冲液进行清洗,通入设置于磁场的ms柱或ls柱(miltenyibiotec)来去除标记细胞,回收非标记细胞。分拣ssea-4阳性细胞时,利用抗ssea4微珠在4℃下标记15分钟后,使用macs缓冲液进行清洗,通入设置于磁场的ms柱或ls柱,利用macs缓冲液清洗柱后,使被捕集在柱上的细胞远离磁场,使用macs缓冲液进行回收。(2)基于层粘连蛋白e8粘附法的纯化将由磁性细胞分离得到的纯化后的细胞以约5×105个细胞/孔接种于ln511e8涂布板(涂布浓度:0.5μg/cm2),在37℃下孵育5分钟后,去除非粘附细胞。1-2基因表达分析(1)实验方法分析各阶段的细胞群中的角膜上皮标记基因及非角膜上皮标记基因的表达。具体而言,对参考例1的(1)及(2)中制备的眼周围细胞群(bulk)、通过磁性细胞分离去除了cd200阳性细胞的细胞群(耗尽cd200)以及通过磁性细胞分离分拣了ssea-4阳性细胞的细胞群(macs1后)、磁性细胞分离后粘附于ln511e8涂布板的细胞群(mls(511))进行基因分析。作为对照,使用了利用facs进行了纯化的cd200阴性/ssea-4阳性/itgb4阳性细胞群。使用qiazol裂解试剂(qiagen)从各细胞群中提取rna,在总量为20μl的反应体系中,使用taqmanassay(lifetechnologies)对使用用于qrt-pcr的superscriptiii第一链合成supermix制作的cdna进行qrt-pcr。作为角膜上皮标记基因,分析了k12、pax6、tp63及itgb4。作为非角膜上皮标记基因,分析了cryaa、rpe65、cd200及k10。(2)结果将结果示于图8。上段(k12、pax6、tp63、itgb4)为角膜上皮标记基因,下段(cryaa、rpe65、cd200、k10)为非角膜上皮标记基因。组合磁性细胞分离与层粘连蛋白e8粘附法而纯化的细胞群(图中为mls(511))中,角膜上皮标记基因(上段)的表达量与对照为大致相同的水平,除了k10稍微表达以外,非角膜上皮标记基因(下段)的表达量在检测极限以下。1-3角膜上皮细胞片的制作(1)实验方法将在上述(2)中粘附于ln511e8涂布板的细胞直接培养3周,结果,均匀的细胞增殖为融合的状态。将利用相差显微镜观察细胞形态的结果示于图9。去除培养基,利用pbs进行清洗,添加2.4u/ml的含分散酶的dmem(lifetechnologies)并在37℃下孵育10分钟。去除培养基,使用pvdf膜环回收片,包埋于oct化合物,制作冷冻切片。在载玻片上用第一抗体(抗k12抗体(n-16,santacruz)、抗pax6抗体(prb-278p,covance)、抗muc16抗体(ov185:1,abcam)、抗p63抗体(4a4,santacruz))在4℃下孵育过夜。利用tbs清洗后,用第二抗体(分别为alexafluor488,568,647标记抗体)在室温下孵育1小时。利用hoechst33342(molecularprobes)在室温下进行对比染色10分钟,利用tbs清洗后,利用荧光显微镜(axioobserverd1)进行观察。(2)结果将结果示于图10。得到的细胞片的k12、pax6、muc16及p63全部为阳性,能够确认到形成了角膜上皮细胞片。1-4构成角膜上皮细胞片的细胞的facs分析(1)实验方法利用accutase、在37℃下,将在上述1-3中在ln511e8涂布板上培养了3周的细胞孵育1小时并剥离细胞,使其单一地分散。利用pbs清洗后,加入bdcytofix/cytoperm溶液(bdbiosciences),在4℃下孵育20分钟来进行固定。接着,利用bdperm/wash缓冲液(bdbioscineces)清洗并再悬浮后,利用第一抗体(抗k12抗体(n-16,santacruz)、抗k14抗体(rck107,abcam))及荧光标记第二抗体进行染色,利用pbs清洗并再悬浮后,使用facsverse(bdbioscinences)进行分析。在为抗k12抗体的情况下,在4℃下使其反应3小时后,使第二抗体在4℃下反应1小时。在为抗k14抗体的情况下,同时添加二次抗体,在室温下使其反应2小时。作为对照,使用将利用facs分选分离的cd200阴性/ssea-4阳性/itgb4阳性细胞在ln511e8涂布板上培养了3周的细胞(参见参考例1),同样地进行剥离、分散及固定后,进行抗体染色,使用facsverse(bdbioscinences)进行分析。(2)结果将结果示于图11。上段(分选)为利用facs分选分离的cd200阴性/ssea-4阳性/itgb4阳性细胞的结果,下段(mls)为通过本发明的方法获得的细胞群的结果。各直方图的左侧的峰为同种型对照的峰。使用通过本发明的方法而获得的细胞群制作的细胞片的复层上皮标记物k14及作为角膜上皮特异性角蛋白的k12的阳性率,与使用通过facs分选而获得的细胞群制作的细胞片相同或在其以上。1-5利用相差显微镜的角膜上皮细胞片的观察(1)实验方法将以下6种细胞培养3周来制作细胞片,利用相差显微镜进行观察。(a)仅macs将利用与上述1-1(1)相同的方法回收的细胞以1×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln511e8(i-matrix;nippi)的12孔板,用角膜上皮维持培养基培养3周。(b)仅ln332将参考例1的(1)及(2)中制备的眼周围细胞悬液以约5×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln332e8的12孔板,在37℃下孵育15分钟后,去除非粘附细胞,然后直接用角膜上皮维持培养基培养3周。(c)仅ln511将参考例1的(1)及(2)中制备的眼周围细胞悬液以约5×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln511e8的12孔板,在37℃下孵育15分钟后,去除非粘附细胞,然后直接用角膜上皮维持培养基培养3周。(d)分选将利用facs分选分离的cd200阴性/ssea-4阳性/itgb4阳性细胞以1×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln511e8的12孔板,用角膜上皮维持培养基培养3周(参见参考例1)。(e)mls(322):通过本发明的制造方法获得的角膜上皮细胞群将利用与上述1-1(1)相同的方法回收的细胞以约5×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln332e8的12孔板,在37℃下孵育5分钟后,去除非粘附细胞,然后直接用角膜上皮维持培养基培养3周。(f)mls(511):通过本发明的制造方法获得的角膜上皮细胞群将利用与上述1-1(1)相同的方法回收的细胞以约5×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln511e8的12孔板,在37℃下孵育15分钟后,去除非粘附细胞,然后直接用角膜上皮维持培养基培养3周。(2)结果将结果示于图12。在上段的(a)仅macs、(b)仅ln332、(c)仅ln511的视野中观察到了不纯细胞菌落,而在(d)分选、(e)mls(322)、(f)mls(511)中,未在形成片的细胞中观察到不纯细胞菌落。1-6纯化效率的评价(1)纯化效率的算出方法对于参考例2的macs前后的细胞群,使用facs求出除cd200阴性/ssea-4阳性/itgb4阳性细胞(角膜上皮细胞)以外的细胞(不纯细胞)的比例(%)。根据各个细胞群中的不纯细胞的比例,利用以下的计算式算出纯化效率(不纯细胞残留率)。纯化效率=macs后的不纯细胞率(%)/macs前的不纯细胞率(%)×100对于参考例3的利用层粘连蛋白e8的纯化(层粘连蛋白e8粘附法)前后的细胞群,使用facs求出除cd200阴性/ssea-4阳性/itgb4阳性细胞(角膜上皮细胞)以外的细胞(不纯细胞)的比例(%)。具体而言,将纯化前的细胞群以5×105个细胞/孔接种于以0.5μg/cm2的浓度涂布了ln332e8、ln411e8或ln511e8的12孔板(bdfalcon),在37℃下孵育5分钟后,去除非粘附细胞。直接培养3周后,剥掉细胞并进行分散至成为单一细胞,进行抗体染色供于facs。根据各个细胞群中的不纯细胞的比例,利用以下的计算式算出纯化效率(不纯细胞残留率)。纯化效率=通过层粘连蛋白e8粘附法进行纯化后培养了3周的细胞群的不纯细胞率(%)/纯化前的不纯细胞率(%)×100将macs后的细胞群供于层粘连蛋白e8粘附法,其后培养3周的细胞群的纯化效率的理论值通过乘以各自的纯化效率而求出。另一方面,实测值通过目视观察存在于培养3周后的细胞片的不纯细胞菌落数而求出。(2)结果将结果示于表3。在macs中,能够使不纯细胞减少到分离前的26.75%。另一方面,层粘连蛋白e8粘附法中,在使用最有效的ln332e8的情况下,能够使不纯细胞减少到分离前的74.14%,而在使用ln411e8或ln511e8的情况下,并未使不纯细胞减少。关于根据它们的实测值算出的理论值,虽然在为macs与ln332e8的组合的情况下,纯化效率为19.83%,在为macs与ln511e8的组合的情况下,纯化效率为27.37%,但是培养这些细胞3周而得到的细胞片中,均不存在不纯细胞菌落(不纯细胞残留率:0%)。其结果证实了:将基于层粘连蛋白e8粘附法的纯化应用于存在大量除角膜上皮细胞以外的细胞(不纯细胞)的、分化诱导后的眼周围细胞悬液(参见参考例1)时,纯化效率低,但是如果应用于预先利用macs使不纯细胞率降低到20%左右的细胞群,则能够几乎完全去除不纯细胞。[表3][实施例2:通过磁性细胞分离与层粘连蛋白e8粘附法的组合而纯化的角膜上皮细胞群中的p63阳性细胞的定量](1)实验方法使用作为上皮干细胞标记物的p63的egfp共表达基因敲入ips细胞(stemcellres.2017oct31;25:256-265.doi:10.1016/j.scr.2017.10.015.),利用与参考例(1)相同的方法,由该ips细胞分化诱导眼周围细胞,利用与参考例(2)相同的方法制备眼周围细胞悬液。将眼周围细胞以1×105个细胞/孔接种于以1μg/cm2的浓度涂布了ln211e8的12孔板(bdfalcon),在37℃下孵育15分钟。回收非粘附细胞,接种于以1μg/cm2的浓度涂布了ln332e8或ln511e8的12孔板(bdfalcon)。将从ln211e8涂布板的1个孔中回收的全部非粘附细胞接种于ln332e8或ln511e8涂布板的1个孔。在37℃下孵育15分钟后,在一部分的孔中去除非粘附细胞并仅继续培养粘附细胞,剩余的孔不去除非粘附细胞而继续培养。添加培养基并直接继续培养粘附于ln211e8涂布板的细胞。1天后,拍摄各孔的相差显微镜图像与荧光显微镜图像。进一步,通过荧光显微镜的100倍观察对所获得的5个视野中的总细胞数与gfp表达细胞(p63阳性细胞)数进行计数,算出p63阳性细胞率。(2)实验结果将显微镜观察图像示于图13。图中上段(phase)为相差显微镜图像、中段(p63(egfp))为荧光显微镜图像、下段(merged)为上段和中段叠加的图像。图中,211ad为将粘附于ln211e8的细胞直接培养的孔、332为利用ln332e8培养ln211e8非粘附细胞的孔、332ad为利用ln332e8培养ln211e8非粘附细胞并去除了非粘附细胞的孔、511为利用ln511e8培养ln211e8非粘附细胞的孔、511ad为利用ln332e8培养ln211e8非粘附细胞并去除了非粘附细胞的孔。图中箭头表示p63阴性细胞,基准尺为100μm。图13显示332ad与511ad中几乎未观察到p63阴性细胞,认为p63阳性细胞在短时间内粘附于ln332e8或ln511e8。将p63阳性细胞率示于图14。各组的标记与图13相同。图14明确表明332ad与511ad的p63阳性细胞率比其他组高。即,可知去除ln332e8或ln511e8的非粘附细胞的工序为对提高角膜上皮细胞的纯度而言重要的工序。另外,本发明并不受上述各实施方式及实施例的限定,可在权利要求所示出的范围内进行各种变更,适当组合分别在不同实施方式中公开的技术手段而得到的实施方式也包含在本发明的技术范围内。此外,记载于本说明书中的学术文献及专利文献的全部内容在本说明书均作为参考而被引用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1