烯基苯衍生物的制作方法
本发明是有关一种烯基苯衍生物,特别是提供一种具有高交联密度的烯基苯衍生物。
背景技术:
由于高分子材料具有质轻与易调整特性等优点,故高分子材料逐渐应用在各种技术领域中。一般而言,除了聚合单体的选用与分子量的调节以外,高分子材料亦可藉由控制其交联密度来调整材料特性,而可满足后端应用的需求。
随着高分子材料的交联密度增加,所制得的高分子材料可具有较佳的抗化性与耐热性。此外,随着抗化性与耐热性的提升,高分子材料的链段可具有更大的变化性,而使得高分子材料可满足不同的应用需求。
然而,一般高分子材料于低温不易产生交联反应,而无法有效增加其交联密度。倘若将温度提高,低耐热性的基团则易裂解,而无法形成交联。此外,习知高分子材料虽于高温下可产生交联反应,但其交联密度过低,故抗化性与耐热性的提升并不显著。
有鉴于此,本发明致力于提供一种高分子聚合单体,以改进习知交联密度过低的缺陷。
技术实现要素:
因此,本发明的一个方面在于提供一种烯基苯衍生物,此烯基苯衍生物是由具有特定结构的基团所键结而成,而于进行交联反应后,可形成具有较高交联密度的聚合物。
根据本发明的一个方面,提出一种烯基苯衍生物。此烯基苯衍生物具有如下式(i)所示的结构:
于式(i)中,ar代表具有至少一烯基取代基的芳香基团,其中相对于-o-ar-o-的氧原子的键结位置,至少一烯基取代基的每一者的键结位置是位于邻位;x代表包含碳的有机基团;r1代表氢原子或r12-r11-,其中r12代表氢原子或包含碳的有机基团,此有机基团的碳数可为1至12,且r11代表碳原子、氮原子、氧原子或硫原子;r2代表-r22-r21-,其中r22与x键结,r22代表包含碳的有机基团,此有机基团的碳数为1至12,且r21代表碳原子、氮原子、氧原子或硫原子。
依据本发明的一实施例,前述的x包含次烷基、
依据本发明的另一实施例,前述芳香基团的芳香环可包含但不限于
依据本发明的又一实施例,前述的烯基取代基分别独立地具有如下式(i-1)或式(i-2)所示的结构:
于式(i-1)与式(i-2)中,r3与r4分别独立地代表氢原子或碳数为1至3的烷基,且「*」代表与芳香基团的芳香环键结的位置。
依据本发明的再一实施例,前述式(i-1)及/或式(i-2)所示的烯基取代基包含顺反异构物。
依据本发明的又另一实施例,前述烯基取代基的数量为小于或等于4。
依据本发明的再另一实施例,前述的r11可相同于或不同于r21,且r12与r22可彼此键结形成饱和或不饱和的环。
依据本发明的更另一实施例,前述的r12与r22可以彼此键结形成苯环。
依据本发明的更另一实施例,当前述的r1不同于r2,且r12与r22不形成饱和或不饱和的环时,式(i)中的
应用本发明的烯基苯衍生物,其是藉由具有特定结构的基团所键结组合而成,而可于进行交联反应后,形成具有较高交联密度的聚合物。据此,所制得的聚合物具有良好的抗化性与耐热性。
附图说明
为了对本发明的实施例及其优点有更完整的理解,现请参照以下的说明并配合相应的附图。必须强调的是,各种特征并非依比例描绘且仅是为了图解目的。相关附图内容说明如下:
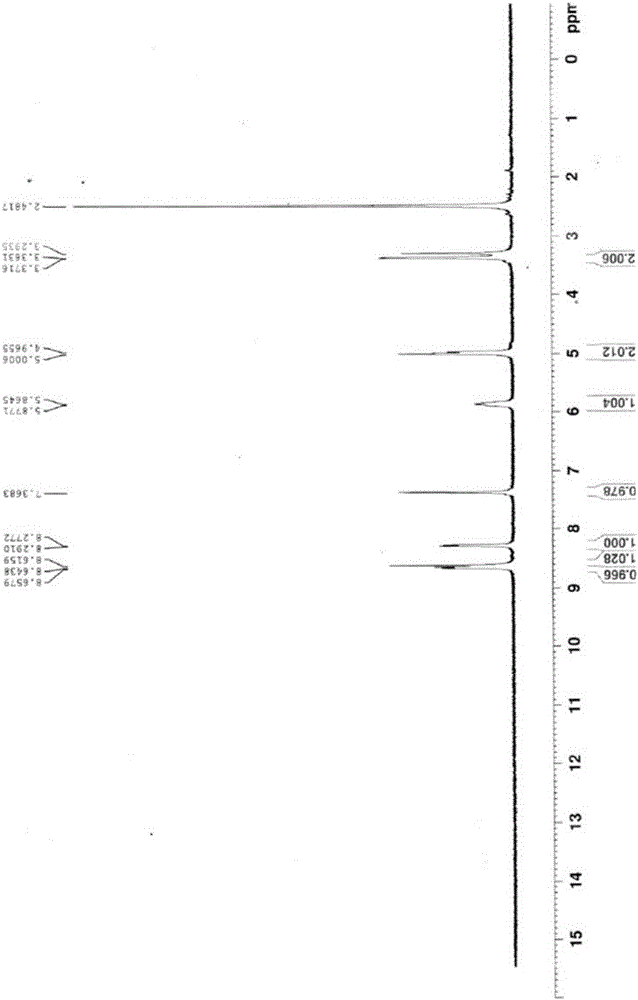
[图1]是显示依照本发明的实施例1所制得的烯基苯衍生物的核磁共振光谱图;
[图2]是显示依照本发明的实施例2所制得的烯基苯衍生物的核磁共振光谱图。
具体实施方式
以下仔细讨论本发明实施例的制造和使用。然而,可以理解的是,实施例提供许多可应用的发明概念,其可实施于各式各样的特定内容中。所讨论的特定实施例仅供说明,并非用以限定本发明的范围。
本发明提供一种烯基苯衍生物。此烯基苯衍生物具有如下式(i)所示的结构:
于式(i)中,ar代表具有至少一个烯基取代基的芳香基团;x代表包含碳的有机基团;r1代表氢原子或r12-r11-,其中r12代表氢原子或包含碳的有机基团,r12所代表的有机基团的碳数可为1至12,且r11代表碳原子、氮原子、氧原子或硫原子;r2代表-r22-r21-,其中r22与x键结,r22代表包含碳的有机基团,r22所代表的有机基团的碳数为1至12,且r21代表碳原子、氮原子、氧原子或硫原子。
前述ar的芳香基团的芳香环可包含但不限于
前述ar中的烯基取代基的数量可小于或等于4。于ar的芳香基团中,相对于-o-ar-o-的氧原子的键结位置,每一个烯基取代基的键结位置是位于邻位(orthoposition)。在一些实施例中,烯基取代基可包含经取代或未经取代的乙烯基(vinyl)或烯丙基(allyl)。在一些实施例中,由与芳香环键结的碳原子起算,烯基取代基的双键结构较佳是位于第一个碳原子或第二个碳原子的位置。在一些实施例中,烯基取代基可具有如下式(i-1)或式(i-2)所示的结构:
于式(i-1)与式(i-2)中,r3与r4分别独立地代表氢原子或碳数为1至3的烷基,且「*」代表与芳香基团的芳香环键结的位置。
在一些实施例中,前述式(i-1)及/或式(i-2)所示的烯基取代基可包含顺反异构物(cis-transisomer)。
在一些实施例中,当前述芳香基团的芳香环是由多个环状结构所构成(例如:此些环状结构是以共价键直接键结在一起,此些环状结构通过共价键和其他原子来键结在一起,及/或此些环状结构是彼此稠合(condensed)),且式(i)中的ar包含二个烯基取代基时,此些烯基取代基可分别键结于不同的环状结构上。
在一些实施例中,当式(i)中的烯基取代基的数量大于1时,此些烯基取代基彼此可为相同的或不相同。
若本发明的烯基苯衍生物不具有烯基取代基,当其进行交联反应时,由于烯基苯衍生物不具有烯基取代基,故此些烯基苯衍生物的分子链间无法产生双键加成反应,而难以提升反应所制得的聚合物的交联密度,因此所制得的聚合物不具有良好的抗化性与耐热性。
如式(i)所示,烯基苯衍生物包含与前述ar键结的「-o-x-」基团,且「-o-x-」基团亦可称之为连结基团,其中x基团是一价键结氧原子(即x基团与氧原子间是单键键结)。前述x所代表的有机基团可例如为次烷基、
举例而言,在一些实施例中,根据前述x所代表的基团,本发明烯基苯衍生物的连结基团可包含但不限于醚基(当x为次烷基时)、酯基(当x为
如式(i)所示,本发明烯基苯衍生物的两侧具有酸酐末端基团(
若r12与r22所代表的含碳的有机基团的碳数大于12时,过长的r12与r22将阻碍烯基取代基间的交联,而降低所制得聚合物的交联密度。
另外,r12可选择性地与r22彼此键结形成饱和或不饱和的环,其中此饱和或不饱和的环可与酸酐的五元环稠合。在一些实施例中,此饱和或不饱和的环可为芳香环或者非芳香环。较佳地,此饱和或不饱和的环的碳数可为3至10。在一具体例中,此饱和或不饱和的环可例如为但不限于苯环。
在一些实施例中,当r1不同于r2,且r12与r22不形成饱和或不饱和的环时,与r1和r2所键结的酸酐五元环中的碳原子(即键结r1的碳原子,以及键结r2的碳原子)可做为手性中心(chiralcenter)原子,式(i)中的
在一具体例中,本发明如式(i)所示的烯基苯衍生物可藉由对具有至少一个烯基取代基与两个羟基的芳香化合物与具有酸酐基团的酰基卤化物进行反应,即可制得由具有至少一个烯基取代基的芳香基团、连结基团与两个酸酐末端基团所组成的烯基苯衍生物。在此具体例中,前述具有至少一个烯基取代基与羟基的芳香化合物可藉由对具有羟基的芳香化合物与烯基化合物进行取代反应来制得。
在另一具体例中,本发明如式(i)所示的烯基苯衍生物可先合成制得酰基卤化物。然后,对具有至少一个烯基取代基与两个羟基的芳香化合物与具有酸酐基团的酰基卤化物进行反应,即可制得烯基苯衍生物的中间产物。接着,对此中间产物与酸酐化合物进行反应,即可制得本发明由具有至少一个烯基取代基的芳香基团、连结基团与两个酸酐末端基团所组成的烯基苯衍生物。
在又一具体例中,本发明可藉由对具有至少一个烯基取代基与两个羟基的芳香化合物、内酯化合物与酸酐化合物进行反应,即可制得如式(i)所示的烯基苯衍生物。
以下利用实施例以说明本发明的应用,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰。
制备烯基苯衍生物
实施例1
首先,将19克(0.1摩尔)的如下式(ii-1-1)所示的2,5-二烯丙基对苯二酚溶解于利用80毫升的无水四氢呋喃与24毫升的吡啶配制而成的混合溶液中,并将42克(0.2摩尔)的如下式(ii-1-2)所示的氯化偏苯三酸酐溶解于270毫升的无水四氢呋喃中。
然后,于冰浴(0℃)下,将含有2,5-二烯丙基对苯二酚的溶液缓慢滴入含有氯化偏苯三酸酐的溶液中。滴加完后,将温度升至室温,以进行酯化反应。反应12小时后,过滤液体,并以水润洗滤饼。
接着,将滤饼放置于160℃的真空烘箱中,并加热24小时,以干燥并同时进行酸酐环化反应。以1,4-二恶烷再结晶所得的固体粗产物,并经160℃真空干燥后,即可制得实施例1的烯基本衍生物,其具有如下式(iii-1)所示的结构,其核磁共振(nuclearmagneticresonance;nmr)光谱图如图1所示。
实施例2
实施例2是使用与实施例1的烯基苯衍生物的合成方法相同的制备方法与反应参数,不同之处在于实施例2是使用如下式(ii-2)所示的2,2’-二烯丙基-4,4’-二羟基联苯来制备烯基苯衍生物。实施例2所制得的烯基苯衍生物具有如下式(iii-2)所示的结构,其核磁共振光谱图如图2所示。
实施例3至实施例9
实施例3至实施例9分别是使用与实施例1的烯基苯衍生物的合成方法相同的制备方法与反应参数,不同之处在于实施例3至实施例9分别是使用如下式(ii-3)至式(ii-9)的芳香化合物来制备烯基苯衍生物。
实施例3至实施例9所制得的烯基苯衍生物分别如下式(iii-3)至式(iii-9)所示。
实施例10
首先,将19.6克(0.202摩尔)的2-呋喃甲胺溶解于200毫升的无水四氢呋喃中,并于冰浴下,缓慢滴入28克(0.199摩尔)的4-氯丁酰氯。待滴加完成后,于室温下搅拌3小时。然后,利用减压浓缩机去除溶剂,即可制得如下式(ii-10-1)所示的第一中间产物。
将15克(0.109摩尔)的碳酸钾与19克(0.1摩尔)的2,5-二烯丙基对苯二酚溶于200毫升的甲醇中,以形成第一溶液。接着,将前述的第一中间产物溶于100毫升的甲醇中,并缓慢滴入第一溶液中。然后,升温至50℃,以进行反应。经反应24小时后,去除溶剂,并以管柱层析纯化,即可制得如下式(ii-10-2)所示的第二中间产物。
将5.2克(0.01摩尔)的第二中间产物与1.96克(0.02摩尔)的马来酸酐溶于30毫升的无水四氢呋喃与二氯甲烷的混合溶液(体积比为1:1)。于室温下搅拌反应24小时后,利用减压浓缩机去除溶剂,即可制得实施例10的烯基苯衍生物,且其具有如下式(iii-10)所示的结构。
实施例11
首先,将12.7克(0.045摩尔)的天冬氨酸二叔丁酯盐酸盐与5.0克(0.049摩尔)的三乙胺溶解于50毫升的二氯甲烷中,并于冰浴下,缓慢滴入5.6克(0.04摩尔)的4-氯丁酰氯。待滴加完成后,于室温下搅拌3小时。然后,利用减压浓缩机去除溶剂,即可制得如下式(ii-11-1)所示的第一中间产物。
将3克(0.022摩尔)的碳酸钾与3.8克(0.02摩尔)的2,5-二烯丙基对苯二酚溶于100毫升的甲醇中,以形成第一溶液。接着,将前述的第一中间产物溶于20毫升的甲醇中,并缓慢滴入第一溶液中。然后,升温至50℃,以进行反应。经反应24小时后,去除溶剂,并以管柱层析纯化,即可制得如下式(ii-11-2)所示的第二中间产物。
将5克(0.006摩尔)的第二中间产物溶于20毫升的乙酸中,并加入2克(0.02摩尔)的乙酸酐。于60℃下搅拌反应8小时后,利用减压浓缩机去除溶剂,并于120℃的真空烘箱干燥24小时,即可制得实施例11的烯基苯衍生物,且其具有如下式(iii-11)所示的结构。
于式(iii-11)中,波浪键(wavybond;即氮原子与酸酐末端基团间的键结)是代表此烯基苯衍生物包含立体异构物。
实施例12
首先,将9.9克(0.04摩尔)的2-羟基琥珀酸二叔丁酯与5.0克(0.049摩尔)的三乙胺溶解于50毫升的二氯甲烷中,并于冰浴下,缓慢滴入5.6克(0.04摩尔)的4-氯丁酰氯。待滴加完成后,于室温下搅拌3小时。然后,利用减压浓缩机去除溶剂,即可制得如下式(ii-12-1)所示的第一中间产物。
将3克(0.022摩尔)的碳酸钾与3.8克(0.02摩尔)的2,5-二烯丙基对苯二酚溶于100毫升的甲醇中,以形成第一溶液。接着,将前述的第一中间产物溶于20毫升的甲醇中,并缓慢滴入第一溶液中。然后,升温至50℃,以进行反应。经反应24小时后,去除溶剂,并以管柱层析纯化,即可制得如下式(ii-12-2)所示的第二中间产物。
将5克(0.006摩尔)的第二中间产物溶于20毫升的乙酸中,并加入2克(0.06摩尔)的乙酸酐。于60℃下搅拌反应8小时后,利用减压浓缩机去除溶剂,并于120℃的真空烘箱干燥24小时,即可制得实施例12的烯基苯衍生物,且其具有如下式(iii-12)所示的结构。
于式(iii-12)中,波浪键(即氧原子与酸酐末端基团间的键结)是代表此烯基苯衍生物包含立体异构物。
实施例13
首先,将19克(0.1摩尔)的2,5-二烯丙基对苯二酚、19.6克(0.2摩尔)的马来酸酐与20.4克(0.2摩尔)的γ-硫代丁内酯溶解于500毫升的无水四氢呋喃中。经搅拌均匀后,加入1克(0.01摩尔)的三乙胺,以进行反应。经反应6小时后,利用减压浓缩机去除溶剂,即可制得实施例13的烯基苯衍生物的粗产物。
然后,经
于式(iii-13)中,波浪键(即硫原子与酸酐末端基团间的键结)是代表此烯基苯衍生物包含立体异构物。
本发明具有特定结构的烯基苯衍生物是由具有至少一个烯基取代基的芳香基团、两个酸酐末端基团与两个连结基团所构成。其中,藉由键结于芳香基团上的烯基取代基,当烯基苯衍生物进行交联反应时,此或此些烯基取代基可进行分子间的双键加成反应,而增进所制得烯基苯衍生物的交联密度,进而提升其抗化性与耐热性。
另外,烯基苯衍生物的末端酸酐基团可进一步与其他单体进行反应,而可制得具有特定结构的聚合物。再者,藉由烯基苯衍生物上的烯基取代基,所制得的聚合物可于聚合反应时进一步交联,而具有较高的交联密度。因此,本发明的烯基苯衍生物的特定结构可同时降低反应活化能及反应温度,并利用烯基取代基的双键结构进行交联,故所制得的聚合物可具有更高的交联密度,而可提升其抗化性与耐热性,以及所形成的膜的特性。
据此,本发明的烯基苯衍生物所具有的烯基取代基可有效地形成分子间交联,故所制得的聚合物可具有更高的交联密度,而大幅提升聚合物的抗化性与耐热性。
虽然本发明已以实施方式揭露如上,然其并非用以限定本发明,在本发明所属技术领域中任何具有通常知识者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰,因此本发明的保护范围当视后附的申请专利范围所界定者为准。
- 还没有人留言评论。精彩留言会获得点赞!