一种呼吸道发热病原体多联荧光PCR检测试剂盒的制作方法
本发明涉及生物技术和病原体检测领域,具体来说是一种呼吸道发热病原体多联荧光pcr检测试剂盒。
背景技术
呼吸道感染是指病原体感染人体的鼻腔、咽喉、气管和支气管等呼吸系统,分为上呼吸道感染和下呼吸道感染,常见病原体为病毒,少数为细菌。明确引起感染的病原体,选择合适的治疗方案,可以有效的防止抗生素滥用,使患者得到及时有效的治疗。
流感病毒(flu)是一种有包膜、分节段基因组的单链rna病毒,属于正粘病毒科。根据核蛋白和包膜内侧面的m1蛋白的抗原性将流感病毒分甲、乙、丙三型。甲型流感病毒再根据包膜表面血凝素(ha)和神经氨酸酶(na)两种刺突的抗原性分若干亚型,目前包括h1~h16亚型和n1~n9亚型,甲型流感病毒的亚型是把ha和na列在一起命名的。h1n1、h3n2为较常见的季节性流感病毒。甲型流感病毒(flua)每10年到30年会大爆发一次,而且每年都会发生甲型或乙型流感病毒(flub)流行病。流感病毒的感染是季节性的,特别在北半球是从11月到4月容易爆发。小孩和老年人以及长期患有心血管肺炎的病人易于被感染。通过吸入空气中飞沫或者传染物仅经过1~3天潜伏期就会散播出去。
呼吸道合胞病毒(rsv)是单链rna包膜病毒,含有两个亚型—a型和b型。广泛分布于世界各地,是引起婴幼儿下呼吸道感染主要的和常见的病原体,在绝大部分地区rsv所致的1岁以内婴幼儿肺炎和支气管炎远远高于其他病原微生物。成年人感染会导致普通感冒。rsv通常是季节性的,易于在冬天和早春感染并引起多达5个月的流行期。我国每年数千万住院的婴幼儿因rsv感染的占50%,且rsv的再感染率很高,成人rsv的再感染同样很常见。该病毒具有传染性强,症状与副流感病毒肺炎、轻症流感病毒肺炎及轻症腺病毒肺炎在临床上几乎无法区别,因此,实验室诊断就显得非常重要。
副流感病毒(piv)是单链rna包膜病毒,四种亚型各有不同的临床和流行病学特征。1型和2型的最典型的临床特征是造成儿童喉气管支气管炎,1型是儿童喉气管支气管炎的主要原因,而2型次之。1型和2型均能造成其它的上呼吸道和下呼吸道疾病。3型经常导致肺炎和细支气管炎。4型通常被认为散发存在,引起的呼吸道症状轻微。副流感病毒常常引起儿童下呼吸道感染的一种病毒,其致病性仅次于呼吸道合胞病毒(rsv)。人类副流感病毒的潜伏期一般在1~7天左右。
腺病毒(adv)是一种双链dna病毒,共有52种血清型,分为a、b、c、d、e和f六个亚属,引起呼吸道感染的主要为b、c、e亚属。腺病毒感染呼吸道的典型症状是咳嗽、鼻塞和咽炎,同时伴有发热、寒战、头痛和肌肉痛等,一般潜伏期5~7天左右,容易侵犯6个月至5岁小孩,占儿童呼吸道感染5%~20%。一般秋春以呼吸道感染为多,春、初夏以合并结膜炎为多。大部份由飞沫传染,少部份由粪便接触感染。疾病的过程约5~7天,也有进入第二星期的。感染2~3星期后产生抗体,可持续一至数年,同型病毒再感染的机率很少。腺病毒引起的呼吸道、泌尿道以及胃肠道感染在临床表现方面与其他病原微生物的感染非常相似,因此,仅根据临床表现来进行疾病的诊断是比较困难的,需要进行实验室诊断加以证实。
肺炎支原体(mp)是造成人类支原体肺炎的病原体。支原体肺炎的病理改变以间质性肺炎为主,有时并发支气管肺炎,称为原发性非典型性肺炎。主要经飞沫传染,潜伏期2~3周,发病率以青少年最高。肺炎支原体是介于细菌与病毒之间的一种胸膜肺炎微生物,为已知独立生活的生物中的最小者,能耐冰冻。mp是儿童和成人社区获得性肺炎的常见病原体。
肺炎衣原体(cpn)是一种专性细胞内寄生菌,是人类呼吸道疾病的重要病原体,可引起急慢性呼吸道疾病,社区获得性肺炎、支气管炎和鼻窦炎5%~10%是由肺炎衣原体引起。肺炎衣原体的感染具有散发和流行交替出现的周期性,散发通常持续3~4年,有2~3年的流行期,在流行期间可有数月的短暂爆发发生。病人之间传播间隔期平均为30天,在密集人群中流行可持续6个月。肺炎衣原体呼引起的吸道感染临床表现不典型,通常以咽痛和音哑起病,数日至7天后出现咳嗽,与其他呼吸道疾病相比,自起病至就医的时间以肺炎衣原体感染为最长。
目前,现有的试剂盒普遍存在检测灵敏度低、检测不便等缺点,需要进行有效的改进。
技术实现要素:
本发明所要解决的技术问题是为了克服现有技术中的检测灵敏度低、操作不便的缺陷,而提供一种呼吸道发热病原体多联荧光pcr检测试剂盒。
本发明解决上述技术问题提供的技术方案是:本发明公开了一种呼吸道发热病原体多联荧光pcr检测试剂盒,包括pcr扩增试剂和对照试剂,所述的pcr扩增试剂由pcr反应缓冲液a、酶系b和各种病原体引物探针混合液构成,所述的对照试剂主要由阴性对照和阳性对照组成。
作为优选,所述的pcr反应缓冲液a的成分为5*buffer,2.5mmdntps,所述的酶系b主要由hotstarthitaqdna聚合酶、m-mlv反转录酶和rna酶抑制剂构成,所述的12种呼吸道发热病原体检测引物探针包含甲型流感病毒、甲型流感病毒h1n1、甲型流感病毒h3n2、甲型流感病毒h1n1(2009)、乙型流感病毒、呼吸道合胞病毒、呼吸道腺病毒、肺炎支原体、肺炎衣原体、人副流感1型、人副流感2型和人副流感3型检测引物探针。
作为优选,所述的5*buffer的组分为50mmtris-hcl、75mmkcl、17.5mmmgcl2。
作为优选,所述的12种呼吸道发热病原体的探针和引物的具体序列和序号如下:
甲型流感病毒上游引物f:gatgagccttctaaccgaggseqidno.1;
甲型流感病毒下游引物r:atcttcaagtctctgcgcgseqidno.2;
甲型流感病毒探针p:5’-荧光报告基团-aggccccctcaaagccgagat-荧光淬基团-3’seqidno.3;
甲型流感病毒h1n1上游引物f:cacaataggagagtgtccaaa
seqidno.4;
甲型流感病毒h1n1下游引物r:gaaaccggcaatggctccseqidno.5;
甲型流感病毒h1n1探针p:5’-荧光报告基团-acaggactaaggaacaccccatccattc-荧光淬基团-3’seqidno.6;
甲型流感病毒h3n2上游引物f:tgttgaacgaagcaaagcctacseqidno.7;
甲型流感病毒h3n2下游引物r:cggatgaggcaactagtgaccseqidno.8;
甲型流感病毒h3n2探针p:5’-荧光报告基团-ctgttacccttatgatgtgccggattatgc-荧光淬基团-3’seqidno.9;
甲型流感病毒h1n1(2009)上游引物f:ttgagctcagtgtcatcatttgaseqidno.10;
甲型流感病毒h1n1(2009)下游引物r:gaggacatgctgccgttacaseqidno.11;
甲型流感病毒h1n1(2009)探针p:5’-荧光报告基团-
cctagttcagacaatggaacgtgttacc-荧光淬基团-3’seqidno.12;
乙型流感病毒上游引物f:acagtggaggatgaagaagatseqidno.13;
乙型流感病毒下游引物r:tcgaattggctttgratgtcctseqidno.14;
乙型流感病毒探针p:5’-荧光报告基团-cactcttcgagcgtcttaatgaaggac-荧光淬基团-3’seqidno.15;
呼吸道合胞病毒上游引物f:ttagcaaagtcaagytgaatgatacaseqidno.16;
呼吸道合胞病毒下游引物r:cataattaggagtgtcaatrctgtctcseqidno.17;呼吸道合胞病毒探针p:5’-荧光报告基团-ctrctgtcatccagcaaatacacyattcaacg-荧光淬基团-3’seqidno.18;
呼吸道腺病毒上游引物f:aggatgcttcggagtacctseqidno.19;
呼吸道腺病毒下游引物r:tgttccccakactgaagtaggtgseqidno.20;
呼吸道腺病毒探针p:5’-荧光报告基团-ccgggtctggtgcagttygcc-荧光淬基团-3’seqidno.21;
肺炎支原体上游引物f:gccctcccgtttgaagcgtactseqidno.22;
肺炎支原体下游引物r:accctaaagacacctatactseqidno.23;
肺炎支原体探针p:5’-荧光报告基团-ccattgccaccaaacaccaaaagc-荧光淬基团-3’seqidno.24;
肺炎衣原体上游引物f:tctctgtaaacaaacccaagggcseqidno.25;
肺炎衣原体下游引物r:agactttgttccagyagctgttgctseqidno.26;
肺炎衣原体基因探针p:5’-荧光报告基团-tccccttgccaacagacgctggcg-荧光淬基团-3’seqidno.27;
人副流感1型上游引物f:agtgctctggaggaagaactaggtgseqidno.28;
人副流感1型下游引物r:ccctatcagcrgtgtcctcseqidno.29;
人副流感1型探针p:5’-荧光报告基团-cccacaggtggtggagccatagaag-荧光淬基团-3’seqidno.30;
人副流感2型上游引物f:atacaacagggcaatgggccaseqidno.31;
人副流感2型下游引物r:gcgaccaccatatacaggaaataaseqidno.32;
人副流感2型探针p:5’-荧光报告基团-tcctgcagttggaagcgggatctatcacc-荧光淬基团-3’seqidno.33;
人副流感3型上游引物f:ttcatctgtatcctcagagatcccseqidno.34;
人副流感3型下游引物r:ccactcccattgcataactccseqidno.35;
人副流感3型探针p:5’-荧光报告基团-atagttgcctggtgcgaactcacca-荧光淬基团-3’seqidno.36;
作为优选,所述的荧光报告基团选自fam、hex、rox、cy3、cy5荧光报告基团,所述的淬灭基团选自bhq1、bhq2、tamra荧光淬灭基团。
一种采用上述发热病原体多联荧光pcr检测试剂盒对呼吸道发热病原体进行检测,检测方法如下:
(1)、样本核酸提取:
采用病毒基因组dna/rna提取试剂盒对样本核酸进行提取,另外也同步对阳性对照和阴性对照进行处理;
(2)加样
用带滤芯的吸嘴分别取已处理好的样本、阴性对照、阳性对照上清各5μl分别加到装有pcr反应混合液的12联排pcr反应管中或96孔pcr板中,盖上管盖,离心数秒后移至扩增检测区;
(3)扩增
将pcr反应管放入荧光pcr扩增仪中进行扩增检测。
作为优选,所述的步骤(1)中,采用qiagen公司的qiaampminelutevirusspinkit(货号:57704)或天根生化科技有限公司的病毒基因组dna/rna提取试剂盒(货号:dp315)进行提取。
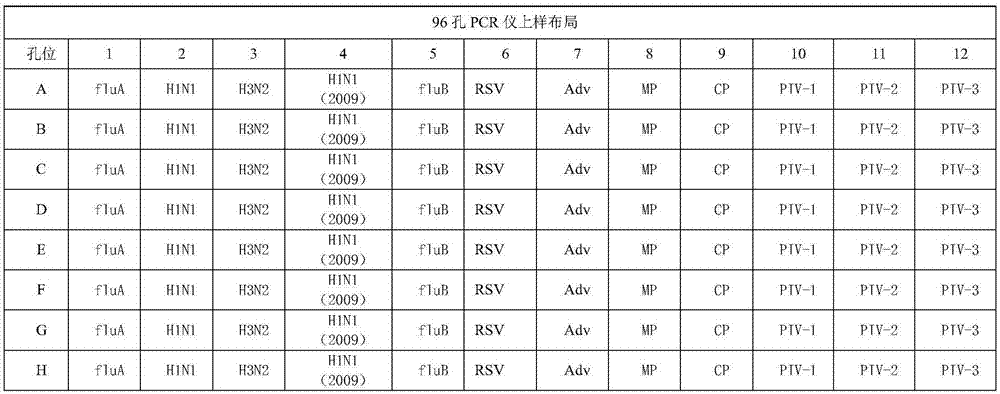
作为优选,所述的步骤(2)中,各联排管在96孔pcr仪上检测布局为
作为优选,所述的步骤(4)中,循环参数设定如下:(ab:abi7500,slan-96):
相对于现有技术,具有以下优点:
1、快速便捷、无污染,试剂盒采用试剂预分装技术,将每种病原体检测的pcr反应mix预分装于96孔pcr反应板pcr反应孔中,扩增时仅需加入酶系b和核酸模板,扩增结束后根据相应孔内有无荧光信号判断是否有相应细菌感染,同时试剂盒采用一步rt-pcr,无需先cdna后开盖加样,避免假阳性污染。
2、准确性好、灵敏度高,采用taqman探针法荧光定量pcr检测,所有病原体引物探针菌根据其基因保守区设计引物探针,保证检测结果的可靠性;化学热启动dna聚合酶具有低温抑制,耐高温扩增能力,检测灵敏度高,最低检测限为103copy/ml。
3、通量大,一次扩增可筛选12种常见的呼吸道发热病原体,检测通量大;
4、本试剂盒采用试剂预分装方法将12种呼吸道发热病原体检测引物探针和pcr扩增反应液预先分装于96孔pcr反应板中,使用时仅需加入酶系b和核酸模板,为流行病学调查、疾病治疗及疫情防治提供更简便、更快速实验检测方案。
附图说明
图1为试剂盒各病原体布局图。
具体实施方式
以下结合具体实施例进一步说明,但本发明并不仅限于这些实施例。
实施例1
扩增体系优化,以甲型流感病毒为例
一、引物浓度优化
pcr体系中,引物浓度过高可能会引发错配,导致非特异扩增,而浓度过低时,会影响pcr产物的生成,因此有必要对引物浓度进行优化。在实验中,我们设置了3个不同引物浓度,用质粒菌(1×105cfu/ml和1×103cfu/ml)及阴性对照作为检测样本,模板用量为5μl,每个反应体系终体积均为25μl,检测不同浓度的扩增差异。当引物浓度低时,扩增效率稍差,而且荧光响应强度也较低。当inva基因引物(10μmol/l)用量为0.5μl以上时,其扩增效率无显著差异。综合考虑,选用200nmol/l作为引物终浓度。
表2-1flua基因引物浓度的确定
二、探针浓度优化
荧光探针是整个定量pcr体系的核心,直接影响着荧光pcr检测结果的好坏。在实验中共设置了三个浓度进行比较。用invalid质粒菌(1×105cfu/ml和1×103cfu/ml)及阴性对照作为检测样本,模板用量为5μl,每个反应体系终体积均为25μl。实验结果见下表3-1,不同的探针浓度对ct值和荧光高度有影响,当inva基因荧光探针(10μmol/l)用量为0.30μl时整体能达到理想的试验效果。
表2-2flua探针的浓度对荧光pcr检测的影响
三、热启动taq酶用量的优化
热启动taq酶是pcr反应中的重要成份,其用量多少直接影响到pcr的扩增效率,因此本次实验配制了4种不同热启动taq酶用量的pcr反应液,热启动taq酶用量分别是1.5u/人份,2.0u/人份,2.5u/人份,3.0u/人份;用flua保守基因人工构建质粒菌(1×105cfu/ml和1×103cfu/ml)和阴性对照作为检测样本,模板用量为5μl,每个反应体系终体积均为25μl。实验结果表明,适当增加热启动taq酶的用量有利于pcr扩增检测,每个体系中加入1.5u/人份体系热启动taq酶就能达到较为理想的扩增效果,见表2-3。
表2-3热启动taq酶用量对flua扩增效率的影响
四、逆转录酶用量的优化
逆转录酶(m-mlv)用量多少直接影响到转录效率。因此本实验配制了4种不同m-mlv用量的pcr反应液,m-mlv用量分别是20u/人份,40u/人份,60u/人份,80u/人份;用flua人工构建质粒菌(1×105cfu/ml和1×103cfu/ml)和阴性对照作为检测样本,模板用量为5μl,每个反应体系终体积均为25μl。实验结果表明,适当增加m-mlv的用量有利于pcr扩增检测,每个体系中加入60u/人份体系m-mlv就能达到较为理想的扩增效果,见表2-4。
表2-4m-mlv用量对flua扩增效率的影响
五、rna酶抑制剂用量的优化
rna酶抑制剂(ri)用量多少直接影响到rna的稳定性。因此本实验配制了4种不同ri用量的pcr反应液,ri用量分别是4u/人份,8u/人份,12u/人份,16u/人份;用flua人工构建质粒菌(1×105cfu/ml和1×103cfu/ml)和阴性对照作为检测样本,模板用量为5μl,每个反应体系终体积均为25μl。实验结果表明,8u/人份,12u/人份,16u/人份的ri对pcr扩增检测无显著差异,综合考虑每个体系中加入8u/人份ri就能达到较为理想的扩增效果,见表2-5。
表2-5ri用量对flua扩增效率的影响
实施例2试剂盒检测操作规范
一、在样本处理区进行样本准备
1.1咽拭子:用拭子拭抹咽后壁和两侧扁桃体部位,应避免触及舌部,迅速将拭子放入标本采集管,旋紧管盖并密闭送检。检测时将咽拭子在病毒采样液中漂洗数次并挤压棉签,取漂洗液直接进行核酸提取。
1.2鼻拭子:将拭子轻轻插入鼻道内鼻腭处,停留片刻后缓慢转动退出,并以同一拭子拭鼻孔两侧,迅速将拭子放入样本采集管,弃尾部,旋紧管盖并密闭,以防干燥。应使用头部为合成纤维的拭子(例如,聚酯纤维),用铝或者塑料做柄(不推荐木柄)。样本采集管中应含有3ml无菌病毒采样液(含蛋白质稳定剂,防治细菌和真菌生长的抗生素,缓冲液)。
1.3核酸提取:本试剂盒不含提取试剂,推荐使用qiagen公司的qiaampminelutevirusspinkit(货号:57704)或天根生化科技有限公司的病毒基因组dna/rna提取试剂盒(货号:dp315)。具体提取步骤请参照相应提取试剂盒说明书。阳性对照与阴性对照与待测样本同步进行处理。
二、试剂准备
在试剂配制室中取出96孔pcr反应板,在室温下待试剂完全溶解后瞬时离心。
三、在样本处理区进行加样
用带滤芯的吸嘴分别取已处理好的样本、阴性对照、阳性对照上清各5μl分别加到装有pcr反应液的pcr反应管中,盖上封口膜,离心数秒后移至扩增检测区;
四、在扩增检测区进行pcr扩增检测
4.1将pcr反应管放入荧光pcr扩增仪中进行扩增检测;
4.2循环参数设定:(abi7500,slan96p):
五、质控标准
5.1阴性对照:结果为阴性;
5.2阳性对照:结果为阳性,阳性对照ct值≤38;
5.3以上两项需在一次实验中同时满足,否则,本次实验无效,实验应重新进行。
以上显示和描述了发明的基本原理、主要特征和发明的优点。本行业的技术人员应该了解,发明不受上述实施例的限制,上述实施例和说明书中描述的只是发明的原理,在不脱离发明精神和范围的前提下发明还会有各种变化和改进,这些变化和改进都落入要求保护的发明的范围内。发明要求的保护范围由所附的权利要求书及其等同物界定。上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
序列表
<120>一种呼吸道发热病原体多联荧光pcr检测试剂盒
<141>2018-04-08
<160>1
<170>siposequencelisting1.0
<210>1
<211>3
<212>dna
<213>2ambystomalateralexambystomajeffersonianum
<400>1
- 还没有人留言评论。精彩留言会获得点赞!