一种马来酸异构酶突变体及其应用的制作方法
本发明涉及生物工程领域,更具体而言,本发明涉及一种马来酸异构酶及其应用。
背景技术:
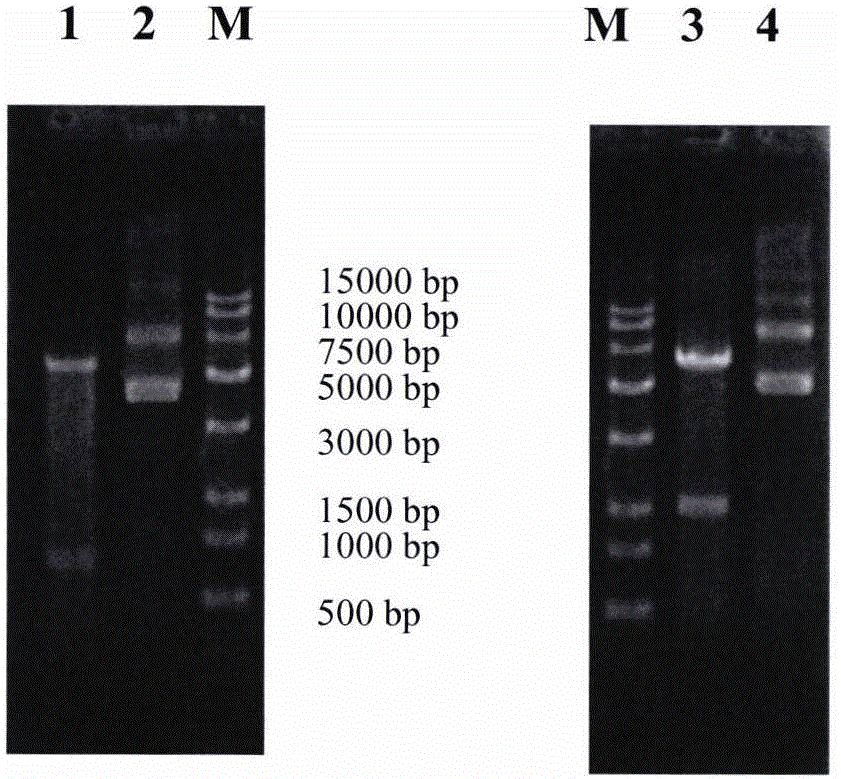
:l-天冬氨酸作为20种基本氨基酸的一种,广泛参与各种蛋白质合成中,是多种生物合成的前体。作为原料,l-天冬氨酸在食品、医药、化工等方面有广泛应用,下游产品包括丙氨酸、环保材料聚天冬氨酸、阿斯巴甜等。传统生产l-天冬氨酸的方法为苯化学法开环裂解,化学催化法生成富马酸,再由l-天冬氨酸生产菌株全菌催化生成l-天冬氨酸。此步骤涉及2步化学催化以及一步发酵全菌体催化,路线长且不经济环保。近年来,报道了由顺式丁烯二酸(马来酸)作为出发底物经过顺式丁烯二酸异构酶(马来酸异构酶,maleatecis-transisomerase,maia,ec5.2.1.1)催化异构化生成富马酸,再经过天冬氨酸氨裂解酶催化合成天冬氨酸的全生物绿色转化方法(参见cn106755157a、cn107475320a)。然而,虽然这些生物绿色合成l-天冬氨酸的工艺取得了巨大进步,但具有成本相对较高、异构酶活力较低、稳定性差等缺点。因此,作为采用新工艺的全生物法仍处于工业化推广困境中。要解决上述问题,最为关键的是提升异构酶表达活性以及稳定性、并进一步整合将生物酶法技术压缩至最低。目前有报道研究的异构酶有serratiamarcessens、rhodococcussp.rha1、alcaligenesfaecalisifo13111、b.stearothermo.philusmi102等物种来源的马来酸异构酶。但是,这些异构酶仍存在酶活力较低、稳定性较差、在工业生产方面易受成本限制等缺陷。因此,本领域仍然存在对新型的马来酸异构酶及其使用方式的需要。技术实现要素:为了解决上述技术问题,本发明的目的是提供一种新型的马来酸异构酶,其相对于目前已知的马来酸异构酶,具有提高的酶活力与稳定性,且在转化马来酸生产l-天冬氨酸时,具有更好的底物转化效果以及更为灵活、简单的使用方式。本发明提供以下技术方案。一方面,本发明提供一种马来酸异构酶突变体,对应于如seqidno.1所示的马来酸异构酶的氨基酸序列,所述马来酸异构酶突变体的氨基酸序列具有f39l和/或a224g的突变。seqidno.1示出了ncbi序列id:wp_010929891.1的马来酸异构酶的氨基酸序列。按照该大类的马来酸异构酶的三维结构特点以及采用酶工程随机突变技术,在一个或多个位点进行突变后得到一系列突变体,再经过稳定性、酶活性等筛选,得到本发明提供的马来酸异构酶突变体。具体地,相对于该已知马来酸异构酶(亲本),本发明提供的马来酸异构酶突变体为两点突变酶(f39l,a224g)的突变。优选地,本发明的马来酸异构酶突变体包含如seqidno.3所示的氨基酸序列;更优选地,所述马来酸异构酶突变体的氨基酸序列如seqidno.3所示。另一方面,本发明提供编码所述马来酸异构酶突变体的基因序列;优选地,所述基因序列包含如seqidno.4所示的核苷酸序列;更优选地,所述基因序列包含如seqidno.4所示的核苷酸序列。还一方面,本发明提供包含所述基因序列的载体;优选地,所述载体为重组载体,优选为重组表达载体,更优选为用于在细菌、例如大肠杆菌(e.coli)中表达的重组表达载体。根据本发明的具体实施方式,所述载体为pet29a-bptm。又一方面,本发明提供包含所述载体的宿主细胞;优选地,所述宿主细胞为用于从所述载体表达所述马来酸异构酶突变体的宿主细胞,优选为细菌细胞,例如大肠杆菌(e.coli)细胞。实验表明,在将底物马来酸转化为富马酸的转化方面,本发明提供的马来酸异构酶突变体相对于亲本酶或其他菌株来源的马来酸异构酶具有显著提高的酶活力与稳定性,具有催化马来酸异构化生成富马酸的用途。因此,再一方面,本发明提供所述马来酸异构酶突变体、所述基因序列、所述载体或者所述宿主细胞在催化马来酸异构化生成富马酸中的应用。在所述应用中,所述马来酸异构酶突变体或由所述基因序列、所述载体或者所述宿主细胞得到的马来酸异构酶突变体可以是酶的游离形式或固定化形式。上述转化得到的富马酸可以同时或进一步地在天冬氨酸氨裂解酶的作用下转化成天冬氨酸。因此,本发明提供所述马来酸异构酶突变体、所述基因序列、所述载体或者所述宿主细胞在以马来酸为底物生产l-天冬氨酸中的应用。在所述应用中,所述马来酸异构酶突变体或由所述基因序列、所述载体或者所述宿主细胞得到的马来酸异构酶突变体可以是酶的游离形式或固定化形式。本发明进一步提供以下技术方案。一方面,本发明提供一种基因构建体(例如核苷酸序列),所述基因构建体包含编码l-天冬氨酸氨裂解酶的基因序列和编码马来酸异构酶或马来酸异构酶突变体的基因序列;优选地,所述基因构建体还包含用于表达l-天冬氨酸氨裂解酶和马来酸异构酶或马来酸异构酶突变体的元件,例如核糖体结合序列。根据本发明的具体实施方式,所述l-天冬氨酸氨裂解酶的氨基酸序列如ncbi序列id:wp_086258271.1所示。所述马来酸异构酶包含如seqidno.1所示的氨基酸序列;优选地,所述马来酸异构酶的氨基酸序列如seqidno.1所示;或者,所述马来酸异构酶突变体包含如seqidno.3所示的氨基酸序列;优选地,所述马来酸异构酶突变体的氨基酸序列如seqidno.3所示。另一方面,本发明提供一种载体,其包含编码l-天冬氨酸氨裂解酶的基因序列和编码马来酸异构酶或马来酸异构酶突变体的基因序列。优选地,所述载体包含本发明提供的所述基因构建体;优选地,所述载体为重组载体,优选为重组表达载体,更优选为用于在细菌、例如大肠杆菌(e.coli)中表达的重组表达载体。根据本发明的具体实施方式,所述载体为pet29a-bptm-easp。又一方面,本发明提供包含所述载体的宿主细胞;优选地,所述宿主细胞为用于从所述载体表达所述l-天冬氨酸氨裂解酶和所述马来酸异构酶或马来酸异构酶突变体的宿主细胞,优选为细菌细胞,例如大肠杆菌(e.coli)细胞。实验表明,本发明的基因构建体在合适体系中,共同表达马来酸异构酶或其突变体与l-天冬氨酸氨裂解酶,并且在该异构酶或其突变体达到转化酶活要求时,l-天冬氨酸合成酶的酶活也可以达到转化相同底物的同等需求,因此具有在以马来酸为底物生产l-天冬氨酸中的用途。因此,还一方面,本发明提供所述基因构建体、所述载体或者所述宿主细胞在以马来酸为底物生产l-天冬氨酸中的应用。在所述应用中,由所述基因构建体、所述载体或者所述宿主细胞得到的马来酸异构酶或其突变体与l-天冬氨酸合成酶可以是酶的游离形式或固定化形式。本发明进一步提供以下技术方案。一方面,本发明提供一种以马来酸为底物生产l-天冬氨酸的方法,所述方法包括,以马来酸为底物,采用本发明提供的所述马来酸异构酶突变体、所述基因序列、所述载体或者所述宿主细胞,联合l-天冬氨酸氨裂解酶一步转化所述底物合成l-天冬氨酸。或者,本发明提供一种以马来酸为底物生产l-天冬氨酸的方法,所述方法包括,以马来酸为底物,采用本发明提供的所述基因构建体、所述载体或者所述宿主细胞,一步转化所述底物合成l-天冬氨酸。在本发明提供的方法中,优选地,参与转化的酶的酶活配比为:马来酸异构酶/l-天冬氨酸氨裂解酶为100-120u/2000-4000u,或者马来酸异构酶突变体/l-天冬氨酸氨裂解酶为120-150u/2000-4000u。优选地,所述马来酸的转化起始浓度为180-200g/l;优选地,所述方法包括:反应温度为40℃,ph为8.0。优选地,所述方法还包括马来酸的循环套用,包括:转化反应结束后,采用马来酸调节ph析出晶体,然后将得到的上清液除杂后加入马来酸且控制l-天冬氨酸的含量在2%以下,用于下一次转化反应。具体而言,本发明通过全基因合成bordetellapertussistohamai马来酸异构酶(ncbi序列id:wp_010929891.1;简称bpt)基因序列,然后将该基因克隆到表达载体pet29a上,并将重组后的表达质粒转化到相应的宿主细胞中,然后通过诱导表达、裂解等获得该酶裂解液。与此同时,制备目前有代表性的其他已知马来酸异构酶的基因序列、克隆入相同质粒、在相应的宿主细胞中平行表达、裂解等,对比异构酶的活力以及稳定性数据。在确认获得高活性高稳定性的异构酶序列的同时,根据本实验室经验以及异构酶三维结构特点,设计一系列突变体,最终获得一株两点突变菌株(bptm)。考察该菌株的酶(简称bptm)的酶活力和稳定性,发现该有突变位点的马来酸异构酶的酶活力提高约20-88%,40℃稳定性增加约20-35%。该酶的氨基酸序列如seqidno.3所示;重组质粒为pet29a-bptm,突变前的重组质粒为pet29a-bpt。进一步地通过引物设计,调取大肠杆菌l-天冬氨酸氨裂解酶ncbi序列id:wp_086258271.1(简称easp)基因序列(简称asp),将asp基因克隆到重组质粒pet29a-bpt或pet29a-bptm上,并将bpt或bptm和asp串联重组后的表达质粒转化到相应的宿主细胞中,表达、裂解制备对应酶液,并利用制备获得的酶液以及最终的一菌双酶组合菌株进行转化条件摸索,最终可以实现同时考察此基因与l-天冬氨酸氨裂解酶的组合。结果发现,通过核糖体结合位点伴随方式,实现了使异构酶达到转化酶活要求的同时使l-天冬氨酸氨裂解酶的酶活力可以达到转化相同底物的同等需求,即两酶的酶活比例配合十分合适:酶活配比可达bpt+easp:100-120u/2000-4000u;bptm+easp:120-150u/2000-4000u。并且,还发现以上配合方式又进一步增强了异构酶或其突变体的稳定性(40℃稳定性增加约20-35%)。增加的酶活与稳定性以及合适的酶活配比,使得仅需较少的菌体或其制备的酶液就可达到较好的底物转化效果。因此,本发明的一菌双酶体系,取得了对于完全转化较合理的酶活配比、更加稳定的异构酶或其突变体的活力,进一步降低生产成本,在一步法从马来酸制备l-天冬氨酸的技术上取得巨大进步。例如,在最终优化条件下,本发明提供的湿菌体仅需3-5g/l,即可完成底物浓度20%的马来酸完全转化成l-天冬氨酸。并且,最终在转化实验中证明无论小试反应还是中试放大反应,该菌株来源的异构酶或其突变体在与任何形式的天冬氨酸氨裂解酶组合时,均取得了良好的转化效果。酶的应用方式可以包括酶液以及菌体两种方式。此外,本发明的发明人发现马来酸异构酶或其突变体无论与天冬氨酸氨裂解酶以何种方式配合使用,可以耐受马来酸替代硫酸调节ph以析出晶体,只要酶活力达到需求,均可满足马来酸循环套用。从而进一步降低成本,实现绿色循环路径,减少硫酸盐污染。总体而言,本发明技术成本更低,绿色,污染小,酸碱用量少,生产周期短,产品质量高,最终产品纯度高,可达99.78%-99.9%。附图说明以下,结合附图来详细说明本发明的实施方案,其中:图1显示了重组质粒的单酶切鉴定图,其中泳道为:1.ecori单切pet29a-bpt;2.pet29a-bpt质粒;m.marker;3.xhoi单切pet29a-bpt-easp;4.pet29a-bpt-easp质粒。图2显示了质粒的结构示意,其中2a为质粒pet29a,2b为重组质粒pet29a-bpt,2c为重组质粒pet29a-bptm,2d为重组质粒pet29a-bpt-easp,2e为重组质粒pet29a-bptm-easp。图3显示了三种酸的标准品的hplc分析图,其中l-天冬氨酸的保留时间为2.120min,马来酸的保留时间为2.850min,富马酸的保留时间为3.015min。具体实施方式以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。实施例1马来酸异构酶(bpt)及其突变体(bptm)的获得全基因合成大肠杆菌密码子优化后的bpt基因序列,以合成序列为模板,扩增bpt目的基因片段(seqidno.1;seqidno.2)。引物序列为:引物1:ccggaattcatgcaaaaaacctaccgtattg(seqidno.6)引物2:ccggaattcttaatacgcaccgctcagc(seqidno.7)pcr扩增反应体系:灭菌水22ul,kapa2*mix25ul,引物1(10um)1ul,引物2(10um)1ul,模板1ul,总体积50ul。pcr反应条件:98℃4min;98℃20sec,60℃15sec,72℃1min,30个循环;72℃10min。扩增的目的片段大小约0.75kb,pcr产物进行纯化回收。用ecor1单酶切pcr产物及大肠杆菌表达载体pet29a,酶切后载体用cip去磷酸化,并分别纯化回收得到相应的酶切产物。在t4dna连接酶的作用下,将酶切产物连接入载体pet29a中的相应位点。连接产物转化入大肠杆菌感受态bl21(de3)菌株中,lb平板(kan抗性)37℃培养过夜。以目的基因特异性引物对平板上生长的单菌落进行菌落pcr鉴定,对菌落pcr鉴定的阳性转化子进行质粒提取,相应质粒用ecor1单酶切鉴定,对于鉴定条带正确的重组质粒送测序。测序正确的即为重组质粒pet29a-bpt。根据本实验室经验以及异构酶三维结构特点,设计一系列突变体,实验室突变筛选酶活力得到提升的菌株单克隆,将获得酶活力提升的菌株提取质粒,送测序获知突变体位置。获得了突变体菌株(bptm),其中的异构酶突变体(bptm)包括两个突变位点:39位phe到leu突变,224位ala到gly突变(seqidno.3)。按照上文所述方法,构建得到重组质粒pet29a-bptm。各质粒的酶切鉴定结果见图1,结构示意见图2。含上述重组质粒的菌株分别命名为bl21(de3)-pet29a-bpt和bl21(de3)-pet29a-bptm。实施例2天冬氨酸氨裂解酶(easp)与bpt、bptm基因串联的克隆easp的基因序列为大肠杆菌自身天冬氨酸氨裂解酶(ncbi登记号:wp_086258271.1)基因。引物序列为:引物3:ccgctcgagtctagagaaagaggagaaatactagatgatgtcaaacaacattcg(seqidno.8);(额外添加的为核糖体结合位点(seqidno.5),本文称为nrbs)引物4:ccgctcgagttactgttcgctttcat(seqidno.9)。pcr扩增反应体系:灭菌水22ul,kapa2*mix25ul,引物3(10um)1ul,引物4(10um)1ul,模板1ul,总体积50ul。pcr反应条件:98℃4min;98℃20sec,60℃15sec,72℃1.5min,30个循环;72℃10min。扩增的目的片段大小约1.4kb,pcr产物进行纯化回收。用xho1单酶切pcr产物及重组载体pet29a-bpt或pet29a-bptm,酶切后载体用cip去磷酸化,并纯化回收得到相应的酶切产物。在t4nda连接酶的作用下,将酶切产物连接入载体中的相应位点。连接产物转化入大肠杆菌感受态bl21(de3)菌株中,lb平板(kan抗性)37℃培养过夜。以目的基因特异性引物对平板上生长的单菌落进行菌落pcr鉴定,对菌落pcr鉴定的阳性转化子进行质粒提取,相应质粒用xho1单酶切鉴定,对于鉴定条带正确的重组质粒送测序。测序正确的即为重组质粒pet29a-bpt-easp或pet29a-bptm-easp。各质粒的酶切鉴定结果见图1,结构示意见图2。含上述重组质粒的菌株分别命名为bl21(de3)-pet29a-bpt-easp和bl21(de3)-pet29a-bptm-easp。实施例3重组原核表达与酶活按照实施例1和2所述,将其它报道来源的马来酸异构酶基因克隆入相同pet29a载体中,得到重组质粒,进而相应得到包含重组质粒的菌株,作为对照菌株。将菌株bl21(de3)-pet29a-bpt、bl21(de3)-pet29a-bptm、bl21(de3)-pet29a-bpt-easp和bl21(de3)-pet29a-bptm-easp以及对照菌株各自培养于lb液体(kan抗性)培养基中,37℃、220rpm培养4~5h,至od1.0左右加入iptg诱导目的蛋白进行表达。诱导条件:20℃,16h,220rpm。离心收集菌体,称取菌体湿重。将收集到的菌体用ph7.020mm磷酸缓冲液进行重悬,菌体浓度为100mg/ml。超声破碎菌体:超声功率200w,设置超声工作时间3s,间歇7s,30min。离心超声裂解液,收集上清酶液,同时制备上清和沉淀的蛋白样品,进行sds-page检测。上清酶液保存于-80℃,以备检测酶活。采用以下测定与分析方法。1.hplc法测定反应液中的马来酸、富马酸和l-天冬氨酸流动相:a.ph2.550mm磷酸二氢钾;b.乙腈;a∶b=95∶5;检测波长:205nm;流速:0.8ml/min;进样量:10μl;色谱柱:innovalods-2150mmx4.6mm5μm;柱温:30℃。具体分析表见图3。2.马来酸异构酶的酶活测定底物马来酸(50g/l,ph8.0)溶液在水浴条件下达到37℃后,吸取950μl底物溶液加入2ml离心管中,加入50μl酶液(10mg/ml),37℃摇床120rpm震荡反应20min。反应结束后分2次稀释至200倍,煮沸2min,用0.45μm的滤膜过滤,吸取10μl注入hplc,测定反应液中富马酸的生成量并计算酶活。1u定义为37℃下生成1微摩尔产物所需的酶量。3.天冬氨酸氨裂解酶的酶活测定底物富马酸母液(200g/l,ph8.0)溶液在水浴条件下达到37℃后,吸取富马酸母液4ml,加入酶液0.1ml(4.1mg/ml),37℃摇床220rpm震荡反应10min。取50μl反应液加入950μl的流动相,然后用纯化水稀释10倍,混匀,煮沸2min,冷却后用0.45μm的滤膜过滤,吸取10μl注入hplc,测定反应液中l-天冬氨酸的生成量并计算酶活。1u定义为37℃下生成1微摩尔产物所需的酶量。4.不同温度下酶活保持率的计算在不同温度下保温一定时间后测定酶活,酶活测定方式参见以上方法,然后用处理后的酶活除以未处理时的酶活,比值的百分率即定义为不同温度下不同处理时间的酶活保持率。结果见下表1。表1.不同情况下的马来酸异构酶的酶活性如表1所示,单独表达的bpt以及bptm的酶活力以及稳定性都较高,明显大于对照物种来源的酶,其中serratiamarcessens来源的异构酶酶活力更低,未评估其温稳性。bpt酶活力约在90-120u/ml,突变体bptm最高可达170u/ml,突变后在40℃的酶活稳定性2h以及4h都明显上升,2h为65.29v.s.72.3,4h为21.58v.s.28.11,稳定性提升约20-35%。同时发现,对于一菌双酶,同时测得easp的酶活为2000-4000u。因此,通过核糖体结合位点伴随方式,实现了使马来酸异构酶达到转化酶活要求的同时使l-天冬氨酸氨裂解酶酶活可以达到转化相同底物同等需求,即两酶酶活比例配合十分合适这一意外效果,二者的酶活配比可达bpt+asp:100-120u/2000-4000u;bptm+asp:120-150u/2000-4000u。并且进一步发现,对于一菌双酶,上述配合方式又进一步增强了马来酸异构酶在40℃的稳定性,对于bpt,2h为65.29v.s.84.87,4h为21.58v.s.29.13;对于bptm,2h为72.3v.s.88.36,4h为28.11v.s.37.23,稳定性提升约20-35%。上述意外效果使得仅需较少的菌体或其制备的酶液就可达到较好的转化效果,属于意想不到的一菌双酶组合效果、进一步降低生产成本。在以下实施例中采用的菌体与酶液的简称见下表2。表2.菌体与酶液来源菌体酶液bl21(de3)-pet29a-bpt菌体1酶液1bl21(de3)-pet29a-bptm菌体2酶液2bl21(de3)-pet29a-bpt-easp菌体3酶液3bl21(de3)-pet29a-bptm-easp菌体4酶液4底物马来酸转化率=(初始酸浓度-实际酸浓度)/初始酸浓度×100%。实施例4酶液1、酶液2放大反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入酶液1或者酶液2(马来酸异构酶2000-3000u/l),天冬氨酸氨裂解酶单独投入83mg(约2-3万u/l,粉或液体)搅匀后,控温40℃反应,转速110-130rpm,ph8.0,每隔1h取样测定马来酸剩余量并得到转化率,反应时间为22-36h,反应最终转化率为99.8-100%。实施例5酶液1、酶液2放大反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入酶液1或者酶液2(马来酸异构酶4000-6000u/l),天冬氨酸氨裂解酶单独投入83mg(约2-3万u/l,粉)搅匀后,控温40℃反应,转速110-130rpm,ph8.0,每隔1h取样测定马来酸剩余量并得到转化率,反应时间为5-7h,反应最终转化率为99.8-100%。实施例6菌体1、菌体2放大反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入菌体1或者菌体2(3-5g/l;马来酸异构酶4000-6000u/l),天冬氨酸氨裂解酶单独投入83mg(约2-3万u/l,粉)搅匀后,控温40℃反应,转速110-130rpm,ph8.0,每隔1h取样测定马来酸剩余量并得到转化率,反应时间为28-48h,反应最终转化率为99.8-100%。实施例7菌体1、菌体2放大反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入菌体1、菌体2(5-8g/l;马来酸异构酶4000-6000u/l),天冬氨酸氨裂解酶单独投入83mg(约2-3万u/l,粉)搅匀后,控温40℃反应,转速110-130rpm,ph8.0,每隔1h取样测定马来酸剩余量并得到转化率,反应时间为16-26h,反应最终转化率为99.8-100%。实施例8酶液3、酶液4放大反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入酶液3或者酶液4(马来酸异构酶2000-3000u/l,天冬氨酸氨裂解酶2-4万u/l),搅匀后,控温40℃反应,转速110-130rpm,ph8.0,每隔1h取样测定马来酸剩余量并得到转化率,反应时间为22-36h,反应最终转化率为99.8-99.9%。实施例9酶液3、酶液4放大反应-2马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,加入酶液3或者酶液4(马来酸异构酶4500-6000u/l,天冬氨酸氨裂解酶4-8万u/l),搅匀后,控温40℃反应,转速110-130rpm,ph8.0。每隔1h取样测定马来酸剩余量并得到转化率,反应时间为4-7h,反应最终转化率为99.9-99.9%。实施例10菌体3、菌体4反应-1马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,菌体3或者菌体4(菌体3-5g/l),搅匀后,控温40℃反应,转速110-130rpm,ph8.0。每隔1h取样测定马来酸剩余量并得到转化率,反应时间为28-48h,反应最终转化率为99.8-99.9%。实施例11菌体3、菌体4反应-2马来酸底物(200g/l)溶液转移至250ml三口烧瓶中,反应体积100ml,起始控温38℃,ph7.9-8.0,菌体3或者菌体4(菌体5-8g/l),搅匀后,控温40℃反应,转速110-130rpm,ph8.0。每隔1h取样测定马来酸剩余量并得到转化率,反应时间为24-28h,反应最终转化率为可达99.9%。实施例12酶液3催化大反应将配好的底物溶液2t(浓度约为18-20%)(ph8.5的马来酸铵)压入反应罐中,开启搅拌,待温度降至38-42℃,加入硫酸镁0.25kg。马来酸异构酶浓缩液20l(酶3浓缩液;马来酸异构酶20-25万u/l;天冬氨酸氨裂解酶500-1000万u/l)加入罐中,开始反应,每隔1h取样记录反应罐的温度变化、ph、马来酸的酸剩余量并得到转化率。12h内完成转化反应,最终转化率大于98.2%。实施例13酶液4催化大反应将配好的底物溶液2t(浓度约为18-20%)(ph8.5的马来酸铵)压入反应罐中,开启搅拌,待温度降至38-42℃,加入硫酸镁0.25kg。马来酸异构酶浓缩液20l(酶4浓缩液;马来酸异构酶25-30万u/l;天冬氨酸氨裂解酶500-1000万u/l)加入罐中,开始反应,每隔1h取样记录反应罐的温度变化、ph、马来酸的酸剩余量并得到转化率。6-8h后完成转化反应,最终转化率大于98.2%,最高可达99.9%。实施例14菌体3催化大反应将配好的底物溶液1.5t(浓度约为18-20%)(ph8.5的马来酸铵)压入反应罐中,开启搅拌,待温度降至38-42℃,加入硫酸镁0.25kg,压入发酵罐发酵结束的菌体3发酵液(根据发酵后菌体产量(每升发酵液湿菌重)估算转化罐内菌体终浓度至0.8%-1%,开始反应,每隔1h取样记录反应罐的温度变化、ph、马来酸的酸剩余量并得到转化率。36-48h后完成转化反应,最终转化率大于97%,最高可达99%。实施例15菌体4催化大反应将配好的底物溶液1.5t(浓度约为18-20%)(ph8.5的马来酸铵)压入反应罐中,开启搅拌,待温度降至38-42℃,加入硫酸镁0.25kg,压入发酵罐发酵结束的菌体4发酵液(根据发酵后菌体产量(每升发酵液湿菌重)估算转化罐内菌体终浓度至0.8%-1%),开始反应,每隔1h取样记录反应罐的温度变化、ph、马来酸的酸剩余量并得到转化率。36-48h后完成转化反应,最终转化率大于98%,最高可达99.5%。实施例16产品后期提取工艺待转化率到98%以上,80℃保持1h杀酶;向反应罐中加入1‰-2‰的活性炭,继续搅拌1h脱色;离心过滤去除活性炭,测定透光率,转入结晶罐,加入硫酸或马来酸,调ph至2.4-2.8,自然降温至70℃,即可打开冷却水,降温至30℃左右,结晶离心。进行水洗,水洗检查至无硫酸或马来酸,即可停止水洗。水洗结束后,脱液。脱液结束后,准备出料。打开螺旋输送机按钮,打开离心机出料按钮,进行出料。干燥后测定产品含量、旋光度、透光率、杂质残留等指标。最终产品天冬氨酸转化率为98.2-99.9%,各项参数指标符合标准,为白色结晶粉末,纯度99.78%-99.9%,达到出口级。实施例17马来酸套用实验将用马来酸调节ph后析出晶体的上清液取出,过5-10kd纤维素膜以及纳滤膜去杂后,测定该上清液中l-天冬氨酸的残余量,然后与一定比例的马来酸溶液再次配比,控制配比后l-天冬氨酸的残余量2%以下,或者通过膜吸附处理控制再次反应液中l-天冬氨酸的残余量2%以下,再启动下一批反应,套用第一批可以达到99.5%转化率,后期套用可同样达到98%以上转化率。累计循环套用批次可达5-10次。实施例18酶保存稳定性酶液1、2放置4℃冷藏7-10天酶活保持率78%左右;菌体1、2在4℃冷藏3-4天,酶活力保持80%以上。酶液3放置4℃冷藏11-12天酶活保持率85%左右;菌体3在4℃冷藏3-4天,酶活力保持80%以上。酶液4放置4℃冷藏12-15天酶活保持率85%左右;菌体4放置4℃冷藏4-5天,酶活力保持80%以上。以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种查尔酮基荧光传感器及其制备方法与应用与流程
- 一种含咔唑基的查尔酮与乙酰乙酸乙酯Micheal加成产物及其制备方法与流程
- 一种查尔酮类似物及其制备方法和用途与流程
- 一种制备4-溴-1,8-二氮萘的方法与制造工艺
- 一种利用磁性固相萃取吸附材料富集检测喜树碱的方法与制造工艺
- 拟南芥At‐UGE2基因及其过表达突变株和缺失突变株在调节植物性状中的应用的制造方法与工艺
- 一种马来酸顺反异构酶的热稳定性改造及其应用的制造方法与工艺
- 一种改进的基于加权图的超密集异构网络干扰协调方法与制造工艺
- 一种自旋标记骆驼宁碱A化合物、制备方法及其用途与制造工艺
- 一种顺‑4‑(2‑甲基‑3‑对叔戊基苯基丙酰基)‑2,6‑二甲基吗啉合成方法与制造工艺