一种利用大肠杆菌生产胞外阿魏酸酯酶的方法与流程
本发明涉及一种利用大肠杆菌生产胞外阿魏酸酯酶的方法,属于生物技术技术领域。
背景技术:
阿魏酸酯酶最早应用于木质纤维素的降解。随着社会的发展和能源危机,越来越多的研究关注于利用木质纤维素来生产生物乙醇,其技术关键是将木质纤维素转化为可发酵的碳源。由于植物细胞壁交联的网状结构,其降解需要一系列纤维素酶和半纤维素酶的协同作用。阿魏酸酯酶属于半纤维素酶家族,它能够打开半纤维素之间、半纤维素和木质素之间交联的酯键,从而有助于其它酶与木质纤维素的结合。根据底物特异性和序列相似性,阿魏酸酯酶可以分为a、b、c、d四个类型。
在阿魏酸酯酶作用木质纤维素的过程中,还能够获得高附加值产物阿魏酸。阿魏酸广泛存在于谷物、水果、蔬菜等植物性食品中,通过酯键与植物细胞壁中的其它成分相交联,根据来源不同最多能占细胞干重的3%。通过阿魏酸酯酶释放的阿魏酸可以应用于保健品和化妆品中。阿魏酸发挥生理作用的方式依赖其抗氧化功能:分子苯环上的3-甲氧基、4-羟基和羧基基团,能够高效的清除活性氧;上调作用细胞中超氧化物歧化酶、过氧化氢酶和谷胱甘肽还原酶等的活性。因此,阿魏酸成为治疗多种与氧化压力相关疾病的潜在物质,例如阿尔茨海默病、癌症、心血管疾病、糖尿病和皮肤病等。
乳酸菌(lacticacidbacteria,lab)是指一类能够发酵可溶性碳水化合物,产生大量乳酸的革兰氏阳性细菌的统称。它包括多个属的物种,乳杆菌属(lactobacillus)是其重要组成部分。乳杆菌分布广泛,天然存在于人体肠道、乳制品、发酵植物食品中。随着相关研究的增多,乳杆菌的应用价值已受到广泛的认可。在医药健康领域中,具有维持微生态平衡、降低胆固醇、提高免疫力等功能;在食品行业中,能够赋予产品独特的风味和更长的保质期。近些年来,关于乳杆菌所产的阿魏酸酯酶逐渐受到研究重视。鉴于乳杆菌作为公认的gras菌株以及阿魏酸酯酶在食品、医药和化妆品行业的应用潜力,自从首例报道之后就颇受关注。目前已从肠道或发酵植物产品中鉴定出多种产阿魏酸酯酶的乳杆菌,包括噬淀粉乳杆菌、植物乳杆菌、约氏乳杆菌、瑞士乳杆菌等。
大肠杆菌因其清楚的基因背景和完善的蛋白表达调控工具,已被作为细胞工厂来生产多种微生物来源的阿魏酸酯酶。但是由于大肠杆菌具有内外双层膜结构,使得阿魏酸酯酶的分泌表达成为一个难题。大肠杆菌所表达的阿魏酸酯酶通常位于胞内,获得纯化的酶常常需要复杂的纯化过程。因此,目前阿魏酸酯酶标准品价格昂贵,其生产工艺达不到工业化规模水平,因此无法实际应用于各相关领域。
中国专利文献cn108342371a(申请号201810324103.1)公开了一种来源于土壤的新型阿魏酸酯酶基因,其核苷酸序列和氨基酸序列分别如seqidno.1和seqidno.2所示。将该酯酶基因在大肠杆菌bl21(de3)中异源表达,纯化后的重组酶(fae-xuan)分子量大小为29kda。fae-xuan对底物阿魏酸甲酯的催化活性最高,酶活为40u/mg,其最适温度为30℃,最适ph为5.0。在ph3.0-10.0下反应4h后,该酶仍能保持75%以上的活性,显示出较强的ph稳定性。
中国专利文献cn102719414a(申请号201210132351.9)一种新型阿魏酸酯酶,其氨基酸序列如seqidno.3所示;本发明还公开了所述新型阿魏酸酯酶的dna,所述dna的核苷酸序列如seqidno.1所示。本发明还公开了含有上述新型阿魏酸酯酶dna的表达载体、重组阿魏酸酯酶及其制备方法,以及所述重组阿魏酸酯酶在降解植物细胞壁中的应用。
上述文献中所表达的阿魏酸酯酶均为胞内表达,依然无法避免后续复杂的纯化过程。
技术实现要素:
针对现有技术的不足,本发明提供一种利用大肠杆菌生产胞外阿魏酸酯酶的方法。
本发明技术方案如下:
一种利用大肠杆菌生产胞外阿魏酸酯酶的方法,包括如下步骤:
(1)制备含有阿魏酸酯酶基因的重组大肠杆菌,所述的阿魏酸酯酶基因的核苷酸序列如seqidno.1所示;
(2)将步骤(1)制得的重组大肠杆菌经iptg或乳糖诱导发酵,经固液分离去除菌体,纯化,制得阿魏酸酯酶。
根据本发明优选的,所述步骤(1)中,制备含有阿魏酸酯酶基因的重组大肠杆菌的步骤如下:
(i)以噬淀粉乳杆菌cgmcc11056的全基因组序列为模板,pcr扩增阿魏酸酯酶基因;pcr扩增特异引物核苷酸序列如下:
forward:5`-tatacatatgtcccgcattacaattg-3`
reverse:5`-tatgctcgaggaataatggttttaaaaat-3`
(ii)用内切酶ndei和内切酶xhoi双酶切步骤(1)制得的pcr产物,插入载体pet22b中,转化大肠杆菌,制得重组大肠杆菌。
根据本发明进一步优选的,所述步骤(i)中,pcr扩增条件:
pcr扩增程序:
94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸45s,30个循环;72℃终延伸5min,16℃保存。
根据本发明进一步优选的,所述步骤(ii)中,大肠杆菌为escherichiacolibl21(de3)。
根据本发明优选的,所述步骤(2)中,诱导发酵步骤如下:
将重组大肠杆菌接种于lb培养基中,35~38℃培养至od600为0.5~0.8,然后加入iptg至培养基中浓度为0.4~0.8mm,继续诱导发酵16~24小时;
或者,将重组大肠杆菌接种于含有乳糖的培养基中,35~38℃发酵36~48小时。
根据本发明优选的,所述步骤(2)中,固液分离为4℃、13000rpm条件下离心15min。
根据本发明优选的,所述步骤(2)中,纯化步骤如下:
将固液分离后的液体经孔径0.22μm滤膜过滤,制得滤液,然后经histrap柱分离,pbs缓冲液中4℃下过夜透析,即得。
根据本发明进一步优选的,所述的histrap柱分离步骤如下:
用5倍柱体积的超纯水过histrap柱,速度为1ml/min,然后用5倍柱体积的bingingbuffer过柱子,再将滤液过histrap柱吸附,然后用10倍柱体积的bindingbuffer进行洗脱,再用5倍柱体积的elutionbuffer过柱子,收集洗脱液,即得;
上述bingingbuffer组份如下:20mm磷酸盐,500mm氯化钠,25mm咪唑,调节ph为7.4;
washingbuffer组份如下:20mm磷酸盐,500mm氯化钠,50mm咪唑,调节ph为7.4;
elutionbuffer组份如下:20mm磷酸盐,500mm氯化钠,500mm咪唑,调节ph为7.4。
一种生产阿魏酸的方法,包括如下步骤:
(1)制备含有阿魏酸酯酶基因的重组大肠杆菌,所述的阿魏酸酯酶基因的核苷酸序列如seqidno.1所示;
(2)将步骤(1)制得的重组大肠杆菌经发酵培养基培养并诱导阿魏酸酯酶表达,经去除菌体,纯化,制得阿魏酸。
根据本发明优选的,所述步骤(1)中,制备含有阿魏酸酯酶基因的重组大肠杆菌的步骤如下:
(i)以噬淀粉乳杆菌cgmcc11056的全基因组序列为模板,pcr扩增阿魏酸酯酶基因;pcr扩增特异引物核苷酸序列如下:
forward:5`-tatacatatgtcccgcattacaattg-3`
reverse:5`-tatgctcgaggaataatggttttaaaaat-3`
(ii)用内切酶ndei和内切酶xhoi双酶切步骤(1)制得的pcr产物,插入pet22b中,转化大肠杆菌,制得重组大肠杆菌。
根据本发明进一步优选的,所述步骤(i)中,pcr扩增条件:
pcr扩增程序:
94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸45s,30个循环;72℃终延伸5min,16℃保存。
根据本发明进一步优选的,所述步骤(ii)中,大肠杆菌为escherichiacolibl21(de3)。
根据本发明优选的,所述步骤(2)中,发酵培养基含有麦麸、玉米麸皮、谷物纤维中的一种或两种以上的组合。
有益效果
本发明首次通过采用限制性内切酶ndei酶切阿魏酸酯酶基因后,核糖体结合位点后的首个酶切位点变为ndei酶切位点,从而获得的阿魏酸酯酶具有天然的n端序列;该特殊结构使得阿魏酸酯酶能够在大肠杆菌合成后分泌至胞外,从而极大简化了阿魏酸酯酶的纯化和利用,对后续阿魏酸的工业化生产具有显著的促进作用。
附图说明
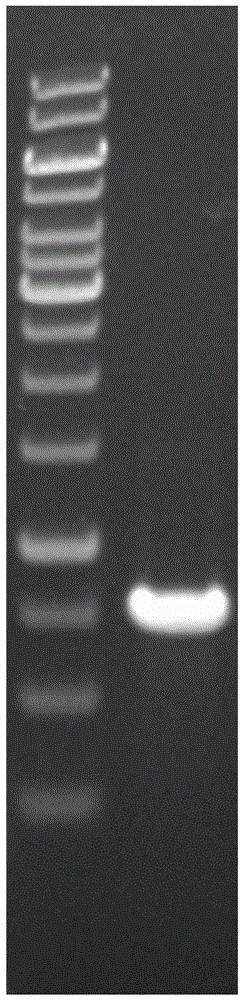
图1、噬淀粉乳杆菌阿魏酸酯酶基因的克隆结果电泳照片;
图2、大肠杆菌工程菌株胞外阿魏酸酯酶活性测定照片;
图3、hplc分析大肠杆菌工程菌株从麦麸中释放阿魏酸的结果图。
具体实施方式
以下将结合附图对本发明作进一步说明,以充分说明本发明的目的、技术特征和技术效果。
生物材料来源
噬淀粉乳杆菌所使用为标准菌cgmccno.11056,购自中国普通微生物菌种保藏管理中心,普通市售产品。
实施例1:噬淀粉乳杆菌阿魏酸酯酶基因的克隆
取1~3ml过夜培养的噬淀粉乳杆菌菌液,6000转/min离心3min收集菌体。重悬于567μlte缓冲液(10mmtris-hcl,1mmedta,ph8.0),添加25μl50mg/ml溶菌酶,混匀,37℃水浴处理1h。加入30μl10%(质量百分比)sds、3μl20mg/ml的蛋白酶k,37℃水浴处理1h。再加入100μl5mnacl、80μlctab/nacl溶液(10%(质量百分比)ctab,0.7mol/lnacl),65℃水浴处理10min。加入等体积的氯仿异戊醇(体积比24:1)抽提,12000转/min离心5min,保留上清。加入终浓度100μg/ml的rnasea溶液,37℃水浴处理30min。再用等体积的酚氯仿异戊醇(体积比25:24:1)和氯仿异戊醇(体积比24:1)各抽提一次。最后加入等体积异丙醇-20℃沉淀30min。12000转/min离心10min,收集dna。用70%(体积百分比)乙醇洗涤2次,42℃培养箱干燥,加40μl无菌水溶解。
根据ncbi数据库中的噬淀粉乳杆菌的全基因组序列,设计扩增阿魏酸酯酶的基因的引物forward1:5`-tatacatatgtcccgcattacaattg-3`和reverse:5`-tatgctcgaggaataatggttttaaaaat-3`。以提取噬淀粉乳杆菌基因组dna作为模板,进行pcr扩增,扩增的噬淀粉阿魏酸酯酶基因结果见图1。pcr结束后胶回收后进行ndei/xhoi双酶切,将酶切产物进行纯化。经检测,核苷酸序列如seqidno.1所示。
实施例2:阿魏酸酯酶基因重组大肠杆菌表达菌株的构建
提取质粒pet-22b,并用ndei和xhoi双酶切,酶切产物进行胶回收。将酶切过的目的基因与载体pet-22b以1:5的摩尔比混匀,使用t4dna连接酶在16℃过夜连接,之后将连接产物加入大肠杆菌dh5α感受态细胞中,进行热激反应转化。将恢复培养好的菌液浓缩后在lb(amp抗性)平板上涂布,37度过夜培养。挑取转化子,酶切验证。将验证成功的dh5α转化子提取质粒后,转入e.colibl21(de3)中,lb(amp抗性)平板筛选出bl21(de3)转化子。
实施例3:利用iptg诱导大肠杆菌基因工程菌株分泌表达阿魏酸酯酶
挑取bl21(de3)转化子到5ml含有amp抗生素的lb中,过夜培养后以2%转接至100mllb培养基中,37℃培养至od值0.6左右时,加入终浓度0.5mm的iptg,继续培养24h诱导蛋白表达。
大肠杆菌基因工程菌株分泌阿魏酸酯酶活性初测:经过诱导表达的大肠杆菌培养液,13000rpm离心10min,收集上清液用0.22μm滤膜过滤后,为其胞外分泌组分。取200ul分泌组分加入放置于检测阿魏酸酯酶活性培养基上的牛津杯中,其成分为以阿魏酸乙酯替代葡萄糖的mrs培养基,添加量为每升培养基中加入15ml溶于n,n-二甲基甲酰胺的10%的阿魏酸乙酯溶液,37℃放置6小时后,观察降解圈产生情况,结果见图2。
胞外分泌阿魏酸酯酶的活性测定:反应体系为1ml,其中包含40μl25mm的阿魏酸对硝基苯酚酯的dsmo溶液,950μl含有1%(v/v)的吐温-80的0.1m磷酸钠缓冲液(ph7.0)和10μl的酶溶液,反应10min后酶标仪检测读数。酶活定义:在室温,ph7.0的条件下,每分钟降解阿魏酸对硝基苯酚酯生成1μm对硝基苯酚所需的酶量定义为一个酶活力单位u。测定的胞外阿魏酸酯酶活性为412.52u/ml。
实施例4:利用乳糖诱导大肠杆菌基因工程菌株分泌表达阿魏酸酯酶
挑取bl21(de3)转化子到5ml含有amp抗生素的lb中,过夜培养后以2%(体积百分比)转接至100mllb培养基中,另补加1%(质量百分比)乳糖作为诱导物,37℃培养48小时,诱导阿魏酸酯酶的表达。
分泌阿魏酸酯酶活性初测以及活性测定方法见实施例3。结果显示在平板上可以产生降解圈,且胞外阿魏酸酯酶活性为331.79u/ml。
实施例5:利用重组表达阿魏酸酯酶的大肠杆菌工程菌株制备阿魏酸
挑取bl21(de3)转化子到5ml含有amp抗生素的lb中,过夜培养后以2%转接至100mllb培养基中,另补加1%(质量百分比)乳糖作为诱导物以及1%(质量百分比)麦麸作为底物,37℃培养48小时,诱导阿魏酸酯酶的表达,并降解底物产生阿魏酸。离心收集上清液,过滤后使用hplc分析阿魏酸含量。
hplc分析阿魏酸含量测定方法如下:高效液相色谱配备有scl-10a控制器,lc-10at泵,sil-10ad自动进样器,spd-m10a发光二极管检测器。使用液相柱为c18反相柱,流动相a为甲醇,b为99:1的水和冰乙酸,流速为1ml/min,检测波长为320nm。结果显示能够释放阿魏酸的含量为213.66um/g底物。
对比例1
使用引物forward2:5`-tatacatatgtttggcgaaatttatgac-3`和reverse:5`-tatgctcgaggaataatggttttaaaaat扩增n端缺失20个氨基酸的阿魏酸酯酶基因,并用ndei和xhoi双酶切,酶切产物进行胶回收。将酶切过的目的基因与载体pet-22b以1:5的摩尔比混匀,使用t4dna连接酶在16℃过夜连接,之后将连接产物加入大肠杆菌dh5α感受态细胞中,进行热激反应转化。将恢复培养好的菌液浓缩后在lb(amp抗性)平板上涂布,37度过夜培养。挑取转化子,酶切验证。将验证成功的dh5α转化子提取质粒后,转入e.colibl21(de3)中,lb(amp抗性)平板筛选出bl21(de3)转化子。
参考实施例3和实施例4对目的蛋白进行诱导,表达出n端缺失20个氨基酸的阿魏酸酯酶,并对胞外阿魏酸酯酶酶活性进行测定,结果均检测不到酶活。
对比例2
提取质粒pet-28b,并用ndei和xhoi双酶切,酶切产物进行胶回收。将酶切过的阿魏酸酯酶目的基因与载体pet-28b以1:5的摩尔比混匀,使用t4dna连接酶在16℃过夜连接,之后将连接产物加入大肠杆菌dh5α感受态细胞中,进行热激反应转化。将恢复培养好的菌液浓缩后在lb(amp抗性)平板上涂布,37度过夜培养。挑取转化子,酶切验证。将验证成功的dh5α转化子提取质粒后,转入e.colibl21(de3)中,lb(amp抗性)平板筛选出bl21(de3)转化子。
参考实施例3和实施例4对目的蛋白进行诱导,表达出n端额外多出载体上氨基酸序列met-gly-ser-ser-his-his-his-his-his-his-ser-ser-gly-leu-val-pro-arg-gly-ser-his的阿魏酸酯酶,并对胞外阿魏酸酯酶酶活性进行测定,结果均检测不到酶活。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思做出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权力要求书所确定的保护范围内。
序列表
<110>齐鲁工业大学
<120>一种利用大肠杆菌生产胞外阿魏酸酯酶的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>744
<212>dna
<213>噬淀粉乳杆菌(lactobacillusamylovorus)
<400>1
atgtcccgcattacaattgaaagagatggtctcaccttagtaggagatcgtgaagagcct60
tttggcgaaatttatgacatggctatacttatgcacggcttcactgcaaatagaaatact120
gatctattaagacagattgctgacgacttacgtgacaaaaatgtagccagcgtgcgtttt180
gacttcaatggtcatggtgaaagcaacggtaaatttgaaaatatgactgtgtgcaacgaa240
attgccgatggtcaagctattttggaatatgtccgtaccgatccacacgtgcgcaatatc300
tttttagtaggtcattctcaaggcggcgtaattgcctcaatgctcgctggactttatccc360
gacattatcaaaaaggttgtgcttttggcccctgcagctcaacttaaggacgatgcatta420
aagggcgatacacaaggcgcaacttacaatcctgatcgcattcctgcaactgtgcctttt480
ggcgataaaaaattaggcggcttctacttaagaaccgcacaagttttgccaatttacgaa540
gtatctgagcgcttcactggtccggtatcagtcattgttggcactaacgatcaagtcgtt600
gatcctaagtatgctaaaaagtatgacgaagtttacgtaaatagtgaaatgcatactatc660
gaaaatgcagatcatagctttactggtcaatacaaagatgaagcagctgacctaaccgca720
caatttttaaaaccattattctag744
- 还没有人留言评论。精彩留言会获得点赞!