藏红花花瓣总多糖及其提取方法和应用与流程
本发明属于藏红花活性成分提取技术领域,尤其涉及藏红花花瓣总多糖及其提取方法和应用。
背景技术:
藏红花(saffron,crocussativusl.),又名番红花、西红花、洎夫蓝、撒法即,为鸢尾科番红花属多年生草本植物,据《中华人名共和国药典》记载,其药用部位为干燥的花柱,藏红花作为传统中药其功效为:活血化瘀,凉血解毒,解郁安神。用于经闭癥瘕,产后瘀阻,温毒发斑,忧郁痞闷,惊悸发狂等。除药用外,它可用作食品添加剂、食用色素和高级香料。近年对藏红花的药理研究表明,其花柱中的主要有效成分—藏红花苷对于癌症、冠心病、动脉粥样硬化、高血脂症等多种疾病具有较好的防治作用。其花柱因产量极低同时具有神奇的药效而被世人封以“植物黄金”的称号,同时,大量的非药用部位—花瓣在藏红花的制药工业中成为副产品,造成极大的资源浪费。
现有技术对藏红花花瓣的活性成分提取工艺,提取率低,提取获得的成分活性低。
技术实现要素:
有鉴于此,本发明提供一种提取率高,活性高的藏红花花瓣总多糖的提取方法和藏红花花瓣总多糖的应用。
为了实现上述目的,本发明提供了以下技术方案:藏红花花瓣总多糖的提取方法,包括以下步骤:1)将藏红花花瓣粉末醇提后风干的滤渣与水以1g:(15~25)ml的比例混合置于95~105℃提取2.5~3.5h后固液分离,收集液相组分,获得藏红花花瓣水提液;2)将所述藏红花花瓣水提液醇沉,收集固相组分获得藏红花花瓣水提物固体粉末;3)将所述藏红花花瓣水提物固体粉末复溶,透析后,用阴离子交换柱层析纯化、凝胶柱层析纯化获得藏红花花瓣总多糖。
优选的,所述滤渣与水的比例为1g:20ml,所述提取的温度为98~102℃。
优选的,所述提取的时间为2.7~3.3h。
优选的,所述醇沉为将乙醇与所述藏红花花瓣水提液混合,至混合液中乙醇的体积浓度为85~95%。
优选的,所述透析的截留分子量为2500~3500d;所述透析的总时间为42~54h,每6~8h换水一次。
优选的,所述阴离子交换柱为deae-sephadexa-50柱。
优选的,所述阴离子交换柱层析的上样浓度为30~40mg/ml;所述阴离子交换柱层析采用0.05~0.6mol/l的nacl溶液梯度洗脱,所述洗脱速度为0.8~1.2ml/min。
优选的,所述凝胶柱层析采用sephadexg-200,所述凝胶柱层析的洗脱液为水,洗脱流速为0.08~0.12ml/min。
本发明还提供了所述提取方法制备获得的藏红花花瓣总多糖。
本发明还提供了所述的藏红花花瓣总多糖在制备药品、保健品和化妆品中的应用。
优选的,所述药品包括防治高血脂症的药品。
本发明的有益效果:本发明中所述藏红花花瓣总多糖的提取方法,通过将藏红花花瓣粉末醇提后风干的滤渣与水以1g:(15~25)ml的比例混合置于95~105℃提取2.5~3.5h后固液分离,醇沉,透析、阴离子交换柱层析和凝胶柱层析获得的藏红花花瓣总多糖得率高,得率为32.10%,纯度为88.10%。体外抗氧化结果显示,随着藏红花花瓣多糖质量浓度的增加,对dpph和oh自由基的清除作用逐渐增强。浓度为16mg/ml时,对dpph自由基的清除能力为29.46%,浓度为20mg/ml时对·oh自由基清除率过半,为63.86%,表现较高的体外抗氧化能力。
附图说明
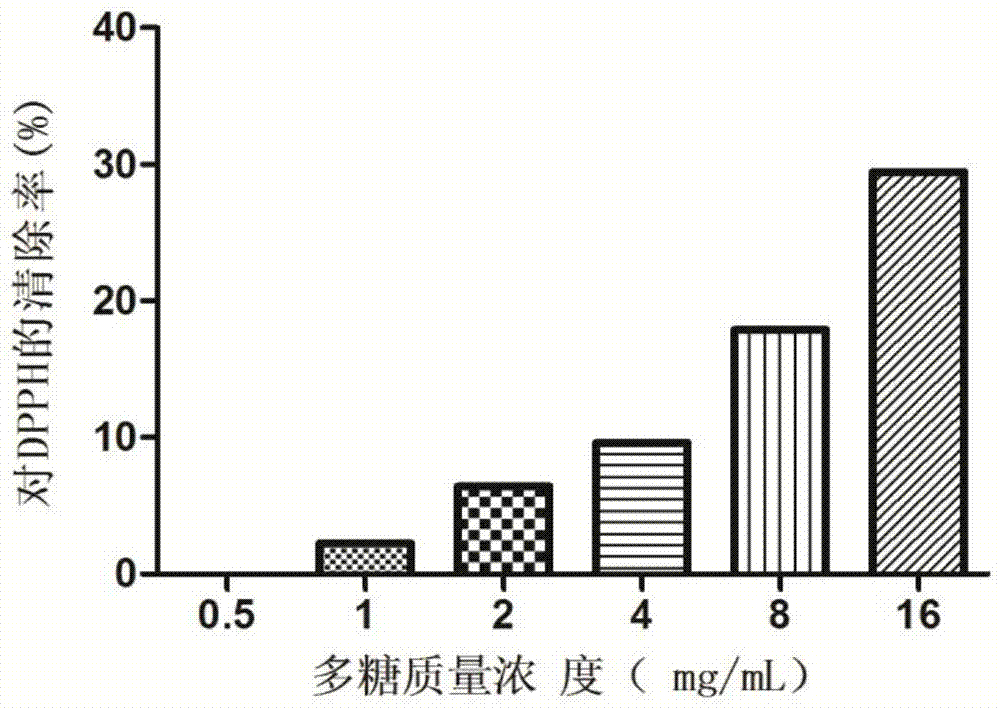
图1为不同浓度的ppc溶液对dpph自由基的清除率试验结果;
图2为不同浓度的ppc溶液对·oh自由基的清除率试验结果;
图3~8为藏红花花瓣多糖对高脂血症小鼠脏器系数的影响;
图9~11为藏红花花瓣多糖对高脂血症小鼠血清葡萄糖、高脂组血清tc、tg的影响。
具体实施方式
本发明提供了藏红花花瓣总多糖的提取方法,包括以下步骤:1)将藏红花花瓣粉末醇提后风干的滤渣与水以1g:(15~25)ml的比例混合置于95~105℃提取2.5~3.5h后固液分离,收集液相组分,获得藏红花花瓣水提液;2)将所述藏红花花瓣水提液醇沉,收集固相组分获得藏红花花瓣水提物固体粉末;3)将所述藏红花花瓣水提物固体粉末复溶,透析后,用阴离子交换柱层析纯化、凝胶柱层析纯化获得藏红花花瓣总多糖。
在本发明中,以藏红花花瓣为原料,所述藏红花花瓣优选为去除藏红花花柱的干燥花瓣。本发明中,所述藏红花花瓣优选的烘干至恒重后进行粉碎获得藏红花花瓣粉末;所述藏红花花瓣粉末的粒度优选的小于30目。本发明中所述藏红花花瓣粉末优选的采用石油醚脱脂后,烘干备用。本发明中所述烘干的温度优选为50~60℃,更优选为56℃。本发明中,所述藏红花花瓣粉末优选的密封避光保存。本发明中所述的醇提优选的包括以下步骤:将上述藏红花花瓣粉末与体积分数为55~65%的乙醇以1g:(15~25)ml的比例混合置于65~75℃提取1.5~2.5h后固液分离,收集固相组分风干后即得到所述滤渣。
本发明将所述滤渣与水以1g:(15~25)ml的比例混合置于95~105℃提取2.5~3.5h后固液分离,收集液相组分,获得藏红花花瓣水提液。在本发明中,所述滤渣与水的比例优选为1g:(18~22)ml,更优选为1g:20ml。本发明中所述提取的温度优选为98~102℃,更优选为100℃;所述提取的时间优选为2.7~3.3h,更优选为3h。本发明在所述提取后进行固液分离,收集液相组分;本发明中,所述固液分离的方法优选为过滤,本发明对所述过滤没有特殊要求,采用本领域常规的纱布过滤、滤纸过滤或膜过滤均可。
本发明在获得所述藏红花花瓣水提液后,将所述藏红花花瓣水提液醇沉。本发明中所述醇沉为将乙醇与所述藏红花花瓣水提液混合,至混合液中乙醇的体积浓度为85~95%,优选为90%。本发明中,所述醇沉的温度优选为4℃,所述醇沉的时间优选为10~16h,更优选为12~14h;本发明在所述醇沉后,进行固液分离,收集固相组分。
将固体组分至于30~50℃,真空干燥10~14小时,即得藏红花花瓣水提物固体粉末。本发明中,所述固液分离的方式优选为离心或过滤;本发明对所述离心或过滤的具体条件没有特殊限定,只要能够实现固液分离即可;本发明中,所述干燥温度优选为40℃,干燥时间为12小时。
本发明在获得所述藏红花花瓣水提物固体粉末进行复溶后透析。在本发明中,所述复溶优选的用蒸馏水进行。在本发明中所述透析的截留分子量优选为2500~3500d,更优选为3000d;所述透析的总时间优选为42~54h,更优选为46~50h,最优选为48h;本发明在所述透析过程中优选的每6~8h换水一次。
本发明在所述透析后,再次浓缩,干燥(方法与藏红花花瓣水提物干燥方法相同)即得藏红花花瓣粗多糖。
得到藏红花花瓣粗多糖后,取100mg样品,超纯水复溶,用阴离子交换柱层析纯化。在本发明中,所述阴离子交换柱优选为deae-sephadexa-50柱。在本发明中,所述deae-sephadexa-50柱的制备采用本领域常规的手段进行,无其他特殊要求。本发明中所述阴离子交换柱层析的上样浓度优选为30~40mg/ml,更优选为31~35mg/ml;本发明中所述阴离子交换柱层析采用0.05~0.6mol/l的nacl溶液梯度洗脱,本发明中,所述梯度洗脱nacl溶液的浓度梯度优选为0.05、0.1、0.2、0.3、0.4、0.5、0.6mol/l;所述洗脱速度优选为0.8~1.2ml/min,更优选为1.0ml/min。在本发明具体实施过程中,自动部分收集器收集洗脱液,4min/管。用硫酸苯酚法测定每管中糖含量。收集糖富集的组分进一步纯化。
本发明在所述阴离子交换柱层析纯化后,将收集到的糖富集组分进行凝胶柱层析。本发明中所述凝胶柱优选为sephadexg-200。在本发明中,所述sephadexg-200柱的制备采用本领域常规的手段进行,无其他特殊要求。本发明中,所述凝胶柱层析的洗脱液为水,所述洗脱流速优选为0.08~0.12ml/min,更优选为0.1ml/min。在本发明具体实施过程中,自动部分收集器收集洗脱下来的液体,20ml/管,测糖含量,收集糖反应呈阳性的组分,经浓缩,干燥(方法与藏红花花瓣水提物干燥方法相同)获得藏红花花瓣总多糖。
本发明提供了上述提取方法制备获得藏红花花瓣总多糖,其中总多糖含量为86.0~91.0%,还原糖的含量为2.5~3.5%,糖醛酸含量为38.5~43.5%,蛋白质含量为2.0~2.2%。
本发明还提供了所述的藏红花花瓣总多糖在制备药品、保健品和化妆品中的应用。
在本发明中,所述的藏红花花瓣总多糖具有清除自由基的作用,对高脂血症具有防治作用,本发明所述藏红花花瓣总多糖无生理毒性,可以应用于药品、保健品和化妆品的制备。本发明对所述藏红花花瓣总多糖在所述药品、保健品和化妆品中的含量没有特殊限定;所述药品、保健品和化妆品中可以只包括所述藏红花花瓣总多糖这一种活性成分,也可以包括所述藏红花花瓣总多糖和其他活性成分;本发明对所述药品、保健品和化妆品中的辅料没有特殊限定,采用常规可接受的辅料即可。本发明中,所述药品包括防治高血脂症的药品。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
精确称取3份醇提后风干的藏红花花瓣粉末,每份2g,分别放于3个相似的三角瓶中,按料水比1:20的比例分别加入40ml蒸馏水,用玻璃棒充分搅拌混匀。塑料保鲜膜封口以后,置于100℃的水浴锅中浸提3h。合并经布氏漏斗抽滤的滤液再重复抽滤一次,之后于旋转蒸发仪中减压浓缩至最小体积,加入乙醇使乙醇最终体积约达到90%,搅拌后放入4℃冰箱静置过夜。所得沉淀物用200目尼龙滤网过滤后收集,于40℃真空干燥箱中干燥12h,得到藏红花花瓣水提物粉末。
将藏红花花瓣水提物粉末用超纯水溶解,转入d3000的透析袋中,两端用透析袋夹子固夹紧,放入超纯水中,4℃透析48h,每隔6h换一次水。透析后用旋转蒸发仪浓缩,放入真空干燥箱中干燥12h,得到藏红花花瓣粗多糖。
阴离子交换柱层析
取8gdeae-sephadexa-50粉末于500ml烧杯中,加入300ml超纯水,沸水浴中溶胀3~4h。溶胀后去掉上层的漂浮的颗粒,用0.5mol/lnaoh浸泡1h,倒入砂芯漏斗用超纯水洗至中性;转入烧杯中用0.5mol/lhcl浸泡0.5h,洗至中性,再用碱洗后洗至中性。加0.05mol/lnacl搅拌,静置半小时后倾去上层颗粒,放入真空泵中抽真空2h。
用0.05mol/lnacl冲洗柱子,用镊子夹住出水管,保留约1/5体积缓冲液,将溶胀好的凝胶一次性装满柱子,连接恒流泵,调节1ml/min的流速,维持此流速冲洗5倍柱体积进行平衡,直至柱床高度稳定。100mg藏红花花瓣粗多糖溶于3ml超纯水上样,用0.05、0.1、0.2、0.3、0.4、0.5、0.6mol/lnacl进行洗脱,流速为1ml/min,自动部分收集器收集洗脱液,4min/管。用硫酸苯酚法测定每管中糖含量。收集糖反应呈阳性部分,浓缩,干燥(方法与藏红花花瓣水提物干燥方法相同),得到糖富集组分,等待进一步纯化。凝胶柱层析
sephadexg-200前处理方法与deae-sephadexa-50类似,溶胀后碱-酸-碱洗后加超纯水抽真空,装柱,平衡。取100mg糖富集组分用3ml超纯水溶解,上样。上样后用超纯水洗脱,流速为0.1ml/min,20ml/管,自动部分收集器收集,收集糖反应呈阳性的组分,干燥后获得藏红花花瓣总多糖。
其中总糖为88.6%、还原糖为3.26%、糖醛酸为42.03%、蛋白质为2.14%。对其单糖组成进行薄层色谱分析,推测藏红花花瓣多糖的单糖组成为葡萄糖醛酸、葡萄糖(也可能为半乳糖)、阿拉伯糖、木糖、鼠李糖,还有一个未知单糖。
实施例2
精确称取3份醇提后风干的藏红花花瓣粉末,每份5g,分别放于3个相似的三角瓶中,按料水比1:20的比例分别加入100ml蒸馏水,用玻璃棒充分搅拌混匀。塑料保鲜膜封口以后,置于98℃的水浴锅中浸提2.8h。合并经布氏漏斗抽滤的滤液再重复抽滤一次,之后于旋转蒸发仪中减压浓缩至最小体积,加入乙醇使乙醇最终体积达到88%,搅拌后放入4℃冰箱静置过夜。所得沉淀物用200目尼龙滤网过滤后收集,于40℃真空干燥箱中干燥12h,得到藏红花花瓣水提物粉末。
将藏红花花瓣水提物粉末用超纯水溶解,转入d3000的透析袋中,两端用透析袋夹子固夹紧,放入超纯水中,4℃透析48h,每隔6h换一次水。透析后用旋转蒸发仪浓缩,放入真空干燥箱中干燥12h,得到藏红花花瓣粗多糖。
阴离子交换柱层析
取8gdeae-sephadexa-50粉末于500ml烧杯中,加入300ml超纯水,沸水浴中溶胀3~4h。溶胀后去掉上层的漂浮的颗粒,用0.5mol/lnaoh浸泡1h,倒入砂芯漏斗用超纯水洗至中性;转入烧杯中用0.5mol/lhcl浸泡0.5h,洗至中性,再用碱洗后洗至中性。加0.05mol/lnacl搅拌,静置半小时后倾去上层颗粒,放入真空泵中抽真空2h。
用0.05mol/lnacl冲洗柱子,用镊子夹住出水管,保留约1/5体积缓冲液,将溶胀好的凝胶一次性装满柱子,连接恒流泵,调节1ml/min的流速,维持此流速冲洗5倍柱体积进行平衡,直至柱床高度稳定。100mg藏红花花瓣粗多糖溶于3ml超纯水上样,用0.05、0.1、0.2、0.3、0.4、0.5、0.6mol/lnacl进行洗脱,流速为1ml/min,自动部分收集器收集洗脱液,4min/管。用硫酸苯酚法测定每管中糖含量。收集糖反应呈阳性部分,浓缩,干燥后,得到糖富集组分,等待进一步纯化。凝胶柱层析
sephadexg-200前处理方法与deae-sephadexa-50类似,溶胀后碱-酸-碱洗后加超纯水抽真空,装柱,平衡。取100mg糖富集组分用3ml超纯水溶解,上样。上样后用超纯水洗脱,流速为0.1ml/min,20ml/管,自动部分收集器收集,收集糖反应呈阳性的组分,干燥后获得藏红花花瓣总多糖。
其中总糖为87.5%、还原糖为3.21%、糖醛酸为42.13%、蛋白质为2.10%。对其单糖组成进行薄层色谱分析,推测藏红花花瓣多糖的单糖组成为葡萄糖醛酸、葡萄糖(也可能为半乳糖)、阿拉伯糖、木糖、鼠李糖,还有一个未知单糖。
实施例3
检测实施例1中获得的藏红花花瓣总多糖对dpph清除能力
将多糖配制成浓度为1,2,4,8,16mg/ml的溶液,按下列步骤测定dpph清除能力,每个浓度三个平行,取平均值。
表1藏红花花瓣总多糖(ppc)对dpph清除能力的实验设置
室温避光放置30min,517nm下测定吸光度
各管平均值标记a1a2a0
清除率(%)=[1-(a1-a2)/a0]×100%
通过6个不同浓度的ppc溶液对dpph自由基的清除率试验结果见图1,我们可以看出随着ppc质量浓度的增加,对dpph自由基的清除作用逐渐增强,具有一定的剂量依赖性。多糖为1mg/ml时开始表现对dpph自由基的清除能力,浓度为16mg/ml时,对dpph自由基的清除能力为29.46%,表现较高的dpph自由基清除活性。
藏红花花瓣总多糖对·oh清除能力
将多糖配制成浓度为2.5,5,10,20,30mg/ml的溶液,按下列步骤测定·oh清除能力,每个浓度三个平行,取平均值。
表2藏红花花瓣总多糖(ppc)对·oh清除能力的实验设置
混匀,37℃水浴30min,12000r/min离心6min,510nm测定吸光度值。
各管平均值标a1a2a0
记
清除率(%)=[1-(a1-a2)/a0]×100%
6个不同浓度的ppc溶液对·oh的清除率如图2所示。随ppc浓度增加,清除作用越来越明显,ppc浓度为10mg/ml时,清除率为30.93%;浓度为20mg/ml时清除率过半,为63.86%。浓度继续增加,清除率增加但效果不成比例。ppc浓度为20mg/ml时即表现较高的oh清除能力。
实施例4
藏红花花瓣总多糖小鼠急性毒性评价
spf级icr小鼠50只,雌雄25只,体重18±2g,购自上海西普尔-必凯实验动物有限公司,动物合格证编号:2008001636633。
将购置的小鼠随机分为五组,每组10只,雌雄各半,分别编号,适应性饲养3天后禁食12小时。第一组为对照组,灌胃等体积溶剂即蒸馏水;其他四组实验组依次按1720mg/kg、2450mg/kg、3500mg/kg、5000mg/kgbw(bodyweight)灌胃藏红花花瓣总多糖(ppc)溶液,组间剂量之比为1:0.7;采用不等浓度等体积的方式灌胃,一天分三次灌完。持续两周,观察相关指标记录死亡数;三天称量一次体重、饮水量和摄食量,两周后脱颈椎处死小鼠,称量心脏、肝脏、脾脏、肾脏和脂肪垫等脏器重量,并计算脏器系数(脏器系数=脏器重量/体重×100%)
生理指标观察记录
给药后观察小鼠死亡情况及死亡时间,精神状态、行为活动、呼吸行为、进食情况以及皮肤、毛发、眼耳口鼻,四肢等。所有数据均采用spss17.0软件进行方差分析,试验所得数据用平均值±标准差的形式表示,组间比较采用anova(单因素方差分析),p<0.05为显著差异,p<0.01为极显著差异。
各组小鼠未出现死亡现象,给药当天3次给药后活动均正常,眼睛未见异常分泌物,皮肤、毛发正常,大小便正常,精神状态正常。给予食物后饮食饮水正常。
实验结果显示:由于各组未出现死亡,因此未测出藏红花花瓣多糖ld50。当灌胃剂量达到5000mg/kg体重时,未见任何毒性反应,处死解剖后肉眼检查各类脏器未发现异常现象,与对照组比较无明显差异,因此推断藏红花花瓣多糖半数致死量大于5000mg/kg体重。
表3小鼠灌胃前后体重的变化
注:与对照组相比*p<0.05,**p<0.01
各组小鼠体重均明显增加,与对照组相比,各剂量组无显著差异(p>0.05)。因此推测灌胃期间藏红花花瓣多糖未对小鼠体重的改变造成影响。
表4和表5所示为各剂量组小鼠心脏、肝脏、脾脏、肾脏、胸腺和脂肪垫的脏器系数。由图表可知,与对照组相比,各剂量组小鼠的脏器系数均无显著性差异(p>0.05)。由此推测灌胃藏红花花瓣多糖对小鼠各脏器不会造成影响。
表4为各剂量组小鼠心脏、肝脏、脾脏的脏器系数
注:与对照组相比*p<0.05,**p<0.01
表5各剂量组小鼠肾脏、胸腺和脂肪垫的脏器系数
注:与对照组相比*p<0.05,**p<0.01
表6小鼠血清tc、tg含量
注:与对照组相比*p<0.05,**p<0.01可知,与对照组相比各剂量组小鼠tg都没有显著性差异(p>0.05),但各组小鼠tc含量均与对照组相比有下降,且差异极显著(p<0.01),高剂量组相比于中低剂量组有也显著降低(p<0.05)。由以上数据推测,对小鼠灌胃藏红花花瓣多糖可能将会影响正常小鼠血清tc含量,但不会影响tg含量。
实施例5
藏红花花瓣总多糖(ppc)对高血脂症的预防作用
试验动物
spf级c57bl/6雄性小鼠50只,体重18±2g,购自上海灵畅生物科技有限公司,动物合格证编号:2013001801015。
正常饲料购自上海斯莱克实验动物有限责任公司,辐照灭菌处理;45%脂肪供能饲料由上述公司定制,辐照灭菌处理,冷冻保存。两种饲料配方如下:
正常饲料配方如表7,45%的脂肪饲料配方如表8所示。
表7正常饲料配方
表845%的脂肪饲料配方
试验设计
50只spf级c57bl/6雄性小鼠于动物实验中心适应性喂养三天,随机分为五组,每组10只:正常组、高脂组、低剂量组、中剂量组、高剂量组。分组后编号,分别饲喂相应饲料,灌胃相应剂量的药物。正常组饲喂正常鼠料,同时灌胃蒸馏水;高脂组饲喂45%脂肪功能的高脂饲料,灌胃蒸馏水;低、中、高剂量组均给予高脂饲料,同时分别灌胃200mg/kgbw、400mg/kgbw、800mg/kgbw的多糖溶液。
采用等体积不等浓度灌胃,每天9:00am灌胃,自由饮食饮水,一周称一次体重、食重、水重。持续给药12周后,每组8只小鼠禁食12h。每组另外两只不禁食。第二天上午眼眶取血后小鼠脱颈椎。解剖,取出肝、肾、脾、心、胸腺、脂肪垫等脏器,称量其湿重,计算脏器系数;并将肝脏及脂肪组织生理盐水漂洗后冻存管分装编号,液氮速冻后转移至-80℃冰箱保存待测。
1.血清生化指标分析
血液于4℃冰箱放置2h,4℃冷冻离心机10000r/min离心10min,分离血清。血清中tc、tg、no、alt、ast、葡萄糖(glu)、hdl-c的测定按所购试剂盒说明书步骤进行,血清中低密度脂蛋白(lowdensitylipoproteincholesterol,ldl-c)及动脉粥样硬化指数(ai)按以下公式计算ldl-c=tc-(hdl-c)-tg/2.2;ai=ldl-c/hdl-c。
2.肝脏生化指标分析
肝脏组织块用冷的生理盐水漂洗后,滤纸吸干,称重按重量/体积比加9倍的生理盐水,组织匀浆器研磨成匀浆,2500r/min离心10min,取上清为10%肝脏组织匀浆,-20℃下保存待测。按照试剂盒说明书测定组织匀浆中tc、tg、no、mda、sod含量。
表9小鼠试验前后体重的变化
注:a表示p<0.05,aa表示p<0.01
本实验前后小鼠体重的变化如表9所示。初始随机分组时,各组小鼠体重没有差异(p>0.05)。经12周饲喂不同饲料、给药处理后,五组小鼠的体重与初始时相比均有极显著增加(p<0.01),且高脂组小鼠体重增加较为明显。与高脂组相比,灌胃藏红花花瓣多糖溶液的各实验组体重略有不同程度的下降,但无显著差异(p>0.05)。
表10高脂小鼠摄食量、饮水量的变化
注:a表示p<0.05,aa表示p<0.01
给药期间每周称量食重和水重,检测得各组小鼠摄食量和饮水量如表10。正常组小鼠因饲喂正常饲料摄食量略高于其余饲喂高脂饲料的各组,但无显著性差异(p>0.05)。与正常组相比,其余各组饮水量均由明显下降(p<0.05),其中低剂量组饮水量与正常组相比有极显著下降(p<0.01),但饲喂高脂饲料各组间无显著差异。对比摄食量和体重增加量,高脂组比正常组食物摄入量少,体重增加量多。3个藏红花给药组食物摄入量与高脂组比相差不大,但体重明显有减少。
藏红花花瓣多糖对高脂血症小鼠脏器系数的影响如图3~8所示。与正常组相比,心、脾、肝、胸腺等脏器没有显著变化(p>0.05),且脾脏系数标准差比较大,可能是由于个体差异造成的;高脂组肾脏有明显显著增加(p<0.05);高脂组和各藏红花给药组脂肪垫系数显著增加(分别为p<0.05,p<0.01,p<0.01,p<0.01)。饲喂高脂饲料组脂肪垫系数显著高于正常饲料组,说明造模成功,高脂饮食增加了小鼠体内脂肪的囤积。
与高脂组相比,心、脾、肾、脂肪垫等脏器没有显著变化(p>0.05);各藏红花给药组肝系数显著增加(分别为p<0.05,p<0.01,p<0.01);藏红花中高剂量组胸腺系数显著增加(分别为p<0.05,p<0.01)。高脂组肝、胸腺系数小于正常组,高脂饮食并未引起肝脏、胸腺肿大,藏红花各给药组肝脏系数和胸腺系数虽有一定程度增加,但与正常组没有显著差异。
藏红花花瓣多糖对高脂血症小鼠血清葡萄糖、高脂组血清tc、tg的影响如图9~11所示;与正常组相比,高脂组血清葡萄糖(血糖)有极显著增加(p<0.01),藏红花各给药组血清葡萄糖均有显著增加(p<0.05);与高脂组比,藏红各给药组血糖有降低趋势,但无显著性差异(p>0.05)。
与正常组相比,高脂组血清tc、tg均有显著升高(分别为p<0.01,p<0.05),说明长时间高脂饮食造成了血脂升高,高脂血症小鼠造模成功。与高脂组相比,藏红花各给药组tc、tg水平均有溶液降低,其中,低剂量组藏红花花瓣多糖可显著降低tc、tg水平(p<0.05),高剂量组可降低显著降低tg水平(p<0.05)。
表11高脂小鼠血清hdl-c、ldl-c及ai水平
注:与正常组相比ap<0.05,aap<0.01;与高脂相比bp<0.05,bbp<0.01;n=10。
试验12周后,与正常组相比,高脂组ldl-c水平极显著升高(p<0.01);但hdl-c水平也显著升高,这可能是由于其tc浓度显著升高(p<0.01)所致,故计算hdl-c与tc比值,高脂组的hdl-c/tc比值下降,但与正常组相比无统计差异。与正常组相比,ai极显著升高(p<0.01),饲喂高脂饲料会显著增加动脉粥样硬化的发病率。
与高脂组相比,给予药物后3个剂量组ldl-c、ldl-c/tc水平均有下降,且低剂量可显著降低ldl-c、ldl-c/tc水平(p<0.05)。hdl-c/tc水平有升高趋势,但无统计意义。与高脂组比,各给药组ai均有不同程度降低,且低剂量组ai值具有显著性差异(p<0.05)。
与高脂组相比,低剂量组藏红花花瓣多糖可显著降低tc、tg水平,高剂量组可降低显著降低tg水平;给予药物后3个剂量组ldl-c、ldl-c/tc水平均有下降,且低剂量可显著降低ldl-c、ldl-c/tc水平。hdl-c/tc水平有升高趋势,但无统计意义;各给药组ai均有不同程度降低,且低剂量组ai值具有显著性差异。此外,藏红花花瓣多糖可在一定程度上降低肝脏中tc、tg含量。这表明藏红花花瓣总多糖能降低血脂水平,有效预防长期高脂饮食引起的高脂血症。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!