化合物以及包括其的光电器件、图像传感器、和电子设备的制作方法
本申请要求于2017年10月20日在韩国知识产权局提交的韩国专利申请no.10-2017-0136882的优先权,将其全部内容引入本文中作为参考。实例实施方式涉及化合物以及包括其的光电器件、图像传感器、和电子设备。
背景技术:
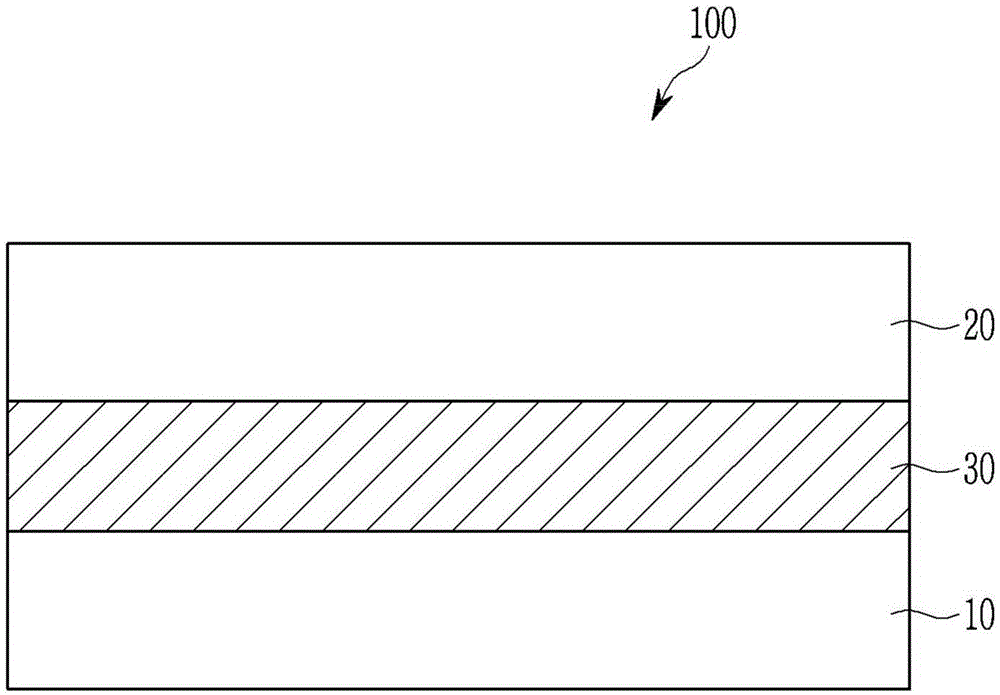
:光电器件利用光电效应将光转换成电信号,它可包括光电二极管、光电晶体管等,并且它可应用于图像传感器、太阳能电池、发光器件等。包括光电二极管的图像传感器可具有高的分辨率且因而小的像素。目前,硅光电二极管被广泛地使用,但是它具有恶化的灵敏度,因为它由于小的像素而具有小的吸收面积。因此,已经研究了能够代替硅的有机材料。有机材料具有高的消光系数并且取决于分子结构而选择性地吸收在特定波长区域中的光,且因而可同时代替光电二极管和滤色器并且结果改善灵敏度和对高的集成作贡献。技术实现要素:实例实施方式提供能够选择性地吸收在绿色波长区域中的光且具有改善的热稳定性的化合物。实例实施方式还提供能够选择性地吸收在绿色波长区域中的光并且在高温工艺期间保持改善的效率的光电器件(例如,有机光电器件)。实例实施方式还提供包括所述光电器件(例如,有机光电器件)的图像传感器。实例实施方式还提供包括所述图像传感器的电子设备。根据实例实施方式,提供由化学式1表示的化合物。[化学式1]在化学式1中,ar3可为如下之一:取代或未取代的具有两个羰基的烃环基团、取代或未取代的具有两个羰基的杂环基团、或其稠合的环,r1-r3可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r1和r2可独立地存在或彼此连接以提供环,ar1和ar2可独立地为如下之一:取代或未取代的c6-c30芳烃基团、取代或未取代的c3-c30杂芳烃基团、或其以稠环形式的组合,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n可为1或2。在一些实施方式中,在化学式1中,ar3可为由化学式2a至化学式2d之一表示的环状基团。[化学式2a]在化学式2a中,y1可为n或cra之一(其中ra为如下之一:氢、氘、或者取代或未取代的c1-c10烷基),r11、r12、r13、r14、和r15可为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,或者r12和r13以及r14和r15可独立地彼此连接以提供芳族环,m1可为0或1,化学式2a中的n可为0或1,和*可为连接点。[化学式2b]在化学式2b中,y2可为o、s、se、te、和c(ra)(cn)之一(其中ra可为如下之一:氢、氰基(-cn)、或c1-c10烷基),r11和r12可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基(-cn)、或其组合,和*为连接点。[化学式2c]在化学式2c中,g1可为如下之一:-s-、-se-、-gerxry-、或-te-,其中rx和ry可相同或不同且可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,r11和r12可相同或不同且可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基、含有氰基的基团、或其组合,和*为连接点。[化学式2d]在化学式2d中,g2为如下之一:-s-、-se-、-gerxry-、或-te-,其中rx和ry相同或不同且独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,r11和r12可相同或不同且可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基、含有氰基的基团、或其组合,和*为连接点。在化学式1中,ar1和ar2的至少一个可在1位上包括杂原子,和所述杂原子可为如下之一:氮(n)、硫(s)、或硒(se)。在一些实施方式中,化学式1中的含n的杂芳族环电子给体部分(即,)可由化学式4a至化学式4e之一表示。[化学式4a]在化学式4a中,g可与化学式1中相同,和r4a-r4d和r5a-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合。r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5a-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环。[化学式4b]在化学式4b中,g可与化学式1中相同,r4a-r4d和r5b-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合。r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环。[化学式4c]在化学式4c中,g可与化学式1中相同,r4b-r4d和r5b-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合。r4b-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环。[化学式4d]在化学式4d中,g可与化学式1中相同,和r4a-r4d以及r5b和r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合。r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环。[化学式4e]在化学式4e中,g可与化学式1中相同,和r4a-r4d以及r5b和r5c可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合。r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b和r5c可彼此连接以提供5元芳族环或6元芳族环。在一些实例实施方式中,所述化合物在薄膜状态中可在大于或等于约500nm且小于或等于约600nm的波长区域中具有最大吸收波长(λ最大)。在一些实例实施方式中,所述化合物在薄膜状态中可呈现出具有约50nm-约120nm的半宽度(fwhm)的光吸收曲线。在一些实例实施方式中,在所述化合物的熔点与在其下所述化合物的初始重量的10重量%可损失的温度(沉积温度)之间的差异可大于或等于约3℃。根据一些实例实施方式,光电器件(例如,有机光电器件)可包括彼此面对的第一电极和第二电极以及在所述第一电极和所述第二电极之间的活性层,和所述活性层可包括由化学式1表示的化合物。根据一些实例实施方式,图像传感器可包括所述光电器件(例如,有机光电器件)。在一些实例实施方式中,所述图像传感器可包括半导体基板和在所述半导体基板上的光电器件。所述半导体基板可集成有配置成感测在蓝色波长区域中的光的多个第一光感测器件和配置成感测在红色波长区域中的光的多个第二光感测器件,且在所述半导体基板上的所述光电器件可配置成选择性地感测在绿色波长区域中的光。在一些实例实施方式中,所述第一光感测器件和所述第二光感测器件可在所述半导体基板中在竖直方向上堆叠。在一些实例实施方式中,所述图像传感器可进一步包括滤色器层,且所述滤色器层可包括配置成选择性地透射在蓝色波长区域中的光的蓝色过滤器和配置成选择性地透射在红色波长区域中的光的红色过滤器。在一些实例实施方式中,所述图像传感器可包括可堆叠的绿色光电器件、配置成选择性地吸收在蓝色波长区域中的光的蓝色光电器件、和配置成选择性地吸收在红色波长区域中的光的红色光电器件。所述绿色光电器件可为上述光电器件(例如,有机光电器件)。根据一些实例实施方式,电子设备包括所述图像传感器。所述化合物可选择性地吸收在绿色波长区域中的光并且具有改善的热稳定性。包括所述化合物的所述光电器件(例如,有机光电器件)、图像传感器、和电子设备可由于改善的波长选择性而呈现出高的效率,并且即使经历高温工艺也可不呈现出性能的降低。附图说明图1为根据一种实例实施方式的光电器件的横截面图,图2为根据另一实例实施方式的光电器件的横截面图,图3为显示根据一种实例实施方式的有机cmos图像传感器的示意性顶部俯视图,图4为显示图3的有机cmos图像传感器的横截面图,图5为显示根据一种实例实施方式的有机cmos图像传感器的横截面图,图6为显示根据另一实例实施方式的有机cmos图像传感器的示意性横截面图,图7为显示根据另一实例实施方式的有机cmos图像传感器的示意性横截面图,和图8为显示根据另一实例实施方式的有机cmos图像传感器的示意图。具体实施方式将在下文中详细地描述实例实施方式,并且其可由本领域技术人员容易地执行。然而,本公开内容可以许多不同的形式体现且将不被解释为限于本文中阐明的实例实施方式。在附图中,为了清楚,层、膜、面板、区域等的厚度被放大。在整个说明书中相同的附图标记表示相同的元件。将理解,当一个元件例如层、膜、区域、或基板被称为“在”另外的元件“上”时,其可直接在所述另外的元件上或者还可存在中间元件。相反,当一个元件被称为“直接在”另外的元件“上”时,则不存在中间元件。在附图中,为了实施方式的清楚,省略了与描述没有关系的部分,并且在整个说明书中相同或类似的构成元件(要素)由相同的附图标记表示。表述例如“的至少一种(个)”当在要素列表(例如a、b和c)之前或之后时,修饰整个要素列表而不修饰所述列表的单独要素。例如,“a、b和c的至少一种”、“a、b或c的至少一种”、“a、b、c、或其组合之一”、以及“a、b、c、及其组合之一”分别可被解释为覆盖以下组合的任一个:a;b;a和b;a和c;b和c;以及a、b、和c”。如本文中使用的,当未另外提供定义时,“取代(的)”指的是化合物或基团的氢被如下的至少一种代替:卤素原子(f、br、cl、或i)、羟基、硝基、氰基、氨基、叠氮基、脒基、肼基、腙基、羰基、氨基甲酰基、硫醇基、酯基、羧基或其盐、磺酸基团或其盐、磷酸基团或其盐、c1-c20烷基、c1-c20烷氧基、c2-c20烯基、c2-c20炔基、c6-c30芳基、c7-c30芳烷基、c2-c20杂芳基、c3-c20杂芳烷基、c3-c30环烷基、c3-c15环烯基、c6-c15环炔基、c2-c20杂环烷基、=s、及其组合。如本文中使用的,当未另外提供具体定义时,“杂”指的是包括选自n、o、s、p、和si的1-3个杂原子。如本文中使用的,“烷基”指的是直链或支化的饱和单价烃基,例如,甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基、戊基、己基等。如本文中使用的,“环烷基”指的是其中所有成环原子为碳的饱和的单价环状烃基,例如,环丙基、环丁基、环戊基、环己基等。如本文中使用的,“芳基”指的是其中环的所有元素具有形成共轭的p轨道的基团,并且可为单环、多环或稠合多环(例如,共享相邻的碳原子对的环)官能团。如本文中使用的,当未另外提供定义时,“含有氰基的基团”指的是其中至少一个氢被氰基代替的单价基团例如c1-c30烷基、c2-c30烯基、或c2-c30炔基。所述含有氰基的基团还可指二价基团例如由=crx'-(crxry)p-cry'(cn)2表示的基团,其中rx、ry、rx'、和ry'相同或不同且独立地为氢和c1-c10烷基之一,并且p为0-10或1-10)的整数。所述含有氰基的基团的具体实例可为二氰基甲基、二氰基乙烯基、氰基乙炔基等。术语“含有氰基的基团”不涵盖氰基(-cn)本身。如本文中使用的,当未另外提供定义时,“其组合”指的是通过单键或者c1-c10亚烷基彼此结合的至少两个基团,或者至少两个彼此稠合的基团。如本文中使用的,“烃环基团”可指的是芳烃环(芳族环)和脂环族烃环(非芳族环)的稠合的环,并且可为例如其中至少一个芳烃环例如c6-c30芳基、例如c6-c20芳基或c6-c10芳基与至少一个脂环族烃环例如c3-c30环烷基、例如c3-c20环烷基或c3-c10环烷基彼此稠合的稠合的环。如本文中使用的,“芳烃基团”可指的是具有芳族环的烃基团,并且包括单环和多环烃,其中所述多环烃的额外的(一个或多个)环可为芳族的或非芳族的。“杂芳烃基团”可指的是在环中包括选自n、o、s、p、和si的一至三个杂原子的芳烃基团。如本文中使用的,“杂环基团”可指的是通过将在芳烃基团(例如c6-c30芳基、c6-c20芳基或c6-c10芳基)、脂环族烃基团(例如c3-c30环烷基、c3-c20环烷基、或c3-c10环烷基)、或它们的稠环的环中的一至三个碳原子用选自n、o、s、p、和si的杂原子代替而获得的基团。所述杂环基团的环中的一个或多个碳原子可任选地被=s取代,即,可形成硫羰基(c=s)。如本文中使用的,“c6-c30芳族烃基团”可包括c6-c30芳基例如苯基或萘基,c6-c30亚芳基等,但不限于此。如本文中使用的,“脂族烃基团”可为例如c1-c15烷基例如甲基、乙基、或丙基;c1-c15亚烷基;c2-c15烯基例如乙烯基或丙烯基;c2-c15亚烯基;c2-c15炔基例如乙炔基或丙炔基;c2-c15亚炔基;等等,但不限于此。如本文中使用的,“5元芳族环”可指的是具有共轭结构的5元环状基团(例如,c5芳基)或具有共轭结构的5元杂环基团(例如,c2-c4杂芳基)。如本文中使用的,“6元芳族环”指的是具有共轭结构的6元环状基团(例如,c6芳基)或具有共轭结构的6元杂环基团(例如,c2-c5杂芳基),但不限于此。芳族环可包括所述5元芳族环或所述6元芳族环,但不限于此。如本文中使用的,“最大吸收波长”指的是在其处吸光度最大的波长,也可称为“峰值吸收波长”。在下文中,描述根据实施方式的化合物。所述化合物由化学式1表示。[化学式1]在化学式1中,ar3可为如下之一:取代或未取代的具有两个羰基的烃环基团、取代或未取代的具有两个羰基的杂环基团、或其稠合的环,r1-r3可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r1和r2可独立地存在或彼此连接以提供环,ar1和ar2可独立地为如下之一:取代或未取代的c6-c30芳烃基团、取代或未取代的c3-c30杂芳烃基团、或其以稠环形式的组合,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、和单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。由化学式1表示的化合物包括含n的杂芳族环电子给体部分、包括含te的5元环的连接体、和由ar3表示的电子受体部分。在化学式1中,由ar3表示的环状基团为电子受体部分且包括至少两个羰基。ar3可为如下之一:取代或未取代的具有两个羰基的烃环基团、取代或未取代的具有两个羰基的杂环基团、或其稠合的环,在一些实施方式中,ar3可为如下之一:取代或未取代的5元芳族环、取代或未取代的6元芳族环、或前述环的两个或更多个的稠环。在化学式1中,ar3可为由化学式2a至化学式2d之一表示的环状基团。[化学式2a]在化学式2a中,y1可为n或cra之一(其中ra为如下之一:氢、氘、或者取代或未取代的c1-c10烷基),r11、r12、r13、r14、和r15可为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,或者r12和r13以及r14和r15可独立地彼此连接以提供芳族环,m1可为0或1,化学式2a中的n可为0或1,和*可为连接点。[化学式2b]在化学式2b中,y2可为o、s、se、te、或c(ra)(cn)之一(其中ra可为如下之一:氢、氰基(-cn)、或c1-c10烷基),r11和r12可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基(-cn)、或其组合,和*可为连接点。[化学式2c]在化学式2c中,g1可为如下之一:-s-、-se-、-gerxry-、或-te-,其中rx和ry可相同或不同且可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,r11和r12可相同或不同且可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基、含有氰基的基团、或其组合,和*可为连接点。[化学式2d]在化学式2d中,g2可为如下之一:-s-、-se-、-gerxry-、或-te-,其中rx和ry相同或不同且独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,r11和r12可相同或不同且可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基、含有氰基的基团、或其组合,和*可为连接点。由化学式2a表示的环状基团可为例如由化学式2a-1或2a-2表示的环状基团。[化学式2a-1][化学式2a-2]在化学式2a-1和2a-2中,y1、r11、m1、和n与在化学式2a中相同,r12a、r12b、和r14a可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,m2、m3、和m4可独立地为范围0-4的整数,和ph1和ph2表示稠合的亚苯基环,条件是可任选地省略ph1和ph2之一。由化学式2b表示的环状基团可为例如由化学式2b-1、2b-2、或2b-3表示的环状基团。[化学式2b-1][化学式2b-2][化学式2b-3]在化学式2b-1、2b-2、和2b-3中,r11和r12与在化学式2b中相同。所述含n的杂芳族环的ar1和ar2通过g连接且由此提供一个总的共轭结构以改善所述化合物的热稳定性。这样的共轭结构可通过使三至四个5元或6元芳族环稠合而形成,但不限于此。ar1和ar2可独立地为如下之一:取代或未取代的c6-c30芳烃基团、取代或未取代的c3-c30杂芳烃基团、或其以通过使芳族环稠合而形成的稠环形式的组合。例如,ar1和ar2可独立地为如下之一:取代或未取代的c6-c20芳烃基团、取代或未取代的c3-c20杂芳烃基团、或其以通过使芳族环稠合而形成的稠环形式的组合。在一些实例实施方式中,所述芳烃基团可为苯、萘、和蒽之一,并且所述杂芳烃基团可为吡咯、吡唑、咪唑、唑、异唑、噻唑、异噻唑、吡啶、哒嗪、嘧啶、吡嗪、吲哚、喹啉、异喹啉、萘啶、噌啉、喹唑啉、酞嗪、苯并三嗪、吡啶并吡嗪、吡啶并嘧啶、吡啶并哒嗪、噻吩、苯并噻吩、硒吩或苯并硒吩之一。在化学式1中,在所述包括含te的5元环的连接体的te和所述电子受体部分的羰基的氧(o)之间的分子内相互作用可增加且由此在特定波长处的吸收强度可得以改善。在所述包括含te的5元环的连接体中,r1和r2可独立地存在或者彼此连接以提供环。当它们提供环时,所述连接体可由化学式3a或化学式3b表示。[化学式3a][化学式3b]在化学式3a和化学式3b中,r可为如下之一:氢、c1-c10烷基、c6-c10芳基、c2-c10杂芳基、或卤素,和a和b独立地为范围1-4的整数。在化学式1中,ar1和ar2的至少一个可在1位处包括杂原子,和所述杂原子可为如下之一:氮(n)、硫(s)、或硒(se)。在此情况下,te、所述电子受体部分的羰基的氧(o)、以及在ar1和ar2的至少一个中的1位处的所述杂原子使分子内相互作用增加且由此改善在特定波长处的吸收强度。化学式1中的含n的杂芳族环电子给体部分可由化学式4a表示。[化学式4a]在化学式4a中,r4a-r4d和r5a-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5a-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、和si的至少一个(种)杂原子。在化学式4a中,当g为-sirgrh-、-gerirj-、或-(c(rm)=c(rn))-时,它可由化学式4a-1、化学式4a-2、或化学式4a-3表示。[化学式4a-1][化学式4a-2][化学式4a-3]在化学式4a-1、化学式4a-2、或化学式4a-3中,r4a-r4d和r5a-r5d与化学式4a中相同,和rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基。在化学式4a中,当g为-sirggrhh-、-geriirjj-、或-(c(rmm)=c(rnn))-时,它可由化学式4aa-1、化学式4aa-2、或化学式4aa-3表示。[化学式4aa-1][化学式4aa-2][化学式4aa-3]在化学式4aa-1、化学式4aa-2、或化学式4aa-3中,r4a-r4d和r5a-r5d与化学式4a中相同,和rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。化学式1中的含n的杂芳族环电子给体部分可由化学式4b表示。[化学式4b]在化学式4b中,r4a-r4d和r5b-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。在化学式4b中,当g为-sirgrh-、-gerirj-、或-(c(rm)=c(rn))-时,它可由化学式4b-1、化学式4b-2或化学式4b-3表示。[化学式4b-1][化学式4b-2][化学式4b-3]在化学式4b-1、化学式4b-2、或化学式4b-3中,r4a-r4d和r5b-r5d与在化学式4b中相同,和rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基。在化学式4b中,当g为-sirggrhh-、-geriirjj-、或-(c(rmm)=c(rnn))-时,它可由化学式4bb-1、化学式4bb-2、或化学式4bb-3表示。[化学式4bb-1][化学式4bb-2][化学式4bb-3]在化学式4bb-1、化学式4bb-2、或化学式4bb-3中,r4a-r4d和r5b-r5d与在化学式4b中相同,和rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。化学式1中的含n的杂芳族环电子给体部分可由化学式4c表示。[化学式4c]在化学式4c中,r4b-r4d和r5b-r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r4b-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b-r5d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。在化学式4c中,当g为-sirgrh-、-gerirj-、或-(c(rm)=c(rn))-时,它可由化学式4c-1、化学式4c-2、或化学式4c-3表示。[化学式4c-1][化学式4c-2][化学式4c-3]在化学式4c-1、化学式4c-2、或化学式4c-3中,r4b-r4d和r5b-r5d与在化学式4c中相同,和rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基。在化学式4c中,当g为-sirggrhh-、-geriirjj-、或-(c(rmm)=c(rnn))-时,它可由化学式4cc-1、化学式4cc-2、或化学式4cc-3表示。[化学式4cc-1][化学式4cc-2][化学式4cc-3]在化学式4cc-1、化学式4cc-2、或化学式4cc-3中,r4b-r4d和r5b-r5d与在化学式4c中相同,和rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。化学式1中的含n的杂芳族环电子给体部分可由化学式4d表示。[化学式4d]在化学式4d中,r4a-r4d以及r5b和r5d可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。在化学式4d中,当g为-sirgrh-、-gerirj-、或-(c(rm)=c(rn))-时,它可由化学式4d-1、化学式4d-2、或化学式4d-3表示。[化学式4d-1][化学式4d-2][化学式4d-3]在化学式4d-1、化学式4d-2、或化学式4d-3中,r4a-r4d以及r5b和r5d与在化学式4d中相同,和rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基。在化学式4d中,当g为-sirggrhh-、-geriirjj-、或-(c(rmm)=c(rnn))-时,它可由化学式4dd-1、化学式4dd-2、或化学式4dd-3表示。[化学式4dd-1][化学式4dd-2][化学式4dd-3]在化学式4dd-1、化学式4dd-2、或化学式4dd-3中,r4a-r4d以及r5b和r5d与在化学式4d中相同,和rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。化学式1中的含n的杂芳族环电子给体部分可由化学式4e表示。[化学式4e]在化学式4e中,r4a-r4d以及r5b和r5c可独立地为如下之一:氢、取代或未取代的c1-c30烷基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、氰基(-cn)、含有氰基的基团、或其组合,r4a-r4d的两个相邻的基团可彼此连接以提供5元芳族环或6元芳族环,或者r5b和r5c可彼此连接以提供5元芳族环或6元芳族环,和g可为如下之一:-(crdre)n-、-o-、-s-、-se-、-n=、-nrf-、-sirgrh-、-sirggrhh-、-gerirj-、-geriirjj-、-(c(rm)=c(rn))-、-(c(rmm)=c(rnn))-、或单键(其中rd、re、rf、rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,其中rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构),且-(crdre)n-中的n为1或2。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。在化学式4e中,当g为-sirgrh-、-gerirj-、或-(c(rm)=c(rn))-时,它可由化学式4e-1、化学式4e-2、或化学式4e-3表示。[化学式4e-1][化学式4e-2][化学式4e-3]在化学式4e-1、化学式4e-2、或化学式4e-3中,r4a-r4d以及r5b和r5c与在化学式4e中相同,和rg、rh、ri、rj、rm、和rn可独立地为如下之一:氢、卤素、取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基。在化学式4e中,当g为-sirggrhh-、-geriirjj-、或-(c(rmm)=c(rnn))-时,它可由化学式4ee-1、化学式4ee-2、或化学式4ee-3表示。[化学式4ee-1][化学式4ee-2][化学式4ee-3]在化学式4ee-1、化学式4ee-2、或化学式4ee-3中,r4a-r4d以及r5b和r5c与在化学式4e中相同,和rgg、rhh、rii、rjj、rmm、和rnn可独立地为如下之一:取代或未取代的c1-c10烷基、或者取代或未取代的c6-c10芳基,并且rgg和rhh、rii和rjj、或者rmm和rnn的至少一对可彼此连接以提供环结构。通过将rgg和rhh、rii和rjj、或者rmm和rnn连接而形成的环结构可为螺环结构或者稠合的环或者例如5元或6元环结构。所述环结构可在其中包括n、o、s、p、或si的至少一个杂原子。由化学式1表示的化合物的具体实例可为化学式5a、化学式5b、化学式5c、化学式5d、和化学式5e的化合物之一,但不限于此。[化学式5a]在化学式5a中,各芳族环的氢可被选自如下的取代基代替:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素(f、cl、br、i)、氰基(-cn)、含有氰基的基团、及其组合,且r1a和r1b可独立地为c1-c6烷基。[化学式5b]在化学式5b中,r11和r12与化学式2b中相同,各芳族环的氢可被选自如下的取代基代替:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素(f、cl、br、或i)、氰基(-cn)、含有氰基的基团、及其组合,且r1a和r1b可独立地为c1-c6烷基。[化学式5c]在化学式5c中,各芳族环的氢可被选自如下的取代基代替:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素(f、cl、br、或i)、氰基(-cn)、含有氰基的基团、及其组合,且r1a和r1b可独立地为c1-c6烷基。[化学式5d]在化学式5d中,各芳族环的氢可被选自如下的取代基代替:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素(f、cl、br、或i)、氰基(-cn)、含有氰基的基团、及其组合,且r1a和r1b可独立地为c1-c6烷基。[化学式5e]在化学式5e中,各芳族环的氢可被选自如下的取代基代替:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c4-c30杂芳基、卤素(f、cl、br、或i)、氰基(-cn)、含有氰基的基团、及其组合,且r1a和r1b可独立地为c1-c6烷基。所述化合物为选择性地吸收在绿色波长区域中的光的化合物,并且可在大于或等于约500nm-约600nm、例如大于或等于约530nm、大于或等于约535nm、或大于或等于约540nm且小于或等于约590nm、或小于或等于约580nm的波长区域中具有最大吸收波长(λ最大)。所述化合物在薄膜状态中可呈现出具有约50nm-约130nm、例如约50nm-约120nm的半宽度(fwhm)的光吸收曲线。在这里,fwhm为与最大吸收点的高度的一半对应的波长的宽度。当半宽度(fwhm)是小的时,通过选择性地吸收在窄的波长区域中的光,波长选择性增加。当所述半宽度(fwhm)在所述范围内时,在绿色波长区域中的选择性可增加。所述薄膜可为在真空条件下沉积的薄膜。所述化合物可通过使用沉积方法形成为薄膜。所述沉积方法可提供均匀的薄膜并且具有小的向所述薄膜中包括杂质的可能性,但是当所述化合物具有比用于沉积的温度低的熔点时,由所述化合物分解的产物可沉积且因而器件的性能可恶化。因此,所述化合物合乎需要地具有比所述沉积温度高的熔点。所述化合物具有例如比所述沉积温度高至少约3℃、例如至少约10℃的熔点且因而可合乎需要地用于沉积。特别地,由化学式1表示的给体/受体型材料可在其熔点(tm)热分解,因为该材料的熔点(tm)与分解温度(td)类似。因此,如果所述材料具有比在其下所述材料真空沉积以形成膜的升华温度(沉积温度,ts)低的tm,则所述材料可在升华(沉积)之前分解且无法用于制造器件。由于对于该材料而言,tm高于ts,且合乎需要地,tm-ts≥3℃,例如tm-ts≥10℃,因此该材料适合用于制造稳定的图像传感器。另外,在图像传感器的制造期间在制造光电器件(有机光电器件)之后需要形成微透镜阵列(mla)以使光聚集。该微透镜阵列需要相对高的温度(约160℃或更大、170℃或更大、180℃或更大、或190℃或更大),且该退火过程可使所述光电器件的性能恶化。在mla的退火过程期间所述光电器件的性能恶化可不是由有机材料的化学分解、而是由其形态变化引起。所述形态变化通常是在材料由于退火过程而开始热振动时引起的,但是具有稳固的分子结构的材料可不具有热振动且可被防止由所述退火过程所致的恶化。所述化合物可由于在给体区域中的共轭结构(式1中的含有g的结构)而被抑制分子的热扰动并且在mla退火过程期间被稳定地保持且因而保证工艺稳定性。所述化合物可为p型半导体化合物。由于所述化合物可起到p型半导体的作用,因此所述化合物可被适当地使用,只要它具有比n型半导体高的lumo能级。例如,当将所述化合物与n型材料例如富勒烯混合时,所述化合物合乎需要地具有比具有4.2ev的lumo能级的富勒烯高的lumo能级。对于所述化合物的合乎需要的homo-lumo能级,当所述化合物具有范围约5.2ev至约5.8ev的homo能级和范围约1.4ev-约2.6ev的能带隙时,所述化合物的lumo能级在约3.8ev-约3.2ev的范围内。具有在所述范围内的homo能级、lumo能级、和能带隙的所述化合物可用作有效地吸收在绿色波长区域中的光的p型半导体化合物,且因而具有高的外量子效率(eqe)且结果改善光电转换效率。在一些实例实施方式中,鉴于薄膜形成,可稳定地沉积的化合物是合乎需要的且因而所述化合物具有约300g/mol-约1500g/mol的分子量。然而,即使所述化合物具有在所述范围之外的分子量,也可没有限制地使用任何可升华的(可沉积的)化合物。另外,当将所述化合物使用涂覆工艺形成为薄膜时,可没有限制地使用被溶解在溶剂中并且被涂覆的化合物。在下文中,参照附图描述包括根据实例实施方式的化合物的光电器件。图1为显示根据一种实例实施方式的光电器件的横截面图。参照图1,根据一种实例实施方式的光电器件100包括第一电极10和第二电极20、以及在第一电极10和第二电极20之间的活性层30。第一电极10和第二电极20之一为阳极且另一个为阴极。第一电极10和第二电极20的至少一个可为光透射电极,且所述光透射电极可由例如透明导体例如氧化铟锡(ito)或氧化铟锌(izo)、或者薄的单层或多层的金属薄层制成。当第一电极10和第二电极20之一为非光透射电极时,其可由例如不透明导体制成。所述不透明导体可为金属例如铝(al)。活性层30包括p型半导体和n型半导体以形成pn结,并且吸收外部光以产生激子,然后将所产生的激子分离成空穴和电子。活性层30包括由化学式1表示的化合物。所述化合物可充当活性层30中的p型半导体化合物。所述化合物为选择性地吸收在绿色波长区域中的光的化合物,且包括所述化合物的活性层30可在大于或等于约500nm且小于或等于约600nm例如大于或等于约530nm、大于或等于约535nm、或大于或等于约540nm且小于或等于约590nm、或小于或等于约580nm的波长区域中具有最大吸收波长(λ最大)。活性层30可呈现出具有约50nm-约130nm、例如约50nm-约120nm的相对窄的半宽度(fwhm)的光吸收曲线。因此,活性层30具有高的对于在绿色波长区域中的光的选择性。所述活性层当以约0.9:1-约1.1:1、例如约1:1的体积比包括由化学式1表示的化合物和c60时可具有大于或等于约5.5×104cm-1、例如约5.8×104cm-1-约10×104cm-1、或约7.0×104cm-1-约10×104cm-1的吸收系数。活性层30可进一步包括用于形成pn结的n型半导体化合物。所述n型半导体化合物可为亚酞菁或亚酞菁衍生物、富勒烯或富勒烯衍生物、噻吩或噻吩衍生物、或其组合。所述富勒烯可包括如下之一:c60、c70、c76、c78、c80、c82、c84、c90、c96、c240、c540、或其混合物、或富勒烯纳米管等。所述富勒烯衍生物可指的是具有连接到其的取代基的这些富勒烯的化合物。所述富勒烯衍生物可包括取代基例如烷基(例如,c1-c30烷基)、芳基(例如,c6-c30芳基)、或杂环基团(例如,c3-c30环烷基)。所述芳基和杂环基团的实例可为苯环、萘环、蒽环、菲环、芴环、苯并[9,10]菲环、并四苯环、联苯环、吡咯环、呋喃环、噻吩环、咪唑环、唑环、噻唑环、吡啶环、吡嗪环、嘧啶环、哒嗪环、吲嗪环、吲哚环、苯并呋喃环、苯并噻吩环、异苯并呋喃环、苯并咪唑环、咪唑并吡啶环、喹嗪环、喹啉环、酞嗪环、萘啶环、喹喔啉环、喹喔唑啉(quinoxazoline)环、异喹啉环、咔唑环、菲啶环、吖啶环、菲咯啉环、噻蒽环、色烯环、呫吨环、吩嗪环、吩噻(phenoxathiin)环、吩噻嗪环、或吩嗪环。所述亚酞菁或所述亚酞菁衍生物可由化学式6表示。[化学式6]在化学式6中,r31-r33可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂芳基、卤素、含有卤素的基团、或其组合,a、b、和c可为范围1-3的整数,和z可为单价取代基。例如,z可为卤素或含有卤素的基团例如f、cl、含有f的基团、或含有cl的基团。所述卤素可指的是f、cl、br、或i且所述含有卤素的基团指的是其中氢的至少一个被f、cl、br、或i代替的烷基(例如c1-c30烷基)。所述噻吩衍生物可例如由化学式7或化学式8表示,但不限于此。[化学式7][化学式8]ewg1-t1-t2-t3-ewg2在化学式7和8中,t1、t2、和t3可为包括取代或未取代的噻吩部分的芳族环,t1、t2、和t3可独立地存在或彼此稠合,x3-x8可独立地为如下之一:氢、氘、取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂环基团、氰基、或其组合,和ewg1和ewg2可独立地为吸电子基团。例如,在化学式8中,x3-x8的至少一个可为吸电子基团例如含有氰基的基团。活性层30可进一步包括选择性地吸收绿色光的第二p型半导体化合物。所述第二p型半导体化合物可为由化学式9表示的化合物。[化学式9]在化学式9中,r41-r43可独立地为如下之一:氢、取代或未取代的c1-c30脂族烃基团、取代或未取代的c6-c30芳族烃基团、取代或未取代的c1-c30脂族杂环基团、取代或未取代的c2-c30芳族杂环基团、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳氧基、硫醇基、取代或未取代的c1-c30烷硫基、取代或未取代的c6-c30芳硫基、氰基、含有氰基的基团、卤素、含有卤素的基团、取代或未取代的磺酰基(例如,取代或未取代的c0-c30氨基磺酰基、取代或未取代的c1-c30烷基磺酰基或者取代或未取代的c6-c30芳基磺酰基)、或其组合,或者r41-r43的两个相邻的基团彼此连接以提供稠合的环,l1-l3可独立地为如下之一:单键、取代或未取代的c1-c30亚烷基、取代或未取代的c6-c30亚芳基、二价的取代或未取代的c3-c30杂环基团、或其组合,r51-r53可独立地为如下之一:取代或未取代的c1-c30烷基、取代或未取代的c1-c30烷氧基、取代或未取代的c6-c30芳基、取代或未取代的c3-c30杂环基团、取代或未取代的c1-c30烷氧基、取代或未取代的胺基(例如,取代或未取代的c1-c30烷基胺基或者取代或未取代的c6-c30芳基胺基)、取代或未取代的甲硅烷基、或其组合,a至c可独立地为范围0-4的整数。基于100重量份的由化学式1表示的化合物,可以约500-约1500重量份的量包括所述选择性地吸收绿色光的第二p型半导体化合物。活性层30可为单层或多层。活性层30可为例如本征层(i层)、p型层/i层、i层/n型层、p型层/i层/n型层、或p型层/n型层等。所述本征层(i层)可以约1:100-约100:1的比率包括化学式1的化合物和所述n型半导体化合物。可在所述范围内以约1:50-约50:1、特别地约1:10-约10:1、和更特别地约1:1的比率包括化学式1的化合物和所述n型半导体化合物。当化学式1的化合物和所述n型半导体化合物具有在所述范围内的组成比时,可有效地产生激子,且可有效地形成pn结。所述p型层可包括化学式1的半导体化合物,和所述n型层可包括所述n型半导体化合物。活性层30可具有约1nm-约500nm且特别地约5nm-约300nm的厚度。当活性层30具有在所述范围内的厚度时,所述活性层可有效地吸收光,有效地将空穴与电子分离,并且传送它们,由此有效地改善光电转换效率。活性层30的最佳厚度可例如由活性层30的吸收系数决定,并且可为例如能够吸收至少约70%或更多、例如约80%或更多、和又例如约90%的光的厚度。在光电器件100中,当光从第一电极10和/或第二电极20进入时,和当活性层30吸收在期望的(和/或替代地预定的)波长区域中的光时,可从内部产生激子。所述激子在活性层30中被分离成空穴和电子,且分离的空穴被传输到作为第一电极10和第二电极20之一的阳极且分离的电子被传输到作为第一电极10和第二电极20的另一个的阴极以使电流在所述光电器件中流动。在下文中,参照图2描述根据另一实例实施方式的光电器件。图2为显示根据另一实例实施方式的光电器件的横截面图。参照图2,像以上实施方式一样,根据本实施方式的光电器件200包括彼此面对的第一电极10和第二电极20、以及在第一电极10和第二电极20之间的活性层30。然而,不同于以上实施方式,根据本实施方式的光电器件200进一步包括在第一电极10和活性层30之间、以及第二电极20和活性层30之间的电荷辅助层40和45。电荷辅助层40和45可促进从活性层30分离的空穴和电子的传输,以增加效率。电荷辅助层40和45可为选自如下的至少一个:用于促进空穴注入的空穴注入层(hil)、用于促进空穴传输的空穴传输层(htl)、用于限制和/或防止电子传输的电子阻挡层(ebl)、用于促进电子注入的电子注入层(eil)、用于促进电子传输的电子传输层(etl)、和用于限制和/或防止空穴传输的空穴阻挡层(hbl)。电荷辅助层40和45可包括例如有机材料、无机材料、或有机-无机材料。所述有机材料可为具有空穴或电子注入、传输或阻挡特性的有机化合物,和所述无机材料可为例如金属氧化物例如氧化钼、氧化钨、氧化镍等。所述空穴传输层(htl)可包括选自例如如下的一种:聚(3,4-亚乙基二氧噻吩):聚(磺苯乙烯)(pedot:pss)、多芳基胺、聚(n-乙烯基咔唑)、聚苯胺、聚吡咯、n,n,n',n'-四(4-甲氧基苯基)-联苯胺(tpd)、4-双[n-(1-萘基)-n-苯基-氨基]联苯(α-npd)、m-mtdata、4,4′,4″-三(n-咔唑基)-三苯基胺(tcta)、及其组合,但不限于此。所述电子阻挡层(ebl)可包括选自例如如下的一种:聚(3,4-亚乙基二氧噻吩):聚(磺苯乙烯)(pedot:pss)、多芳基胺、聚(n-乙烯基咔唑)、聚苯胺、聚吡咯、n,n,n',n'-四(4-甲氧基苯基)-联苯胺(tpd)、4,4’-双[n-(1-萘基)-n-苯基-氨基]联苯(α-npd)、m-mtdata、4,4′,4″-三(n-咔唑基)-三苯基胺(tcta)、及其组合,但不限于此。所述电子传输层(etl)可包括选自例如如下的一种:1,4,5,8-萘-四羧酸二酐(ntcda)、浴铜灵(bcp)、lif、alq3、gaq3、inq3、znq2、zn(btz)2、bebq2、及其组合,但不限于此。所述空穴阻挡层(hbl)可包括选自例如如下的一种:1,4,5,8-萘-四羧酸二酐(ntcda)、浴铜灵(bcp)、lif、alq3、gaq3、inq3、znq2、zn(btz)2、bebq2、及其组合,但不限于此。可省略电荷辅助层40和45的任一个。所述光电器件可应用于多种领域例如太阳能电池、图像传感器、光电探测器、光电传感器、和发光器件,但不限于此。在下文中,参照附图描述包括所述光电器件的图像传感器的实例。作为图像传感器的实例,描述有机cmos图像传感器。图3为显示根据实例实施方式的有机cmos图像传感器的示意性顶部俯视图,且图4为显示图3的有机cmos图像传感器的横截面图。参照图3和4,根据实例实施方式的有机cmos图像传感器300包括集成有光感测器件50b和50r、传输晶体管(未示出)、和电荷存储器55的半导体基板310,下部绝缘层60,滤色器层70,上部绝缘层80,和光电器件100。半导体基板310可为硅基板,且集成有光感测器件50b和50r、所述传输晶体管(未示出)、和电荷存储器55。光感测器件50r和50b可为光电二极管。光感测器件50b和50r、所述传输晶体管、和/或电荷存储器55可集成在每个像素中,且如所述图中所示,光感测器件50b和50r可分别包括在蓝色像素和红色像素中且电荷存储器55可包括在绿色像素中。光感测器件50b和50r感测光,由所述光感测器件感测的信息可通过所述传输晶体管传输,电荷存储器55电连接至光电器件100,且电荷存储器55的信息可通过所述传输晶体管传输。在所述图中,光感测器件50b和50r例如平行地布置,但不限于此,例如,蓝色光感测器件50b和红色光感测器件50r可在竖直方向上堆叠。金属线(未示出)和焊盘(垫)(未示出)形成于半导体基板110上。为了减少信号延迟,所述金属线和焊盘可由具有低的电阻率的金属例如铝(al)、铜(cu)、银(ag)、及其合金制成,但不限于此。此外,其不限于所述结构,且所述金属线和焊盘可安置在光感测器件50b和50r下面。下部绝缘层60形成于所述金属线和所述焊盘上。下部绝缘层60可由无机绝缘材料例如氧化硅和/或氮化硅,或低介电常数(低k)材料例如sic、sicoh、sico、和siof制成。下部绝缘层60具有使电荷存储器55暴露的沟槽。所述沟槽可用填料填充。滤色器层70形成于下部绝缘层60上。滤色器层70包括在蓝色像素中形成并且选择性地透射蓝色光的蓝色过滤器70b和在红色像素中形成并且选择性地透射红色光的红色过滤器70r。在实例实施方式中,可设置青色过滤器70c和黄色过滤器70y分别代替蓝色过滤器70b和红色过滤器70r。在本实施方式中,不包括绿色过滤器,但可进一步包括绿色过滤器。可省略滤色器层70。例如,当蓝色光感测器件50b和红色光感测器件50r在竖直方向上堆叠时,蓝色光感测器件50b和红色光感测器件50r可取决于它们的堆叠深度而选择性地吸收在相应波长区域中的光,且可不装备滤色器层70。上部绝缘层80形成于滤色器层70上。上部绝缘层80消除由滤色器层70引起的台阶并且使表面变平滑。上部绝缘层80和下部绝缘层60可包括使焊盘暴露的接触孔(未示出)、和使绿色像素的电荷存储器55暴露的通孔85。光电器件100形成于上部绝缘层80上。光电器件100包括如上所述的第一电极10、活性层30、和第二电极20。第一电极10和第二电极20可为透明电极,且活性层30与以上描述的相同。活性层30选择性地吸收和/或感测在绿色波长区域中的光并且代替绿色像素的滤色器。当光从第二电极20进入时,在绿色波长区域中的光可主要被吸收在活性层30中并且被光电转换,而在其余波长区域中的光通过第一电极10且可在光感测器件50b和50r中被感测。如上所述,所述选择性地吸收在绿色波长区域中的光的光电器件被堆叠且由此图像传感器的尺寸可减少并且可实现小型化的图像传感器。如上所述,由化学式1表示的化合物可用作半导体化合物,在薄膜状态中在化合物之间的聚集被抑制,且由此取决于波长的光吸收特性可得以保持。由此,绿色波长选择性可得以保持,由除绿色波长区域之外的其它光的不必要的吸收引起的串扰可减少且灵敏度可增加。在一种实施方式中,在图4中,可进一步在光电器件100上设置另外的滤色器层。所述滤色器层可包括蓝色滤色器70b和红色滤色器70r、或者青色滤色器70c和黄色滤色器70y。可在光电器件100上设置滤色器层。具有这样的结构的有机cmos图像传感器示于图5中。图5为显示根据实例实施方式的有机cmos图像传感器的横截面图。参照图5,有机cmos图像传感器400具有与图4中显示的有机cmos图像传感器300相同的结构,除了在光电器件100上设置包括蓝色过滤器72b和红色过滤器72r的滤色器层72之外。另外,可设置青色过滤器72c和黄色过滤器72y分别代替蓝色过滤器72b和红色过滤器72r。在图4和5中,包括图1的光电器件100,但其不限于此,且因而可以相同的方式应用图2的光电器件200。图6显示具有这样的结构的图像传感器的结构,且为包括图2中的光电器件200的有机cmos图像传感器500的横截面图。图7为显示根据另一实例实施方式的有机cmos图像传感器的横截面图。参照图7,像图6中所示的实例实施方式一样,有机cmos图像传感器600包括集成有光感测器件50b和50r、传输晶体管(未示出)、和电荷存储器55的半导体基板310,绝缘层80,和光电器件100。然而,不同于图6中所示的实例实施方式,根据图7中所示的实例实施方式的有机cmos图像传感器600包括堆叠的蓝色光感测器件50b和红色光感测器件50r且不包括滤色器层70。蓝色光感测器件50b和红色光感测器件50r与电荷存储器55电连接,且电荷存储器55的信息可通过所述传输晶体管(未示出)传输。蓝色光感测器件50b和红色光感测器件50r可取决于堆叠深度而选择性地吸收在相应波长区域中的光。如上所述,所述选择性地吸收在绿色波长区域中的光的光电器件被堆叠且所述红色光感测器件和所述蓝色光感测器件被堆叠,且由此图像传感器的尺寸可减小且可实现小型化的图像传感器。如上所述,光电器件100具有改善的绿色波长选择性,并且由除绿色波长区域之外的其它光的不必要的吸收引起的串扰可减少,同时增加灵敏度。在图7中,包括图1的光电器件100,但其不限于此,且因而可以相同的方式应用图2的光电器件200。图8为显示根据另一实例实施方式的有机cmos图像传感器的示意图。参照图8,根据本实施方式的有机cmos图像传感器包括堆叠的选择性地吸收在绿色波长区域中的光的绿色光电器件(g)、选择性地吸收在蓝色波长区域中的光的蓝色光电器件(b)、和选择性地吸收在红色波长区域中的光的红色光电器件。在所述图中,所述红色光电器件、绿色光电器件、和蓝色光电器件顺序地堆叠,但堆叠顺序可没有限制地改变。所述绿色光电器件可为以上光电器件100或光电器件200,所述蓝色光电器件可包括彼此面对的电极以及介于其间并且包括选择性地吸收在蓝色波长区域中的光的有机材料的活性层,且所述红色光电器件可包括彼此面对的电极以及介于其间并且包括选择性地吸收在红色波长区域中的光的有机材料的活性层。如上所述,所述选择性地吸收在绿色波长区域中的光的绿色光电器件、所述选择性地吸收在红色波长区域中的光的红色光电器件、和所述选择性地吸收在蓝色波长区域中的光的蓝色光电器件被堆叠,且由此图像传感器的尺寸可减小且可实现小型化的图像传感器。所述图像传感器吸收在适当的波长区域中的光且可显示出全部改善的灵敏度(ysnr10)和颜色再现性(δe*ab)而不管堆结构。在这里,ysnr10表示所述图像传感器的灵敏度,其是以在2007年国际图像传感器研讨会(ogunquitmaine,usa)中印刷的juhaalakarhu的“imagesensorsandimagequalityinmobilephones”中描述的方法测量的,并且由在10的信噪比下的由勒克斯表示的最小照度表示。因此,ysnr10越小,灵敏度越高。另一方面,颜色再现性(δe*ab)显示与在x-rite图表中的标准颜色的差异,和δe*ab在1976年被cie(commissioninternationaldel'eclairage)定义为在l*a*b*色空间上的两个点之间的距离。例如,色差可根据方程1计算。[方程1]在方程1中,δl*表示与在室温(约20℃-约25℃)下的色坐标l*相比,色坐标l*的变化,δa*表示与在室温下的色坐标a*相比,色坐标a*的变化,和δb*表示与在室温下的色坐标b*相比,色坐标b*的变化。为了制造在高的颜色再现性下具有高的灵敏度的图像传感器,在δe*ab≤3下ysnr10≤100勒克斯,且在这里,所述化合物可实现在δe*ab≤3下ysnr10≤100勒克斯的灵敏度。所述图像传感器可应用于多种电子设备例如移动电话、数码相机等,但不限于此。在下文中,参照实施例更详细地说明实施方式。然而,这些实施例是非限制性的,并且本发明构思不限于此。实施例合成实施例1:由化学式1-1表示的化合物(2-((5-(10h-吩硒嗪-10-基)碲吩-2-基)亚甲基)-1h-茚-1,3(2h)-二酮)的合成[化学式1-1][反应方案1-1](i)化合物(1)的合成参考在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将10.0g(32.7mmol)的2-碘碲吩和6.17g(25.2mmol)的10h-吩硒嗪在100ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和2.66g(27.7mmol)的naotbu的存在下加热和回流。将来自其的产物通过硅胶柱层析法(1:4的体积比的甲苯:己烷)分离和纯化以获得4.25g的10-(碲吩-2-基)-10h-吩硒嗪(产率:39.8%)。(iii)化合物(3)的合成在-15℃下将1.84ml的磷酰氯以逐滴方式添加到6.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到200ml的二氯甲烷和4.25g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加100ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。通过使用二氯甲烷从其萃取有机层并且将有机层用氯化钠水溶液洗涤,然后通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得2.50g的5-(10h-吩硒嗪-10-基)碲吩-2-甲醛(产率:55.2%)。(iv)由化学式1-1表示的化合物(4)的合成将2.50g(4.21mmol)的化合物(3)悬浮在乙醇中,向其添加0.74g(5.05mmol)的1h-茚-1,3(2h)-二酮,并且使混合物在50℃下反应2小时以获得2.02g的最终的由化学式1-1表示的化合物(产率:82.8%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ7.87(s,1h),7.72(m,6h),7.49(m,4h),7.34(m,3h),6.82(d,1h)。合成实施例2:由化学式1-2表示的化合物(2-((5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环(azasilin)-5(10h)-基)碲吩-2-基)亚甲基)-1h-茚-1,3(2h)-二酮)的合成[化学式1-2][反应方案1-2](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将15.0g(49.1mmol)的2-碘碲吩和10.0g(44.6mmol)的10,10-二甲基-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和12.9g(133.9mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得6.8g的10,10-二甲基-5-(碲吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环(产率:37.8%)。(iii)化合物(3)的合成在-15℃下将6.2ml的磷酰氯以逐滴方式添加到30.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和6.8g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。将通过使用二氯甲烷从其萃取的有机层用氯化钠水溶液洗涤,然后通过向其添加无水硫酸镁进行干燥。将由其获得的产物通过硅胶柱层析法(己烷:乙酸乙酯=4:1(体积比))分离和纯化以获得2.82g的5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)碲吩-2-甲醛(产率:38.8%)。(iv)由化学式1-2表示的化合物(4)的合成将2.82g(6.54mmol)的化合物(3)悬浮在乙醇中,将1.15g(7.85mmol)的1h-茚-1,3(2h)-二酮添加到其,然后,与其在50℃下反应2小时以获得2.20g的最终的由化学式1-2表示的化合物(产率:60.1%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ7.98(s,1h),8.12(m,6h),7.52(m,4h),7.54(m,3h),6.98(d,1h),0.47(s,6h)。合成实施例3:由化学式1-3表示的化合物(5-((5-(10h-吩硒嗪-10-基)碲吩-2-基)亚甲基)-1,3-二甲基-2-硫代二氢嘧啶-4,6(1h,5h)-二酮)的合成[化学式1-3][反应方案1-3](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将10.0g(32.7mmol)的2-碘碲吩和6.17g(25.2mmol)的10h-吩硒嗪在100ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和2.66g(27.7mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得4.25g的10-(碲吩-2-基)-10h-吩硒嗪(产率:19.6%)。(iii)化合物(3)的合成在-15℃下将1.84ml的磷酰氯以逐滴方式添加到6.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到180ml的二氯甲烷和2.10g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加100ml的水,向其添加氢氧化钠水溶液直至ph变成14,然后,将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将由其获得的产物通过硅胶柱层析法(己烷:乙酸乙酯=4:1(体积比))分离和纯化以获得2.50g的5-(10h-吩硒嗪-10-基)碲吩-2-甲醛(产率:53.6%)。(iv)由化学式1-3表示的化合物(4)的合成将2.50g(4.21mmol)的化合物(3)悬浮在乙醇中,并且将0.87g(5.05mmol)的以在j.pharmacol.,1944,82,292,p.4417中描述的方法合成的1,3-二甲基-2-硫代巴比妥酸添加至其且与其在50℃下混合2小时以获得1.76g的最终的由化学式1-3表示的化合物(产率:69.1%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.29(s,1h),7.83(d,1h),7.73(d,2h),7.51(d,2h),7.37(t,2h),6.99(t,2h),5.32(d,1h),3.67(d,6h)。合成实施例4:由化学式1-4表示的化合物(5-((5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)碲吩-2-基)亚甲基)-1,3-二甲基-2-硫代二氢嘧啶-4,6(1h,5h)-二酮)的合成[化学式1-4][反应方案1-4](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将15.0g(49.1mmol)的2-碘碲吩和10.0g(44.6mmol)的10,10-二甲基-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和12.9g(133.9mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得6.8g的10,10-二甲基-5-(碲吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环(产率:37.8%)。(iii)化合物(3)的合成在-15℃下将6.2ml的磷酰氯以逐滴方式添加到30.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和6.8g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,然后通过向其添加无水硫酸镁进行干燥。将由其获得的产物通过硅胶柱层析法(己烷:乙酸乙酯=4:1(体积比))分离和纯化以获得2.82g的5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)碲吩-2-甲醛(产率:38.8%)。(iv)由化学式1-4表示的化合物(4)的合成将2.82g(6.54mmol)的化合物(3)悬浮在乙醇中,并且将1.35g(7.85mmol)的1,3-二甲基-2-硫代巴比妥酸添加到其,并且与其在50℃下反应2小时以获得2.98g的最终的由化学式1-4表示的化合物(产率:77.8%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.46(s,1h),8.26(d,1h),7.80(d,2h),7.71(d,2h),7.54(t,2h),7.42(t,2h),6.93(d,1h),3.68(d,6h),0.45(s,6h)。合成实施例5:由化学式1-5表示的化合物的合成[化学式1-5][反应方案1-5](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将15.0g(49.1mmol)的2-碘碲吩和11.3g(44.6mmol)的10,10-二乙基-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3和12.9g(133.9mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得7.2g的10,10-二乙基-5-(碲吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环(产率:37.4%)。(iii)化合物(3)的合成在-15℃下将13.5ml的磷酰氯以逐滴方式添加到34.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和7.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将由其获得的产物通过硅胶柱层析法(己烷:乙酸乙酯=4:1(体积比))分离和纯化以获得2.00g的5-(10,10-二乙基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)碲吩-2-甲醛(产率:26.1%)。(iv)由化学式1-5表示的化合物(4)的合成将2.00g(4.36mmol)的化合物(3)悬浮在乙醇中,向其添加0.90g(5.23mmol)的1,3-二甲基-2-硫代巴比妥酸,然后在50℃下反应2小时以获得2.04g的最终的由化学式1-5表示的化合物(产率:76.4%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.46(s,1h),8.26(d,1h),7.82(d,2h),7.72(d,2h),7.56(t,2h),7.46(t,2h),6.93(d,1h),3.70(d,6h),1.50(t,4h),0.90(s,6h)。合成实施例6:由化学式1-6表示的化合物的合成[化学式1-6][反应方案1-6](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将15.0g(49.1mmol)的2-碘碲吩和11.2g(44.6mmol)的5h-螺[二苯并[b,e][1,4]氮杂硅杂己环-10,1'-硅杂环戊烷(silolane)在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3和12.9g(133.9mmol)的naotbu的存在下加热和回流2小时。将来自其的产物通过硅胶柱层析法(1:4的体积比的甲苯:己烷)分离和纯化以获得6.8g的5-(碲吩-2-基)-5h-螺[二苯并[b,e][1,4]氮杂硅杂己环-10,1'-硅杂环戊烷(产率35.5%)。(iii)化合物(3)的合成在-15℃下将12.4ml的磷酰氯以逐滴方式添加到38.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和6.8g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得2.00g的5-(5h-螺[二苯并[b,e][1,4]氮杂硅杂己环-10,1'-硅杂环戊烷]-5-基)碲吩-2-甲醛(产率:27.6%)。(iv)由化学式1-6表示的化合物(4)的合成将2.00g(4.38mmol)的化合物(3)悬浮在乙醇中,向其添加0.90g(5.25mmol)的1,3-二甲基-2-硫代巴比妥酸,并且使混合物在50℃下反应2小时以获得2.1g的最终的由化学式1-6表示的化合物(产率:78.5%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.48(s,1h),8.28(d,1h),7.82(d,2h),7.74(d,2h),7.58(t,2h),7.46(t,2h),6.92(d,1h),3.72(d,6h),1.88(t,8h)合成实施例7:由化学式1-7表示的化合物的合成[化学式1-7][反应方案1-7](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘碲吩。(ii)化合物(2)的合成将15.0g(49.1mmol)的2-碘碲吩和12.0g(44.6mmol)的10,10-二甲基-5,10-二氢二苯并[b,e][1,4]氮杂锗杂己环(azagermine)在200ml的无水甲苯中在4.5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和12.9g(133.9mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得6.2g的10,10-二甲基-5-(碲吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂锗杂己环(产率:31.0%)。(iii)化合物(3)的合成在-15℃下将5.0ml的磷酰氯以逐滴方式添加到16.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和6.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加200ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得2.2g的5-(10,10-二甲基二苯并[b,e][1,4]氮杂锗杂己环-5(10h)-基)碲吩-2-甲醛(产率:32.0%)。(iv)由化学式1-7表示的化合物(4)的合成将2.2g(4.63mmol)的化合物(3)悬浮在乙醇中,并且向其添加0.96g(5.55mmol)的1,3-二甲基-2-硫代巴比妥酸,然后在50℃下反应2小时以获得2.1g的最终的由化学式1-7表示的化合物(产率:72.1%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.36(s,1h),8.16(d,1h),7.76(d,2h),7.62(d,2h),7.44(t,2h),7.42(t,2h),6.93(d,1h),3.68(d,6h),0.65(s,6h)。合成参考例1:由化学式2-1表示的化合物的合成[化学式2-1][反应方案2-1](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘硒吩。(ii)化合物(2)的合成将10.0g(38.9mmol)的2-碘硒吩和8.71g(35.4mmol)的10h-吩硒嗪在100ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和3.17g(106.15mmol)的naotbu的存在下加热和回流2小时。将来自其的产物通过硅胶柱层析法(1:4的体积比的甲苯:己烷)分离和纯化以获得8.2g的10-(硒吩-2-基)-10h-吩硒嗪(产率:54.7%)。(iii)化合物(3)的合成在-15℃下将8.0ml的磷酰氯以逐滴方式添加到30.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到180ml的二氯甲烷和8.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加200ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得4.5g的5-(10h-吩硒嗪-10-基)硒吩-2-甲醛(产率:51.1%)。(iv)由化学式2-1表示的化合物(4)的合成将2.00g(4.96mmol)的化合物(3)悬浮在乙醇中,向其添加0.44g(2.98mmol)的1h-茚-1,3(2h)-二酮,然后在50℃下反应2小时以获得2.0g的最终的由化学式2-1表示的化合物(产率:75.9%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ7.87(s,1h),7.72(m,6h),7.49(m,4h),7.42(m,3h),6.82(d,1h)。合成参考例2:由化学式2-2表示的化合物的合成[化学式2-2][反应方案2-2](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘硒吩。(ii)化合物(2)的合成将15.0g(58.4mmol)的2-碘硒吩和11.9g(58.4mmol)的10,10-二甲基-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和15.3g(159.22mmol)的naotbu的存在下加热和回流2小时。将来自其的产物通过硅胶柱层析法(1:4的体积比的甲苯:己烷)分离和纯化以获得11.2g的10,10-二甲基-5-(硒吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环(产率:59.5%)。(iii)化合物(3)的合成在-15℃下将8.2ml的磷酰氯以逐滴方式添加到38.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和11.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得6.82g的5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)硒吩-2-甲醛(产率:56.4%)。(iv)由化学式2-2表示的化合物(4)的合成将3.00g(7.85mmol)的化合物(3)悬浮在乙醇中,向其添加1.38g(9.41mmol)的1h-茚-1,3(2h)-二酮,然后在50℃下反应2小时以获得3.40g的最终的由化学式2-2表示的化合物(产率:84.9%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ7.98(s,1h),8.12(m,6h),7.60(m,3h),7.52(m,4h),6.98(d,1h),0.47(s,6h)。合成参考例3:由化学式2-3表示的化合物的合成[化学式2-3][反应方案2-3](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘硒吩。(ii)化合物(2)的合成将10.0g(38.9mmol)的2-碘硒吩和8.71g(35.4mmol)的10h-吩硒嗪在100ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和10.2g(106.15mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4(体积比))分离和纯化以获得8.2g的10-(硒吩-2-基)-10h-吩硒嗪(产率:54.7%)。(iii)化合物(3)的合成在-15℃下将8.0ml的磷酰氯以逐滴方式添加到30.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到180ml的二氯甲烷和8.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加200ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得4.5g的5-(10h-吩硒嗪-10-基)硒吩-2-甲醛(产率:51.1%)。(iv)由化学式2-3表示的化合物(4)的合成将2.00g(4.96mmol)的化合物(3)悬浮在乙醇中,向其添加1.03g(5.95mmol)的1,3-二甲基-2-硫代巴比妥酸,并且使混合物在50℃下反应2小时以获得2.15g的最终的由化学式2-3表示的化合物(产率:77.8%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.29(s,1h),7.83(d,1h),7.73(d,2h),7.51(d,2h),7.37(t,2h),7.16(t,2h),5.32(d,1h),3.67(d,6h)。合成参考例4:由化学式2-4表示的化合物的合成[化学式2-4][反应方案2-4](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘硒吩。(ii)化合物(2)的合成将15.0g(58.4mmol)的2-碘硒吩和11.9g(58.4mmol)的10,10-二甲基-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环在200ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和15.3g(159.22mmol)的naotbu的存在下加热和回流2小时。将来自其的产物通过硅胶柱层析法(1:4的体积比的甲苯:己烷)分离和纯化以获得11.2g的10,10-二甲基-5-(硒吩-2-基)-5,10-二氢二苯并[b,e][1,4]氮杂硅杂己环(产率49.0%)。(iii)化合物(3)的合成在-15℃下将8.2ml的磷酰氯以逐滴方式添加到38.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到300ml的二氯甲烷和11.2g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加300ml的水,向其添加氢氧化钠水溶液直至ph变成14,并且将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(4:1的体积比的己烷:乙酸乙酯)分离和纯化以获得6.82g的5-(10,10-二甲基二苯并[b,e][1,4]氮杂硅杂己环-5(10h)-基)硒吩-2-甲醛(产率:54.0%)。(iv)由化学式2-4表示的化合物(4)的合成将3.00g(7.85mmol)的化合物(3)悬浮在乙醇中,向其添加1.62g(9.41mmol)的1,3-二甲基-2-硫代巴比妥酸,然后在50℃下反应2小时以获得3.15g的最终的由化学式2-4表示的化合物(产率:74.8%)。将所述化合物升华和纯化直至99.9%的纯度。1h-nmr(500mhz,二氯甲烷-d2):δ8.46(s,1h),8.26(d,1h),7.80(d,2h),7.71(d,2h),7.56(t,2h),7.50(t,2h),6.93(d,1h),3.68(d,6h),0.45(s,6h)。合成参考例5:由化学式2-5表示的化合物的合成[化学式2-5][反应方案2-5](i)化合物(1)的合成参照在efficientsynthesisof2-iodoand2-dicyanomethylderivativesofthiophene,selenophene,telluropheneandthieno[3,2-b]thiophene,takahashi,k.;tarutani,s.heterocycles1996,43,1927-1935中公开的方法合成2-碘硒吩。(ii)化合物(2)的合成将2.0g(7.80mmol)的2-碘硒吩(化合物(1)和1.2g(7.09mmol)的二苯基胺在30ml的无水甲苯中在5摩尔%的pd(dba)2、5摩尔%的p(tbu)3、和0.75g(7.80mmol)的naotbu的存在下加热和回流2小时。将由其获得的产物通过硅胶柱层析法(甲苯:己烷=1:4的体积比)分离和纯化以获得1.40g的化合物(2)(产率:66.2%)。(iii)化合物(3)的合成在-15℃下将1.75ml的磷酰氯以逐滴方式添加到6.0ml的n,n-二甲基甲酰胺,并且将混合物在室温(24℃)下搅拌2小时。在-15℃下将来自其的所得物以逐滴方式缓慢地添加到60ml的二氯甲烷和1.4g的化合物(2)的混合物,并将所获得的混合物在室温下搅拌30分钟且在减压下浓缩。随后,向其添加100ml的水,向其添加氢氧化钠水溶液直至ph变成14,然后将所获得的混合物在室温(24℃)下搅拌2小时。用二氯甲烷从其萃取有机层,将有机层通过使用氯化钠水溶液洗涤,并且通过向其添加无水硫酸镁进行干燥。将来自其的产物通过硅胶柱层析法(己烷:乙酸乙酯=4:1(体积比))分离和纯化以获得1.0g的化合物(3)(产率:65.3%)。(iv)由化学式2-5表示的化合物(4)的合成将0.33g(1.09mmol)的化合物(3)悬浮在乙醇中,向其添加0.23g(1.3mmol)的1,3-二甲基-2-硫代巴比妥酸,并且使混合物在50℃下反应2小时以获得0.47g的由化学式2-5表示的化合物(产率:90%)。1hnmrppm(cdcl3)8.5(s)-1h,7.9(d)-1h,7.5-7.3(m)-10h,6.6(d)-1h,3.8(d)-6h合成对比例1:由化学式3-1表示的化合物的合成[化学式3-1][反应方案3-1]以在daltontransactions,44(3),1473-1482;2015中描述的方法合成5-(二苯基氨基)噻吩-2-甲醛,然后使其与1,3-二甲基-2-硫代巴比妥酸缩合反应以获得根据合成对比例1的化合物。1hnmrppm(cdcl3)8.4(s)-1h,7.8(d)-1h,7.5-7.3(m)-10h,6.5(d)-1h,3.7(d)-6h评价1:合成实施例1至7的化合物的光吸收特性评价根据合成实施例1至7的化合物的取决于波长的光吸收特性(最大吸收波长、半宽度(fwhm)、和吸收系数)。将根据合成实施例1至7的各化合物沉积以制造薄膜并且使用cary5000uv光谱仪(varianinc.)评价各膜在紫外-可见光(uv-vis)区域中的光吸收特性。在它们之中,合成实施例1、合成实施例3、和合成实施例4的结果示于表1中。(表1)参照表1,合成实施例1、合成实施例3、和合成实施例4的化合物显示出在绿色波长区域中的最大吸收波长、窄的半宽度(fwhm)、和高的吸收系数(表明高的吸收强度)。由所述结果,合成实施例1、合成实施例3、和合成实施例4的化合物具有改善的在绿色波长区域中的吸收选择性。由所述homo和lumo能级可以看出,合成实施例1、合成实施例3、和合成实施例4的化合物对于p型半导体是合乎需要的。另外,将合成实施例1至7的各化合物和c60(n型半导体)以1:1的体积比共沉积以制造薄膜。使用cary5000uv光谱仪(varianinc.)评价各薄膜在紫外-可见光(uv-vis)区域中的光吸收特性。使用ac-3光电子能谱仪(rikenkeiki)测量homo能级并且使用通过cary5000uv光谱仪(varianinc.)测量的能带隙计算lumo能级。在它们之中,合成实施例1至4的结果示于表2中。(表2)参照表2,合成实施例1至4的化合物当它们与所述n型半导体一起使用时也显示出在绿色波长区域中的最大吸收波长、窄的半宽度(fwhm)、和高的吸收系数。由所述结果,合成实施例1至4的化合物具有改善的在绿色波长区域中的吸收选择性。评价2:合成实施例1至7和合成参考例1至5的化合物的热稳定性通过测量在10pa下的10重量%损失温度(ts10,沉积温度)和在10pa下的50重量%损失温度(ts50,沉积温度)来评价根据合成实施例1至7和合成参考例1至5的化合物的热稳定性。所述沉积温度是以热重分析(tga)方法测量的。在它们之中,合成实施例1至4、6和7的结果示于表3中。(表3)当化合物具有比在真空沉积期间的沉积温度低的熔点时,所述化合物可分解并且同时气化且因而未能被形成为膜。因此,期望化合物的熔点高于沉积温度。参照表3,根据合成实施例1至4、6和7的化合物可具有比沉积温度高大于或等于33℃的熔点。因此,根据合成实施例1至4、6和7的化合物具有高的在熔点与沉积温度之间的差异且因而可保证工艺稳定性。实施例1:光电器件的制造通过在玻璃基板上溅射ito而形成约150nm厚的阳极,并且通过以1:1的体积比共沉积根据合成实施例1的由化学式1-1表示的化合物(p型半导体化合物)和c60(n型半导体化合物)而在其上形成100nm厚的活性层。随后,在其上形成10nm厚的氧化钼(moox,0<x≤3)薄膜作为电荷辅助层。在所述氧化钼薄膜上,通过溅射ito而形成7nm厚的阴极,从而制造光电器件。实施例2至7:光电器件的制造根据与实施例1相同的方法制造根据实施例2至7的光电器件,除了分别使用根据合成实施例2至7的化合物代替根据合成实施例1的化合物之外。参考例1至5:光电器件的制造根据与实施例1相同的方法制造根据参考例1至5的光电器件,除了分别使用根据合成参考例1至5的化合物代替根据合成实施例1的化合物之外。评价3:光电器件的光吸收特性使用cary5000uv光谱仪(varianinc.)评价根据实施例1至7和参考例1至5的光电器件在紫外-可见光(uv-vis)区域中的光吸收特性。在它们之中,实施例1至6以及参考例1和3的结果示于表4中。(表4)λ最大(nm)fwhm(nm)实施例1550120实施例2550100实施例3540109实施例454096实施例554590实施例654590参考例1520105参考例3515107参照表4,包括根据合成实施例1至6的化合物的根据实施例1至6的光电器件显示出在大于或等于540nm的绿色波长区域中的最大吸收波长和窄的fwhm,这显示改善的在绿色波长区域中的波长选择性。评价4:光电器件的外量子效率(eqe)评价根据实施例1至7和参考例1至5的光电器件的外量子效率(eqe)。外量子效率(eqe)是通过使用ipce测量系统(mcscienceinc.,韩国)测量的。eqe是通过用si光电二极管(hamamatsuphotonicsk.k.,日本)校正ipce测量系统并且分别安装根据实施例1至7和参考例1至5的光电器件而在范围从约350nm到约750nm的波长处测量的。另外,在将根据实施例1至7和参考例1至5的光电器件在160℃下退火3小时、在170℃下退火3小时、和在180℃下退火3小时之后,使用所述测量系统在范围从约350nm到约750nm的波长处测量eqe。在它们之中,实施例1至7的结果示于表5中。在表5中,外量子效率是当向其施加-3v电压时在最大光吸收波长处测量的。(表5)参照表5,根据实施例1至7的光电器件在高温下退火之后以及在室温下(未退火)显示出优异的外量子效率。另外,在将根据实施例3、4和7以及参考例4的光电器件在190℃下退火3小时之后,使用所述测量系统在范围从约350nm到约750nm的波长处测量eqe。结果示于表6中。(表6)实施例在-3v下的eqe(%)实施例344实施例464实施例762参考例4-在表6中,根据参考例4的光电器件的薄膜被损坏且因而可无法测量eqe。相反,根据实施例3、4和7的光电器件在于190℃的高温下退火之后显示出良好的外量子效率。评价5:光电器件的暗电流评价根据实施例1至7和参考例1至5的光电器件的暗电流(dc)。所述暗电流是通过使用ipce测量系统(mcscienceinc.,韩国)测量的。所述暗电流是通过用si光电二极管(hamamatsuphotonicsk.k.,日本)校正ipce测量系统并且分别安装根据实施例1至7和参考例1至5的光电器件而在范围从约350到约750nm的波长处测量的。另外,在将根据实施例1至7和参考例1至5的光电器件在160℃下退火3小时、在170℃下退火3小时、和在180℃下退火3小时之后,使用所述测量系统在范围从约350到约750nm的波长处测量暗电流。在它们之中,实施例1至4的结果示于表7中。在表7中,暗电流是当向其施加-3v电压时在最大光吸收波长处测量的。(表7)参照表7,根据实施例1至4的光电器件在于高温下退火之后显示出低的暗电流。光电器件的响应时间评价根据实施例1至7和参考例1至5的光电器件的响应时间(滞后时间)。所述响应时间是通过如下测量的:使用来自上部电极(阴极)的具有530nm的中间波长的入射led光,将其以3v/100nm的电强度施加至根据实施例1至7和参考例1至5的光电器件,和在关掉所述led光之后0.1秒之后测量余像电流。另外,为了评价根据实施例1至7和参考例1至5的光电器件的热稳定性,在将根据实施例1至7和参考例1至5的光电器件在160℃下退火3小时、在170℃下退火3小时、和在180℃下退火3小时之后,根据与以上描述的相同的方法测量在被容许在高温下之后的响应时间。在它们之中,实施例1至4的结果示于表8中。(表8)参照表8,根据实施例1至4的光电器件在于高温下退火之后显示出快的响应时间。图像传感器的灵敏度(ysnr10)分别设置根据实施例1至4和参考例4的光电器件以将图像传感器制造成具有如图4中所示的图像传感器300的光电器件100的结构。通过在d-65的光源下拍摄macbeth图的18%灰度块(灰斑,graypatch)的照片而测量来自macbeth图的24色的色差δe*ab和ysnr10。在这里,镜头具有2.8的f值和80%的透射率,且对于红外线截止过滤器使用干涉型镜头。所述图像传感器的像素尺寸为1.4μm,且所述图像传感器的帧率为15fps。ysnr10是以在2007年国际图像传感器研讨会(ogunquitmaine,usa)的概要中印刷的juhaalakarhu的“imagesensorsandimagequalityinmobilephones”中描述的方法测量的。ysnr10(亮度)是通过用ccm(色彩校正矩阵)补偿颜色而在δe*ab=3处获得的。在容许所述图像传感器在160℃下保持(静置)3小时之后,测量在δe*ab=3处的ysnr10。在它们之中,实施例4和参考例4的结果示于表9中。(表9)参照表9,包括根据实施例4的有机光电器件的图像传感器在用ccm(色彩校正矩阵)进行颜色补偿了的δe*ab=3处具有小于或等于94的低的ysnr10值且因而可实现在1.4μm的高图像品质像素下的高的灵敏度。另外,包括根据实施例4的有机光电器件的图像传感器在于高温下退火之后显示出不变的ysnr10。尽管已经关于目前被认为是实践性的实例实施方式的内容描述了本公开内容,但是将理解,发明构思不限于所公开的实施方式,而是相反,意图覆盖包括在所附权利要求的精神和范围内的各种变型和等同布置。<符号说明>10:第一电极20:第二电极30:活性层40,45:电荷辅助层100,200:光电器件300,400,500:有机cmos图像传感器310:半导体基板70b、72b:蓝色过滤器70r、72r:红色过滤器70、72:滤色器层85:通孔60:下部绝缘层80:上部绝缘层50b,50r:光感测器件55:电荷存储器当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1