一种烟草外向整流钾离子通道基因NtSKOR1及其克隆方法与应用与流程
本发明属于遗传工程技术领域,具体涉及一种烟草外向整流钾离子通道基因ntskor1及其克隆方法与应用。
背景技术:
钾是植物生长所必须的一种矿质营养元素之一,是植物体内含量最丰富的一价阳离子。植物吸收钾主要是通过根部进行的,吸收的形态是k+。植物吸收钾的方式分为两种:主动吸收和被动吸收。主动吸收需要消耗能量,但主动吸收的速率很高。在土壤溶液中k+浓度较高时,k+的吸收主要为被动吸收。在植物体内钾以k+的形态存在。根吸收的k+很容易被转运到地上部,在植物体内也很容易从一个部位转移到其它部位,并可以在植物体内被重复利用。在植物体内钾不足的情况下,钾被优先分配到生一长旺盛的幼嫩组织、器官中。
在植物中钾离子通道主要包括shaker钾离子通道、tpk通道和kir-like通道。skor属于shaker钾离子通道家族,skor主要在根中表达,当k+被吸收进入根中,skor通过中柱使它被转移到木质部并随木质部汁液运往地上部芽,这可能是惟一对木质部汁液中钾分泌起作用的shakerk+通道。此外,skor还在木质部和花粉中表达。有研究表明,skor与gork能进行物理互作形成有功能的异聚外向整流通道。
钾被认为是烟草的品质元素,钾含量是评价烟叶品质优劣的重要指标之一。烟叶钾含量提高可以改善烟叶的组织结构,使烟叶结构细腻,而且还能提高烟叶外观色泽,使烟叶呈深橘黄色,香气足,吃味好,富有弹性和韧性,填充性增强。另外钾还可以增强烟叶糖类、色素类、芳香类物质的合成积累。烟草中还未见skor钾离子通道基因的报道,克隆烟草钾离子通道基因skor,对调控烟草钾离子含量、培育高质量烟叶具有重要意义。
技术实现要素:
本发明的第一目的在于提供一种烟草外向整流钾离子通道基因ntskor1;第二目的在于提供所述的烟草外向整流钾离子通道基因ntskor1的克隆方法;第三目的在于提供所述的烟草外向整流钾离子通道基因ntskor1的应用。
本发明的第一目的是这样实现的,所述的烟草外向整流钾离子通道基因ntskor1的核苷酸序列如seqidno:1所示。
本发明的第二目的是这样实现的,包括以下步骤:
a、烟草叶片cdna合成:提取烟草根部组织rna,反转录得到第一链cdna;
b、ntskor1基因的pcr扩增:以烟草叶片cdna为模板,根据ntskor1基因序列设计引物,进行pcr扩增,回收和纯化pcr扩增产物;
c、纯化产物与载体链接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
本发明的第三目的是这样实现的,所述的烟草外向整流钾离子通道基因ntskor1在获得低钾离子含量的转基因烟草植株中的应用。
本发明还提供一种所述烟草外向整流钾离子通道基因ntskor1的重组载体。
本发明还提供提供一种所述烟草外向整流钾离子通道基因ntskor1的表达盒。
本发明还提供一种所述烟草外向整流钾离子通道基因ntskor1的转基因细胞系。
本发明还提供一种所述烟草外向整流钾离子通道基因ntskor1的重组菌。
本发明还提供一种利用crsipr/cas9编辑技术对烟草ntskor1基因进行功能鉴定的方法,具体包括以下步骤:
(1)构建crispr/cas9载体
a、根据ntskor1基因组序列设计crispr/cas9靶位点(pam),即gagagtagcagaggaagtactgg,该靶位点位于第一外显子。
b、靶位点引物设计
根据a设计的靶位点合成靶位点引物:
p1:5’-attggagagtagcagaggaagtac-3’,
p2:5’-aaacgtacttcctctgctactctc-3’;
其中p1灰色区域为靶位点tgg前的20个核苷酸,p2中灰色区域为p1灰色区域的反向互补序列。
c、在靶位点两侧设计编辑材料的检测引物,
sdf:5’-tccatcacacgaactctcca-3’,
sdr:5’-gagagcaagagagagaggagt-3’,扩增长度475bp。
d、制备dsdna
将步骤b中设计合成的引物通过退火形成互补dnaoligo,具体步骤如下:
反应体系50μl,包括sdf20μl,sdr20μl,10×annealingbuffer5μl,灭菌双蒸水5μl。退火程序为:95℃,5min;90℃,1min;80℃,1min;70℃,1min;60℃,1min;50℃,1min;40℃,1min;30℃,1min;20℃,1min;10℃,1min。
e、酶切phse401载体,并与步骤d所制备dsdna进行连接。
利用bsai酶对phse401载体进行酶切,酶切体系50μl,包括:质粒5μl,10×buffer5μl,bsai2μl,灭菌双蒸水38μl。37℃酶切1h。
酶切后对酶切产物进行电泳检测分析,可见1200bp和11520bp两个条带,回收11520bp的酶切产物备用;
利用t4dna连接酶将所回收的大片段酶切产物与步骤d所制备dsdna进行连接,连接时20μl体系进行:所回收载体酶切产物3μl,退火所形成dsdna产物10μl,t4dnabuffer2μl,t4dna连接酶1μl,灭菌双蒸水4μl。16℃过夜连接;
f、测序验证
将步骤e中连接产物转化大肠杆菌,筛选阳性克隆(phse401载体抗性为kan)并进行菌落pcr检测,
菌落pcr检测时,所用引物设计:
u6-26pf:5’-tgtcccaggattagaatgattaggc-3’;
p2:5’-aaacgtacttcctctgctactctc-3’;
对菌落pcr检测验证正确的阳性克隆菌株培养扩增后进一步进行测序分析,测序时所用引物为:
u6-26p-f:5’-tgtcccaggattagaatgattaggc-3’。
对测序结果进行分析,选择构建正确的克隆(phse401-skor1)保存备用。
(2)农杆菌转化
从-80℃冰箱中取出农杆菌感受态细胞(c58c1),放置冰上溶解后加入载体phse401-skor14μl;液氮速冻1分钟,转入37℃水浴5分钟,再冰浴2分钟,向混合物中加入1mllb液体培养基,28℃、220rpm培养3~4小时;培养物涂布于含有卡那霉素100mg/l和利福平25mg/l的lb固体培养基上,28℃倒置培养2~3天,可见含有目标载体的农杆菌克隆。
(3)烟草转化
a、挑取含有目标载体的农杆菌克隆,在含有那霉素和利福平的lb平板上划线,28℃培养2~3天;刮取划线菌斑接菌于含有那霉素和利福平的ms培养基中,28℃,220rpm震荡培养,菌液浓度达到od=0.5~0.8时进行侵染;
b、将烟草叶片置于500ml广口瓶中,加入适量75%乙醇,漂洗1min;弃乙醇,加入0.1%的hgcl2溶液,置摇床上室温振荡15~30分钟;弃溶液,用无菌水冲洗6遍;
c、将叶片取出,用无菌吸水纸洗去表面液体,取无菌叶片用剪刀切成1cm×1cm的小片,将切成小片的烟草叶片放入含目标载体的无菌ms液体培养基悬浮菌液中,静置15~20min;取出烟草叶片,用无菌滤纸吸去多余菌液,于含有6-ba(0.02mg/l)、naa(2mg/l)的ms培养基中25℃暗培养两天;将烟草叶片转入分化培养基中,切口接触培养基,分化培养基为含有6-ba(0.5mg/l)、naa(0.1mg/l)、潮霉素(20mg/l)、头孢霉素(500mg/l)的ms培养基,每2~3周继代一次,切口处逐渐形成愈伤组织,最后分化出芽;
d、将长至3~5cm的芽切下,转入ms培养基诱导生根,生根后的转基因植株由生根培养基中取出,用自来水洗净培养基,移植于灭菌的营养土中。
(4)测序筛选编辑材料
t0代转基因苗生长1周左右,选取20株烟苗取叶片并利用dneasyplantminikit(qiagen)提取dna,利用步骤(1)c中设计的引物sdf/sdr进行扩增,扩增产物纯化后利用正向引物测序。对测序结果分析,获得一株插入1个碱基g的编辑材料(图4)。种植该编辑材料t1代通过测序筛选编辑纯合单株收种获得t2代。
(5)编辑材料钾含量
温室盆栽种植编辑纯合材料ntskor1-cp及对照。每株按5g纯氮使用烟草专用复合肥(氮﹕磷﹕钾=10﹕10﹕15),分5次施入。现蕾期取上部叶(16-19位叶),中部叶(9-11位叶),下部叶(3-5位叶),杀青后检测钾含量。结果见图5,编辑材料三个部位叶片钾含量比对照都显著降低,表明ntskor1基因敲除后影响了钾离子向地上部的运输。
本发明利用同源克隆技术从烟草中得到一个烟草外向整流钾离子通道基因ntskor1,利用crispr/cas9编辑技术对ntskor1进行功能验证,结果表明ntskor1基因具有将钾离子从根部转运到地上部的功能。烟草中ntskor1基因的鉴定还未见报道,该基因的鉴定为通过调控基因的表达调控烟草钾含量提供了新基因。
附图说明
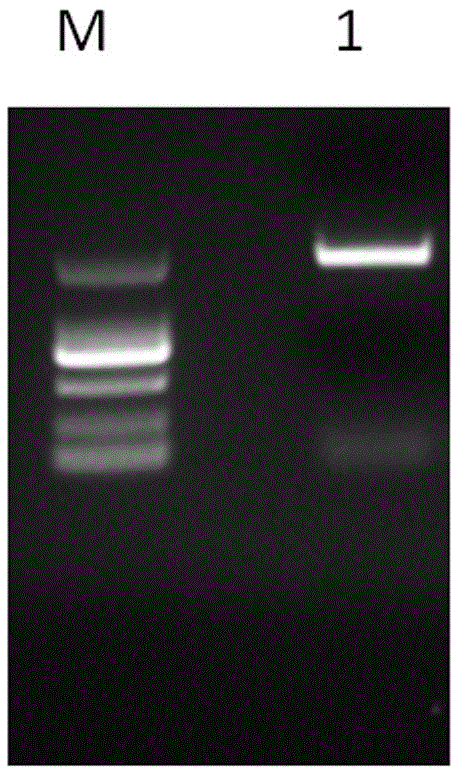
图1为利用引物对ntskor1f/ntskor1r扩增ntskor1基因cds产物的琼脂糖凝胶电泳图,扩增产物大小约为2466bp,m:dl2000,1:ntskor1cdspcr产物;
图2为ntskor1基因组织特异性表达分析结果,ntskor1基因主要在根部表达;
图3为ntskor1蛋白与拟南芥atskor蛋白序列比对,其中s1-s6为预测的6个跨膜区,p为孔形成区,ank为锚定蛋白区;
图4为crispr/cas9编辑ntskor1基因材料编辑靶位点测序结果,其中,pam为编辑靶位点,wild为野生型序列,cp为编辑材料序列,ntskor1-cp材料插入一个碱基g;
图5为ntskor1基因编辑材料与对照上部、中部、下部烟叶钾含量比较。ntskor1-cp为编辑材料,ck为对照。
具体实施方式
下面结合实施例和附图对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
本发明所述的烟草外向整流钾离子通道基因ntskor1的核苷酸序列如seqidno:1所示。
所述的烟草外向整流钾离子通道基因ntskor1编码的氨基酸序列如seqidno:2所示。
本发明所述的烟草外向整流钾离子通道基因ntskor1的克隆方法,包括以下步骤:
a、烟草叶片cdna合成:提取烟草根部组织rna,反转录得到第一链cdna;
b、ntskor1基因的pcr扩增:以烟草叶片cdna为模板,根据ntskor1基因序列设计引物,进行pcr扩增,回收和纯化pcr扩增产物;
c、纯化产物与载体链接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
b步骤中所述的引物为:
ntskor1f:5’-atgacgagagtagcagagga-3’
ntskor1r:5’-tcaagttgattgatcattgatc-3’。
b步骤中所述的pcr反应体系是选用phusion高保真扩增酶反应体系,体系总体积50μl,包括:200ngcdna,5×phusionhf反应缓冲液10μl,10mmdntp1μl,2u的phusion®high-fidelitydnapolymerase,10μm的正反向引物各1μl,补水至50μl。
b步骤中所述的pcr扩增的反应条件是在mastercycler®pro扩增仪上进行,反应程序为:98℃,30秒;98℃,7秒;58℃,30秒;72℃,60秒;35个循环;72℃延伸7分钟。
本发明所述的烟草外向整流钾离子通道基因ntskor1的应用为所述的烟草外向整流钾离子通道基因ntskor1在获得低钾离子含量的转基因烟草植株中的应用。
含有权利要求1或2所述的烟草外向整流钾离子通道基因ntskor1的重组载体。
含有权利要求1或2所述的烟草外向整流钾离子通道基因ntskor1的表达盒。
含有权利要求1或2所述的烟草外向整流钾离子通道基因ntskor1的转基因细胞系或重组菌。
下面以具体实施案例对本发明做进一步说明:
实施例1
烟草钾离子外向整流基因ntskor1的克隆
a、根据拟南芥atskor基因的蛋白序列(np_186934.1)搜索ncbi数据库得到烟草中同源基因ntskor1序列,利用此序列设计基因克隆引物:
正向引物:ntskor1f:5’-atgacgagagtagcagagga-3’
反向引物:ntskor1r:5’-tcaagttgattgatcattgatc-3’
b、提取烟草根部组织rna,反转录得到第一链cdna;
c、以反转录得到的第一链cdna作为模板,用引物ntskor1f/ntskor1r进行pcr扩增,pcr产物经琼脂糖凝胶电泳分离后回收并纯化(图1);
d、纯化产物与载体连接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
c步骤中pcr扩增的反应体系是选用phusion高保真扩增酶反应体系,体系总体积50μl,包括:200ngcdna,5×phusionhf反应缓冲液10μl,10mmdntp1μl,2u的phusion®high-fidelitydnapolymerase,10μm的正反向引物各1μl,补水至50μl。
c步骤中pcr扩增的反应条件是在mastercycler®pro扩增仪上进行,反应程序为:98℃,30秒;98℃,7秒;58℃;30秒,72℃;60秒,35个循环;72℃延伸7分钟;
实施例2
烟草ntskor1基因组织特异性表达分析
a、种植栽培烟草云烟87,旺长期提取根、茎、叶片rna,反转录得到第一链cdna。
b、根据ntskor1基因序列设计qrt-pcr引物
qf:gtcaagttgtaactcgagtccac,
qr:ggaaatatctccgaatgagctg。
以烟草actin基因作为内参,actin-f:ctgaggtccttttccaacca和actin-rtacccgggaacatggtagag。以根、茎、叶片cdna为模板进行荧光定量pcr,反应在rochelightcycler480上利用lightcycler480sybrgreenimaster进行,20µl体系含有10µllightcycler480sybrgreenimaster(2×),正反引物各1µl(10µmol/l),cdna1µl(反转录产物稀释4倍),7µl灭菌蒸馏水。反应程序如下:95℃预变性5min;95℃变性20s,60℃退火15s,72℃延伸15s;45个循环。荧光定量pcr结果采用2-△△ct方法计算ntskor1基因的相对表达量。每个处理设3个生物学重复,由excel软件绘制柱状图(图2)。结果表明,ntskor1主要在烟草根部表达。
实施例3
烟草ntskor1基因编码蛋白保守域分析
将ntskor1蛋白与拟南芥atskor蛋白进行多序列比对(图3)。ntskor1具有skor蛋白保守结构域,如跨膜区s1-s6,孔形成区p,锚定蛋白区ank等保守结构域,且ntskor1在这些结构域区与atskor同源性较高。
实施例4
利用crsipr/cas9编辑技术对烟草ntskor1基因进行功能鉴定
(1)构建crispr/cas9载体
a、根据ntskor1基因组序列设计crispr/cas9靶位点(pam),即gagagtagcagaggaagtactgg,该靶位点位于第一外显子。
b、靶位点引物设计
根据a设计的靶位点合成靶位点引物:
p1:5’-attggagagtagcagaggaagtac-3’,
p2:5’-aaacgtacttcctctgctactctc-3’;
其中p1灰色区域为靶位点tgg前的20个核苷酸,p2中灰色区域为p1灰色区域的反向互补序列。
c、在靶位点两侧设计编辑材料的检测引物,
sdf:5’-tccatcacacgaactctcca-3’,
sdr:5’-gagagcaagagagagaggagt-3’,扩增长度475bp。
d、制备dsdna
将步骤b中设计合成的引物通过退火形成互补dnaoligo,具体步骤如下:
反应体系50μl,包括sdf20μl,sdr20μl,10×annealingbuffer5μl,灭菌双蒸水5μl。退火程序为:95℃,5min;90℃,1min;80℃,1min;70℃,1min;60℃,1min;50℃,1min;40℃,1min;30℃,1min;20℃,1min;10℃,1min。
e、酶切phse401载体,并与步骤d所制备dsdna进行连接。
利用bsai酶对phse401载体进行酶切,酶切体系50μl,包括:质粒5μl,10×buffer5μl,bsai2μl,灭菌双蒸水38μl。37℃酶切1h。
酶切后对酶切产物进行电泳检测分析,可见1200bp和11520bp两个条带,回收11520bp的酶切产物备用;
利用t4dna连接酶将所回收的大片段酶切产物与步骤d所制备dsdna进行连接,连接时20μl体系进行:所回收载体酶切产物3μl,退火所形成dsdna产物10μl,t4dnabuffer2μl,t4dna连接酶1μl,灭菌双蒸水4μl。16℃过夜连接;
f、测序验证
将步骤e中连接产物转化大肠杆菌,筛选阳性克隆(phse401载体抗性为kan)并进行菌落pcr检测,
菌落pcr检测时,所用引物设计:
u6-26pf:5’-tgtcccaggattagaatgattaggc-3’;
p2:5’-aaacgtacttcctctgctactctc-3’;
对菌落pcr检测验证正确的阳性克隆菌株培养扩增后进一步进行测序分析,测序时所用引物为:
u6-26p-f:5’-tgtcccaggattagaatgattaggc-3’。
对测序结果进行分析,选择构建正确的克隆(phse401-skor1)保存备用。
(2)农杆菌转化
从-80℃冰箱中取出农杆菌感受态细胞(c58c1),放置冰上溶解后加入载体phse401-skor14μl;液氮速冻1分钟,转入37℃水浴5分钟,再冰浴2分钟,向混合物中加入1mllb液体培养基,28℃、220rpm培养3~4小时;培养物涂布于含有卡那霉素100mg/l和利福平25mg/l的lb固体培养基上,28℃倒置培养2~3天,可见含有目标载体的农杆菌克隆。
(3)烟草转化
a、挑取含有目标载体的农杆菌克隆,在含有那霉素和利福平的lb平板上划线,28℃培养2~3天;刮取划线菌斑接菌于含有那霉素和利福平的ms培养基中,28℃,220rpm震荡培养,菌液浓度达到od=0.5~0.8时进行侵染;
b、将烟草叶片置于500ml广口瓶中,加入适量75%乙醇,漂洗1min;弃乙醇,加入0.1%的hgcl2溶液,置摇床上室温振荡15~30分钟;弃溶液,用无菌水冲洗6遍;
c、将叶片取出,用无菌吸水纸洗去表面液体,取无菌叶片用剪刀切成1cm×1cm的小片,将切成小片的烟草叶片放入含目标载体的无菌ms液体培养基悬浮菌液中,静置15~20min;取出烟草叶片,用无菌滤纸吸去多余菌液,于含有6-ba(0.02mg/l)、naa(2mg/l)的ms培养基中25℃暗培养两天;将烟草叶片转入分化培养基中,切口接触培养基,分化培养基为含有6-ba(0.5mg/l)、naa(0.1mg/l)、潮霉素(20mg/l)、头孢霉素(500mg/l)的ms培养基,每2~3周继代一次,切口处逐渐形成愈伤组织,最后分化出芽;
d、将长至3~5cm的芽切下,转入ms培养基诱导生根,生根后的转基因植株由生根培养基中取出,用自来水洗净培养基,移植于灭菌的营养土中。
(4)测序筛选编辑材料
t0代转基因苗生长1周左右,选取20株烟苗取叶片并利用dneasyplantminikit(qiagen)提取dna,利用步骤(1)c中设计的引物sdf/sdr进行扩增,扩增产物纯化后利用正向引物测序。对测序结果分析,获得一株插入1个碱基g的编辑材料(图4)。种植该编辑材料t1代通过测序筛选编辑纯合单株收种获得t2代。
(5)编辑材料钾含量
温室盆栽种植编辑纯合材料ntskor1-cp及对照。每株按5g纯氮使用烟草专用复合肥(氮﹕磷﹕钾=10﹕10﹕15),分5次施入。现蕾期取上部叶(16-19位叶),中部叶(9-11位叶),下部叶(3-5位叶),杀青后检测钾含量。结果见图5,编辑材料三个部位叶片钾含量比对照都显著降低,表明ntskor1基因敲除后影响了钾离子向地上部的运输。
sequencelisting
<110>云南省烟草农业科学研究院
<120>一种烟草外向整流钾离子通道基因ntcipk1及其克隆方法与应用
<130>2018
<160>8
<170>patentinversion3.3
<210>1
<211>1365
<212>dna
<213>ntcipk1核苷酸序列
<400>1
atggtattgatacagcaagaagaagaaataagaagtgaaagaggaaagaagggaatgcga60
gttgggaaatacgaacttggaaaaactttaggagaaggtaattttggcaaagttaagtac120
gcaaaacacaaagattctggccaatcttttgctatcaaaattttggagaaaaatcgaatt180
caagatcttagaatcaccgatcagataaagagggagattaaaaccttaaaagtcctcaag240
catccaaatgtggtcagattatacgaggtcttagcaagcaaaaccaagatttacatggtg300
ctggaatatgtaaatggtggtgaattatttgacagaattgcttctgaaggaaaactagca360
gaaacacaaggcagaaaactctttcaacaattaattgatggtgttagttattgccatgac420
aaaggtgtcttccatagagacctcaagctagagaatgtcctcattgatgcagaaaaaaac480
ataaagattacagattttggactaagtgcattacctcaacacttaagggatgacggcttg540
ttgcatacaacatgtggtagccccaactacgttgctcctgaaattctttctaacagagga600
tacgatggcgcgacatcagatacatggtcatgtggagtcatcttatatgtcattctcact660
ggttttttaccctttgatgatagaaatcttgcagttctttatcaaaagatttttaagggg720
gatgcaccagtaccaaaatggttatctcaaggagcaaagaatcttataaagaggattctt780
gatccaaatccgcatactcgcataacaatggcagagattaaagaggatgagtggttcaaa840
caagactatactcctgctaatcctgatgaatatgaagattttgaagatgatcatgcatcc900
tcagatgatgaagtgttgacagtacatgaagcaccacttgatacagaaagagatccagaa960
tcaccttctgttatcaataatgcctttcagctaattgggatgtcctcatgttttgatctt1020
tctggattttttgaaaatgaggatgcctctgagaggaagatcagattcacatctaatctc1080
tctccaaaagaattgctagagaggattgagcatttagcagtgcaaatgggatttcaagtc1140
cagaaaaaacctggaaagttgaaagtattgctagaacacaaaggtcaaaaaactcaagcc1200
agtctttcaatagtagcagaggtttttgagattagcacatccttgtatgttgtagagtta1260
caaaaatcttcaggggattctacggtatatagagagttatgcaataggttatcaaatgaa1320
ttgggtgtccagcaaagtcaagagctcttgcccaccaaattatga1365
<210>2
<211>454
<212>prt
<213>ntcipk1氨基酸序列
<400>2
metvalleuileglnglngluglugluileargsergluargglylys
151015
lysglymetargvalglylystyrgluleuglylysthrleuglyglu
202530
glyasnpheglylysvallystyralalyshislysaspserglygln
354045
serphealailelysileleuglulysasnargileglnaspleuarg
505560
ilethraspglnilelysarggluilelysthrleulysvalleulys
65707580
hisproasnvalvalargleutyrgluvalleualaserlysthrlys
859095
iletyrmetvalleuglutyrvalasnglyglygluleupheasparg
100105110
ilealasergluglylysleualagluthrglnglyarglysleuphe
115120125
glnglnleuileaspglyvalsertyrcyshisasplysglyvalphe
130135140
hisargaspleulysleugluasnvalleuileaspalaglulysasn
145150155160
ilelysilethrasppheglyleuseralaleuproglnhisleuarg
165170175
aspaspglyleuleuhisthrthrcysglyserproasntyrvalala
180185190
progluileleuserasnargglytyraspglyalathrseraspthr
195200205
trpsercysglyvalileleutyrvalileleuthrglypheleupro
210215220
pheaspaspargasnleualavalleutyrglnlysilephelysgly
225230235240
aspalaprovalprolystrpleuserglnglyalalysasnleuile
245250255
lysargileleuaspproasnprohisthrargilethrmetalaglu
260265270
ilelysgluaspglutrpphelysglnasptyrthrproalaasnpro
275280285
aspglutyrgluaspphegluaspasphisalaserseraspaspglu
290295300
valleuthrvalhisglualaproleuaspthrgluargaspproglu
305310315320
serproservalileasnasnalapheglnleuileglymetserser
325330335
cyspheaspleuserglyphephegluasngluaspalasergluarg
340345350
lysileargphethrserasnleuserprolysgluleuleugluarg
355360365
ilegluhisleualavalglnmetglypheglnvalglnlyslyspro
370375380
glylysleulysvalleuleugluhislysglyglnlysthrglnala
385390395400
serleuserilevalalagluvalphegluileserthrserleutyr
405410415
valvalgluleuglnlysserserglyaspserthrvaltyrargglu
420425430
leucysasnargleuserasngluleuglyvalglnglnserglnglu
435440445
leuleuprothrlysleu
450
<210>3
<211>22
<212>dna
<213>ntcipk1f
<400>3
atggtattgatacagcaagaag22
<210>4
<211>24
<212>dna
<213>ntcipk1r
<400>4
tcataatttggtgggcaagagctc24
<210>5
<211>24
<212>dna
<213>p1
<400>5
attgggaaagaagggaatgcgagt24
<210>6
<211>24
<212>dna
<213>p2
<400>6
aaacactcgcattcccttctttcc24
<210>7
<211>20
<212>dna
<213>cipk1df
<400>7
atctaagcagcggattgacg20
<210>8
<211>21
<212>dna
<213>cipk1dr
<400>8
agcagagagagagagacctga21
- 还没有人留言评论。精彩留言会获得点赞!