一种双芳基马来酰亚胺类化合物及其药学上可接受的盐及其制备方法和应用与流程
本发明主要涉及一种双芳基马来酰亚胺类化合物及其药学上可接受的盐及其制备方法和应用,公开了作为异柠檬酸脱氢酶1(idh1)突变体抑制剂及其在治疗idh1突变介导的胶质瘤和急性髓性白血病等恶性肿瘤中的应用。
背景技术:
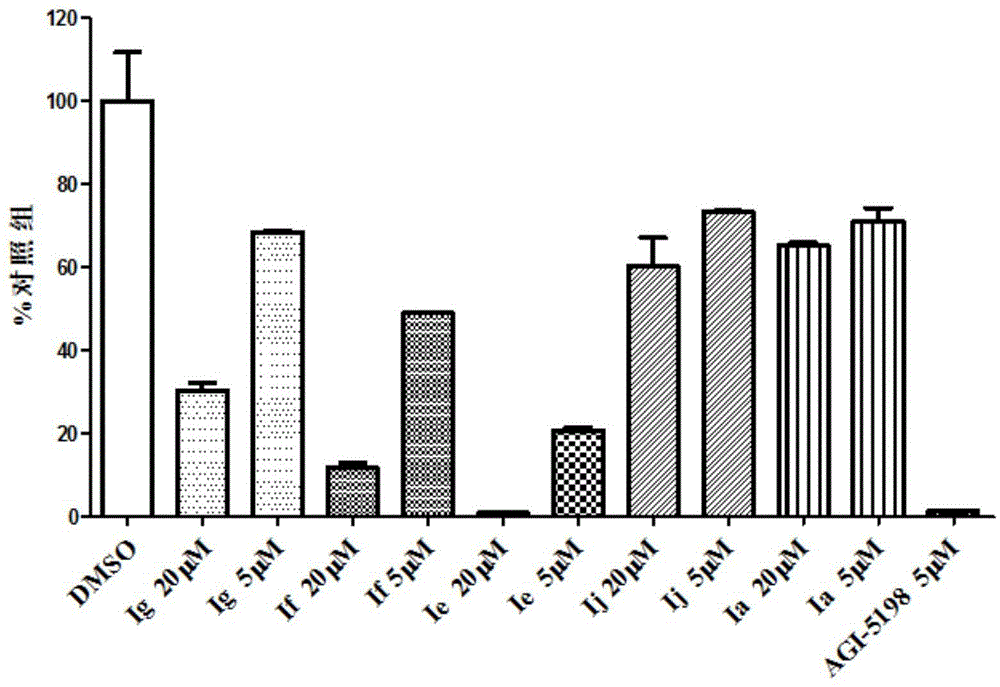
:恶性肿瘤是威胁人类健康的重大疾病之一。在世界范围内,2008年有850万人死于肿瘤,并且按照目前的趋势,至2020年预计会有2000万新发癌症病例,其中死亡人数将达到1200万。肿瘤的防治已成为各国医药界的重要研究课题。尽管人们对肿瘤的起因和发展有了较深入的了解,并有大量的抗肿瘤药物在临床上使用。然而这些应用广泛的抗肿瘤药物往往存在毒副作用大,易产生耐药等问题,使其临床治疗受到较大的限制。因而研制新型、高效、低毒的抗肿瘤药物具有十分重要的意义。异柠檬脱氢酶1(isocitratedehydrogenase-1,idh1)是三羧酸循环(tca)的关键限速酶。主要存在于胞质和过氧化物酶体,可利用烟酰胺腺嘌呤二核苷酸磷酸(nadp)作为电子受体,使异柠檬酸氧化脱羧成α-酮戊二酸(α-ketoglutarate,α-kg),并产生还原态烟酰胺腺嘌呤二核苷酸磷酸(nadph),两种产物均参与能量代谢、氨基酸和维生素合成等,因此,该酶的活性调节将直接影响idh1或idh1底物参与调控的不同生物途径,发挥不同的生物功能。近期研究发现,idh1在多种恶性肿瘤中包括胶质瘤、急性髓系白血病、软骨肉瘤、胆管癌和急性淋巴白血病存在较高的突变,其中包括idh1/r132h(arg132tohis)、idh1/r132l(arg132tolys)和idh1/r132c(arg132tocys)等,以idh1/r132h突变为主。idh1发生突变后,其催化异柠檬酸氧化脱羧生成a-kg的能力大大下降,同时突变后的idh1还出现了一种新的功能,即催化nadph依赖性的还原反应增强,将a-kg还原成2-羟基戊二酸(2-hg)由于2-hg和α-kg结构相似,导致2-hg与α-kg竞争。上述两方面的原因均会使α-kg依赖的一些双加氧酶包括脯氨酸羟化酶(prolylhydroxylase,phd)、dna羟化酶tet家族和组蛋白赖氨酸脱甲基酶(histonelysinedemethylases,kdms)等的活性下降,最终导致肿瘤的发生。鉴于idh1突变在肿瘤发生发展中的重要作用,突变的idh1蛋白已成为潜在的极具吸引力的抗肿瘤靶点。目前已有部分idh1突变体抑制剂其中包括美国agios制药公司开发的ag-120,德国汉诺威医学院发现的hms-101和诺华制药公司的idh305已作为抗肿瘤药物进入临床研究并取得了可喜的临床作用,进一步证实了idh1突变体抑制剂在肿瘤治疗中的有效性。因此,开发具有新型结构的高效idh1突变体抑制剂用于高效、低毒的抗肿瘤新药开发已成为当务之急。技术实现要素:本发明的目的是提供一种双芳基马来酰亚胺类化合物及其药学上可接受的盐,及其制备方法和应用,公开了作为异柠檬酸脱氢酶1(idh1)突变体抑制剂及其在治疗idh1突变介导的胶质瘤和急性髓性白血病等恶性肿瘤中的应用。所述的一种双芳基马来酰亚胺类化合物及其药学上可接受的盐,其特征在于所述双芳基马来酰亚胺类化合物的结构通式如式(ⅰ)所示:其中:r1为h,ch3和c2h5,ar1和ar2各自独立的选自:环上为无取代、单取代、双取代或三取代的苯环、萘环、吲哚、氮杂吲哚、吲唑、氮杂吲唑、咪唑、苯并咪唑、氮杂苯并咪唑、呋喃、苯并呋喃或吡啶并呋喃,其中单取代、双取代或三取代所用的取代基为卤素;碳原子数为1-4的直链、支链或环烷基;碳原子数为1-4的直链、支链或环烷氧基;碳原子数为2-5的直链、支链或环烯基。所述的一种双芳基马来酰亚胺类化合物及其药学上可接受的盐,其特征在于ar1和ar2中含有-nh-部分,则所述-nh-部分的h原子被r2取代,r2为碳原子数为1-4的直链、支链或环烷基;碳原子数为2-5的直链、支链或环烯基;或者为-(ch2)nr3取代,其中r3为羟基或无取代、一取代和二取代的咪唑、三氮唑、吗啉、哌啶、氨基和哌嗪,一取代和二取代所用的取代基为卤素,碳原子数为1-4的直链、支链或环烷基,碳原子数为1-4的直链、支链或环烷氧基。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐的制备方法,其特征在于包括如下步骤:1)在非极性溶剂中,在pdcl2(ph3)2的作用下,以式(1)所示的取代的3-氯-4-芳杂环马来酰亚胺、与式(2)所示的取代的锡化物在80-120℃下发生still偶联反应,反应为2-5小时后反应产物经柱色谱提纯获得式(3)所示的双芳基马来酰亚胺基本骨架;2)步骤1)得到的式(3)所示的双芳基马来酰亚胺基本骨架在过量胺醇溶液或醋酸胺的作用下发生胺解反应,反应产物经柱色谱提纯获得到式(ⅰ)所示的双芳基马来酰亚胺类化合物;其反应方程式如下:所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐的制备方法,其特征在于步骤1)所述非极性溶剂为甲苯或二甲苯;取代的3-氯-4-芳杂环马来酰亚胺、取代的锡化物和pdcl2(ph3)2的投料物质的量之比为1-1.5:1:0.05-0.2。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐的制备方法,其特征在于当双芳基马来酰亚胺基本骨架中含有-nh-部分,在反应溶剂中,在nah的作用下,将步骤1)得到的双芳基马来酰亚胺基本骨架与r2x在反应温度为60-90℃下发生进一步的n-烷基化得到,反应时间为5-10小时,r2为碳原子数为1-4的直链、支链或环烷基;碳原子数为2-5的直链、支链或环烯基;或者为-(ch2)nr3取代,x为卤素。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐的制备方法,其特征在于反应溶剂为dmf或dmso;双芳基马来酰亚胺基本骨架、nah和r2x的物质的量之比为1:1-1.1:1-1.5。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐的制备方法,其特征在于胺醇溶液为甲胺醇溶液或乙胺醇溶液溶液,当与甲胺醇溶液或乙胺醇溶液作为氨解试剂时,反应温度为15-30℃,反应时间为1-3小时;当采用醋酸胺作为氨解试剂时,反应温度为130-150℃,反应时间为5-8小时。反应产物经柱色谱提纯获得。本发明所述的双芳基马来酰亚胺类化合物ⅰ也可以芳基乙酰胺4和芳基酮酸酯5在叔丁醇钾的作用下缩合制得:反应溶剂为四氢呋喃;反应温度为-5~5℃;芳基乙酰胺4、芳基酮酸酯5和叔丁醇钾的物质的量之比为1:1~1.5:3~4;反应时间为1-3小时;反应产物经柱色谱提纯获得,反应式见scheme2:ar1、ar2、r1和r2如前所述,x为卤素。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐作为idh1突变体抑制剂的应用。所述的应用,所述的idh1突变体为idh1/r132h(arg132tohis)、idh1/r132c(arg132tocys)或idh1/r132l(arg132tolys)中的任意一种。所述的双芳基马来酰亚胺类化合物及其药学上可接受的盐在制备抗恶性肿瘤药物的应用,所述恶性肿瘤包括胶质瘤、急性髓系白血病、急性淋巴白血病、软骨肉瘤、胆管癌或结肠癌。通过采用上述技术,本发明得到的双芳基马来酰亚胺类化合物及其药学上可接受的盐是一种新型的idh1突变体抑制剂,可作为idh1/r132h(arg132tohis)、idh1/r132c(arg132tocys)和idh1/r132l(arg132tolys)等idh1突变体抑制剂的应用,它可用于治疗胶质瘤、急性髓系白血病、急性淋巴白血病、软骨肉瘤、胆管癌和结肠癌等idh1突变介导的恶性肿瘤。附图说明图1为本发明的部分产品对2-hg的检测结果图。具体实施方式本发明结合实施例作进一步的说明。以下的实施例是说明本发明的,而不是以任何方式限制本发明。1.中间体及目标化合物的制备:实施例1:1-甲基-3-(三丁基锡基)-1h-吡唑[3,4-b]并吡啶(2a)在三口瓶中加入2.0g(4.9mmol)3-(三丁基锡基)-1h-吡唑[3,4-b]并吡啶和30ml无水dmf,控制温度0~5℃,分批加入0.22g(5.5mmol)60%nah,加完后保温搅拌30min,然后滴加0.84g(5.9mmol)碘甲烷,滴完后于0~5℃反应1h,然后升至室温反应0.5h,反应完后将反应液倒入600ml水中,二氯甲烷萃取(50ml×3),合并有机层,饱和食盐水洗涤(150ml×3),无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用硅胶柱层析(石油醚:乙酸乙酯=6:1,v/v)提纯,得到1.56g油状物2a,产率75.5%。1hnmr(cdcl3)δ:0.89(9h,t,j=7.5hz),1.21-1.26(6h,m),1.33-1.38(6h,m),1.58-1.63(6h,m),4.19(3h,s),7.04-7.07(1h,m),8.01(1h,dd,j=8.0,1.5hz),8.51(1h,dd,j=4.5,1.5hz).实施例2:1-乙基-3-(三丁基锡基)-1h-吡唑[3,4-b]并吡啶(2b)合成方法同实施1,只是用溴乙烷替代碘甲烷,得到油状物2b,收率:62.3%,1hnmr(cdcl3)δ:0.89(9h,t,j=7.5hz),1.22-1.27(6h,m),1.34-1.40(6h,m),1.54(3h,t,j=7.5hz),1.57-1.64(6h,m),4.63(2h,q,j=7.5hz),7.04-7.07(1h,m),8.00(1h,dd,j=8.0,1.5hz),8.50(1h,dd,j=4.5,1.5hz).实施例3:1-丁基-3-(三丁基锡基)-1h-吡唑[3,4-b]并吡啶(2c)合成方法同实施1,只是用溴丁烷替代碘甲烷,得到油状物2c,收率58.3%,1hnmr(cdcl3)δ:0.89(9h,t,j=7.5hz),0.95(3h,t,j=7.5hz),1.20-1.29(8h,m),1.32-1.39(8h,m),1.56-1.63(6h,m),4.57(2h,t,j=7.5hz),7.03-7.08(1h,m),8.01(1h,dd,j=8.0,1.5hz),8.50(1h,dd,j=4.5,1.5hz).实施例4:3-(1h-吲哚-3-基)-1-苯基-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(3a)在三口瓶中加入1.3g(4.0mmol)3-氯-4-(1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮(1a),1.6g(3.8mmol)化合物2a,0.38g(9.1mmol)氯化锂,0.38g(0.6mmol)pd(pph3)2cl2和50ml无水甲苯,氮气保护下于100℃反应3h,反应完后将反应液倒入200ml水中,乙酸乙酯萃取(100ml×3),合并有机层,有机层用饱和食盐水洗涤(100ml×3),无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用硅胶柱层析(二氯甲烷:甲醇=30:1,v/v)提纯,得到0.83g红色固体3a,产率52.2%,熔点:216-218℃。1hnmr(dmso-d6)δ:4.02(3h,s),6.34(1h,d,j=8.0hz),6.72(1h,t,j=8.0hz),7.07(1h,t,j=8.0hz),7.18-7.24(1h,m),7.43-7.50(2h,m),7.52-7.61(4h,m),8.13(1h,dd,j=8.0,1.5hz),8.28(1h,d,j=3.0hz),8.58(1h,dd,j=4.5,1.5hz),12.03(1h,s).实施例5:3-(1h-吲哚-3-基)-1-苯基-4-(1-乙基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(3b)合成方法同实施4,只是用2b替代2a,得到红色固体3b,收率:48.2%,熔点:201-203℃。1hnmr(cdcl3)δ:1.29(3h,t,j=7.0hz),4.51(2h,q,j=7.0hz),6.38(1h,d,j=8.0hz),6.78(1h,t,j=8.0hz),7.13(1h,t,j=8.0hz),7.14-7.20(1h,m),7.36(1h,d,j=8.0hz),7.40-7.45(1h,m),7.50-7.58(4h,m),8.17(1h,d,j=3.0hz),8.31(1h,dd,j=8.0,1.5hz),8.59(1h,dd,j=4.5,1.5hz),9.06(1h,s).实施例6:3-(1h-吲哚-3-基)-1-苯基-4-(1-丁基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(3c)合成方法同实施4,只是用2c替代2a,得到红色固体3c,收率:42.1%,熔点:206-207℃。1hnmr(cdcl3)δ:0.85(3h,t,j=7.0hz),1.22-1.29(2h,m),1.65-1.71(2h,m),4.46(2h,t,j=7.0hz),6.42(1h,d,j=8.0hz),6.77(1h,t,j=8.0hz),7.09-7.16(2h,m),7.36(1h,d,j=8.0hz),7.39-7.43(1h,m),7.49-7.57(4h,m),8.18(1h,d,j=3.0hz),8.30(1h,dd,j=8.0,1.5hz),8.58(1h,dd,j=4.5,1.5hz),9.00(1h,s).实施例7:3-(5-甲氧基-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3d)合成方法同实施4,只是用3-氯-4-(5-甲氧基-1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮1b替代1a,得到红色固体3d,收率:45.9%,熔点:197-199℃。1hnmr(cdcl3)δ:3.05(3h,s),4.11(3h,s),5.72(1h,d,j=2.5hz),6.74(1h,dd,j=8.5,2.5hz),7.07-7.14(1h,m),7.22(1h,d,j=8.5hz),7.39-7.45(1h,m),7.50-7.57(4h,m),8.14(1h,dd,j=8.0,1.5hz),8.17(1h,d,j=3.0hz),8.57(1h,dd,j=4.5,1.5hz),8.96(1h,s).实施例8:3-(6-溴-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3e)在三口瓶中加入0.3g(0.75mmol)3-氯-4-(6-溴-1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮1c,0.07g(1.7mmol)氯化锂,0.07g(0.1mmol)pd(pph3)2cl2和30ml无水甲苯,氮气保护下于100℃左右缓慢滴加0.21g(0.5mmol)2a和10ml无水甲苯组成的溶液,滴完后保温反应2h,反应完后将反应液倒入100ml水中,乙酸乙酯萃取(50ml×3),合并有机层,有机层用饱和食盐水洗涤(50ml×3),无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用硅胶柱层析(二氯甲烷:甲醇=30:1,v/v)提纯,得到0.075g红色固体3e,收率30.4%,熔点:>250℃。1hnmr(dmso-d6)δ:4.05(3h,s),6.46(1h,d,j=8.5hz),6.91(1h,d,j=8.0hz),7.19-7.25(1h,m),7.41-7.47(1h,m),7.49-7.58(4h,m),7.65(1h,d,j=1.5hz),8.14(1h,dd,j=8.0,1.5hz),8.29(1h,d,j=3.0hz),8.60(1h,dd,j=4.5,1.5hz),12.07(1h,s).实施例9:3-(6-氯-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3f)合成方法同实施8,只是用3-氯-4-(6-氯-1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮1d替代1c,得到红色固体3f,收率:38.7%,熔点:>250℃。1hnmr(dmso-d6)δ:4.05(3h,s),6.49(1h,d,j=8.5hz),6.81(1h,dd,j=8.5,1.5hz),7.20-7.26(1h,m),7.40-7.45(1h,m),7.50(1h,d,j=1.5hz),7.51-7.59(4h,m),8.14(1h,dd,j=8.0,1.5hz),8.30(1h,d,j=3.0hz),8.60(1h,dd,j=4.5,1.5hz),12.07(1h,s).实施例10:3-(6-氟-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3g)合成方法同实施8,只是用3-氯-4-(6-氟-1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮1e替代1c,得到红色固体3g,收率:49.4%,熔点:>250℃。1hnmr(dmso-d6)δ:4.04(3h,s),6.42-6.48(1h,m),6.65(1h,td,j=9.0,2.0hz),7.20-7.26(2h,m),7.42-7.46(1h,m),7.49-7.55(4h,m),8.15(1h,dd,j=8.0,1.5hz),8.26(1h,d,j=3.0hz),8.60(1h,dd,j=4.5,1.5hz),12.04(1h,s).实施例11:3-(5-氟-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3h)合成方法同实施8,只是用3-氯-4-(5-氟-1h-吲哚-3-基)-1-苯基-1h-吡咯-2,5-二酮1f替代1c,得到红色固体3h,收率:44.9%,熔点:219-221℃。1hnmr(dmso-d6)δ:4.06(3h,s),6.13(1h,d,j=9.5hz),6.95(1h,td,j=9.5,2.5hz),7.20-7.26(1h,m),7.42-7.48(2h,m),7.50-7.59(4h,m),8.17(1h,dd,j=8.0,1.5hz),8.35(1h,d,j=3.0hz),8.61(1h,dd,j=4.5,1.5hz),12.11(1h,s).实施例12:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3i)在三口瓶中加入100mg(0.24mmol)化合物3a和10ml无水dmf,搅拌溶解后加入9.6mg(0.24mmol)60%的nah,室温搅拌30min,然后加入52mg(0.36mmol)1-(3-氯丙基)-1h-咪唑,升温至80℃反应5h,反应完后将反应液倒入200ml水中,乙酸乙酯萃取(50ml×3),合并有机层,饱和食盐水洗(150ml×3),无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用硅胶柱层析(二氯甲烷:甲醇:三乙胺=120:4:1,v/v/v)提纯,得到64.4mg红色固体3i,产率51.0%,熔点:126-128℃。1hnmr(cdcl3)δ:2.42-2.49(2h,m),4.00(2h,t,j=7.0hz),4.04(3h,s),4.20(2h,t,j=7.0hz),6.34(1h,d,j=8.0hz),6.80(1h,t,j=8.0hz),6.98(1h,s),7.11-7.15(2h,m),7.17(1h,t,j=8.0hz),7.23(1h,d,j=8.0hz),7.38-7.43(1h,m),7.49-7.53(4h,m),7.56(1h,s),8.20(1h,s),8.25(1h,dd,j=8.0,1.5hz),8.58(1h,dd,j=4.5,1.5hz).实施例13:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-乙基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3j)合成方法同实施12,只是用3b替代3a,得到红色固体3j,收率:46.5%,熔点:96-98℃。1hnmr(cdcl3)δ:1.27(3h,t,j=7.0hz),2.43-2.49(2h,m),4.02(2h,t,j=7.0hz),4.22(2h,t,j=7.0hz)4.49(2h,q,j=7.0hz),6.39(1h,d,j=8.0hz),6.81(1h,t,j=8.0hz),6.99(1h,s),7.15-7.19(3h,m)7.24(1h,d,j=8.0hz),7.39-7.44(1h,m),7.51-7.59(5h,m),8.20(1h,s),8.33(1h,dd,j=8.0,1.5hz),8.59(1h,dd,j=4.5,1.5hz).实施例14:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-丁基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3k)合成方法同实施12,只是用3c替代3a,得到红色固体3k,收率:40.2%,熔点:196-198℃。1hnmr(cdcl3)δ:0.83(3h,t,j=7.0hz),1.22-1.28(2h,m),1.62-1.67(2h,m),2.41-2.44(2h,m),4.01(2h,t,j=7.0hz),4.21(2h,t,j=7.0hz)4.43(2h,t,j=7.0hz),6.40(1h,d,j=8.0hz),6.79(1h,t,j=8.0hz),6.96(1h,s),7.11-7.19(3h,m)7.23(1h,d,j=8.0hz),7.40-7.44(1h,m),7.51-7.58(4h,m),7.59(1h,s),8.18(1h,s),8.28(1h,dd,j=8.0,1.5hz),8.58(1h,dd,j=4.5,1.5hz).实施例15:3-(1-(3-(1h-咪唑-1-基)丙基)-5-甲氧基-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3l)合成方法同实施12,只是用3d替代3a,得到红色固体3l,收率:48.7%,熔点:92-94℃。1hnmr(cdcl3)δ:2.25-2.32(2h,m),2.96(3h,s),4.01-4.05(5h,m),4.10(2h,t,j=7.0hz),5.70(1h,d,j=2.5hz),6.72(1h,dd,j=8.5,2.5hz),6.94(1h,s),7.17-7.21(1h,m),7.25(1h,s),7.37(1h,d,j=8.5hz),7.43-7.47(1h,m),7.52-7.57(4h,m),7.69(1h,s),8.14(1h,dd,j=8.0,1.5hz),8.26(1h,s),8.59(1h,dd,j=4.5,1.5hz).实施例16:3-(6-溴-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3m)合成方法同实施12,只是用3e替代3a,得到红色固体3m,收率:47.1%,熔点:88-90℃。1hnmr(dmso-d6)δ:2.24-2.32(2h,m),4.03-4.06(5h,m)4.29(2h,t,j=7.0hz),6.61(1h,d,j=8.5hz),6.94(1h,s),7.00(1h,dd,j=8.0,1.5hz),7.21-7.24(2h,m),7.43-7.47(1h,m),7.54-7.58(4h,m),7.68(1h,s),7.81(1h,d,j=1.5hz),8.15(1h,dd,j=8.0,1.5hz),8.32(1h,s),8.59(1h,dd,j=4.5,1.5hz).实施例17:3-(6-氯-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3n)合成方法同实施12,只是用3f替代3a,得到红色固体3n,收率:43.6%,熔点:116-118℃。1hnmr(dmso-d6)δ:2.25-2.30(m,2h),4.05(3h,s),4.09(t,j=7.0hz,2h),4.30(t,j=7.0hz,2h),6.49(1h,d,j=8.5hz),6.81(1h,dd,j=8.5,1.5hz),7.21-7.24(2h,m),7.41-7.44(1h,m),7.50(1h,d,j=1.5hz),7.52-7.59(4h,m),7.69(s,1h),7.80(d,j=1.5hz,1h),8.14(1h,d,j=8.0hz),8.30(1h,s),8.60(1h,dd,j=4.5,1.5hz)。实施例18:3-(6-氟-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3o)合成方法同实施12,只是用3g替代3a,得到红色固体3o,收率:52.6%,熔点:107-109℃。1hnmr(cdcl3)δ:2.42-2.47(2h,m),4.04(2h,t,j=7.0hz),4.07(3h,s),4.16(2h,t,j=7.0hz),6.33-6.38(1h,m),6.81(1h,td,j=9.0,2.0hz),6.94(1h,dd,j=9.0,2.0hz),6.99(1h,s),7.14-7.17(2h,m),7.40-7.44(1h,m),7.51-7.55(4h,m),7.65(1h,s),8.18(1h,s),8.28(1h,dd,j=8.5,1.5hz),8.60(1h,dd,j=4.5,1.5hz).实施例19:3-(5-氟-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3p)合成方法同实施13,只是用3h替代3a,得到红色固体3p,收率:49.2%,熔点:85-87℃。1hnmr(cdcl3)δ:2.41-2.47(2h,m),4.02(2h,t,j=7.0hz),4.10(3h,s),4.18(2h,t,j=7.0hz),6.13(1h,dd,j=9.5,2.5hz),6.93-6.98(2h,m),7.14-7.18(3h,m),7.40-7.45(1h,m),7.52-7.56(5h,m),8.25(1h,s),8.29(1h,dd,j=8.0,1.5hz),8.61(1h,dd,j=4.5,1.5hz).实施例20:3-(1-(2-(1h-咪唑-1-基)乙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3q)合成方法同实施13,只是用1-(2-氯乙基)-1h-咪唑替换1-(3-氯丙基)-1h-咪唑,得到红色固体3q,收率:46.3%,熔点:113-115℃。1hnmr(cdcl3)δ:4.10(3h,s),4.46(2h,t,j=6.5hz),4.56(2h,t,j=6.5hz),6.39(1h,d,j=8.0hz),6.76(1h,s),6.78-6.83(1h,m),7.04(1h,s),7.12-7.17(3h,m),7.24(1h,s),7.39-7.44(1h,m),7.51-7.54(4h,m),7.95(1h,s),8.15(1h,dd,j=8.5,1.5hz),8.57(1h,dd,j=4.5,1.5hz).实施例21:3-(1-(4-(1h-咪唑-1-基)丁基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(3r)合成方法同实施13,只是用1-(4-氯丁基)-1h-咪唑替换1-(3-氯丙基)-1h-咪唑,得到红色固体3r,收率:42.2%,熔点:167-169℃。1hnmr(cdcl3)δ:1.84-1.96(4h,m),3.92(2h,t,j=7.0hz),4.05(3h,s),4.24(2h,t,j=7.0hz),6.35(1h,d,j=8.0hz),6.80-6.86(2h,m),7.06(1h,s),7.11-7.14(1h,m),7.18(1h,t,j=8.0hz),7.30(1h,d,j=8.0hz),7.40-7.44(1h,m),7.48(1h,s),7.50-7.57(4h,m),8.22(1h,s),8.24(1h,dd,j=8.0,1.5hz),8.58(1h,dd,j=4.5,1.5hz).实施例22:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰa)在三口瓶中加入53mg(0.1mmol)化合物3i和7.7g(100mmol)醋酸铵,氮气保护下于140℃左右反应6h,冷却后将反应液倒入40ml水中,用碳酸钠溶液中和至碱性,然后用乙酸乙酯萃取(30ml×3),有机层合并后用饱和食盐水洗(50ml×3),无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用硅胶柱层析(二氯甲烷:甲醇:三乙胺=120:4:1,v/v/v)提纯,得到41mg红色固体ⅰa,产率91.1%,熔点:173-175℃。1hnmr(cdcl3)δ:2.41-2.42(2h,m),3.98(2h,t,j=6.8hz),4.04(3h,s),4.17(2h,t,j=6.8hz),6.30(1h,d,j=8.0hz),6.78(1h,t,j=8.0hz),6.97(1h,s),7.10-7.12(1h,m),7.13-7.16(2h,m),7.20(1h,t,j=8.0hz),7.60(1h,s),8.11-8.14(2h,m),8.55(1h,d,j=4.5hz);8.84(1h,s).实施例23:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-乙基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰb)合成方法同实施22,只是用3j替代3i,得到红色固体ⅰb,收率:84.1%,熔点:120-122℃。1hnmr(cdcl3)δ:1.28(3h,t,j=7.0hz),2.40-2.43(2h,m),3.98(2h,t,j=7.0hz),4.19(2h,t,j=7.0hz),4.47(2h,q,j=7.0hz),6.32(1h,d,j=8.0hz),6.76(1h,t,j=8.0hz),6.96(1h,s),7.12-7.18(3h,m),7.20(1h,d,j=8.0hz),7.60(1h,s),8.11(1h,s),8.22(1h,dd,j=8.0,1.5hz),8.57(1h,dd,j=4.5,1.5hz),9.00(1h,s).实施例24:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-丁基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰc)合成方法同实施22,只是用3k替代3i,得到红色固体ⅰc,收率:86.3%,熔点:200-202℃。1hnmr(cdcl3)δ:0.83(3h,t,j=7.0hz),1.21-1.27(2h,m),1.62-1.68(2h,m),2.42-2.47(2h,m),4.00(2h,t,j=7.0hz),4.20(2h,t,j=7.0hz)4.43(2h,t,j=7.0hz),6.35(1h,d,j=8.0hz),6.76(1h,t,j=8.0hz),6.99(1h,s),7.12-7.18(3h,m)7.21(1h,d,j=8.0hz),7.64(1h,s),8.11(1h,s),8.18(1h,dd,j=8.0,1.5hz),8.26(1h,s),8.57(1h,dd,j=4.5,1.5hz).实施例25:3-(1-(3-(1h-咪唑-1-基)丙基)-5-甲氧基-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰd)合成方法同实施22,只是用3l替代3i,得到红色固体ⅰd,收率:83.1%,熔点:124-126℃。1hnmr(cdcl3)δ:2.39-2.45(2h,m),3.04(3h,s),3.99(2h,t,j=7.0hz),4.10(3h,s),4.15(2h,t,j=7.0hz),5.68(1h,d,j=2.5hz),6.76(1h,dd,j=9.0,2.5hz),6.96(1h,s),7.08-7.11(2h,m),7.19(1h,s),7.59(1h,s),8.07(1h,dd,j=8.0,1.5hz),8.09(1h,s),8.34(1h,s),8.56(1h,dd,j=4.5,1.5hz).实施例26:3-(6-溴-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(ⅰe)合成方法同实施22,只是用3m替代3i,得到红色固体ⅰe,收率:89.2%,熔点:151-153℃。1hnmr(dmso-d6)δ:2.24-2.30(2h,m),4.01-4.05(5h,m),4.27(2h,t,j=7.0hz),6.47(1h,d,j=8.5hz),6.92-6.96(2h,m),7.18-7.20(1h,m),7.25(1h,s),7.69(1h,s),7.78(1h,d,j=1.5hz),8.07(1h,dd,j=8.0,1.5hz),8.24(1h,s),8.57(1h,dd,j=4.5,1.5hz),11.29(1h,s).实施例27:3-(6-氯-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰf)合成方法同实施22,只是用3n替代3j,得到红色固体ⅰf,收率:85.4%,熔点:158-159℃。1hnmr(dmso-d6)δ:2.21-2.35(2h,m),4.01(3h,s),4.04(2h,t,j=7.0hz),4.28(2h,t,j=7.0hz),6.51(1h,d,j=8.5hz),6.84(1h,dd,j=8.5,1.5hz),6.96(1h,s),7.18-7.21(1h,m),7.26(1h,s),7.65(1h,d,j=1.5hz),7.72(1h,s),8.08(1h,dd,j=8.0,1.5hz),8.26(1h,s),8.57(1h,dd,j=4.5,1.5hz),11.29(1h,s).实施例28:3-(6-氟-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰg)合成方法同实施22,只是用3o替代3j,得到红色固体ⅰg,收率:90.1%,熔点:138-140℃。1hnmr(dmso-d6)δ:2.25-2.30(2h,m),4.01-4.04(5h,m),4.25(2h,t,j=7.0hz),6.45-6.48(1h,m),6.68(1h,td,j=9.0,2.5hz),6.95(1h,s),7.18-7.20(1h,m),7.26(1h,s),7.40(1h,dd,j=10.0,2.5hz),7.70(1h,s),8.08(1h,dd,j=8.0,1.5hz),8.24(1h,s),8.57(1h,dd,j=4.5,1.5hz),11.28(1h,s).实施例29:3-(5-氟-1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰh)合成方法同实施22,只是用3p替代3j,得到红色固体ⅰh,收率:84.8%,熔点:136-137℃。1hnmr(dmso-d6)δ:2.29-2.35(2h,m),4.02(3h,s),4.10(2h,t,j=7.0hz),4.31(2h,t,j=7.0hz),6.16(1h,dd,j=10.5,2.5hz),6.99(1h,td,j=9.0,2.5hz),7.17(1h,s),7.21-7.23(1h,m),7.41(1h,s),7.51-7.54(1h,m),8.11(1h,dd,j=8.0,1.5hz),8.13(1h,s),8.32(1h,s),8.59(1h,dd,j=4.5,1.5hz),11.29(1h,s).实施例30:3-(1-(2-(1h-咪唑-1-基)乙基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰi)合成方法同实施22,只是用3q替代3j,得到红色固体ⅰi,收率:88.1%,熔点:120-122℃。1hnmr(cdcl3)δ:4.10(3h,s),4.40(2h,t,j=6.5hz),4.54(2h,t,j=6.5hz),6.33(1h,d,j=8.0hz),6.74-6.78(2h,m),7.05(1h,s),7.09-7.16(3h,m),7.22(1h,s),7.84(1h,s),8.01(1h,dd,j=8.5,1.5hz),8.27(1h,s),8.55(1h,dd,j=4.5,1.5hz).实施例31:3-(1-(4-(1h-咪唑-1-基)丁基)-1h-吲哚-3-基)-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1-苯基-1h-吡咯-2,5-二酮(ⅰj)合成方法同实施26,只是用3r替代3j,得到红色固体ⅰj,收率:86.9%,熔点:200-202℃。1hnmr(500mhz,cdcl3)δ:1.84-1.95(m,4h),3.92(d,j=7.0hz,2h),4.06(s,3h),4.22(t,j=7.0hz,2h),6.31(d,j=8.0hz,1h),6.79(t,j=8.0hz,1h),6.88(s,1h),7.06-7.12(m,2h),7.16(t,j=8.0hz,1h),7.28(d,j=8.0hz,1h),7.48(s,1h),8.11-8.15(m,2h),8.22(s,1h),8.57(dd,j=4.5,1.5hz,1h).实施例323-(1-甲基-1h-吡咯并[2,3-b]吡啶-3-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰk)在三口烧瓶中加入52.9mg(0.28mmol)2-(1-甲基-1h-吡咯[2,3-b]吡啶-3-基)乙酰胺4a,115mg(0.37mmol)2-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-2-氧代乙酸甲酯5a,20ml无水thf搅拌溶解,冷却至0℃左右,缓慢滴加98mg(0.87mmol)叔丁醇钾和10ml无水thf组成的溶液,滴完后,保温反应0.5h,然后升至室温反应1h。冷却至-5℃左右,加入5ml35%的盐酸,保温搅拌0.5h,然后将反应液倒入100ml冰水中,用碳酸氢钠中和至碱性,用乙酸乙酯萃取(100ml×3),合并有机相,用无水硫酸钠干燥,过滤,滤液减压浓缩回收溶剂,残留物用硅胶柱层析(二氯甲烷:甲醇=30:1)提纯,得到14.2mg红色固体ⅰk,收率为11.3%,熔点:207-209℃。1hnmr(dmso-d6)δ:2.18-2.30(m,2h),3.88(s,3h),3.97(t,j=7.0hz,2h),4.23(t,j=7.0hz,2h),6.65-6.69(m,1h),6.72(t,j=7.5hz,1h),6.85(d,j=7.5hz,1h),6.93(s,1h),7.02(d,j=7.5hz,1h),7.06(t,j=7.5hz,1h),7.20(s,1h),7.42(d,j=8.5hz,1h),7.62(s,1h),7.80(s,1h),8.03(s,1h),8.12(d,j=4.0hz,1h),11.02(s,1h).实施例333-(苯并三氮唑-1-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰl)合成方法同实施32,只是用2-(苯并三氮唑-1-基)乙酰胺4b替代4a,得到红色固体ⅰl,收率为8.3%,熔点:170-172℃。1hnmr(dmso-d6)δ:2.26-2.33(m,2h),4.06(t,j=7.0hz,2h),4.31(t,j=7.0hz,2h),5.65(d,j=8.0hz,1h),6.56(t,j=7.5hz,1h),7.02-7.10(m,2h),7.33(s,1h),7.44-7.53(m,3h),7.63(d,j=8.0hz,1h),7.94(s,1h),8.17(d,j=8.5hz,1h),8.32(s,1h),11.57(s,1h).实施例343-(1h-吡咯并[2,3-b]吡啶-1-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰm)合成方法同实施32,只是用2-(1h-吡咯并[2,3-b]吡啶-1-基)乙酰胺4c替代4a,得到红色固体ⅰm,收率为14.3%,熔点:242-243℃。1hnmr(dmso-d6)δ:2.24-2.31(m,2h),4.00(t,j=7.0hz,2h),4.27(t,j=7.0hz,2h),5.92(d,j=8.0hz,1h),6.50(t,j=7.5hz,1h),6.77(d,j=3.6hz,1h),7.00(t,j=7.4hz,1h),7.02-7.07(m,2h),7.29(s,1h),7.38(d,j=8.5hz,1h),7.67(d,j=3.6hz,1h),7.84(s,1h),7.96(dd,j=4.5,1.5hz,1h),8.02(dd,j=8.0,1.5hz,1h),8.16(s,1h),11.30(s,1h).实施例353-(1h-吡咯[3,2-c]吡啶-1-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰn)合成方法同实施32,只是用2-(1h-吡咯[3,2-c]吡啶-1-基)乙酰胺4e替代4a,得到红色固体ⅰn,收率为10.4%,熔点:>250℃。1hnmr(dmso-d6)δ:2.23-2.31(m,2h),3.99(t,j=7.0hz,2h),4.28(t,j=7.0hz,2h),5.98(d,j=8.0hz,1h),6.54(t,j=7.5hz,1h),6.91(d,j=3.5hz,1h),6.95-7.04(m,3h),7.26(s,1h),7.40(d,j=8.5hz,1h),7.68(d,j=3.5hz,1h),7.73(s,1h),7.93(d,j=6.0hz,1h),8.12(s,1h),8.85(s,1h),11.36(s,1h).实施例363-(呋喃并[2,3-b]吡啶-3-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰo)合成方法同实施32,只是用2-(3-呋喃并[2,3-b]吡啶)乙酰胺4f替代4a,得到红色固体ⅰo,收率为20.2%,熔点:184-186℃。1hnmr(dmso-d6)δ:2.21-2.28(m,2h),3.98(t,j=7.0hz,2h),4.26(t,j=7.0hz,2h),6.79(t,j=7.5hz,1h),6.89-6.94(m,2h),6.98-7.02(m,1h),7.10(t,j=8.0hz,1h),7.21(s,1h),7.26(dd,j=8.0,1.5hz,1h),7.46(d,j=8.5hz,1h),7.64(s,1h),7.95(s,1h),8.19(dd,j=5.0,1.5hz,1h),8.40(s,1h),11.31(s,1h).实施例373-(1-甲基-1h-吲哚-3-基)-4-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1h-吡咯-2.5-二酮(ⅰp)合成方法同实施32,只是用2-(1-甲基-1h-吲哚-3-基)乙酰胺4g替代4a,得到红色固体ⅰp,收率为10.0%,熔点:224-226℃。1hnmr(dmso-d6)δ:2.16-2.23(m,2h),3.87(s,3h),3.90(t,j=7.0hz,2h),4.18(t,j=7.0hz,2h),6.60(t,j=7.5hz,1h),6.66(d,j=8.0hz,1h),6.74(t,j=7.5hz,1h),6.92(s,1h),6.96-7.03(m,2h),7.06(t,j=7.5hz,1h),7.15(s,1h),7.39-7.44(m,2h),7.56(s,1h),7.68(s,1h),7.88(s,1h),10.96(s,1h).实施例38:3-(1-(3-(1h-咪唑-1-基)丙基)-1h-吲哚-3-基)-1-甲基-4-(1-甲基-1h-吡唑[3,4-b]并吡啶-3-基)-1h-吡咯-2,5-二酮(ⅰq)在三口瓶中加入52.6mg(0.1mmol)化合物4a和5ml32%的甲胺醇溶液,室温反应2h,反应完后将反应液减压浓缩,残留物用硅胶柱层析(二氯甲烷:甲醇:三乙胺=120:4:1,v/v/v)提纯,得到39mg红色固体ⅰq,产率84.0%,1hnmr(dmso-d6)δ:2.26-2.32(2h,m),3.09(3h,s),4.00(3h,s),4.03(2h,t,j=7.0hz),4.28(2h,t,j=7.0hz),6.44(1h,d,j=8.0hz),6.78(1h,t,j=8.0hz),6.95(1h,s),7.12(1h,t,j=8.0hz),7.16-7.19(1h,m),7.25(1h,s),7.47(1h,t,j=8.5hz),7.68(1h,s),8.06(1h,dd,j=8.0,1.5hz),8.28(1h,s),8.57(dd,j=4.0,1.5hz,1h).2.idh1/r132h抑制活性的测定idh1-r312h的测活方法是利用荧光检测技术。该方法的反应是在384深孔板中,反应总体积是50ul。蛋白、抑制剂、nadph和α-kg的混合液在包含:tris-hcl25mm(ph7.0),25mmnacl,bsa0.025%,8mmmncl2的缓冲液中进行反应,该反应利用nadph的减少来确定酶活性。nadph在340nm激发光激发后可发射出波长为460nm的可检测的荧光信号,从而观察酶的活性变化以及化合物对其的抑制情况。反应中设置多复不加酶的背景孔和不含化合物的全酶活性孔。ic50的值通过公式:y=100/(1+10^((logic50-x)*hillslope))获得。在idh1-r132h反应体系中,nadph的浓度为12μm,酶的浓度是27nm,部分化合物的测试结果见表1:表1:目标化合物对idh1/r132h的抑制活性化合物ic50±se(μm)agi-5198(阳性对照)0.13±0.01ⅰa0.05±0.00ⅰb0.23±0.03ⅰc0.95±0.12ⅰd13.62±0.34ⅰe0.06±0.00ⅰf0.14±0.02ⅰg0.09±0.01ⅰh0.17±0.02ⅰi4.42±0.08ⅰj0.10±0.02ⅰk0.54±0.13ⅰl1.40±0.03ⅰm3.91±0.85ⅰn3.72±1.24ⅰo2.22±0.19ⅰp1.48±0.08ⅰq0.93±0.02从表1数据可以看出,大部分化合物显示了良好的idh1/r132h抑制活性。3.idh1/r312c抑制活性的测定idh1-r312c的测活方法是利用荧光检测技术。该方法的反应是在384深孔板中,反应总体积是50ul。蛋白、抑制剂、nadph和α-kg的混合液在包含:tris-hcl25mm(ph7.0),25mmnacl,bsa0.025%,8mmmncl2的缓冲液中进行反应,该反应利用nadph的减少来确定酶活性。nadph在340nm激发光激发后可发射出波长为460nm的可检测的荧光信号,从而观察酶的活性变化以及化合物对其的抑制情况。反应中设置多复不加酶的背景孔和不含化合物的全酶活性孔。ic50的值通过公式:y=100/(1+10^((logic50-x)*hillslope))获得。在idh1-r132h反应体系中,nadph的浓度为12μm,酶的浓度是36nm,部分化合物的测试结果见表2:表2:目标化合物对idh1/r132c的抑制活性化合物ic50±se(μm)agi-5198(阳性对照)0.35±0.07ⅰa0.46±0.09ⅰe0.16±0.03ⅰf0.40±0.03ⅰg0.38±0.06ⅰj1.30±0.15ⅰk0.73±0.16从表2数据可以看出,上述化合物显示了良好的idh1/r312c抑制活性。4.化合物对野生型idh1(idh1/wt)选择性的测定idh1-wt的测活方法是利用荧光检测技术。该方法的反应是在384深孔板中,反应总体积是50ul。蛋白、抑制剂、nadp和异柠檬酸的混合液在包含:tris-hcl25mm(ph7.0),25mmnacl,bsa0.025%,1mmmgcl2的缓冲液中进行反应,idh1-wt催化异柠檬酸生成α-酮戊二酸,将nadp还原成nadph。该反应利用nadph的生成来确定酶活性。nadph在340nm激发光激发后可发射出波长为460nm的可检测的荧光信号,从而观察酶的活性变化以及化合物对其的抑制情况。反应中设置多复不加酶的背景孔和不含化合物的全酶活性孔。ic50的值通过公式:y=100/(1+10^((logic50-x)*hillslope))获得。在idh1-wt反应体系中,nadp的浓度为75μm,酶的浓度是30nm。部分化合物的测试结果见表3:表3:目标化合物对idh1/wt的抑制活性化合物抑制率%(20μg/ml)agi-5198(阳性对照)30.79±4.70ⅰa17.65±8.18ⅰe19.56±7.61ⅰf24.55±10.65ⅰg2.65±10.82ⅰj13.45±10.6ⅰk21.45±7.91从表3数据可以看出,本发明提供的化合物对野生型的idh1(idh1/wt)具有很好的选择性。5.2-hg的检测过表达idh1r132h突变的胶质瘤细胞u87-mg,培养在高糖dmem,10%fbs培养基中,置于co2培养箱(37℃,5%co2,95%空气)培养。检测化合物对2-羟基戊二酸(2-hg)生成的影响时,以2.5x104接种到96孔板中,化合物孵育48小时,弃去培养基,pbs洗三遍。细胞裂解后,代谢产物衍生和提取后,利用lc-ms-ms检测细胞内2-hg以及l-谷氨酸(l-glu)的变化。使用l-谷氨酸作为细胞代谢物量的对照,即将2-hg和l-glu的质谱信号强度相除来代表细胞内2-hg的浓度,部分化合物的测试结果见图1,从图1的结果表明:ⅰa,ⅰj,ⅰe,ⅰf和ⅰg都能浓度依赖的抑制表达idh1/r132h的u87mg细胞内2-hg的产生,体现了很好的靶向作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 低介电常数树脂基材用处理铜箔及使用该处理铜箔的覆铜层压板以及印刷配线板的制造方法与工艺
- 含有色酮结构的吡唑类N‐对溴苯基马来酰亚胺衍生物及其制备方法与应用与制造工艺
- 一种双吲哚马来酰亚胺生物碱HD‑ZWM288在制备抗肿瘤微管抑制剂药物的应用的制造方法与工艺
- 马来酰亚胺膜的制造方法与工艺
- 多孔性酰亚胺系树脂膜制造系统、隔膜、及多孔性酰亚胺系树脂膜制造方法与制造工艺
- 聚苯并噁嗪前体及其制备方法与制造工艺
- 含酰亚胺结构的环三磷腈无卤阻燃剂、制备方法及用途与制造工艺
- 开关型硫醇荧光标记试剂及其合成方法和应用与制造工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺