从胎膜中分离培养间充质干细胞的方法与流程
本发明属于间充质干细胞技术领域,具体涉及一种从胎膜中分离培养间充质干细胞的方法。
背景技术:
胎膜与胎儿的发育密切相关,其构成围绕并保护胎儿的羊膜腔,从子宫壁分离后的胎膜厚度约为200-300μm,由羊膜/中间海绵层/平滑绒毛膜/滋养层/壁蜕膜构成;目前已有研究表明人羊膜,绒毛膜及壁蜕膜中都含有较丰富的间充质干细胞,间充质干细胞是一种多能基质细胞,具有很强的自我更新能力和多项分化潜能,能够分化成成骨细胞,软骨细胞和脂肪细胞,在临床上有广泛的应用前景。
现有的间充质干细胞的分离过程常引用外源酶消化组织块,但该分离过程繁琐,操作时间长,且外源酶的残留还会对细胞质量产生影响。
技术实现要素:
针对现有技术中存在的上述问题,本发明提供一种从胎膜中分离培养间充质干细胞的方法,该方法操作简单,分离过程中无需引入外源酶,制得的间充质干细胞活性好。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种从胎膜中分离培养间充质干细胞的方法,包括以下步骤:
(1)从胎膜组织中分离羊膜,平滑绒毛膜及壁蜕膜组织;
(2)将步骤(1)所得的羊膜,平滑绒毛膜及壁蜕膜组织剪成组织块,加入组织清洗液进行清洗;
(3)向清洗好的羊膜,平滑绒毛膜及壁蜕膜组织中分别加入无血清培养基进行重悬,然后接种至培养瓶中,在37℃,5%co2,饱和湿度条件下进行培养;
(4)每隔3-4天更换一次培养基,直至p0代细胞融合度达到40-50%或非p0代细胞融合度达到70-85%;
(5)对步骤(4)所得细胞进行消化,用无血清培养基终止消化,然后过100μm孔径的筛网去除组织,再对细胞悬液进行稀释,离心,重悬,接种至培养瓶中进行传代培养;
(6)待传代后的细胞融合度达到70-90%时,对步骤(5)所得细胞进行消化,收集细胞,加入pbs或0.9%氯化钠注射液,清洗细胞,然后将预冷的细胞冻存液加入细胞中,重悬细胞,然后分装,放入梯度冻存盒中冻存。
进一步地,步骤(1)具体过程为:剪取胎盘边缘的胎膜组织,用组织清洗液对胎膜组织进行清洗,洗去血液,然后用组织镊剥离羊膜,平滑绒毛膜及壁蜕膜组织,分别对这三种组织进行清洗,并剔除血管等其他组织;
进一步地,组织清洗液为pbs溶液或0.9%氯化钠注射液中加入抗菌-抗真菌剂(三抗),抗菌-抗真菌剂占总溶液体积的1%。
进一步地,无血清培养基为含1%glutamax(gibico,ctstmglutamaxtm-isupplement,货号为a1286001)的mesenculttm-acf培养基。
进一步地,步骤(3)中接种密度为5-7mg/cm2,培养基体积与接种面积比为1:15-18。
进一步地,步骤(5)中接种密度为7×103-1.2×104个/cm2。
进一步地,步骤(5)和步骤(6)中采用0.25%胰蛋白酶对细胞进行消化。
进一步地,步骤(6)中细胞冻存液为10%dmso+90%无血清培养基。
进一步地,步骤(6)中重悬细胞至密度为2×106个/ml。
进一步地,步骤(6)中冻存时先在-80℃冻存24h后再转入气相液氮罐中保存。
本发明提供的从胎膜中分离培养间充质干细胞的方法,具有以下有益效果:
本发明提供了一种从胎膜中分离出羊膜、平滑绒毛膜和壁蜕膜三种组织来源的间充质干细胞的方法,改变了现有的取材部位,简化了分离工艺。
本发明采用组织块贴壁法提取间充质干细胞,提取工艺简单快捷,无需引入外源酶,降低了外源物对细胞制剂质量产生影响的风险,且制备的细胞活性佳,纯度高,增殖能力更强。
附图说明
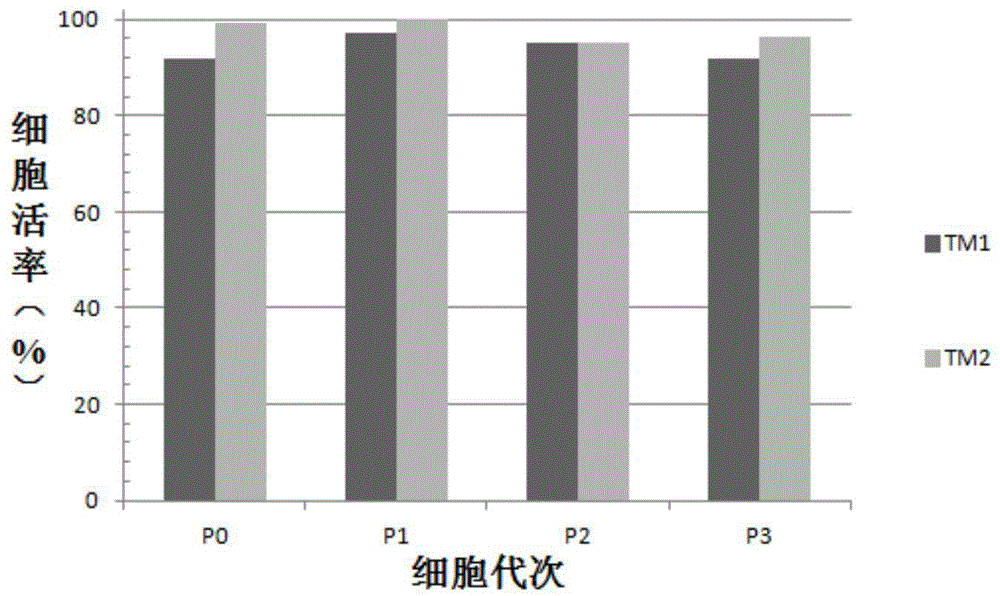
图1为实施例1和对比例1中的各代次细胞在传代或冻存时的细胞活率。
图2为实施例2、3和对比例2中的各代次细胞在传代或冻存时的细胞活率。
图3为实施例1和和对比例1所得细胞随着培养时间的加长,细胞数量变化情况。
图4为壁蜕膜来源(实施例1)的间充质干细胞p0代和p3代显微镜图片。
图5为羊膜来源(实施例2)的间充质干细胞p0代和p3代显微镜图片。
图6为平滑绒毛膜来源(实施例3)的间充质干细胞p0代和p3代显微镜图片。
图7为实施例1中的细胞表面标志物检测结果。
图8为实施例2中的细胞表面标志物检测结果。
图9为实施例3中的细胞表面标志物检测结果。
图10为对比例1中的细胞表面标志物检测结果。
图11为对比例2中的细胞表面标志物检测结果。
具体实施方式
本发明从胎膜中分离培养间充质干细胞过程中,所用的试剂如下:
组织清洗液:组织清洗液为pbs溶液或0.9%氯化钠注射液中加入1%抗菌-抗真菌剂(三抗),抗菌-抗真菌剂占总溶液体积的1%。
无血清培养基:含1%glutamax(gibico,ctstmglutamaxtm-isupplement,货号为a1286001)的mesenculttm-acf培养基。
细胞冻存液:10%dmso+90%无血清培养基。
实施例1
一种从胎膜中分离培养壁蜕膜来源的间充质干细胞的方法,包括以下步骤:
(1)临产前采集母血进行传染病检测,包括梅毒、艾滋、乙肝、丙肝等,选取健康足月的胎盘;
(2)剪取胎盘边缘的胎膜组织,将其剪成适当大小,用组织清洗液对胎膜组织进行清洗,洗去血液,然后剔除胎膜下层壁蜕膜面残留的血管组织,再次进行清洗,用组织镊剥离壁蜕膜组织,将其置于平皿中进行清洗并剔除滋养层及血管;
(3)将分离好的壁蜕膜组织转移到50ml离心管中,剪至约3mm3的组织块,加入组织清洗液,于700×g,离心清洗5min;
(4)向清洗好的壁蜕膜组织中加入无血清培养基进行重悬,然后接种至培养瓶中,接种密度为5mg/cm2,培养基体积与接种面积比为1:16,在37℃,5%co2,饱和湿度条件下进行培养;
(5)每隔3-4天更换一次培养基,直至p0代细胞融合度达到45%或非p0代细胞融合度达到80%;
(6)向培养瓶中加入0.25%胰蛋白酶,对步骤(5)所得细胞进行消化,接着用无血清培养基终止消化,消化完成后,将组织细胞悬液过100μm孔径的筛网去除组织,在细胞悬液中加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后加入无血清培养基重悬,调整密度为1.0×104个/cm2,接种至培养瓶中进行传代培养;
(7)待传代后的细胞融合度达到85%时,加入0.25%胰蛋白酶对细胞进行消化,收集细胞,加入0.9%氯化钠注射液,进行稀释,500×g,离心清洗3min,然后将预冷的细胞冻存液加入细胞中,重悬细胞使细胞密度为2×106个/ml,然后以1ml/支分装至冻存管中,放入梯度冻存盒,先在-80℃冻存24h后再转入气相液氮罐中保存。
实施例2
一种从胎膜中分离培养羊膜来源的间充质干细胞的方法,包括以下步骤:
(1)临产前采集母血进行传染病检测,包括梅毒、艾滋、乙肝、丙肝等,选取健康足月的胎盘;
(2)剪取胎盘边缘的胎膜组织,将其剪成适当大小,用组织清洗液对胎膜组织进行清洗,洗去血液,然后用组织镊剥离羊膜组织,将其置于平皿中进行清洗;
(3)将分离好的羊膜组织转移到50ml离心管中,剪至约3mm3的组织块,加入组织清洗液,于700×g,离心清洗5min;
(4)向清洗好的羊膜组织中加入无血清培养基进行重悬,然后接种至培养瓶中,接种密度为6mg/cm2,培养基体积与接种面积比为1:16,在37℃,5%co2,饱和湿度条件下进行培养;
(5)每隔3-4天更换一次培养基,直至p0代细胞融合度达到45%或非p0代细胞融合度达到80%;
(6)向培养瓶中加入0.25%胰蛋白酶,对步骤(5)所得细胞进行消化,接着用无血清培养基终止消化,消化完成后,将组织细胞悬液过100μm孔径的筛网去除组织,在细胞悬液中加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后加入无血清培养基重悬,调整密度为1.0×104个/cm2,接种至培养瓶中进行传代培养;
(7)待传代后的细胞融合度达到85%时,加入0.25%胰蛋白酶对细胞进行消化,收集细胞,加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后将预冷的细胞冻存液加入细胞中,重悬细胞使细胞密度为2×106个/ml,然后以1ml/支分装至冻存管中,放入梯度冻存盒,先在-80℃冻存24h后再转入气相液氮罐中保存。
实施例3
一种从胎膜中分离培养平滑绒毛膜来源的间充质干细胞的方法,包括以下步骤:
(1)临产前采集母血进行传染病检测,包括梅毒、艾滋、乙肝、丙肝等,选取健康足月的胎盘;
(2)剪取胎盘边缘的胎膜组织,将其剪成适当大小,用组织清洗液对胎膜组织进行清洗,洗去血液,然后用组织镊剥除上层羊膜组织后,剥取平滑绒毛膜层,将其置于平皿中进行清洗并剔除残留血管;
(3)将分离好的平滑绒毛膜组织转移到50ml离心管中,剪至约3mm3的组织块,加入组织清洗液,于700×g,离心清洗5min;
(4)向清洗后的平滑绒毛膜组织中加入无血清培养基进行重悬,然后接种至培养瓶中,接种密度为6mg/cm2,培养基体积与接种面积比为1:16,在37℃,5%co2,饱和湿度条件下进行培养;
(5)每隔3-4天更换一次培养基,直至p0代细胞融合度达到45%或非p0代细胞融合度达到80%;
(6)向培养瓶中加入0.25%胰蛋白酶,对步骤(5)所得细胞进行消化,接着用无血清培养基终止消化,消化完成后,将组织细胞悬液过100μm孔径的筛网去除组织,在细胞悬液中加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后加入无血清培养基重悬,调整密度为1.0×104个/cm2,接种至培养瓶中进行传代培养;
(7)待传代后的细胞融合度达到85%时,加入0.25%胰蛋白酶对细胞进行消化,收集细胞,加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后将预冷的细胞冻存液加入细胞中,重悬细胞使细胞密度为2×106个/ml,然后以1ml/支分装至冻存管中,放入梯度冻存盒,先在-80℃冻存24h后再转入气相液氮罐中保存。
对比例1
一种从胎膜中分离培养壁蜕膜来源的间充质干细胞的方法,包括以下步骤:
(1)临产前采集母血进行传染病检测,包括梅毒、艾滋、乙肝、丙肝等,选取健康足月的胎盘;
(2)剪取胎盘边缘的胎膜组织,将其剪成适当大小,用组织清洗液对胎膜组织进行清洗,洗去血液,然后剔除胎膜下层壁蜕膜面残留的血管组织,再次进行清洗,用组织镊剥离壁蜕膜组织,将其置于平皿中进行清洗并剔除滋养层及血管;其中,组织清洗液为d-hank’s液加入三抗,使得三抗占总溶液体积的1%;
(3)将分离好的壁蜕膜组织转移到50ml离心管中,剪至约3mm3的组织块,加入组织清洗液,于700×g,离心清洗5min;
(4)向清洗好的壁蜕膜组织中加入d-hank’s液进行重悬,然后分别加入终浓度为2%的ⅱ型和ⅳ型胶原酶,37℃水浴震荡消化2h;
(5)消化完成后加入无血清培养基进行稀释,混悬液过过100μm孔径的筛网去除组织,再于500×g,离心清洗5min,然后向细胞沉淀中加入无血清培养基重悬,接种至培养瓶中,接种密度为6.0×103个/cm2,在37℃,5%co2,饱和湿度条件下进行培养;
(5)48h后进行第一次换液,然后每隔3-4天更换一次培养基,直至p0代或非p0代细胞融合度达到80%;
(6)向培养瓶中加入0.25%胰蛋白酶,对步骤(5)所得细胞进行消化,接着用无血清培养基终止消化,消化完成后,在细胞悬液中加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后加入无血清培养基重悬,调整密度为1.0×104个/cm2,接种至培养瓶中进行传代培养;
(7)待传代后的细胞融合度达到85%时,加入0.25%胰蛋白酶对细胞进行消化,收集细胞,加入0.9%氯化钠注射液,进行稀释,500×g,离心清洗3min,然后将预冷的细胞冻存液加入细胞中,重悬细胞使细胞密度为2×106个/ml,然后以1ml/支分装至冻存管中,放入梯度冻存盒,先在-80℃冻存24h后再转入气相液氮罐中保存。
对比例2
一种从胎盘中分离培养绒毛膜板来源的间充质干细胞的方法,包括以下步骤:
(1)临产前采集母血进行传染病检测,包括梅毒、艾滋、乙肝、丙肝等,选取健康足月的胎盘;
(2)用组织清洗液清洗胎盘胎儿面,剥离胎盘胎儿面覆盖的羊膜后,避开血管剪取胎盘绒毛膜板组织,并放入平皿中进行清洗,然后剔除绒毛膜板上的绒毛及血管;其中,组织清洗液为0.9%氯化钠注射液中加入三抗,使得三抗占总溶液体积的1%;
(3)将分离好的绒毛膜板组织转移到50ml离心管中,剪至约3mm3的组织块,加入组织清洗液,于700×g,离心清洗5min;
(4)将清洗后的绒毛膜板组织弃上清后加入无血清培养基进行重悬,然后接种至培养瓶中,接种密度为6mg/cm2,培养基体积与接种面积比为1:16,在37℃,5%co2,饱和湿度条件下进行培养;
(5)每隔3-4天更换一次培养基,直至p0代细胞融合度达到45%或非p0代细胞融合度达到80%;
(6)向培养瓶中加入0.25%胰蛋白酶,对步骤(5)所得细胞进行消化,接着用无血清培养基终止消化,消化完成后,将组织细胞悬液过100μm孔径的筛网去除组织,在细胞悬液中加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后加入无血清培养基重悬,调整密度为1.0×104个/cm2,接种至培养瓶中进行传代培养;
(7)待传代后的细胞融合度达到85%时,加入0.25%胰蛋白酶对细胞进行消化,收集细胞,加入0.9%氯化钠注射液进行稀释,500×g,离心清洗3min,然后将预冷的细胞冻存液加入细胞中,重悬细胞使细胞密度为2×106个/ml,然后以1ml/支分装至冻存管中,放入梯度冻存盒中,先在-80℃冻存24h后再转入气相液氮罐中保存。
对上述细胞做如下检测:
1、细胞活率检测
计算实施例1-3和对比例1-2中的各代次细胞在传代或冻存时的细胞活率,结果如图1和2所示。
图1为实施例1和对比例1的细胞活率结果图,图1中tm1为对比例1中的细胞活率,tm2为实施例1中的细胞活率。图2为实施例2和实施例3及对比例2中的细胞活率结果图,图2中每组柱形图中从左到右分别为平滑绒毛膜来源(实施例3)、羊膜来源(实施例2)和绒毛膜板来源(对比例2)的间充质干细胞。
由图1和2可知,经过本发明方法分离培养的壁蜕膜、羊膜和平滑绒毛膜来源的各个代次的间充质干细胞的活率均较高,而采用组织块消化法分离过程中引入外源酶后会影响细胞存活率。
实施例1和对比例1所得细胞随着培养时间的加长,细胞数量变化情况见图3。
由图3可知,实施例1和对比例1所得细胞数量均随着培养时间的加长,细胞先加速增加,后保持平衡,但实施例1所得细胞增殖能力明显比对比例1的要强。
对比例2中虽然分离培养过程与本发明方法一致,但来源不同,会影响组织分离时间,以分离1g组织为基础,实施例3分离时间为30min,而对比例2分离时间为50min,对比例2比实施例3分离时间要长20min,但相同培养时间所得p0代细胞总量无显著差异。
2、细胞表面标志物检测
图4-6分别为壁蜕膜来源、羊膜来源、平滑绒毛膜来源的间充质干细胞p0代和p3代显微镜图片,左边为p0代,右边为p3代。
取实施例1-3及对比例1-2中的p3代间充质干细胞5.0×106个,用于细胞表面标志物cd105、cd90、cd73、cd45、cd34、cd19、cd11b、hla-dr进行检测,检测结果如图7-11和表1所示。图7-11分别为壁蜕膜来源、羊膜来源、平滑绒毛膜来源、对比例1和对比例2中的细胞表面标志物检测结果。
表1各来源细胞表面标志物检测结果
由图7和表1可知,经过本发明方法分离培养的壁蜕膜来源的p3代间充质干细胞阴性表达cd45、cd34、cd19、cd11b、hla-dr,且表达量均小于2%,阳性表达cd105、cd90、cd73,且表达量均大于99%,符合isct要求。
由图8和表1可知,经过本发明方法分离培养的羊膜来源的p3代间充质干细胞阴性表达cd45、cd34、cd19、cd11b、hla-dr,且表达量均小于2%,阳性表达cd105、cd90、cd73,且表达量均大于99%,符合isct要求。
由图9和表1可知,经过本发明方法分离培养的平滑绒毛膜来源的p3代间充质干细胞阴性表达cd45、cd34、cd19、cd11b、hla-dr,且表达量均小于2%,阳性表达cd105、cd90、cd73,且表达量均大于99%,符合isct要求。
由图10和表1可知,经过对比例1方法分离培养的p3代间充质干细胞阴性表达cd45、cd34、cd19、cd11b、hla-dr,且表达量均小于2%,阳性表达cd105、cd90、cd73,且表达量均大于95%,符合isct要求。
由图11和表1可知,经过对比例2方法分离培养的p3代间充质干细胞阴性表达cd45、cd34、cd19、cd11b、hla-dr,且表达量均小于2%,阳性表达cd105、cd90、cd73,且表达量均大于99%,符合isct要求。
3、支原体和真细菌检测
取实施例1-3和对比例1-2中1.0ml细胞培养原液(培养完每批次的细胞培养基为细胞原液)用于支原体检测,清洗完细胞的细胞清洗液15ml用于真细菌检测,检测结果均为阴性。
综上所述,采用组织块贴壁法分离提取人胎膜中三种来源的间充质干细胞具有细胞纯度高,细胞活力优,增殖能力强的特点;组织块贴壁法相比消化法分离的壁蜕膜来源间充质干细胞活细胞活力更高,增殖能力更强,操作步骤更加简单快捷;平滑绒毛膜组织较胎盘绒毛膜板组织分离容易,相同培养时间所得p0代细胞总量无显著差异。
- 还没有人留言评论。精彩留言会获得点赞!