特异性抗原刺激CD4淋巴细胞表达CD69用于诊断结核杆菌感染的方法与流程
本发明涉及医学检测领域,特别涉及特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法。
背景技术:
结核病(tuberculosis,tb)是由结核分枝杆菌(mycobacteriumtuberculosis,mtb)引起的一种与机体细胞免疫密切相关的慢性传染病,严重威胁着人类健康。近年来,随着mtb耐药株的不断增加与播散,以及卡介苗预防下降,特别是化疗药物和免疫抵制剂的广泛使用,结核病在全球呈明显回升趋势,流行情况日益严峻。中国是结核病的重灾区,结核病发病人数占全球的11.36%,位居全球第二。mtb感染人体后,根据个体的免疫情况,可以发生三种结局:第一种结局是个体免疫力旺盛,直接将感染的mtb杀死;第二种是机体免疫力不足以杀死全部mtb,但能抑制mtb的大量增殖,使之达到平衡状态,从而导致潜伏性结核感染(latenttuberculosisinfection,ltbi);第三种是机体的免疫力过低导致mtb大量增殖,引发临床疾病。据估计,世界上有近1/3的人口感染结核杆菌,其中只有5%~10%左右的人会发病,其余90%~95%的人群处于潜伏感染。然而,在机体免疫功能紊乱时,可导致ltbi转变为活动性结核病。因此,结核患者尤其是ltbi患者高效及时的结核早期诊断是结核规范性治疗的起点。
结核病的实验室诊断技术一直是结核病防控的瓶颈。现有诊断手段包括病原学诊断如mtb分离培养、涂片镜检和分子检测诊断等方法。但上述方法都有各自局限,如mtb分离培养耗时长(一般需要6~8周),灵敏度不高,且存在生物安全风险,仅在结核病定点医院开展。涂片镜检敏感度低(只有20%~30%的阳性率),且不能区分结核分枝杆菌和非结核分枝杆菌,往往延误治疗。分子诊断操作复杂,且结核杆菌的生物学特性,该方法的灵敏度和特异性不能满足临床需求。以上这些方法都需要从感染部位获取标本如痰、胸水、腹水、脑脊液等,但对于痰涂片阴性或病原学检查阴性,而临床又高度怀疑结核;尤其是无法获取病灶标本如骨结核、肠结核等,对结核病的诊断和排除诊断急需一种新的实验室检查方法,免疫学诊断应运而生。近年来,科学家通过比较基因组学发现了结核分支杆菌具备而卡介苗、其他分支杆菌没有的基因区域,且位于此区域的两个蛋白早期分泌抗原-6(esat-6)和培养基滤过蛋白-10(cfp-10)具有较强的th表位。在此基础之上,结合t细胞免疫检测技术的进展建立了一种新型的结核特异性t细胞免疫体外检测方法——基于酶联免疫斑点技术的结核感染t淋巴细胞斑点试验(t-spot.tb)和基于酶联免疫吸附技术的t淋巴细胞γ-ifn体外释放试验(igra)。
t-spot.tb和igra的原理基本一致,均为机体对mtb感染后发生的细胞免疫反应。利用特异性的结核抗原esat-6和cfp-10作为刺激原,经过全血中的抗原递呈细胞刺激特异性th细胞产生ifn-γ,于37℃体外培养16-24小时后检测产生ifn-γ的淋巴细胞数量(t-spot.tb)或培养液中ifn-γ含量(igra.tb),判断全血中是否存在结核特异性t细胞及其活力。由于采用结核菌特有抗原作为刺激原,不受卡介苗和非结核分枝杆菌的影响,对结核感染的检测灵敏度和特异性均较高。
t-spot.tb和igra两种方法在诊治结核病中的价值无显著区别,但在技术层面,t-spot.tb和igra.tb共同的缺陷:①是以总淋巴细胞为研究对象,并非cd4+的t淋巴细胞,而cd4+t淋巴细胞是人类抗mtb的主要免疫调节细胞,其检测结果的特异性和灵敏度会受到影响。②是t-spot.tb检测细胞内细胞因子的变化,igra.tb试验检测的是细胞内释放出来的细胞因子,检测过程较复杂,且影响因素多。③是对t-spot.tb而言,检测过程中对分离的pbmc计数要求准确,否则影响结果准确性;结果判断时,用肉眼存在主观性,否则需用仪器读数,且斑点多时有重叠现象;而对igra.tb试验来说,虽不用准确计数pbmc数,但用elisa检测培养上层液的ifn-γ,每次检测均需做标准曲线,不适用单个标本检验,且计算较复杂。
技术实现要素:
为了克服现有技术中所存在的上述不足,本发明提供了特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法;本发明的方法有着操作简单的特点,且用血量与用培养基量小,使得本发明的方法还有着经济效益高和适用性广的优点,还增加了诊断的灵敏度和缩短了检测时间,适合在结核病的检测中应用和推广。
本发明解决其技术问题的技术方案是:特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法,包括以下步骤:
1)细胞培养:
设三管;第一管为阴性对照管:在含9~11%小牛血清的1640细胞培养基中加入cd28和cd49d,使培养基中cd28和cd49d浓度各为0.9~0.12ug/ml后,再加入0.2~0.3ml肝素抗凝的外周血;第二管为阳性对照管:在含9~11%小牛血清的1640细胞培养基中加入pha、cd28和cd49d,使培养基中pha浓度为9~11ug/ml和cd28、cd49d浓度各为0.9~0.12ug/ml后,再加入0.2~0.3ml肝素抗凝的外周血;第三管为测定管:在含9~11%小牛血清的1640细胞培养基中加入esat-6、cfp-10、cd28、cd49d,使培养基中esat-6和cfp-10浓度各为4.5~5.5ug/ml,cd28和cd49d浓度各为0.9~1ug/ml后,再加入0.2~0.3ml肝素抗凝的外周血;
把阴性对照管、阳性对照管和测定管放入36~38℃、4~6%co2培养箱中培养20~24小时;
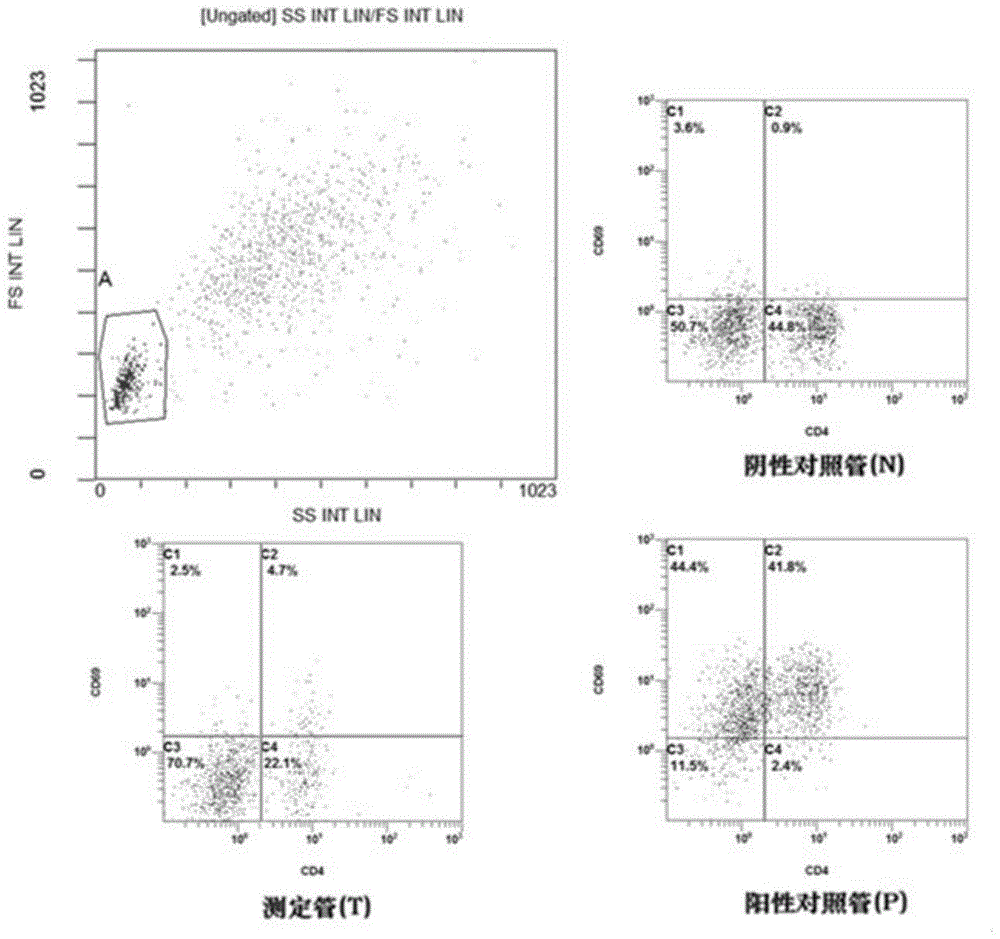
2)多色免疫表型标记与流式细胞术检测:从培养的3管全血中各取45~55ul分别加入到三根流式管中,然后,每根流式管中加入cd4-fitc、cd69-apc各4~6ul,常温避光15~20min;加nh4cl溶血素400~450ul,轻微振荡混匀;调整流式细胞仪中前向与侧向散射光的电压,根据cd4-ss设门,取cd4+细胞分析cd4+cd69+群细胞百分率,测定结果为测定管的cd4+cd69+群细胞百分率-阴性对照管的cd4+cd69+群细胞百分率。
作为优化方案,本发明的特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法,包括以下步骤:
1)细胞培养:
设三管;第一管为阴性对照管:在含10%小牛血清的1640细胞培养基中加入cd28和cd49d,使培养基中cd28和cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;第二管为阳性对照管:在含10%小牛血清的1640细胞培养基中加入pha、cd28和cd49d,使培养基中pha浓度为10ug/ml和cd28、cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;第三管为测定管:在含10%小牛血清的1640细胞培养基中加入esat-6、cfp-10、cd28、cd49d,使培养基中esat-6和cfp-10浓度各为5ug/ml,cd28和cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;
把阴性对照管、阳性对照管和测定管放入37℃、5%co2培养箱中培养24小时;
2)多色免疫表型标记与流式细胞术检测:从培养的3管全血中各取50ul分别加入到三根流式管中,然后,每根流式管中加入cd4-fitc、cd69-apc各5ul,常温避光15min;加nh4cl溶血素400ul,轻微振荡混匀;调整流式细胞仪中前向与侧向散射光的电压,根据cd4-ss设门,取cd4+细胞分析cd4+cd69+群细胞百分率,测定结果为测定管的cd4+cd69+群细胞百分率-阴性对照管的cd4+cd69+群细胞百分率。
作为优化,所述步骤1中,所设的三管中,含10%小牛血清的1640细胞培养基的用量为0.2ml。
与现有技术相比,本发明的特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法以多色流式细胞术为检测平台,建立多色标记术,检测cd4+t淋巴细胞经结核特异性抗原esat-6和cfp-10刺激后,以及在协同分子cd49d,cd28共同作用下,结核分枝杆菌抗原致敏淋巴细胞活化的细胞表型cd4+cd69+的表达变化,具有显著的进步,具体如下:
1)直接检测结核分枝杆菌致敏的cd4+t淋巴细胞经结核分枝杆特异性抗原蛋白(cfp-10和esat-6)再次刺激后迅速活化的免疫细胞,提高了检测特异性;
2)直接检测经结核杆菌特异性抗原蛋白(cfp-10和esat-6)刺激后cd4+t淋巴细胞的表面免疫表型cd4+cd69+,相比t-spot.tb检测细胞内细胞因子变化的方法和igra.tb试验检测细胞内释放出细胞因子的方法,操作更加简单,敏感性更高,且检测成本更低;
3)本发明的方法无需要制备标准曲线、可单个进行检测,检测的时间缩短5小时以上,减少了许多人力和物力的成本。
附图说明
图1是本发明的流式设门方案。
具体实施方式
下面通过具体实施例,并结合附图,对本发明的技术方案做进一步具体说明,但并不作为对本发明限制的依据。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或本领域常用的。
实施例
特异性抗原刺激cd4淋巴细胞表达cd69用于诊断结核杆菌感染的方法,包括以下步骤:
1)细胞培养:
设三管;第一管为阴性对照管:在含10%小牛血清的1640细胞培养基中加入cd28和cd49d,使培养基中cd28和cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;第二管为阳性对照管:在含10%小牛血清的1640细胞培养基中加入pha、cd28和cd49d,使培养基中pha浓度为10ug/ml和cd28、cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;第三管为测定管:在含10%小牛血清的1640细胞培养基中加入esat-6、cfp-10、cd28、cd49d,使培养基中esat-6和cfp-10浓度各为5ug/ml,cd28和cd49d浓度各为1ug/ml后,再加入0.2ml肝素抗凝的外周血;所设的三管中,含10%小牛血清的1640细胞培养基的用量为0.2ml;
把阴性对照管、阳性对照管和测定管放入37℃、5%co2培养箱中培养24小时;
2)多色免疫表型标记与流式细胞术检测:从培养的3管全血中各取50ul分别加入到三根流式管中,然后,每根流式管中加入cd4-fitc、cd69-apc各5ul,常温避光15min;加nh4cl溶血素400ul,轻微振荡混匀;调整流式细胞仪中前向与侧向散射光的电压,根据cd4-ss设门,取cd4+细胞分析cd4+cd69+群细胞百分率,测定结果为测定管的cd4+cd69+群细胞百分率-阴性对照管的cd4+cd69+群细胞百分率。
对113例结核病组、95例非结核疾患组和23例健康人组外周全血分别经结核杆菌特异性抗原蛋白(cfp-10和esat-6)刺激24小时,用流式细胞术检测淋巴细胞表面免疫标记cd4+cd69+的表达:经roc曲线统计分析,cd69的roc曲线下的面积(auc)为0.886,截断值为0.750,灵敏度为85.1%,特异性为83.6%,阳性预测值73.8%,阴性预测值88.6%。
收集113例疑似结核的患者进行临床双盲实验验证,其中最终临床确诊为结核病的患者有45例,其余68例患者均为非结核病人。用本发明的方法进行验证:得出灵敏度为82.2%,特异性为82.4%,阳性预测75.5%,阴性预测值87.5%,诊断符合率82.3%。
本发明的方法对结核分枝杆菌感染的诊断灵敏度和特异性更高。45例结核病患者用本发明的方法与涂片找抗酸杆菌、结核杆菌培养法比较检测准确度分别为82.2%、31.1%和37.8%。本方法诊断结核分枝杆菌感染的灵敏度为85.1%,特异性为83.6%。用tb.igra和t-spot.tb检测,灵敏度一般为(75~80)%,特异性为(70~75)%。本发明的方法相比于上述其他的方法有着更高灵敏度和特异性,增加了在临床诊断中的准确性。
本发明的方法在保证检测准确度的同时,降低所需要培养与刺激的外周血至0.2ml。使得待测者的取血方式可以增加一种末梢取血的方式,这一方面使得该方法能适用于不易抽取静脉血的新生儿、幼儿,增加了适用人群与范围,另一方面也给缓解了其他验血项目所需血量的压力,尽可能的减少了对待测者的血量选取。
注:检测灵敏度表示为:(结核病患者检测阳性数/结核病患者总数)×100%;检测特异性表示为:(1-健康志愿者检测阳性数/健康志愿者总数)×100%。
上述对本申请中涉及的发明的一般性描述和对其具体实施例的描述不应理解为是对该发明技术方案构成的限制。本领域所属技术人员根据本申请的公开,可以在不违背所涉及的发明构成要素的前提下,对上述一般性描述或/和实施例中的公开技术特征进行增加、减少或组合,形成属于本申请保护范围之内的其它的技术方案。
- 还没有人留言评论。精彩留言会获得点赞!