一种基于咔唑衍生物取代的氮杂环分子的有机光电材料及其制备方法和应用与流程
本发明涉及有机发光材料技术领域,特别涉及一种基于咔唑衍生物取代的氮杂环分子的有机光电材料及其制备方法和应用。
背景技术:
21世纪以来,oled显示技术逐步推广应用于手机与平板,以及电视、数码像机和可携带设备等商业领域,逐渐积累能与lcd行业抗争的竞争优势。在oleds器件中,依据简单的数据统计预测:在电致发光时,只有25%的注入电荷可以生成单线态激子(s1),导致荧光的产生(s1→s0),而剩余75%的注入电荷则生成三线态激子(t1),能够用于产生磷光(t1→s0)。大多数的有机发光材料旋轨耦合作用弱,使得t1激子的辐射失活速率非常低,从而容易发生激子淬灭而造成发光上的损失。对于传统的荧光材料,这75%的三线态激子的能量并不能得到有效利用,导致了器件理论上的外量子效率仅为5%左右。有机磷光材料在有机芳香体系中引入重金属原子来提高旋轨耦合的作用,促进本身跃迁禁阻的三线态向基态跃迁,因此可以充分提升两种激子的利用率,使得器件的内量子效率可以接近100%,然而需要用到相对比较贵重的稀有金属。
此外在热力学平衡过程中,利用反向系间窜越risc将是一种有效的捕获t1激子的方法。当t1和s1的能量差足够小时,分子可以通过热运动克服热活化能促进risc的过程,促进t1激子的有效利用,实现发光效率的提高,这就是tadf材料设计的最基本的原则。tadf材料发展至今,在器件的实际应用中限制其发展的关键问题不再仅仅是通过分子和器件结构设计来获得最为优异的发光表现,还要求不同光色的器件在高亮度与足够强的电压驱动下能抑制住效率的滚降,并且能够持续维持材料自身的稳定性。因此,提升发光层主客体稳定性的设计与方法选用将会是tadf器件能够开发自身潜能的关键。
通过探索分子结构的设计与器件发光效率的关系,总结出制备高效、低滚降的有机发光材料的方法,可以为有机光电器件得到广泛的商业化应用铺平道路,具有十分重要的学术意义和巨大的经济价值。
技术实现要素:
为了克服现有技术的上述缺点与不足,本发明的目的在于提供一种基于咔唑衍生物取代的氮杂环分子的有机光电材料,分子结构简单、性能稳定、具有较高的分解温度和较强的电化学稳定性,能够制备形态和性能稳定的薄膜。
本发明的另一目的在于提供上述基于咔唑衍生物取代的氮杂环分子的有机光电材料的制备方法,合成方法简便,容易提纯。
本发明的再一目的在于提供上述基于咔唑衍生物取代的氮杂环分子作为有机光电材料的应用。
本发明的目的通过以下技术方案实现:
一种基于咔唑衍生物取代的氮杂环分子的有机光电材料,具有如下p1n~p15n所示的化学结构式中的任一种:
其中,ar表示(1)和(2)中任意一种类型的咔唑衍生物基团:
所述的基于咔唑衍生物取代的氮杂环分子的有机光电材料的制备方法,包括以下步骤:
(1)制备a~o中任一项中间体:
(2)在惰性气体的保护下,在有机溶剂中加入步骤(2)制备的中间体、咔唑衍生物、碱混合均匀,加热回流搅拌反应,经由冷却、萃取、旋干溶剂、柱层析,得到所述基于咔唑衍生物取代的氮杂环分子的有机光电材料;
中间体c、h、m与咔唑衍生物的摩尔比分别为1:(1~1.2),其余中间体与咔唑衍生物所用的摩尔比为1:(2~2.5);
所述碱为无机碱,用量与咔唑衍生物的摩尔比为(1.8~2.5):1。
步骤(1)所述制备a~o中任一项中间体,具体为:
在惰性气体的保护下,在混合溶剂中加入不同位置取代的卤代氮杂环分子、中间体a~c中任一种、碱以及催化剂混合均匀,加热回流搅拌反应,经由冷却、萃取、旋干溶剂、柱层析,得到中间体a~o;
所述中间体a~c结构分别如下:
所述中间体a~c任一项中间体的制备方法如下:
将不同基团取代的对溴氟苯溶解在四氢呋喃中,然后往里面逐滴加入正丁基锂,将体系保持在-78℃搅拌反应1~1.5h之后,将异丙醇频哪醇硼酸酯缓慢加入到反应体系中,继续保持在-78℃搅拌反应1~1.5h,然后将体系恢复至室温反应过夜。
所述混合溶剂为甲苯/乙醇,所述碱为碳酸钾水溶液,所述催化剂为四(三苯基膦)钯。
所述加热回流反应温度为80~90℃,反应时间12~24h。
步骤(2)所述咔唑衍生物为3,6-二叔丁基咔唑和3,6-二甲氧基咔唑中的任意一种,所述碱为碳酸铯。
步骤(2)所述加热回流反应的温度为140~160℃,反应时间为18~24h。所述的基于咔唑衍生物取代的氮杂环分子的有机光电材料应用于有机发光二极管中。
与现有技术相比,本发明具有以下优点和有益效果:
(1)本发明所得到的基于咔唑衍生物取代的氮杂环分子的有机光电材料,其结构简单,合成方法简便,分子量确定,容易提纯,合成重现性好。
(2)本发明所得到的基于咔唑衍生物取代的氮杂环分子的有机光电材料具有较高的分解温度和较强的电化学稳定性,能够制备形态和性能稳定的薄膜。
(3)本发明所得到的基于咔唑衍生物取代的氮杂环分子的有机光电材料,通过能级调控可以实现发光颜色的调节以及载流子传输等其他光电物理性能的调控,利用其作为发光层可以获得高亮度下滚降控制非常好的有机发光二极管器件。
附图说明
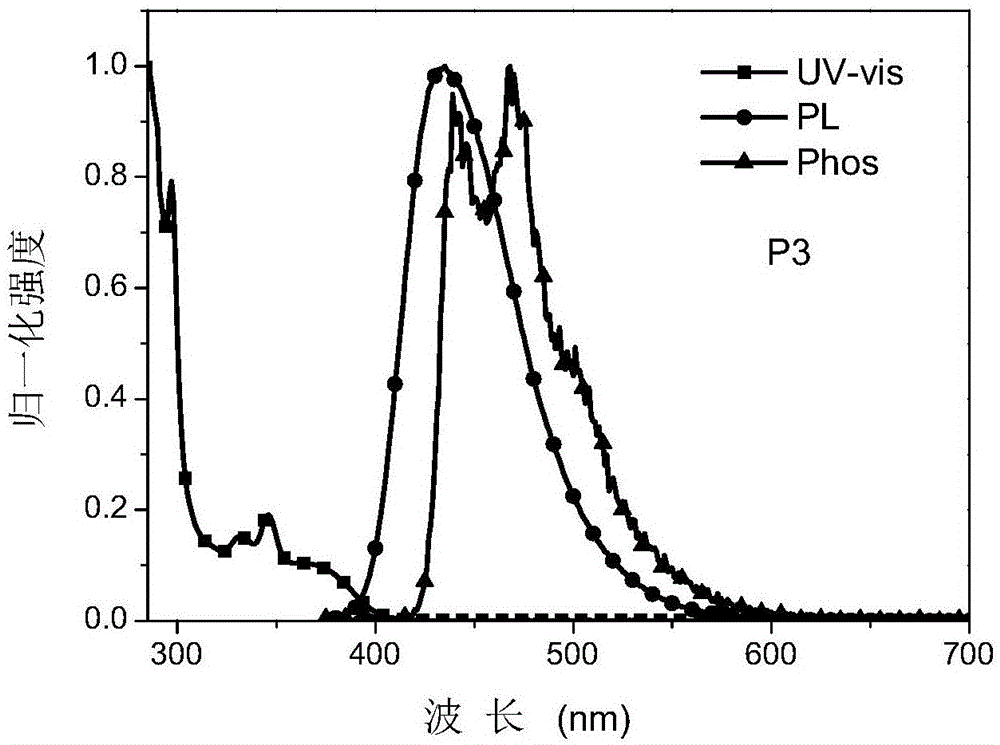
图1为p3在甲苯溶液的吸收、室温发射光谱和低温磷光光谱。
图2为p15在甲苯溶液的吸收、室温发射光谱和低温磷光光谱。
图3为p1在二氯甲烷溶液中120次循环氧化的循环伏安曲线。
图4为p24在二氯甲烷溶液中120次循环氧化的循环伏安曲线。
图5为实施例31制备的有机发光二极管器件的电流密度-电压-亮度关系曲线图。
图6为实施例31制备的有机发光二极管器件的最大外量子效率-亮度关系曲线图。
图7为实施例31制备的有机发光二极管器件的电致发光光谱图。
图8为实施例32采用p1作为主体制备的有机发光二极管器件的电流密度-电压-亮度关系曲线图。
图9为实施例32采用p1作为主体制备的有机发光二极管器件的电流效率-亮度-功率效率关系曲线图。
图10为实施例32采用p1作为主体制备的有机发光二极管器件的最大外量子效率-亮度关系曲线图。
具体实施方式
下面结合实施例,对本发明作进一步地详细说明,但本发明的实施方式不限于此。
实施例1
本实施例首先制备中间体a,具体合成步骤如下式所示:
在n2氛围和-78℃的低温环境下,在100ml的三口瓶中将5-溴-2-氟-1,3-二甲基苯2.03g(10mmol)溶解在60ml无水的四氢呋喃thf中,然后往里面逐滴加入2.5mol/l的正丁基锂(正己烷作溶剂)6.0ml,将体系保持在-78℃搅拌反应1h。之后,将异丙醇频哪醇硼酸酯4.1ml(20mmol)缓慢加入到反应体系中,继续保持在-78℃搅拌反应1h,然后将体系恢复至室温反应过夜。反应结束后,旋蒸除去thf,用二氯甲烷dcm和水萃取多次,取出有机相,旋蒸除去多余的dcm,用硅胶柱柱层析得到1.75g的中间体a,产率70%。分子式:c14h20bfo2;m/z=250.15;m/s=250.15(100%),249.16(24.8%),251.16(15.1%),250.16(3.8%);元素分析:c,67.23;h,8.06;b,4.32;f,7.60;o,12.79。
之后制备中间体a,具体合成步骤如下式所示:
在n2氛围保护下,在250ml的三口瓶中加入4,6-二氯-2-苯基嘧啶562.68mg(2.5mmol)和a中间体1.38g(5.5mmol),用90ml的甲苯和30ml的乙醇溶解,之后加入配置好的2mol/l的碳酸钾水溶液30ml以及催化剂四三苯基膦钯231.2mg(0.2mmol),加热至80℃回流反应20h。反应结束后将体系冷却至室温,旋蒸除去甲苯和乙醇,用二氯甲烷dcm和水萃取多次,取出有机相,旋蒸除去多余的dcm,用硅胶柱柱层析得到901mg的中间体a,产率90%。分子式:c26h22f2n2;m/z=400.18;m/s=400.18(100.0%),401.18(28.1%),402.18(2.7%),402.18(1.1%);元素分析:c,77.98;h,5.54;f,9.49;n,7.00。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p1,具体合成步骤如下式所示:
在n2氛围保护下,在250ml的三口瓶中加入3,6-二叔丁基咔唑1.23g(4.4mmol)和a中间体800.94mg(2mmol),用80ml的n,n’-二甲基甲酰胺dmf溶解,之后加入碳酸铯2.61g(8mmol),加热至150℃回流反应24h。反应结束后将体系冷却至室温,用二氯甲烷dcm和水萃取多次除去dmf,取出有机相,旋蒸除去多余的dcm,用硅胶柱柱层析得到1.40g的产物p1,产率76%。分子式:c66h70n4;m/z=918.56;m/s=918.56(100.0%),919.56(71.4%),920.57(25.1%),921.57(5.0%);元素分析:c,86.23;h,7.68;n,6.09。
实施例2
基于咔唑衍生物取代的氮杂环分子的有机光电材料p2,具体合成步骤如下式所示:
将实施例1中制备p1使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例1相同,可以得到1.22g的产物p2,产率75%。分子式:c54h46n4o4;m/z=814.35;m/s=814.35(100.0%),815.36(58.4%),816.36(16.7%),817.36(2.3%);元素分析:c,79.58;h,5.69;n,6.87;o,7.85。
实施例3
首先制备中间体b,具体合成步骤如下式所示:
将实施例1中制备a中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,4-二氯-6-苯基-1,3,5-三嗪565.15mg(2.5mmol),其余原料和步骤均与实施例1相同,可以得到883mg的中间体b,产率88%。分子式:c25h21f2n3;m/z=401.17;m/s=401.17(100.0%),402.17(27.0%),403.18(2.7%),402.17(1.1%);元素分析:c,74.80;h,5.27;f,9.46;n,10.47。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p3,具体合成步骤如下式所示:
将实施例1中制备p1使用的a中间体换成等当量的b中间体802.92mg(2mmol),其余原料和步骤均与实施例1相同,可以得到1.47g的产物p3,产率80%。分子式:c65h69n5;m/z=919.56;m/s=919.56(100.0%),920.56(70.3%),921.56(24.3%),922.57(5.5%);元素分析:c,84.83;h,7.56;n,7.61。
实施例4
基于咔唑衍生物取代的氮杂环分子的有机光电材料p4,具体合成步骤如下式所示:
将实施例2中制备p2使用的a中间体换成等当量的b中间体802.92mg(2mmol),其余原料和步骤均与实施例2相同,可以得到1.27g的产物p4,产率78%。分子式:c53h45n5o4;m/z=815.35;m/s=815.35(100.0%),816.35(57.3%),817.35(16.1%),818.36(2.2%);元素分析:c,78.02;h,5.56;n,8.58;o,7.84。
实施例5
首先制备中间体c,具体合成步骤如下式所示:
在n2氛围保护下,在250ml的三口瓶中加入2-氯-4,6-苯基嘧啶666.83mg(2.5mmol)和a中间体750.36mg(3mmol),用90ml的甲苯和30ml的乙醇溶解,之后加入配置好的2mol/l的碳酸钾水溶液30ml以及催化剂四三苯基膦钯231.2mg(0.2mmol),加热至80℃回流反应20h。反应结束后将体系冷却至室温,旋蒸除去甲苯和乙醇,用二氯甲烷dcm和水萃取多次,取出有机相,旋蒸除去多余的dcm,用硅胶柱柱层析得到815mg的中间体c,产率92%。分子式:c24h19fn2;m/z=354.15;m/s=354.15(100.0%),355.16(26.0%),356.16(2.7%);元素分析:c,81.33;h,5.40;f,5.36;n,7.90。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p5,具体合成步骤如下式所示:
在n2氛围保护下,在250ml的三口瓶中加入3,6-二叔丁基咔唑698.58mg(2.5mmol)和c中间体708.86mg(2mmol),用80ml的n,n’-二甲基甲酰胺dmf溶解,之后加入碳酸铯1.63g(5mmol),加热至150℃回流反应24h。反应结束后将体系冷却至室温,用二氯甲烷dcm和水萃取多次除去dmf,取出有机相,旋蒸除去多余的dcm,用硅胶柱柱层析得到921mg的产物p5,产率75%。分子式:c44h43n3;m/z=613.35;m/s=613.35(100.0%),614.35(47.6%),615.35(11.1%),616.36(1.7%);元素分析:c,86.09;h,7.06;n,6.85。
实施例6
基于咔唑衍生物取代的氮杂环分子的有机光电材料p6,具体合成步骤如下式所示:
将实施例5中制备p5使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑568.15mg(2.5mmol),其余原料和步骤均与实施例5相同,可以得到875mg的产物p6,产率78%。分子式:c38h31n3o2;m/z=561.24;m/s=561.24(100.0%),562.24(41.1%),563.25(5.5%),563.25(2.7%);元素分析:c,81.26;h,5.56;n,7.48;o,5.70。
实施例7
首先制备中间体d,具体合成步骤如下式所示:
将实施例1中制备a中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,6-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例1相同,可以得到689mg的中间体d,产率85%。分子式:c20h18f2n2;m/z=324.14;m/s=324.14(100.0%),325.15(21.6%),326.15(2.2%);元素分析:c,74.06;h,5.59;f,11.71;n,8.64。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p7,具体合成步骤如下式所示:
将实施例1中制备p1使用的a中间体换成等当量的d中间体648.74mg(2mmol),其余原料和步骤均与实施例1相同,可以得到1.21g的产物p7,产率72%。分子式:c60h66n4;m/z=842.53;m/s=842.53(100.0%),843.53(64.9%),844.54(20.7%),845.54(3.5%);元素分析:c,85.47;h,7.89;n,6.64。
实施例8
基于咔唑衍生物取代的氮杂环分子的有机光电材料p8,具体合成步骤如下式所示:
将实施例7中制备p7使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例7相同,可以得到1.09g的产物p8,产率74%。分子式:c48h42n4o4;m/z=738.32;m/s=738.32(100.0%),739.32(51.9%),740.33(13.2%),739.32(1.5%);元素分析:c,78.03;h,5.73;n,7.58;o,8.66。
实施例9
首先制备中间体e,具体合成步骤如下式所示:
将实施例7中制备d中间体使用的2,6-二溴吡嗪换成等当量的2,5-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例7相同,可以得到721mg的中间体e,产率89%。分子式:c20h18f2n2;m/z=324.14;m/s=324.14(100.0%),325.15(21.6%),326.15(2.2%);元素分析:c,74.06;h,5.59;f,11.71;n,8.64。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p9,具体合成步骤如下式所示:
将实施例7中制备p7使用的d中间体换成等当量的e中间体648.74mg(2mmol),其余原料和步骤均与实施例1相同,可以得到1.29g的产物p9,产率77%。分子式:c60h66n4;m/z=842.53;m/s=842.53(100.0%),843.53(64.9%),844.54(20.7%),845.54(3.5%);元素分析:c,85.47;h,7.89;n,6.64。
实施例10
基于咔唑衍生物取代的氮杂环分子的有机光电材料p10,具体合成步骤如下式所示:
将实施例9中制备p9使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例9相同,可以得到1.15g的产物p10,产率78%。分子式:c48h42n4o4;m/z=738.32;m/s=738.32(100.0%),739.32(51.9%),740.33(13.2%),739.32(1.5%);元素分析:c,78.03;h,5.73;n,7.58;o,8.66。
实施例11
本实施例首先制备中间体b,具体合成步骤如下式所示:
将实施例1中制备中间体a的5-溴-2-氟-1,3-二甲基苯换成等当量的5-溴-2-氟-1,3-二甲氧基苯2.35g(10mmol),其余原料和步骤均与实施例1相同,可以得到1.83g的中间体b,产率65%。分子式:c14h20bfo4;m/z=282.14;m/s=282.14(100.0%),281.15(24.8%),283.15(15.1%),282.15(3.8%);元素分析:c,59.60;h,7.15;b,3.83;f,6.73;o,22.68。
之后制备中间体f,具体合成步骤如下式所示:
将实施例1中制备中间体a使用的a中间体换成等当量的b中间体1.55g(5.5mmol),其余原料和步骤均与实施例1相同,可以得到998mg中间体f,产率86%。分子式:c26h22f2n2o4;m/z=464.15;m/s=464.15(100.0%),465.16(28.1%),466.16(3.8%);元素分析:c,67.24;h,4.77;f,8.18;n,6.03;o,13.78。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p11,具体合成步骤如下式所示:
将实施例1中制备p1使用的a中间体换成等当量的f中间体928.94mg(2mmol),其余原料和步骤均与实施例1相同,可以得到1.30g的产物p11,产率68%。分子式:c66h70n4o4;m/z=982.54;m/s=982.54(100.0%),983.54(71.4%),984.55(25.1%),985.55(5.0%);元素分析:c,80.62;h,7.18;n,5.70;o,6.51。
实施例12
基于咔唑衍生物取代的氮杂环分子的有机光电材料p12,具体合成步骤如下式所示:
将实施例11中制备p11使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例11相同,可以得到1.28g的产物p12,产率73%。分子式:c54h46n4o8;m/z=878.33;m/s=878.33(100.0%),879.33(58.4%),880.34(16.7%),881.34(2.3%);元素分析:c,73.79;h,5.28;n,6.37;o,14.56。
实施例13
本实施例首先制备中间体g,具体合成步骤如下式所示:
将实施例11中制备f中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,4-二氯-6-苯基-1,3,5-三嗪565.15mg(2.5mmol),其余原料和步骤均与实施例11相同,可以得到1.05g的中间体g,产率90%。分子式:c25h21f2n3o4;m/z=465.15;m/s=465.15(100.0%),466.15(27.0%),467.16(2.7%),466.15(1.1%);元素分析:c,64.51;h,4.55;f,8.16;n,9.03;o,13.75。基于咔唑衍生物取代的氮杂环分子的有机光电材料p13,具体合成步骤如下式所示:
将实施例11中制备p11使用的f中间体换成等当量的g中间体930.92mg(2mmol),其余原料和步骤均与实施例11相同,可以得到1.40g的产物p13,产率71%。分子式:c65h69n5o4;m/z=983.53;m/s=983.53(100.0%),984.54(70.3%),985.54(24.3%),986.55(4.7%);元素分析:c,79.32;h,7.07;n,7.12;o,6.50。
实施例14
基于咔唑衍生物取代的氮杂环分子的有机光电材料p14,具体合成步骤如下式所示:
将实施例13中制备p13使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例13相同,可以得到1.30g的产物p14,产率74%。分子式:c53h45n5o8;m/z=879.33;m/s=879.33(100.0%),880.33(57.3%),881.33(16.1%),882.34(2.2%);元素分析:c,72.34;h,5.15;n,7.96;o,14.55。
实施例15
本实施例首先制备中间体h,具体合成步骤如下式所示:
将实施例5中制备c中间体使用的a中间体换成等当量的b中间体846.36mg(3mmol),其余原料和步骤均与实施例5相同,可以得到879mg的中间体h,产率91%。分子式:c24h19fn2o2;m/z=386.14;m/s=386.14(100.0%),387.15(26.0%),388.15(2.7%);元素分析:c,74.60;h,4.96;f,4.92;n,7.25;o,8.28。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p15,具体合成步骤如下式所示:
将实施例5中制备p5使用的c中间体换成等当量的h中间体772.86mg(2mmol),其余原料和步骤均与实施例5相同,可以得到943mg的产物p15,产率73%。分子式:c44h43n3o2;m/z=645.34;m/s=645.34(100.0%),646.34(47.6%),647.34(11.1%),646.33(1.1%);元素分析:c,81.83;h,6.71;n,6.51;o,4.95。
实施例16
基于咔唑衍生物取代的氮杂环分子的有机光电材料p16,具体合成步骤如下式所示:
将实施例6中制备p6使用的c中间体换成等当量的h中间体772.86mg(2mmol),其余原料和步骤均与实施例6相同,可以得到902mg的产物p16,产率76%。分子式:c38h31n3o4;m/z=593.23;m/s=593.23(100.0%),594.23(41.1%),595.24(5.5%),595.24(2.7%);元素分析:c,76.88;h,5.26;n,7.08;o,10.78。
实施例17
本实施例首先制备中间体i,具体合成步骤如下式所示:
将实施例11中制备f中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,6-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例11相同,可以得到845mg的中间体i,产率87%。分子式:c20h18f2n2o4;m/z=388.12;m/s=388.12(100.0%),389.13(21.6%),390.13(2.2%);元素分析:c,61.85;h,4.67;f,9.78;n,7.21;o,16.48。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p17,具体合成步骤如下式所示:
将实施例11中制备p11使用的f中间体换成等当量的i中间体776.74mg(2mmol),其余原料和步骤均与实施例11相同,可以得到1.32g的产物p17,产率73%。分子式:c60h66n4o4;m/z=906.51;m/s=906.51(100.0%),907.51(64.9%),908.52(20.7%),909.52(3.5%);元素分析:c,79.44;h,7.33;n,6.18;o,7.05。
实施例18
基于咔唑衍生物取代的氮杂环分子的有机光电材料p18,具体合成步骤如下式所示:
将实施例17中制备p17使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例17相同,可以得到1.14g的产物p18,产率71%。分子式:c48h42n4o8;m/z=802.30;m/s=802.30(100.0%),803.30(51.9%),804.31(13.2%),804.30(1.6%);元素分析:c,71.81;h,5.27;n,6.98;o,15.94。
实施例19
本实施例首先制备中间体j,具体合成步骤如下式所示:
将实施例17中制备i中间体使用的2,6-二溴吡嗪换成等当量的2,5-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例17相同,可以得到864mg的中间体j,产率89%。分子式:c20h18f2n2o4;m/z=388.12;m/s=388.12(100.0%),389.13(21.6%),390.13(2.2%);元素分析:c,61.85;h,4.67;f,9.78;n,7.21;o,16.48。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p19,具体合成步骤如下式所示:
将实施例17中制备p17使用的i中间体换成等当量的j中间体776.74mg(2mmol),其余原料和步骤均与实施例17相同,可以得到1.43g的产物p19,产率79%。分子式:c60h66n4o4;m/z=906.51;m/s=906.51(100.0%),907.51(64.9%),908.52(20.7%),909.52(3.5%);元素分析:c,79.44;h,7.33;n,6.18;o,7.05。
实施例20
基于咔唑衍生物取代的氮杂环分子的有机光电材料p20,具体合成步骤如下式所示:
将实施例19中制备p19使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例19相同,可以得到1.22g的产物p20,产率76%。分子式:c48h42n4o8;m/z=802.30;m/s=802.30(100.0%),803.30(51.9%),804.31(13.2%),804.30(1.6%);元素分析:c,71.81;h,5.27;n,6.98;o,15.94。
实施例21
本实施例首先制备中间体c,具体合成步骤如下式所示:
将实施例1中制备中间体a的5-溴-2-氟-1,3-二甲基苯换成等当量的5-溴-2-氟-1,3-二叔丁基基苯2.87g(10mmol),其余原料和步骤均与实施例1相同,可以得到2.01g的中间体b,产率60%。分子式:c20h32bfo2;m/z=334.25;m/s=334.25(100.0%),333.25(24.8%),335.25(21.6%),334.25(5.4%);元素分析:c,71.86;h,9.65;b,3.23;f,5.68;o,9.57。
之后制备中间体k,具体合成步骤如下式所示:
将实施例1中制备中间体a使用的a中间体换成等当量的c中间体1.84g(5.5mmol),其余原料和步骤均与实施例1相同,可以得到1.17g中间体k,产率82%。分子式:c38h46f2n2;m/z=568.36;m/s=568.36(100.0%),569.37(41.1%),570.37(8.2%);元素分析:c,80.24;h,8.15;f,6.68;n,4.93。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p21,具体合成步骤如下式所示:
将实施例1中制备p1使用的a中间体换成等当量的k中间体1.14g(2mmol),其余原料和步骤均与实施例1相同,可以得到1.46g的产物p21,产率67%。分子式:c78h94n4;m/z=1086.75;m/s=1086.75(100.0%),1087.75(84.4%),1088.75(35.1%),1089.76(8.8%);元素分析:c,86.14;h,8.71;n,5.15。
实施例22
基于咔唑衍生物取代的氮杂环分子的有机光电材料p22,具体合成步骤如下式所示:
将实施例21中制备p21使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例21相同,可以得到1.36g的产物p22,产率69%。分子式:c66h70n4o4;m/z=982.54;m/s=982.54(100.0%),983.54(71.4%),984.55(25.1%),985.55(5.0%);元素分析:c,80.62;h,7.18;n,5.70;o,6.51。
实施例23
本实施例首先制备中间体l,具体合成步骤如下式所示:
将实施例21中制备k中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,4-二氯-6-苯基-1,3,5-三嗪565.15mg(2.5mmol),其余原料和步骤均与实施例21相同,可以得到1.20g的中间体l,产率84%。分子式:c37h45f2n3;m/z=569.36;m/s=569.36(100.0%),570.36(40.0%),571.36(7.8%),570.36(1.1%);元素分析:c,78.00;h,7.96;f,6.67;n,7.37。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p23,具体合成步骤如下式所示:
将实施例21中制备p21使用的k中间体换成等当量的l中间体1.14g(2mmol),其余原料和步骤均与实施例21相同,可以得到1.41g的产物p23,产率65%。分子式:c77h93n5;m/z=1087.74;m/s=1087.74(100.0%),1088.75(83.3%),1089.75(34.2%),1090.75(9.3%);元素分析:c,84.96;h,8.61;n,6.43。
实施例24
基于咔唑衍生物取代的氮杂环分子的有机光电材料p24,具体合成步骤如下式所示:
将实施例23中制备p23使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例23相同,可以得到1.24g的产物p24,产率63%。分子式:c65h69n5o4;m/z=983.53;m/s=983.53(100.0%),984.54(70.3%),985.54(24.3%),986.55(4.7%);元素分析:c,79.32;h,7.07;n,7.12;o,6.50。
实施例25
本实施例首先制备中间体m,具体合成步骤如下式所示:
将实施例5中制备c中间体使用的a中间体换成等当量的c中间体1.00g(3mmol),其余原料和步骤均与实施例5相同,可以得到954mg的中间体m,产率87%。分子式:c30h31fn2;m/z=438.25;m/s=438.25(100.0%),439.25(32.4%),440.25(2.7%),440.25(2.4%);元素分析:c,82.16;h,7.12;f,4.33;n,6.39。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p25,具体合成步骤如下式所示:
将实施例5中制备p5使用的c中间体换成等当量的m中间体877.18mg(2mmol),其余原料和步骤均与实施例5相同,可以得到949mg的产物p25,产率68%。分子式:c50h55n3;m/z=697.44;m/s=697.44(100.0%),698.44(54.1%),699.45(14.3%),700.45(2.5%);元素分析:c,86.04;h,7.94;n,6.02。
实施例26
基于咔唑衍生物取代的氮杂环分子的有机光电材料p26,具体合成步骤如下式所示:
将实施例6中制备p6使用的c中间体换成等当量的m中间体877.18mg(2mmol),其余原料和步骤均与实施例6相同,可以得到852mg的产物p26,产率66%。分子式:c44h43n3o2;m/z=645.34;m/s=645.34(100.0%),646.34(47.6%),647.34(11.1%),646.33(1.1%);元素分析:c,81.83;h,6.71;n,6.51;o,4.95。
实施例27
本实施例首先制备中间体n,具体合成步骤如下式所示:
将实施例21中制备k中间体使用的4,6-二氯-2-苯基嘧啶换成等当量的2,6-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例21相同,可以得到1.08g的中间体n,产率88%。分子式:c32h42f2n2;m/z=492.33;m/s=492.33(100.0%),493.33(34.6%),494.34(3.1%),494.34(2.7%);元素分析:c,78.01;h,8.59;f,7.71;n,5.69。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p27,具体合成步骤如下式所示:
将实施例21中制备p21使用的k中间体换成等当量的n中间体985.40mg(2mmol),其余原料和步骤均与实施例21相同,可以得到1.29g的产物p27,产率64%。分子式:c72h90n4;m/z=1010.72;m/s=1010.72(100.0%),1011.72(77.9%),1012.72(29.9%),1013.73(6.7%);元素分析:c,85.49;h,8.97;n,5.54。
实施例28
基于咔唑衍生物取代的氮杂环分子的有机光电材料p28,具体合成步骤如下式所示:
将实施例27中制备p27使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例27相同,可以得到1.22g的产物p28,产率67%。分子式:c60h66n4o4;m/z=906.51;m/s=906.51(100.0%),907.51(64.9%),908.52(20.7%),909.52(3.5%);元素分析:c,79.44;h,7.33;n,6.18;o,7.05。
实施例29
本实施例首先制备中间体o,具体合成步骤如下式所示:
将实施例27中制备n中间体使用的2,6-二溴吡嗪换成等当量的2,5-二溴吡嗪594.70mg(2.5mmol),其余原料和步骤均与实施例27相同,可以得到1.07g的中间体o,产率87%。分子式:c32h42f2n2;m/z=492.33;m/s=492.33(100.0%),493.33(34.6%),494.34(3.1%),494.34(2.7%);元素分析:c,78.01;h,8.59;f,7.71;n,5.69。
基于咔唑衍生物取代的氮杂环分子的有机光电材料p29,具体合成步骤如下式所示:
将实施例21中制备p21使用的k中间体换成等当量的o中间体985.40mg(2mmol),其余原料和步骤均与实施例21相同,可以得到1.35g的产物p29,产率67%。分子式:c72h90n4;m/z=1010.72;m/s=1010.72(100.0%),1011.72(77.9%),1012.72(29.9%),1013.73(6.7%);元素分析:c,85.49;h,8.97;n,5.54。
实施例30
基于咔唑衍生物取代的氮杂环分子的有机光电材料p30,具体合成步骤如下式所示:
将实施例29中制备p29使用的3,6-二叔丁基咔唑换成等当量的3,6-二甲氧基咔唑999.94mg(4.4mmol),其余原料和步骤均与实施例29相同,可以得到1.27g的产物p30,产率70%。分子式:c60h66n4o4;m/z=906.51;m/s=906.51(100.0%),907.51(64.9%),908.52(20.7%),909.52(3.5%);元素分析:c,79.44;h,7.33;n,6.18;o,7.05。
实施例31
应用本发明的基于咔唑衍生物取代的氮杂环分子的有机光电材料(p3和p15)作为有机发光二极管器件的发光层客体,实施的通用器件结构如下:ito/tapc(30nm)/mcp(10nm)/dpepo:xwt%p3或p15(35nm)/dpepo(10nm)/tmpypb(40nm)/lif(1nm)/al(100nm)。其中ito为阳极,tapc为空穴传输层,mcp为激子阻挡层,dpepo为发光层的主体和激子阻挡层,tmpypb为电子传输层,lif为电子注入层,al为阴极,x为10或20。
该有机发光二极管器件的制备过程如下:将ito透明导电玻璃在清洗剂中超声处理,再用去离子水清洗,用丙酮和乙醇的混合溶剂超声去油,在洁净的环境下烘烤至完全除去水分,用紫外光和臭氧清洗,并用低能阳离子轰击处理。将上述带有阳极ito的玻璃置于真空腔内,抽真空至1×10-5-9×10-3pa,在上述阳极膜上以
本实施例优化后的有机发光二极管器件的电流密度-电压-亮度曲线图、最大外量子效率-亮度关系曲线图和电致发光光谱图分别如图5、图6、图7所示,基本表征数据如表1所示。p3和p15在甲苯溶液中的吸收、室温发射光谱和低温磷光光谱如图1和图2所示,从光致和电致发光光谱可以看出这两种材料是有ct特征的纯蓝光和深蓝光材料。从器件的相关表征数据中可以发现,采用p3作为发光客体制备的器件的启亮电压大约需要3.6v,电流效率最高可以达到34cd/a左右,最大外量子效率能够达到25.2%的水平,对高亮度下的效率滚降有明显的抑制,cie坐标为(0.15,0.17),且电致发光光谱半峰宽只有70nm。对于p15,器件优化后的最大外量子效率也能达到10.8%的水平,cie坐标为(0.15,0.09),表现出良好的发光光色。
表1以p3和p15作为客体的有机发光二极管器件的基本数据
实施例32
应用本发明的基于咔唑衍生物取代的氮杂环分子的有机光电材料(p1和p20)作为有机发光二极管器件的发光层主体,实施的通用器件结构如下:ito/tapc(30nm)/tcta(10nm)/p1或p20:xwt%g1或y1(30nm)/t2t(10nm)/nbphen(40nm)/lif(1nm)/al(100nm)。其中tcta和t2t为激子阻挡层,g1和y1为发光客体,g1为4czipn,y1为tri-pxz-trz,nbphen为电子传输层,其余材料在该有机发光二极管器件的作用与实施例31相同。对于4czipn,x=6;对于tri-pxz-trz,x=3。
本实施的有机发光二极管器件的制备步骤基本上与实施例31相同。
本实施例采用p1作为主体优化后的有机发光二极管器件的电流密度-电压-亮度曲线图、电流效率-亮度-功率效率曲线图和最大外量子效率-亮度关系曲线图分别如图8、图9、图10所示,基本表征数据如表2所示。从器件的相关表征数据中可以发现,采用p1作为主体,器件的启亮电压仅需要2.8v,且器件的最大eqe都能够达到接近20%的水平。而更值得注意的是,绿光和黄光器件在高亮度下都展现出了极低的效率滚降(4czipn器件在1000、5000、10000cd/m2下效率滚降分别为11%、20%、31%;tri-pxz-trz器件在1000、5000、10000cd/m2下效率滚降分别为15%、28%、39%),采用p20作为主体,器件的也仅需要3v左右的启亮电压,黄光器件的最大eqe同样能够达到接近20%的水平,同样也有着不错的效率滚降,是目前采用4czipn和tri-pxz-trz作为客体在高亮度下效率滚降最低的发光器件之一。
表2以p1和p20作为主体的有机发光二极管器件的基本数据
实施例31和32所述的tapc、mcp、dpepo、tmpypb、tcta、t2t、nbphen、4czipn、tri-pxz-trz的分子式分别如下所示:
在oleds的实际应用中,在电流或电压的驱动下,载流子在不同的传输层间不断运动,因而各层材料也在经历着持续不断的电化学氧化还原过程。因此,优异的电化学稳定性对于在高亮度下材料老化和破坏的抑制是至关重要的。我们可以利用循环伏安(cv)法来测定材料的homo与lumo能级,以及材料的电化学稳定性。p1和p24的cv曲线见图3和图4,从中我们可以看到,在咔唑的3,6-位引入叔丁基或甲氧基可以锁住反应活性位点,而叔丁基上又不存在较为活泼的α-h原子,还具备一定的空间位阻,甲氧基则存在不活泼的醚键,从而能够将电化学氧化的破坏限制在一个非常低的水平,在经历过120个循环的扫描之后,依旧能保持着非常不错的电化学可逆性。对于还原过程,含氮杂环作为吸电单元,也可以保持比较良好的电化学可逆性,从而保证这类材料整体上具备相当优异的电化学稳定性。
从上述器件实施例和电化学特性分析可以看出,由于叔丁基或甲氧基的修饰,减少了咔唑基团电化学聚合的位点,使得叔丁基咔唑基团和甲氧基咔唑基团相比于咔唑基团其电化学稳定性可以得到显著的提高,这对于oleds这种电驱动的器件在高能情况下发光性能的稳定是非常有益的。其次,叔丁基咔唑和甲氧基咔唑基团在与咔唑基团保持基本相同的t1能级的前提下,增强了给电性,降低了材料的s1能级,从而可以使得tc基团取代的分子δest得到降低。此外,通过在苯环与给体的连接处引入烷基或烷氧基,使得原先平面性较强的咔唑衍生物基团增大其扭转角,弱化给受体间电子耦合的作用,使得分子的能隙增大,有利于获得光色较好的蓝光材料,还能够显著提升分子的t1能级,从而能够得到性能较佳的主体材料和发光客体材料。这些基于咔唑衍生物取代的氮杂环分子的有机光电材料作为发光层的有机发光二极管器件在发光效率和性能滚降控制方面相较于具有类似结构的发光分子具有一定的优势。
实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!