苯硼酸修饰的共轭聚合物及其制备方法与应用与流程
本发明涉及荧光传感检测技术领域,具体涉及一种苯硼酸修饰的共轭聚合物,其制备方法,及其在可控细胞膜成像中的应用。
背景技术:
近十几年来,阳离子共轭聚合物(ccp)因其优异的性能,在化学与生物传感等技术领域的应用引起了广泛而热切的关注。阳离子共轭聚合物具有共轭聚合物优良的光学性能,同时也有良好的水溶性,相对于水溶性小分子荧光探针来说,阳离子共轭聚合物具备分子导线效应,可以起到信号放大效果。由于带有多个正电荷,阳离子共轭聚合物可以和带负电荷的生物大分子发生非特异性吸附,而且其具有高亮度、优异的光稳定性以及可调的荧光发射光谱,使其具有良好的成像能力。进一步地,通过修饰靶向基团到阳离子共轭聚合物上,可使其在细胞水平或分子水平实现特异性传感或成像。
细胞膜表面的糖蛋白和糖脂参与细胞增殖、分化、免疫应答和细胞通讯等众多重要的细胞活动。然而,异常的糖蛋白表达可引起严重疾病,这种过表达的糖蛋白可作为疾病诊断的重要标志物。同时,细胞膜上的糖蛋白也被用作细胞膜成像的靶点,这些成像策略为科学家分析不同生理时期细胞的形态和结构做出了很大贡献。可控细胞膜成像技术可以成为根据人类需求进行细胞成像的有力策略,但关于这方面的研究却很少有报道。
苯硼酸(pba)作为顺式二醇识别基团可应用于分子识别、分子检测、疾病诊断、细胞靶向或杀菌等生物医学领域。pba可以通过识别糖蛋白的顺式二醇单元与细胞膜结合,形成的动态共价键可以通过调节缓冲液ph或加入竞争分子来调节。这为构建基于pba的可控功能化自组装系统,特别是细胞膜成像奠定了基础。然而,ccp/pba的可控细胞成像系统尚未见报道。
技术实现要素:
本发明的目的在于提供一种共轭聚合物,特别是一种苯硼酸修饰的共轭聚合物,其制备方法,及其在可控细胞膜成像中的应用。本发明提供的共轭聚合物用于细胞膜成像时,具有识别特异性高,成像功能可控等优点。
为此,第一方面,本发明提供一种共轭聚合物,其为式i-式iii所示聚合物中的任意一种:
其中,m为1-12的整数;
n为10-200的整数。
进一步,m为4-8的整数,优选m为6。
第二方面,本发明提供式i-式iii所示聚合物的制备方法,包括以下步骤:
(1)将化合物a和化合物b进行铃木反应(suzuki反应),得到聚合物c,m的定义与权利要求1中的定义相同,
(2)将聚合物c和化合物d进行季铵化反应,得到产物;
所述化合物d为3-(溴甲基)苯硼酸时,所得产物为式i所示聚合物;
所述化合物d为2-(溴甲基)苯硼酸时,所得产物为式ii所示聚合物;
所述化合物d为4-(溴甲基)苯硼酸时,所得产物为式iii所示聚合物。
第三方面,本发明提供式i-式iii所示聚合物中的任意一种在制备荧光成像剂中的应用。
进一步,所述荧光成像剂为细胞膜荧光成像剂。
第四方面,本发明提供一种细胞膜成像方法,包括以式i-式iii所示聚合物中的任意一种作为荧光成像剂进行成像。
进一步,所述细胞膜成像方法包括以下步骤:
配置成像剂,其包括式i-式iii所示聚合物中的任意一种;用成像剂与待成像细胞进行孵育,孵育后进行荧光成像。
进一步,所述待成像细胞经过如下预处理:用多聚甲醛固定待处理细胞。
进一步,所述孵育为37℃孵育5-10min,优选5min。
进一步,所述成像剂还包括d-葡萄糖。
进一步,所述d-葡萄糖与所述聚合物的摩尔比为100-500,其中聚合物的摩尔数以单个重复单元计。
进一步,当所述成像剂包括d-葡萄糖时,其配置方法为向缓冲液中加入所述聚合物和d-葡萄糖,37℃孵育20-40min,优选30min。
进一步,所述荧光成像的激发光波长为405nm。
pba可以通过识别糖蛋白的顺式二醇单元与细胞膜特异性结合,本发明将pba修饰在阳离子共轭聚合物的侧链,得到的聚合物可以特异性结合细胞膜,同时保留良好的光学性能,具有优良的细胞膜成像功能。
pba与顺式二醇作用过程中,硼元素的电荷可由中性变化为负电荷,本发明在研究过程中发现,这表明负电荷细胞膜与正电荷的功能材料之间可能以可调的静电相互作用的超分子方式作用。本发明通过加入d-葡萄糖,调控苯硼酸基团与细胞膜表面的结合进而调控其细胞成像能力,实现了可控的细胞膜成像。
与现有技术相比,本发明的技术方案具有以下优点:
(1)本发明提供的共轭聚合物可用于细胞膜成像,且具有特异性高、光学性能稳定的优点;且其成像能力可根据需要由d-葡萄糖进行调控。
(3)本发明提供了相应的制备方法,工艺简单、易于操作、成本低廉。
(3)本发明提供了一种可控的细胞膜成像方法,应用该方法,可以用d-葡萄糖对共轭聚合物结合细胞膜的功能进行调控,从而使细胞膜成像具有可控性。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:
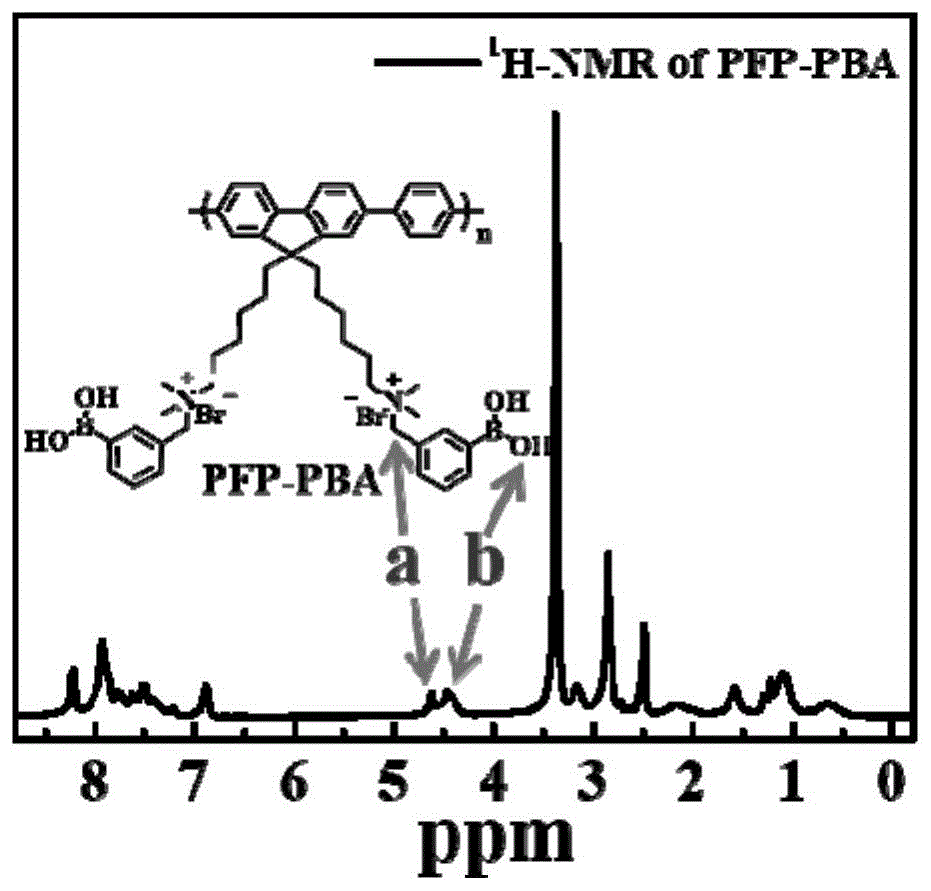
图1为实施例1制备得到的聚合物i1(pfp-pba)的核磁氢谱图;
图2为实施例1制备得到的聚合物i1(pfp-pba)在二甲亚砜和水中的吸收和荧光光谱;
图3为实施例1制备得到的聚合物i1(pfp-pba)滴入硼酸指示剂ars后ars的吸收光谱;
图4为实施例1制备得到的聚合物i1(pfp-pba)加入d-葡萄糖前后pfp-pba的zeta电位和粒径变化;
图5为实施例5细胞成像结果图。
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
本发明对试验中所用到的材料以及试验方法进行一般性和/或具体的描述,在下面的实施例中,如果无其他特别的说明,聚合物的摩尔数以单个重复单元计。
实施例1
本实施例提供了一种共轭聚合物,其制备步骤如下:
第1步、聚合物2的合成:
在氩气气氛条件下,将0.174g化合物1(0.3mmol)以及0.099g化合物b(0.3mmol)溶解在由10ml四氢呋喃和4ml2.0m碳酸钾溶剂混合得到的溶剂中,加入钯催化剂后,体系升温至85℃反应48h。反应停止后,真空除去溶剂,残留物重新溶解在1ml三氯甲烷中,逐滴滴入大量丙酮中,过滤得到滤渣,经真空干燥得到67.5mg棕色固体,及聚合物2,产率为43%。产物表征:1hnmr(400mhz,dmso-d6,ppm):8.06-7.96(br),7.91-7.79(br),3.15-3.12(br),2.91-2.80(br),2.56-2.53(br),1.03(br).
第2步、聚合物i1的合成
将20mg聚合物2(0.04mmol)和50mg3-(溴甲基)苯硼酸(0.23mmol)溶解于3ml四氢呋喃中回流24h,等体系冷却至室温后,过滤得到滤渣,所得滤渣用四氢呋喃洗涤三次,真空干燥后得到9.5mg棕色固体,即式i1所示聚合物(下文简称为pfp-pba),产率25%,其核磁氢谱见图1,产物表征:1h-nmr(400mhz,dmso-d6,ppm):8.30-8.17(br),8.15-7.83(br),7.80-7.10(br),6.95-6.80(br),4.70-4.55(br),4.50-4.30(br),3.22-3.09(br),2.94-2.76(br),2.37-1.85(br),1.72-1.47(br),1.20-0.95(br),0.80-0.30(br).
实施例2表征pfp-pba
本实施例对pfp-pba进行表征,通过检测实施例1制备得到的pfp-pba在二甲亚砜(dmso)和水中的紫外-可见吸收光谱以及荧光发射光谱,测得其在不同溶剂里的最大吸收波长和最大发射波长。检测得到的pfp-pba在二甲亚砜和水中的吸收和荧光光谱见图2。
实施例3验证pfp-pba对邻二醇的识别能力
本实施例对pfp-pba对邻二醇的识别能力进行验证。通过将pfp-pba滴入硼酸指示剂ars后检测ars的吸收光谱,以验证pfp-pba对邻二醇的识别能力。具体步骤如下:
将25μmars溶解在hepes缓冲液(10mm,ph7.98)中,25℃恒温下,向体系逐渐滴加pfp-pba,每次滴加后测量ars的吸收光谱,检测得到的吸收光谱见图3。
ars为硼酸指示剂,且含有邻二醇结构。加入pfp-pba后,ars的吸收光谱发生了变化,说明苯硼酸修饰在聚合物上以后,仍具有识别邻二醇的能力。
实施例4
本实施例测量pfp-pba与d-葡萄糖作用前后的zeta电位和dls变化。
将20μmpfp-pba溶解在hepes缓冲液(10mm,ph7.98)中,加入10mmd-葡萄糖,测量加入d-葡萄糖前后pfp-pba的zeta电位和粒径,测量结果见图4。
根据图4,加入d-葡萄糖后,pfp-pba的粒径增大且电位发生变化,可知pfp-pba可与d-葡萄糖结发生结合作用。与d-葡萄糖结合后,pfp-pba中作为细胞膜表面糖蛋白识别位点被屏蔽,而且苯硼酸基团中的硼元素由电中性变为电负性,从而降低了pfp-pba的整体正电荷量。
实施例5细胞成像
本实施例应用pfp-pba进行细胞成像,设置实验组1-2和对照组1-2,各组所用成像剂如下,实验组1:pfp-pba,实验组2:d-葡萄糖+pfp-pba,对照组1:式d所示聚合物(下文简称为pfp,其结构式如下所示),对照组2:pfp+d-葡萄糖。
实验步骤如下:
(1)将pc12细胞以1×105细胞/ml的细胞密度接种于35mm培养皿中,培养6h后,在室温下用4%多聚甲醛固定15min,然后用pbs洗涤3次。
(2)配置成像剂:实验组1:向hepes缓冲液中加入20μmpfp-pba;实验组2:向hepes缓冲液中加入20μmpfp-pba和10mmd-葡萄糖,37℃预孵育30min;对照组1:向hepes缓冲液中加入20μmpfp;对照组2:向hepes缓冲液中加入20μmpfp和10mmd-葡萄糖,37℃预孵育30min。
(3)将步骤(2)制备得到的各组成像剂分别加入经步骤(1)处理的细胞,37℃孵育5分钟后,用hepes缓冲液(10mm,ph=7.98)洗涤细胞。
(4)在奥林巴斯fv1200-bx6上进行clsm成像,用405nm波长激发聚合物,在410-500nm范围内采集信号,细胞成像图见图5。
由实验组1(pfp-pba)的成像结果可知,pfp-pba可与细胞膜进行特异性结合,且其具有较强的光捕捉能力,被激发后可以发射出强烈的荧光,因此可用于细胞荧光成像检测。pfp-pba结合细胞细胞膜的原理是:pfp-pba可以通过苯硼酸基团与细胞膜表面的糖蛋白的邻二醇结构形成动态共价键,且正电荷的pfp-pba还可以通过静电作用与负电荷的细胞膜结合。相较于现有技术中的阳离子共轭聚合物,如pfp,本发明提供的pfp-pba用于细胞膜成像时,识别细胞膜的特异性更高。
由实验组2(pfp-pba+d-葡萄糖)和对照组2(pfp+d-葡萄糖)的成像结果可知,连接苯硼酸基团后,pfp-pba的细胞膜成像能力可由d-葡萄糖进行调控,这是由于pfp-pba与d-葡萄糖结合后,苯硼酸基团作为细胞膜表面糖蛋白识别位点被屏蔽,而且与葡萄糖结合后,硼元素由电中性变为电负性,从而降低了pfp-pba的整体正电荷量,与细胞膜结合的作用降低,动态共价键与静电作用等超分子方式的协同作用,使pfp-pba具有可控的细胞膜成像能力。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!